内体分选转运复合体:确保有丝分裂正确进行的分子机器
高吴陆怡 杨玉 张鹏霞 商宇

摘要:有丝分裂是真核细胞增殖的重要环节。内体分选转运复合体是与膜剪切过程密切相关的多蛋白复合体,其功能涉及内体成熟、病毒出芽、自噬等过程,其结构和功能异常与癌症等疾病发生发展密切相关。本文总结了内体分选转运复合体在细胞有丝分裂不同阶段所发挥的作用,以及内体分选转运复合体调控有丝分裂作用在疾病方面的研究进展。
关键词:有丝分裂;内体分选转运复合体;纺锤体检查点;癌症
中图分类号: R394.2文献标识码: A文章编号:1000-503X(2024)02-0287-06
DOI:10.3881/j.issn.1000-503X.15609
Endosomal Sorting Complex Required for Transport:The Molecular Machine for Ensuring Proper Mitosis
GAO Wuluyi,YANG Yu,ZHANG Pengxia,SHANG Yu
Key Laboratory of Microecology-Immune Regulatory Network and Related Diseases,School of Basic Medicine,Jiamusi University,Jiamusi,Heilongjiang 154007,China
Corresponding author:SHANG Yu Tel:13339558842,E-mail:shangyu0454@outlook.com
ABSTRACT:Mitosis is a key step of eukaryote proliferation.Endosomal sorting complex required for transport,a protein complex closely associated with membrane shearing,is involved in endosome maturation,virus budding,and autophagy.The structural and functional abnormalities of the complex are associated with the occurrence and progression of cancer and other diseases.In this paper,we summarized the roles of the endosomal sorting complex required for transport in different stages of mitosis and reviewed the studies about the role of the complex in regulating mitosis in diseases.
Key words:mitosis;endosomal sorting complex required for transport;spindle assembly checkpoint;cancer
Acta Acad Med Sin,2024,46(2):287-292
內体分选转运复合体(endosomal sorting complex required for transport,ESCRT)系统是在真核细胞中执行膜剪切功能的重要分子机器。ESCRT系统可在膜的特定位点组装成蛋白复合体,并完成膜的剪切,其功能涉及自噬、多囊泡体生成、逆转录病毒出芽、膜修复等过程[1]。外源性化合物及氧化应激反应等刺激会使细胞膜受损,ESCRT系统可及时有效地修复细胞膜,保证胞膜的完整,维持细胞存活[2]。有研究发现,ESCRT系统不仅可以修复膜破裂,抵抗细胞坏死,还可以让即将死亡的细胞释放信号,以提醒周围细胞抵御破坏因子的侵害避免死亡[3]。Ritter等[4]研究证明ESCRT系统介导的膜修复机制可以使癌细胞逃避细胞毒性T淋巴细胞的攻击,但同时发现将ESCRT系统成员带电多泡体蛋白(charged multivesicular body protein,CHMP)4B沉默后,癌细胞膜修复功能减弱,恢复细胞毒性T淋巴细胞杀伤癌细胞的能力,从而导致癌细胞失去了逃避细胞毒性T淋巴细胞攻击的能力,显然,这一发现对于探索ESCRT系统的功能具有重要价值。细胞分裂是生物体最基本的生命过程之一,细胞在分裂期完成胞内物质的平均分配与子代细胞的生成。有证据表明,ESCRT系统直接参与细胞分裂,如裂殖酵母的ESCRT系统与其他酶相互作用直接调控酵母的细胞分裂[5]。鉴于此,我们对ESCRT系统在真核细胞分裂期各个阶段所发挥的作用及ESCRT系统异常与疾病的关系进行了总结与梳理,并展望未来研究的方向。
1 染色体正确分离是细胞有丝分裂的核心事件
有丝分裂是细胞增殖的基本过程,从分裂间期到分裂期,染色质相互靠近,围绕在核膜和核仁周围,进入分裂期后,染色质高度聚集形成染色体,随后核膜破裂,中心体向两极移动形成纺锤体,纺锤体与染色体的动粒正确结合后,姐妹染色单体之间的黏连蛋白被降解,染色单体分离[6]。染色体分布和分离的关键监测和调控机制是纺锤体组装检查点(spindle assembly checkpoint,SAC),SAC是细胞周期后期促进复合物的关键激活物,可保证纺锤体与染色体的正确组装,如果染色体未与纺锤体正确连接,SAC将阻止染色体分离[7]。SAC发挥作用的主要结构是由有丝分裂阻滞缺陷蛋白(mitotic arrest deficient,MAD)2、细胞分裂周期蛋白20等组成的有丝分裂检查点复合体(mitotic checkpoint complex,MCC)[8]。MCC在分裂前期位于动粒,当染色体排列正确,且与纺锤体双向连接正确后,MCC离开动粒并解体,细胞分裂周期蛋白20激活细胞周期后期促进复合物,可使分离酶抑制蛋白泛素化,并释放分离酶破坏黏连蛋白对姐妹染色单体之间的束缚,使得姐妹染色单体分离,顺利进入分裂后期[9]。在分裂末期,染色体重新解聚成染色质,核膜核仁重新出现,赤道板处的细胞膜逐渐融合,最后通过细胞间桥断裂与胞质分裂使两个子代细胞分离,完成有丝分裂全过程[10]。
2 ESCRT通过膜剪切重塑等过程调控细胞生理功能
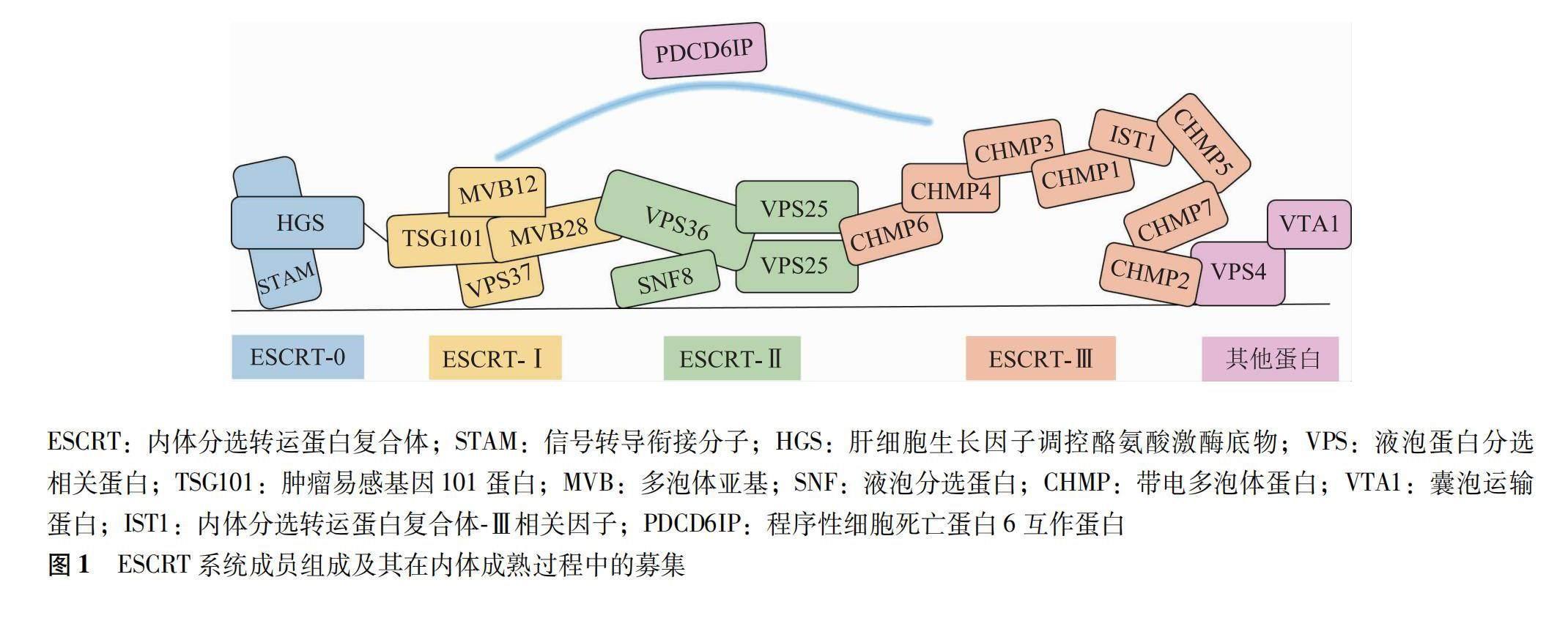
ESCRT系统包括蛋白复合体ESCRT-0、ESCRT-Ⅰ、ESCRT-Ⅱ与ESCRT-Ⅲ,以及辅助蛋白液泡蛋白分选相关蛋白(vacuolar protein sorting-associated protein,VPS)4、程序性细胞死亡蛋白6互作蛋白(programmed cell death 6-interacting protein,PDCD6IP)等成员[11]。膜剪切与膜重塑是ESCRT的核心功能。在内体成熟过程中,ESCRT-0被招募至内体膜,ESCRT-Ⅰ借助其成员肿瘤易感基因101蛋白(tumor susceptibility gene 101 protein,TSG101)与ESCRT-0成员肝细胞生长因子调控酪氨酸激酶底物的相互作用,从而被募集至内体膜,随后,ESCRT-Ⅰ又经ESCRT-Ⅱ成员VPS36将ESCRT-Ⅱ招募至胞膜,并诱导膜内陷,同时,ESCRT-Ⅲ借助CHMP6与VPS25的结合被招募到内体膜后,胞膜内陷随之被剪切生成腔内泡体[12-13]。ESCRT-Ⅲ介导泛素化的膜受体蛋白进入腔内泡体,待降解的蛋白在腔内聚集后形成多囊泡体,最后,VPS4和囊泡运输蛋白将ESCRT-Ⅲ从膜上脱离并回收利用[14](图1)。
自噬是由溶酶体所介导的降解细胞内受损的细胞器与蛋白质的生物过程,自噬前体封口后成为自噬体,自噬体与溶酶体融合后,其内包裹的物质即被降解,实现细胞器更新和满足细胞代谢需要[15-16]。在酵母中的研究表明,自噬前体封口过程中,ESCRT-Ⅲ通过与自噬相关蛋白17相互作用被招募到自噬前体膜上,并完成自噬前体的封口成熟,随后ESCRT-Ⅲ和自噬相关蛋白17在VPS4作用下,从自噬膜上分离[17-18]。Takahashi等[19]研究发现在细胞中抑制ESCRT-Ⅲ成员CHMP2A的表达后,自噬体发生双膜闭合障碍,且成熟自噬体数量减少,说明ESCRT-Ⅲ在自噬体膜闭合重塑过程中具有重要作用,因此ESCRT系统在细胞自噬过程中发挥许多不同类型的作用。在泛素化蛋白的降解过程中,ESCRT-0成员肝细胞生长因子调控酪氨酸激酶底物和信号转导衔接分子基序可以识别泛素化蛋白,并通过依次招募后续成员将泛素化蛋白运送到溶酶体进行降解。美国加州大学的一项研究显示,在患有神经退行性疾病(朊病毒病)的小鼠中敲除ESCRT-0成员肝细胞生长因子调控酪氨酸激酶底物后,发现突触处的泛素化蛋白的降解受阻,进而加速了突触神经的退化,可使神经退行性疾病进一步恶化[20]。
3 ESCRT参与细胞有丝分裂并确保遗传染色体正确分离
在细胞有丝分裂中,ESCRT系统参与动粒-微管紧密附着、SAC监测、核膜重塑和胞膜剪切重塑等过程。在分裂前中期,ESCRT系统成员通过确保动粒-微管的紧密附着,保证姐妹染色单体正确分离。NDC80复合物是由动粒蛋白NDC80与动粒蛋白NUF2等4个成员组成的蛋白复合体,与Rod-ZW10-Zwilch(RZZ)复合体相互作用共同维持动粒-微管的紧密附着[21]。ESCRT-Ⅲ成员CHMP4C在分裂期的前中期通过调节NDC80-NUF2亚复合体移动至动粒,并且使氨基端区域与纺锤体微管结合,促进动粒-微管的稳定附着[22]。CHMP4C除了与NDC80结合外,还促进MCC的MAD1-MAD2亚复合体和RZZ复合体组装,并使其移至动粒,待MAD1-MAD2-RZZ复合体在动粒-微管稳定附着后,CHMP4C才离开染色体[23]。
在有丝分裂最后阶段的核膜重塑和胞膜剪切过程中,ESCRT系统执行关键的膜剪切功能,ESCRT-Ⅲ成员CHMP7、CHMP2、CHMP4等直接参与核膜重塑与封口的过程,CHMP7可以与含Lap2-Emerin-Man1结构域的蛋白如LEM2直接结合,进而募集ESCRT-Ⅲ至核膜处完成核膜重塑[24-26]。LEM2-CHMP7復合物的过度组装也会导致膜畸变,反过来损害核膜完整性[24-25]。在分裂末期,ESCRT系统参与连接两细胞的细胞间桥的分解和胞膜的剪切重塑,此过程标志着胞质分裂的最终完成[27]。相对分子质量为55 000的中心体蛋白在胞质分裂开始时迁移到中间体后,可招募PDCD6IP和ESCRT-Ⅰ成员TSG101,TSG101通过其UEV结构域与细胞骨架蛋白胞裂蛋白9相互作用,又进一步募集VPS25及ESCRT-Ⅲ[28-29]。ESCRT-Ⅲ在中间体的两侧被募集后,以螺旋结构延伸到脱落部位形成细丝,且与VPS4协同切断胞膜,使得细胞分离[30]。脱落检查点是胞膜剪切重塑过程中的监测机制,可进一步确保染色体平均分配与有丝分裂过程完整。这一监控机制的关键环节是极光激酶B与ESCRT-Ⅲ的相互作用,当细胞存在染色体异常时,极光激酶B被激活继而导致CHMP4C磷酸化,进而延迟ESCRT系统的后续招募过程,抑制VPS4定位到脱落部位,从而阻滞胞质继续分裂,直到染色体异常问题得到解决[31]。总之,ESCRT系统直接参与有丝分裂的各个阶段,确保遗传物质的均等分配与细胞内结构的正确配置,主要作用机制为:在有丝分裂前期,ESCRT系统成员CHMP4C协助MCC和RZZ复合物移动至动粒,待纺锤丝与动粒连接紧密后,细胞周期后期促进复合物被激活,进而泛素化分离酶抑制蛋白释放分离酶使姐妹染色单体分离。在有丝分裂后期,姐妹染色单体向两端分离。有丝分裂末期,相对分子质量为55 000的中心体蛋白、TSG101和PDCD6IP定位于中间体后,招募ESCRT-Ⅲ定位于中间体两端,ESCRT-Ⅲ在VPS4协同下切割胞膜,使细胞分离(图2)。
4 ESCRT的异常会参与某些疾病的发生
目前,与ESCRT系统关系最密切的疾病过程是病毒的出芽。以人类免疫缺陷病毒为例,人类免疫缺陷病毒在病毒组装部位以Gag蛋白的L结构域代替ESCRT-0直接与ESCRT-Ⅰ成员TSG101的泛素结合酶E2结构域结合,且Gag蛋白的YPXL结构域与PDCD6IP的V结构域相互作用,最后ESCRT-Ⅰ与PDCD6IP共同招募ESCRT-Ⅲ和VPS4完成病毒的出芽[32]。
ESCRT还与很多疾病有关,如在神经退行性疾病中,ESCRT-Ⅲ成员CHMP2B的基因突变或者缺失可以导致树突棘的损伤,并影响突触的成熟,从而引起额颞叶痴呆[33]。Waegaert等[34]在小鼠体内实验中发现CHMP2B内含子突变可能由于自噬流阻滞,进而损伤小鼠的突触,小鼠表现出步态缓慢、肌肉无力等类似于肌萎缩侧索硬化症的临床表现。Ferraiuolo等[35]发现TSG101在多种癌症中高表达,并且表达程度与肿瘤的恶性程度相关,如乳腺癌、胃癌。Habib等[36]发现TSG101的剪切突变存在于多种恶性肿瘤,如白血病、乳腺癌、宫颈癌、肺癌等。除了TSG101以外,Shi等[37]发现ESCRT-I成员VPS28在乳腺癌中高表达,MicroRNA-491-5p作为转录后调控因子可降低VPS28的表达,促进乳腺癌细胞的凋亡。另外,在中风大鼠脑中CHMP2A、CHMP4B和VPS4A低表达,而凋亡坏死基因高表达,大鼠表现为脑坏死[38]。
5 ESCRT调控有丝分裂作用在疾病方面的研究进展
有丝分裂是细胞最基本的生命活动,其异常是很多疾病的病因,而ESCRT系统是与细胞基本功能关系密切的分子机器。染色体分离异常导致非整倍染色体的出现,这种现象常见于各种肿瘤,主要原因就是SAC监测机制的缺陷,如鼻咽癌、乳腺癌和卵巢癌都表现为MAD2低表达,造成SAC的功能缺陷,而SAC成员有丝分裂检查点丝氨酸/苏氨酸蛋白激酶BUB1也被发现在急性髓系白血病细胞中表达下调[39]。T细胞白血病也存在着MAD2由胞核向胞质的异常移位与SAC功能缺陷的现象[40]。ESCRT系统参与的SAC监测机制、脱落检查点机制等过程,在确保细胞有丝分裂正确进行过程中发挥着至关重要的作用,因此,ESCRT功能失调所致细胞有丝分裂异常应该与很多疾病有关。Dong等[41]研究发现,遗传性血色病蛋白的缺失影响了肝癌细胞中CHMP1B的定位,进而导致细胞分裂末期细胞分离受到抑制,使癌细胞的增殖阻滞在G2/M期,且出现多中心体、胞质分裂缺陷等现象。Seu等[42]通过对体外先天性红细胞生成异常性贫血细胞模型的研究,發现VPS4A突变导致细胞分裂缺陷与红细胞生成障碍。值得注意的是,有研究发现ESCRT系统成员的失调与细胞周期异常相关疾病关系密切,如在TSG101基因敲除的小鼠中,发现P53基因增多,且细胞发生周期阻滞,影响胚胎细胞生成[43]。除此之外,少突胶质细胞中TSG101的缺失会造成小鼠自噬相关基因P62的积累,导致神经退行性疾病的发生[44]。也有研究发现,胶质瘤患者的VPS25基因的RNA表达量增高,且VPS25还可以调控细胞周期相关蛋白变化,随后在胶质母细胞瘤细胞中敲减VPS25后,细胞发生周期阻滞[45]。
6 展望
有丝分裂是真核细胞的基本生命过程,ESCRT系统直接参与细胞分裂,是与细胞基本功能关系密切的分子机器。有丝分裂是细胞周期的关键环节,ESCRT系统成员失调导致的细胞周期异常可以影响有丝分裂的进程,进而导致疾病的发生与发展。然而,在这个调控过程中,有哪些调节因素会通过ESCRT影响有丝分裂进程?这些影响因素以及ESCRT系统本身的变化将以何种方式影响疾病的进程?这些问题仍待解答,也是未来研究方向。我们希望本文能够启发研究者的灵感,进一步从有丝分裂的角度挖掘ESCRT系统的功能及其成员参与的分子机制,丰富ESCRT系统与疾病关系的认知。通过深入研究两者的关系,ESCRT系统有望成为癌症等疾病治疗的新靶点。
利益冲突 所有作者声明均无利益冲突
作者贡献声明 高吴陆怡:文献整理、文章撰写;杨玉:文献整理、文章摘要撰写;张鹏霞:修改提纲、对学术问题进行解答;张鹏霞、商宇:文章的润色;商宇:最后的审阅和定稿,并同意対研究工作诚信负责
参 考 文 献
[1]Lefebvre C,Legouis R,Culetto E.ESCRT and autophagies:endosomal functions and beyond[J].Semin Cell Dev Biol,2018,74:21-28.DOI:10.1016/j.semcdb.2017.08.014.
[2]赵莎莎,石丽君,吴迎.ESCRT复合体在细胞质膜损伤修复中的功能[J].生物化学与生物物理进展,2022,49(3):503-513.DOI:10.16476/j.pibb.2021.0269.
[3]Gong YN,Guy C,Olauson H,et al.ESCRT-III acts downstream of MLKL to regulate necroptotic cell death and its consequences[J].Cell,2017,169(2):286-300.DOI:10.1016/j.cell.2017.03.020.
[4]Ritter AT,Shtengel G,Xu CS,et al.ESCRT-mediated membrane repair protects tumor-derived cells against T cell attack[J].Science,2022,376(6591):377-382.DOI:10.1126/science.abl3855.
[5]Rezig IM,Bremner SK,Bhutta MS,et al.Genetic and cytological methods to study ESCRT cell cycle function in fission yeast[J].Methods Mol Biol,2019,1998:239-250.DOI:10.1007/978-1-4939- 9492-2_18.
[6]Song XH,Conti D,Shrestha RL,et al.Counteractio between Astrin-PP1 and Cyclin-B-CDK1 pathways protects chromosome-microtubule attachments independent of biorientation[J].Nat Commun,2021,12(1):7010.DOI:10.1038/s41467-021-27131-9.
[7]Alfieri C,Chang L,Zhang Z,et al.Molecular basis of APC/C regulation by the spindle assembly checkpoint[J].Nature,2016,536(7617):431-436.DOI:10.1038/nature19083.
[8]Piano V,Alex A,Stege P,et al.CDC20 assists its catalytic incorporation in the mitotic checkpoint complex[J].Science,2021,371(6524):67-71.DOI:10.1126/science.abc1152.
[9]Bufe A,García Del Arco A,Hennecke M,et al.Wnt signaling recruits KIF2A to the spindle to ensure chromosome congression and alignment during mitosis[J].Proc Natl Acad Sci USA,2021,118(34):e2108145118.DOI:10.1101/2020.12.22.404020.
[10]Zhang Q,Sivakumar S,Chen YJ,et al.Ska3 phosphorylated by Cdk1 binds Ndc80 and recruits ska to kinetochores to promote mitotic progression[J].Curr Biol,2017,27(10):1477-1484.DOI:10.1016/j.cub.2017.03.060.
[11]Schneberg J,Lee IH,Iwasa JH,et al.Reversetopology membrane scission by the ESCRT proteins[J].Nat Rev Mol Cell Biol,2017,18(1):5-17.DOI:10.1038/nrm.2016.121.
[12]Gill DJ,Teo H,Sun J,et al.Structural insight into the ESCRT-I/-II link and its role in MVB trafficking[J].EMBO J,2007,26(2):600-612.DOI:10.1038/sj.emboj.7601501.
[13]趙雅惠,吴旻,林福呈,等.内体分拣转运复合体的组成及其功能研究[J].中国细胞生物学学报,2017,39(2):215-222.DOI:10.11844/cjcb.2017.02.0287.
[14]Meng B,Lever AML.The interplay between ESCRT and viral factors in the enveloped virus life cycle[J].Viruses,2021,13(2):324-335.DOI:10.3390/V13020324.
[15]Tang CY,Livingston MJ,Liu ZW,et al.Autophagy in kidney homeostasis and disease[J].Nat Rev Nephrol,2020,16(9):489-508.DOI:10.1038/s41581-020-0309-2.
[16]Kaushik S,Tasset I,Arias E,et al.Autophagy and the hallmarks of aging[J].Ageing Res Rev,2021,72:101468-101478.DOI:10.1016/j.arr.2021.101468.
[17]Isono E.ESCRT is a great sealer:nonendosomal function of the ESCRT machinery in membrane repair and autophagy[J].Plant Cell Physiol,2021,62(5):766-774.DOI:10.1093/pcp/pcab045.
[18]Zhou F,Wu ZL,Zhao MZ,et al.Rab5-dependent autophagosome closure by ESCRT[J].J Cell Biol,2019,218(6):1908-1927.DOI:10.1083/jcb.201811173.
[19]Takahashi Y,He H,Tang Z,et al.An autophagy assay reveals the ESCRT-Ⅲ component CHMP2A as a regulator of phagophore closure[J].Nat Commun,2018,9(1):2855-2868.DOI:10.1038/s41467-018-05254- w.
[20]Lawrence JA,Aguilar-Calvo P,Ojeda-Juárez D,et al.Diminished neuronal ESCRT-0 function exacerbates AMPA receptor derangement and accelerates prioninduced neurodegeneration[J].J Neurosci,2023,43(21):3970-3984.DOI:10.1523/JNEUROSCI.1878-22.2023.
[21]Amin MA,McKenney RJ,Varma D.Antagonism between the dynein and Ndc80 complexes at kinetochores controls the stability of kinetochore-microtubule attachments during mitosis[J].J Biol Chem,2018,293(16):5755-5765.DOI:10.1074/jbc.RA117.001699.
[22]Petsalaki E,Dandoulaki M,Zachos G.Chmp4c is required for stable kinetochore-microtubule attachments[J].Chromosoma,2018,127(4):461-473.DOI:10.1007/s00412-018-0675-8.
[23]Petsalaki E,Dandoulaki M,Zachos G.The ESCRT protein Chmp4c regulates mitotic spindle checkpoint signaling[J].J Cell Biol,2018,217(3):861-876.DOI:10.1083/jcb.201709005.
[24]Shankar R,Lettman MM,Whisler W,et al.The ESCRT machinery directs quality control over inner nuclear membrane architecture[J].Cell Rep,2022,38(3):110263-110282.DOI:10.1016/j.celrep.2021.110263.
[25]Vietri M,Schultz SW,Bellanger A,et al.Unrestrained ESCRT-III drives micronuclear catastrophe and chromosome fragmentation[J].Nat Cell Biol,2020,22(7):856-867.DOI:10.1038/s41556-020-0537-5.
[26]Gu M,LaJoie D,Chen OS,et al.LEM2 recruits CHMP7 for ESCRT-mediated nuclear envelope closure in fission yeast and human cells[J].Proc Natl Acad Sci USA,2017,114(11):E2166-E2175.DOI:10.1073/pnas.1613916114.
[27]Antanaviiūt I,Gibie?a P,Prekeris R,et al.Midbody:from the regulator of cytokinesis to postmitotic signaling organelle[J].Medicina(Kaunas),2018,54(4):53-63.DOI:10.3390/medicina54040053.
[28]Tedeschi A,Almagro J,Renshaw MJ,et al.Cep55 promotes cytokinesis of neural progenitors but is dispensable for most mammalian cell divisions[J].Nat Commun,2020,11(1):1746-1762.DOI:10.1038/s41467-020-15359-w.
[29]Karasmanis EP,Hwang D,Nakos K,et al.A septin double ring controls the spatiotemporal organization of the ESCRT machinery in cytokinetic abscission[J].Curr Biol,2019,29(13):2174-2182.DOI:10.2139/ssrn.3291327.
[30]Sadler JBA,Wenzel DM,Williams LK,et al.A cancer-associated polymorphism in ESCRT-III disrupts the abscission checkpoint and promotes genome instability[J].Proc Natl Acad Sci USA,2018,115(38):8900-8908.DOI:10.1101/361659.
[31]Renshaw MJ,Panagiotou TC,Lavoie BD,et al.CDK11-cyclin L1β regulates abscission site assembly[J].J Biol Chem,2019,294(49):18639-18649.DOI:10.1074/jbc.RA119.009107.
[32]Ju YC,Bai HC,Ren LZ,et al.The role of exosome and the ESCRT pathway on enveloped virus infection[J].Int J Mol Sci,2021,22(16):9060-9072.DOI:10.3390/ijms22169060.
[33]West RJH,Ugbode C,Fort-Aznar L,et al.Neuroprotective activity of ursodeoxycholic acid in CHMP2BIntron5models of frontotemporal dementia[J].Neurobiol Dis,2020,144:105047.DOI:10.1016/j.nbd.2020.105047.
[34]Waegaert R,Dirrig-Grosch S,Liu HY,et al.Alteration of the neuromuscular junction and modifications of muscle metabolism in response to neuron-restricted expression of the CHMP2B mutant in a mouse model of ALS-FTD syndrome[J].Biomolecules,2022,12(4):497-521.DOI:10.3390/biom12040497.
[35]Ferraiuolo RM,Manthey KC,Stanton MJ,et al.The multifaceted roles of the tumor susceptibility gene 101(TSG101)in normal development and disease[J].Cancers(Basel),2020,12(2):450-466.DOI:10.3390/cancers12020450.
[36]Habib E,Cook A,Mathavarajah S,et al.Adding some “Splice” to stress eating:autophagy,ESCRT and alternative splicing orchestrate the cellular stress response[J].Genes(Basel),2021,12(8):1196-1210.DOI:10.3390/genes12081196.
[37]Shi WJ,Hu DJ,Xing Y,et al.Deciphering the oncogenic role of VPS28 modulated by miR-491-5p in breast cancer cells using in silico and functional analysis[J].Front Mol Biosci,2021,8:634183-634194.DOI:10.3389/fmolb.2021.634183.
[38]Tian J,Zhang YY,Peng YW,et al.Polymyxin B reduces brain injury in ischemic stroke rat through a mechanism involving targeting ESCRT-III machinery and RIPK1/RIPK3/MLKL pathway[J].J Cardiovasc Transl Res,2022,15(5):1129-1142.DOI:10.1007/s12265-022-10224-1.
[39]傅云峰,謝幸,叶大风.肿瘤与纺锤体检查点的研究现状[J].国外医学(肿瘤学分册),2005,32(1):3-6.DOI:10.3760/cma.j.issn.1673-422X.2005.01.001.
[40]Kasai T,Iwanaga Y,Iha H,et al.Prevalent loss of mitotic spindle checkpoint in adult T-cell leukemia confers resistance to microtubule inhibitors[J].J Biol Chem,2002,277(7):5187-5193.DOI:10.1074/jbc.M110295200.
[41]Dong P,Cai Z,Li B,et al.HFE promotes mitotic cell division through recruitment of cytokinetic abscission machinery in hepatocellular carcinoma[J].Oncogene,2022,41(36):4185-4199.DOI:10.1038/s41388-022- 02419-2.
[42]Seu KG,Trump LR,Emberesh S,et al.VPS4A mutations in humans cause syndromic congenital dyserythropoietic anemia due to cytokinesis and trafficking defects[J].Am J Hum Genet,2020,107(6):1149-1156.DOI:10.1016/j.ajhg.2020.10.013.
[43]Kaul Z,Mookherjee D,Das S,et al.Loss of tumor susceptibility gene 101(TSG101)perturbs endoplasmic reticulum structure and function[J].Biochim Biophys Acta Mol Cell Res,2020,1867(9):118741-118756.DOI:10.1016/j.bbamcr.2020.118741.
[44]Walker WP,Oehler A,Edinger AL,et al.Oligodendroglial deletion of ESCRT-I component TSG101 causes spongiform encephalopathy[J].Biol Cell,2016,108(11):324-337.DOI:10.1111/boc.201600014.
[45]Zhu XL,Yang H,Zhang MY,et al.YTHDC1-mediated VPS25 regulates cell cycle by targeting JAK-STAT signaling in human glioma cells[J].Cancer Cell Int,2021,21(1):645-659.DOI:10.1186/s12935-021-0230 4-0.
(收稿日期:2023-04-03)

