鲤疱疹病毒二型(CyHV-Ⅱ)疫苗研究进展
吴琳娇 孙丽芳 朱春华 张红 董盼盼 陈磊清 吴允昆
摘要:鲤疱疹病毒Ⅱ型(Cyprinid herpesvirus Ⅱ,CyHV-Ⅱ)对任何发育时期的金鱼、鲫鱼及其杂交品种均具有感染能力,能够引起金鱼疱疹病(goldfish haematopoietic necrosis, GFHN),是一种传染性强且死亡率极高的疫病,给我国金鱼和鲫鱼养殖业造成巨大经济损失,鱼用疫苗的研发是预防和治疗该疫病最有效的办法。综述了CyHV-Ⅱ灭活疫苗、亚单位疫苗、核酸疫苗、活载体疫苗和纳米递送疫苗的研究进展,并对鱼用疫苗纳米材料的应用前景进行了探讨,以期为金鱼疱疹病害防治和鱼用疫苗研究提供新技术方法和新思路策略。
关键词:鲤疱疹病毒二型(CyHV-Ⅱ);免疫途径;纳米材料;疫苗类型
doi:10.13304/j.nykjdb.2022.0775
中圖分类号:S943 文献标志码:A 文章编号:10080864(2024)02013708
金鱼造血器官坏死症病毒(goldfishhaematopoietic necrosis virus,GFHNV)又名鲤疱疹病毒Ⅱ型(Cyprinid herpesvirus Ⅱ, CyHV-Ⅱ),主要侵染鲤科鱼类的脾脏、肾脏、肝脏等器官,引起脾脏细胞包涵体、肾脏的造血干细胞和肾小管上皮细胞坏死[1]。感染CyHV-Ⅱ时,受感染的金鱼会出现沉底、精神萎靡、呼吸频率加快、眼球突出、腹部膨大、鱼体表面可观察到出血等症状[23]。CyHV-Ⅱ传染性强、潜伏周期长,并且常在水温15~25 ℃时爆发[4-6],因此,防治难度极大,在世界范围内广泛传播。此外,CyHV-Ⅱ对各发育时期的金鱼[2]、鲫鱼及其变种[7]均有感染能力,其中以幼鱼的症状最显著,且死亡率可达100%。CyHV-Ⅱ不仅可通过水平传播,也存在母体向鱼卵的垂直传播途径,因此,对CyHV-Ⅱ的综合预防迫在眉睫。
自1995年在日本发现CyHV-Ⅱ ST-J1毒株以来[8],金鱼造血器官坏死症逐渐蔓延到全球水产行业。近10年,江苏、广州、武汉等地陆续爆发大规模CyHV-Ⅱ疫情,淡水鱼养殖行业受到巨大冲击,相关从业者迫切需要有效、高效且经济的方法来防控此病[9]。目前针对CyHV-Ⅱ的特效药物仍处于探索阶段。因此,在生产中较有效的策略依旧是通过控制水温、改善养殖环境和投喂抗生素等手段遏制病毒传播链,抑制其蔓延。Guo等[10]运用生物絮凝技术改善水质,虽有效提高了异育银鲫的免疫力,但不利于鱼体生长。上述方法在一定条件下可限制病毒传播,但由于经济适用性较低,且技术要求高等,难以大规模应用于疫情防控。
疫苗因其经济、高效、长效、安全性高等特点被认为是对抗外源病毒感染的有效方式。目前,多种类型CyHV-Ⅱ疫苗已被证明有效,如衣壳蛋白亚单位疫苗、DNA疫苗、杆状病毒载体疫苗等。多数鱼用疫苗均采用注射和浸泡的方式接种,因此,受种鱼常因应激反应过大导致损伤或死亡[11]。此外,接种方式的限制难以达到大规模接种的需求。目前,基于纳米材料递送保护性抗原实现免疫的策略已较为成熟,通过纳米材料负载保护性抗原并黏附在鱼食上,被鱼食用后,在鱼肠道内根据pH改变释放抗原刺激免疫系统应答[12],从而实现群体免疫,极大地降低了疫苗接种的难度和工作强度。本文探讨了不同类型CyHV-Ⅱ疫苗以及免疫方式,并对纳米材料在CyHV-Ⅱ疫苗开发中的潜在应用前景展开讨论,以期为CyHV-Ⅱ的综合防治提供参考。
1 CyHV-Ⅱ的结构
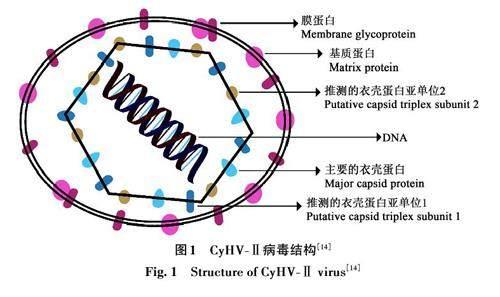
线性双链DNA 病毒CyHV-Ⅱ的表面具有囊膜结构,直径为170~200 nm[13],含有多种膜糖蛋白(membrane glycoprotein)和基质蛋白(matrixprotein)。成熟病毒粒子中的核衣壳呈20 面体状,直径为90~120 nm,含主要的核衣壳蛋白(major capsid protein)和衣壳蛋白亚基(putativecapsid triplex submit)[14](图1)。它们与鲤痘疱疹病(Cyprinid herpesvirus Ⅰ, CyHV-Ⅰ)和锦鲤疱疹病毒(Koi herpesvirus, KHV)同属于异样疱疹病毒科,对比3种病毒的基因组信息发现,CyHV-Ⅰ、CyHV-Ⅱ和KHV基因组分别包含137、154和155个蛋白编码区,且约有120个同源基因呈共线排列[15]。
2 鱼类疫苗的免疫途径
鱼类疫苗的免疫途径主要包括注射、浸泡和口服免疫3种。通过不同的接种方式,疫苗的免疫效果不同。
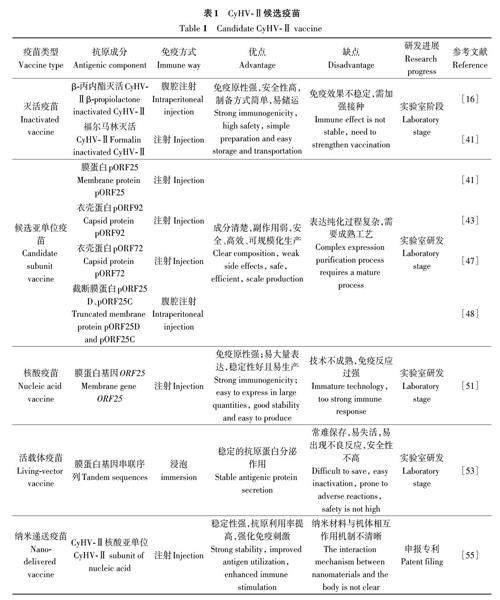
注射免疫是一种有效的接种方式,会引起强烈的免疫应答反应。Zhang等[16]用β-丙内酯灭活的CyHV-Ⅱ疫苗,以腹腔注射方式免疫鲫鱼,免疫保护率达71.4%。注射免疫操作难度大,且易引起应激反应,目前,常利用机械注射取代人工注射,虽减弱了应激反应,但前期投入成本高,难以推广。
浸泡免疫是一种实用、有效的鱼类大规模疫苗接种方法。通过浸泡抗原被鱼皮肤、腮或肠道吸收,引起免疫反应,但鱼皮肤和鳃吸收抗原的效率有限,且许多大分子蛋白质和质粒难以透过细胞膜进入细胞,因此缺乏继发反应[17]。浸泡疫苗与佐剂一起使用常获得更好的效果[18],经β-丙内酯灭活的CyHV-Ⅱ分别与β-葡聚糖、山莨菪碱和东莨菪碱混合后,浸泡免疫异育银鲫,能明显抑制CyHV-Ⅱ的复制,提高免疫效率[19]。
相对于注射和浸泡免疫,口服免疫是一种非侵入性途径,也是对不同体型的鱼类进行疫苗接种的最简单方法之一,具有大规模化、省时省力、操作简单等优点。口服疫苗模拟天然感染的过程,作用于大肠黏膜,引起高效黏膜反应,继而激活体液免疫和细胞免疫,持续时间长、免疫强度大[20],但需要大剂量的抗原,且每条鱼吸收的剂量无法确定[21]。此外,疫苗的有效性受胃中低pH和肠道中消化酶等影响。疫苗在鱼后肠中被吸收时效果更显著,因为肠道黏膜具有吸收可溶性或颗粒性抗原的能力,在这一区域具有多种淋巴细胞、巨噬细胞、粒细胞和浆细胞等,是肠道免疫应答的重要组成部分[22]。Li等[23]构建了重组杆状病毒载体疫苗BacCarassius-D4ORFs,分别以口服和注射的方式免疫异育银鲫,使融合基因D4ORFs 在鱼体内成功复制表达,有效降低了鱼群发病率和死亡率。由此表明,病毒载体疫苗可通过口服和注射方式免疫鲫鱼,但在口服给药过程中,保护抗原通过胃和肠的前部分在抵达后肠时开始发挥作用是目前的研究重点。利用纳米载体疫苗,结合口服佐剂,可中和胃酸,运载保护抗原,提高免疫效果[24]。
3 鱼类疫苗纳米递送载体
口服免疫具有操作简单、适用范围广、成本低等优点,成为鱼类免疫途径的首选,但其效力受胃肠环境的影响。因此,对于鱼用口服疫苗,如何将其安全有效地递送到目标靶点,且在机体内不会被破坏和降解问题亟待解决。随着纳米技术的发展,将纳米材料作为递送系统有望解决上述问题,同时纳米颗粒具有的佐剂效应还可以增强机体免疫应答。
纳米材料的生物相容性好,可提高抗原的生物利用度且减少副作用,但许多纳米材料本身对机体免疫刺激不足,因此常加上佐剂以高效刺激免疫系统,特异性地激起多重免疫反应,如体液免疫和细胞免疫[25]。目前,用于开发鱼用疫苗的纳米材料主要有纳米脂质体、合成聚合纳米材料、无机納米材料和天然来源纳米材料等。
3.1 脂质纳米材料
脂质纳米材料是由磷脂双分子层包裹目标分子形成类似生物膜的一种微型包囊体结构,其生物相容性和可降解性有利于提高药效和降低毒性,因此被广泛用于药物传递[26]。Reyes 等[27]利用一种阳离子脂质体DOTAP(1, 2-diolyl-3-trimethylamine-propane)将VP2衣壳蛋白基因包裹后,疫苗更加稳定,以口服递送方式免疫大西洋鲑鱼,鱼群死亡率降低,受免疫大西洋鲑鱼体内抗体表达水平较高。脂质体通常被制成纳米颗粒,模仿病原体的特性,具有诱导体液和细胞介导免疫反应的能力[28]。
3.2 合成聚合纳米材料
聚乳酸-羟基乙酸(polylactic acid-hydroxyaceticacid,PLGA)是常见的合成聚合有机物,由聚乳酸和聚乙醇组成,具有易降解、释放时间长的特点,被食品药品监督管理局(Food and DrugAdministration,FDA)批准用于药物输送、诊断和临床和基础科学研究[29]。Zhang等[30]利用PLGA纳米颗粒包埋疫苗PMMMA-PLGA(PTRBL)/Trx-SIP,PMMMA 中羧基电离产生的负电荷具有排斥作用,屏蔽了疫苗纳米粒子,使其在鱼后肠中释放,刺激并引发强烈的免疫应答反应。该疫苗对胃中低pH和肠道的水解酶环境具有一定耐受性,可缓慢靶向释放,且在机体内易降解;但其部分成分为医用级PLGA,价格高昂,因此难以实现大范围推广。
3.3 无机纳米材料
与有机高分子纳米材料相比,无机纳米材料具有相对稳定的结构和较低的生产成本,主要包括各种金属及氧化物、无机盐、非金属氧化物等,在应用于纳米疫苗之前需要进行修饰以改善其生物相容性[31]。介孔二氧化硅纳米载体(mesoporous silica nanocarriers,MSN)具有广泛的医学应用前景,其生物相容性可以提高药物的治疗效率[32]。Zhang等[33]将溶藻弧菌的二氢脂酰胺脱氢酶(dihydroamide dehydrogenase, DLDH)抗原加载到MSN中,构建MSN-DLDH纳米疫苗传递系统,在其表面加以邻苯二甲酸羟丙基甲基纤维素(hydroxypropyl methyl cellulose pHthalate,HP55)包封抗原。该纳米疫苗在人工胃液和肠液中相对稳定,具有高负载量、pH可控制释放、价格低廉、性质稳定等优点,但其不能完全抵抗胃酸的降解且在体内积累,过多也会产生毒性。Hu 等[34]将CyHV- Ⅲ ORF149 表达载体与单壁碳纳米管(single-walled carbon nanotubes,SWCNTs)偶联制备疫苗,并通过腹腔注射鱼群,免疫保护率达81.9%;在相同剂量下,SWCNTs载体疫苗的保护率比裸DNA疫苗高33.9%。
3.4 天然来源纳米材料
天然来源的壳聚糖纳米材料具有优良的药物传递载体性能,具有生物相容性、无毒、可降解等特性,易从肾脏排出。根据其抑菌、吸附螯合等性质,可在机体内缓慢持续地释放药物[35]。Zheng等[36]采用离子凝胶法制备了包裹质粒DNA的壳聚糖纳米颗粒pDNA-CS-NPs(chitosan nanoparticles, CSNPs),口服免疫多宝鱼产生较强的免疫保护作用,相对存活率达68%。海藻酸盐也是一种天然来源的纳米材料,Ballesteros等[37]将冻干海藻酸盐与传染性胰腺坏死病病毒(infectious pancreaticnecrosis virus,IPNV)VP2 基因重组质粒混合制备pcDNA-VP2疫苗,能有效诱导天然免疫反应和特异性免疫反应。天然来源的多功能多糖研究历史悠长,再结合现代的新型技术,借鉴TRBIV疫苗的经验,将其制备成微球,黏附性好,可通过口、鼻、胃肠等黏膜给药,适用于CyHV-Ⅱ口服疫苗的研发。
4 CyHV-Ⅱ疫苗类型和研发进展
目前,已知的鱼类疫苗可分为传统疫苗和新型疫苗2种类型。传统疫苗有灭活疫苗、弱毒疫苗等。CyHV-Ⅱ灭活疫苗免疫原性好,可引起机体免疫应答反应,安全性高,制备简单,但疫苗组分不确定,免疫效果不稳定,需要加强接种[38]。
新型疫苗有基因工程疫苗、遗传重组疫苗、合成肽段疫苗等。其中基因工程疫苗被广泛研究和应用,包括亚单位疫苗、核酸疫苗、活载体疫苗、纳米疫苗等。亚单位疫苗常利用免疫原性较强的膜蛋白和衣壳蛋白作为抗原。活载体疫苗在机体内具备一定的增殖能力,可对机体产生持久的保护;但由于病毒的随机变异性,成分相对不稳定,有毒力返强的风险,生物安全隐患较大。核酸疫苗在机体内表达的抗原与天然抗原的构象更为接近,免疫原性更强;但机体摄取质粒效率较低,大部分易被降解。将纳米材料作为递送载体,可以有效保护抗原免受外界环境的影响,在改善靶向抗原呈递、刺激先天性免疫、增强T细胞反应等方面具有较好的作用[39]。
4.1 灭活疫苗
灭活疫苗是指将病原微生物及其代谢产物经过理化方法处理,使其丧失感染性或毒性而保留免疫原性的一类制剂[40]。Ito等[41]用福尔马林灭活的CyHV-Ⅱ作为抗原免疫金鱼,免疫保护率为57%~63.6%。Dharmaratnam 等[42]研制CyHV-Ⅱ灭活疫苗免疫鱼群后,累积死亡率下降,相对成活率达74.03%,免疫效果显著,并能触发鱼体免疫基因的表达,但其免疫应答反应持续的时间较短,因此需要进行多次接种。
4.2 亚单位疫苗
亚单位疫苗是将抗原性相关蛋白重组表达制作成的疫苗,即把特定的抗原基因片段构建在特定载体中表达产生抗原蛋白,具有批量生产、安全性强的优点。
目前,CyHV-Ⅱ亚单位疫苗的研究多集中于衣壳蛋白制备的传统亚单位疫苗[4344]、激酶蛋白重组疫苗[45]和表面囊膜蛋白重组疫苗[46]。Gao等[47]鉴定出CyHV-Ⅱ有74个蛋白,包含3种衣壳蛋白、18种膜蛋白、53种其他蛋白;其中有8种主要的免疫原性蛋白,包括4 种囊膜蛋白和3 种衣壳蛋白。Zhou 等[48] 研究表明,pORF25 是防治异育银鲫GFHN感染的潜在候选疫苗。Dong等[49]利用酵母细胞表面展示技术研制了CyHV-Ⅱ口服疫苗,该疫苗增强了对异育银鲫的保护作用,提高了异育银鲫的存活率。亚单位疫苗由于成分清楚、副作用弱、免疫应答反应强等优点在鱼类中广泛应用;但其在制备过程中,必须纯化以消除抗原中的内毒素,且易产生不溶性、包涵体和非功能性蛋白。
4.3 核酸疫苗
核酸疫苗是将外源病原体的抗原相关基因插入表达载体中,并通过质粒在体内转染宿主细胞并表达,可诱导免疫保护应答,对鱼体起到长时间的免疫保护作用[50]。Yuan等[51]基于CyHV-Ⅱ ORF25基因构建的pEGFP-N1-ORF25 DNA 疫苗可诱导鲤鱼产生特异性抗体,组织相容性基因在鱼肾脏中的表达较高,免疫保护率达70%,表明以抗原基因ORF25 构建的DNA疫苗具有较强的免疫保护作用。但质粒转染宿主细胞可引起宿主基因突变,导致机体表型改变甚至癌变死亡。此外,核酸疫苗在体内持续表达产生抗原蛋白,易打破机体自身的免疫平衡,引发免疫耐受的相关病症。
目前,对核酸疫苗中的表达载体进行基因构建和改造,包括强启动子、密码子优化、联合多基因串连表达等,可制成多联多价疫苗。通过以上方式优化的核酸疫苗在免疫效应方面有一定程度的增强,但其具体应用及安全性等方面还待进一步研究。
4.4 活载体疫苗
活载体疫苗是指将致病病毒的抗原表位基因或者非致病基因进行整合后构建的重组活载体疫苗,主要包括细菌活载体疫苗和病毒活载体疫苗。Cao等[52]利用杆状病毒表达系统构建CyHV-Ⅱ的截短膜蛋白基因疫苗浸泡免疫健康异育银鲫,实验组的IL-11、IFNα 和补体组成基因C3 均显著上调表达。Zhang等[53]构建了重组杆状病毒载体疫苗BacCarassius-D4ORFs六面体,分别通过口服和注射途径接种异育银鲫,相对存活率分别达59.3%和80.01%。
活载体疫苗可以稳定分泌抗原蛋白,免疫后提高鲫鱼的存活率,具有潜在的医疗价值,可用于CyHV-Ⅱ引起的鲤疱疹病毒感染的预防和治疗。活载体疫苗保留的病毒活性成分常较难保存,需要冷藏或者冷冻保存,在常温下易失去活性,且易被其他抗原和抗體影响免疫效果。同时,一些活载体病毒宿主范围广,对细胞趋向性和致病性不同,存在基因结构改变致使毒力返强的问题,机体易出现不良反应,安全性较低[54]。
4.5 纳米递送疫苗
纳米疫苗是直径1~100 nm范围的小分子颗粒,其内部或表面孔径可附着引起免疫应答的成分,传递至机体后引起免疫应答反应[24]。运用纳米材料递送抗原,其免疫原性增强,且稳定性更好,便于贮存和运输。贡成良等[55]公开了基于杆状病毒表达系统制备包裹CyHV-Ⅱ抗原多角体的方法,用该病毒接种家蚕培养细胞,重组病毒表达的CyHV-Ⅱ的抗原蛋白被包裹进家蚕质型多角体内。翟秋明等[56]在其基础上将微米级别疫苗设计成纳米晶体包裹的亚单位疫苗,对抗原有防降解作用和缓控释放作用。纳米材料能够增加抗原释放和循环时间,有利于抗原靶向APCs,但其所载药物的包封率较低,对机体细胞因子的表达分泌刺激有限[5758],且与机体的相互作用机制尚未明晰,因此需要对纳米疫苗的组成、包载及释药能力等进一步优化,还需对其免疫作用机制进行深入研究。
免疫佐剂是纳米递送疫苗不可或缺的部分,在增强免疫系统对抗原的反应方面起辅助作用,一些佐剂具有刺激细胞因子分泌和激活免疫信号通路的特性[59]。Huo等[60]构建CyHV-Ⅱ的重组质粒pcORF25 和pcCCL35.2,它们作为CyHV-Ⅱ的DNA疫苗和分子佐剂,在体内和体外均得到有效的表达。Liu等[61]利用包含CyHV-Ⅲ包膜蛋白基因ORF25 和鲤鱼IL-1β 基因的质粒构建DNA疫苗,用其免疫鲤鱼,可在鱼体中检测到ORF25特异性抗体,而IL-1β的表达增强了亚单位疫苗的免疫效力。DNA 疫苗与分子佐剂结合是防治CyHV-Ⅱ感染的有效方法,可以保护金鱼免受病毒侵袭,且应激反应弱、成本低,可在养殖场水平大规模口服接种,是一种有前景的鱼类疫苗策略。
5 结语
近年来,金鱼疱疹病持续大规模爆发,其发病急、致死率高,造成严重经济损失,因此该病的预防和治疗对我国渔业发展至关重要。对抗传染病的方法,预防大于治疗,研究出安全有效的疫苗迫在眉睫。CyHV-Ⅱ疫苗还处于实验室研究阶段,尚未有商品化疫苗上市(表1)。综上传统疫苗和基因工程疫苗通过不同的途径免疫鱼群,大部分可诱导特异性免疫应答,产生相应抗体,但与直接作用于靶点诱导黏膜免疫的CyHV-Ⅱ纳米疫苗相比,其免疫原性不高,且利用效率较低。
目前,CyHV-Ⅱ疫苗在抗原选择、传递机制、佐剂影响等方面尚缺乏深入研究,因此,在疫苗的设计、应用和增强作用效果存在巨大的创新空间。基因工程疫苗与纳米运载系统融合可迅速提高负载率,以应对不断变异的病毒。虽然现阶段只有少数纳米疫苗处于早期临床阶段,但在预防CyHV-Ⅱ方面已表现出巨大潜力。纳米载体有利于提高疫苗的稳定性、活性、安全性,可为CyHV-Ⅱ的预防提供更优质的策略。
参考文献
[1] HEDRICK R P, GILAD O, YUN S, et al .. A herpesvirus
associated with mass mortality of juvenile and adult koi, a
strain of common carp [J]. J. Aquat. Anim. Health, 2000, 12(1):
44-57.
[2] JEFFERY K R, BATEMAN K, BAYLEY A, et al .. Isolation of
a cyprinid herpesvirus 2 from goldfish, Carassius auratus (L.),
in the UK [J]. J. Fish Dis., 2007, 30(11):649-656.
[3] HEDRICK R P, WALTZEK T B, MCDOWELL T S.
Susceptibility of koi carp, common carp, goldfish, and goldfish×
common carp hybrids to Cyprinid herpesvirus-2 and
herpesvirus-3 [J]. J. Aquat. Anim. Health, 2006, 18(1):26-34.
[4] DANEK T, KALOUS L, VESELY T, et al .. Massive mortality of
Prussian carp Carassius gibelio in the upper Elbe basin
associated with herpesviral hematopoietic necrosis (CyHV-2) [J].
Dis. Aquat. Organ, 2012, 102(2):87-95.
[5] FICHI G, CARDETI G, COCUMELLI C, et al .. Detection of
Cyprinid herpesvirus 2 in association with an Aeromonas sobria
infection of Carassius carassius (L.), in Italy [J]. J. Fish Dis.,
2013, 36(10):823-830.
[6] OUYANG P, ZHOU Y J, WANG K Y, et al .. First report of
Cyprinid herpesvirus 2 outbreak in cultured gibel carp,
Carassius auratus gibelio at low temperature [J]. J. World
Aquacult. Soc., 2020, 51(5):1208-1220.
[7] GOODWIN A E, KHOO L, LAPATRA S E, et al .. Goldfish
hematopoietic necrosis herpesvirus (Cyprinid herpesvirus 2) in
the USA: Molecular confirmation of isolates from diseased fish [J].
J. Aquat. Anim. Health, 2006, 18(1):11-18.
[8] JUNG S J, MIYAZAKI T. Herpesviral haematopoietic necrosis
of goldfish, Carassius auratus (L.) [J]. J. Fish Dis., 1995, 18(3):
211-220.
[9] WANG L, HE J, LIANG L, et al.. Mass mortality caused by
Cyprinid herpesvirus 2 (CyHV-2) in Prussian carp (Carassius
gibelio) in China [J]. B Eur. Assoc. Fish Pat., 2012, 32(5):164-173.
[10] GUO Q, ZHANG M M, LI Y, et al .. Biofloc technology (BFT):
an alternative aquaculture system for prevention of Cyprinid
herpesvirus 2 infection in Gibel carp (Carassius auratus
gibelio) [J]. Fish Shellfish Immun., 2018, 83:140-147.
[11] M-ASHAHBAZI, SANTOS H A. Revolutionary impact of
nanovaccines on immunotherapy [J]. New Eng. J. Med., 2015,
2(2):44-50.
[12] AHMAD M Z, AHMAD J, HAQUE A, et al .. Emerging
advances in synthetic cancer nano-vaccines: opportunities and
challenges [J]. Expert Rev. Vaccines, 2020, 19(11):1053-1071.
[13] JIANG N, YUAN D, ZHANG M, et al .. Diagnostic case report:
disease outbreak induced by CyHV-2 in goldfish in China [J/OL].
Aquaculture, 2020, 523:735156 [2022-08-15]. https://doi.org/
10.1016/j.aquaculture.2020.735156.
[14] GROFF J M, LAPATRA S E, MUNN R J, et al .. A viral
epizootic in cultured populations of juvenile goldfish due to a
putative herpesvirus etiology [J]. J. Vet. Diagn. Invest., 1998,
10(4):375-378.
[15] DAVISON A J, KUROBE T, GATHERER D, et al ..
Comparative genomics of carp herpesviruses [J]. J. Virol.,
2013, 87(5):2908-2922.
[16] ZHANG L L, MA J, FAN Y D, et al .. Immune response and
protection in gibel carp, Carassius gibelio, after vaccination
with beta-propiolactone inactivated Cyprinid herpesvirus 2 [J].
Fish Shellfish Immun., 2016, 49:344-350.
[17] BOGWALD J, DALMO R A. Review on immersion vaccines
for fish: an update 2019 [J/OL]. Microorganisms, 2019, 7(12):
7120627 [2022-08-15]. https://doi.org/10.3390/microorganisms
7120627.
[18] ZHAO R, GENG Y, YU Z, et al .. New detection of Cyprinid
herpesvirus 2 associated with mass mortality in colour crucian
carp (Carassius auratus), in China [J]. Aquac. Res., 2019,
50(6):1705-1709.
[19] YAN Y Y, HUO X C, AI T S, et al .. β-glucan and anisodamine
can enhance the immersion immune efficacy of inactivated
Cyprinid herpesvirus 2 vaccine in Carassius auratus gibelio [J].
Fish Shellfish Immun., 2020, 98(3):285–295.
[20] HUSBAND A J. Novel vaccination strategies for the control of
mucosal infection [J]. Vaccine, 1993, 11(2):107-112.
[21] MUNANGANDU H M, PAUL J, EVENSEN O. An overview
of vaccination strategies and antigen delivery systems for
streptococcus agalactiae vaccines in Nile Tilapia (Oreochromis
niloticus) [J/OL]. Vaccines, 2016, 4(4):4040048 [2022-08-15].
https://doi.org/10.3390/vaccines4040048.
[22] SILIN D S, LYUBOMSKA O V, JIRATHITIKAL V, et al .. Oral
vaccination: where we are? [J]. Expert Opin. Drug Del., 2007,
4(4):323-340.
[23] LI K, YUAN R, ZHANG M T, et al .. Recombinant baculovirus
BacCarassius-D4ORFs has potential as a live vector vaccine
against CyHV-2 [J]. Fish Shellfish Immun., 2019, 92(1):
101-110.
[24] ZAMAN M, GOOD M F, TOTH I. Nanovaccines and their
mode of action [J]. Methods, 2013, 60(3):226-231.
[25] SMITH J D, MORTON L D, ULERY B D. Nanoparticles as
synthetic vaccines [J]. Curr. Opin. Biotech., 2015, 34:217-224.
[26] SEO M W, PARK T E. Recent advances with liposomes as
drug carriers for treatment of neurodegenerative diseases [J].
Biomed. Eng. Lett., 2021, 11(3):211-216.
[27] REYES M, RAMIREZ C, NTILDE A I, et al .. A novel "infeed"
delivery platform applied for oral DNA vaccination
against IPNV enables high protection in Atlantic salmon
(Salmon salar) [J]. Vaccine, 2017, 35(4):626-632.
[28] CVJETINOVIC D, PRIJOVIC Z, JANKOVIC D, et al ..
Bioevaluation of glucose-modified liposomes as a potential
drug delivery system for cancer treatment using 177-Lu
radiotracking [J]. J. Control Release, 2021, 332:301-311.
[29] MAKADIA H K, SIEGEL S J. Poly lactic-co-glycolic acid
(PLGA) as biodegradable controlled drug delivery carrier [J].
Polymers-Basel, 2011, 3(3):1377-1397.
[30] ZHANG L, ZENG Z Z, HU C H, et al .. Controlled and targeted
release of antigens by intelligent shell for improving applicability
of oral vaccines [J]. Biomaterials, 2016, 77:307-319.
[31] MARASINI N, SKWARCZYNSKI M, TOTH I. Oral delivery of
nanoparticle-based vaccines [J]. Expert Rev. Vaccines, 2014,
13(11):1361-1376.
[32] ZHANG C C, XIE H Y, ZHANG Z Y, et al .. Applications and
biocompatibility of Mesoporous silica nanocarriers in the field
of medicine [J/OL]. Front PHarmacol., 2022, 13:829796 [2022-
08-15]. https://doi.org/10.3389/fpHar.2022.829796.
[33] ZHANG W B, ZHU C H, XIAO F N, et al .. pH-controlled
release of antigens using mesoporous silica nanoparticles
delivery system for developing a fish oral vaccine [J/OL]. Front.
Immunol., 2021, 12: 644396 [2022-08-15]. https://doi. org/
10.3389/fimmu.2021.644396.
[34] HU F, LI Y Y, WANG Q, et al .. Carbon nanotube-based DNA
vaccine against koi herpesvirus given by intramuscular
injection [J]. Fish Shellfish Immun., 2020, 98:810-818.
[35] CAO Y, TAN Y F, WONG Y S, et al .. Recent advances in
chitosan-based carriers for gene delivery [J]. Mar. Drugs, 2019,
17(6):381 [2022-08-15]. https://doi.org/10.3390/md17060381.
[36] ZHENG F R, LIU H Z, SUN X Q, et al .. Development of oral
DNA vaccine based on chitosan nanoparticles for the
immunization against reddish body iridovirus in turbots (Hthalmus
maximus Scop ) [J]. Aquaculture, 2016, 452:263-271.
[37] BALLESTEROS N A, ST-JEAN S R, PEREZ-PRIETO S I.
Food pellets as an effective delivery method for a DNA vaccine
against infectious pancreatic necrosis virus in rainbow trout
(Oncorhynchus mykiss, Walbaum) [J]. Fish Shellfish Immun.,
2014, 37(2):220-228.
[38] NEVES A, URBINATTI P, MALAFRONTE R, et al .. Malaria
outside the Amazon region: natural Plasmodium infection in
Anop Helines captured near an indigenous village in the Vale
do Rio Branco, Itanhaem, SP, Brazil [J]. Acta Trop., 2013,
125(1):102-106.
[39] DAS A, ALI N. Nanovaccine: an emerging strategy [J]. Exp.
Rev. Vaccines, 2021, 20(10):1273-1290.
[40] SALGADO-MIRANDA C, LOZA-RUBIO E, ROJAS-ANAYA
E, et al .. Viral vaccines for bony fish: past, present and future [J].
Expert Rev. Vaccines, 2013, 12(5):567-578.
[41] ITO T, KURITA J, OZAKI A, et al .. Growth of cyprinid
herpesvirus 2 (CyHV-2) in cell culture and experimental
infection of goldfish Carassius auratus [J]. Dis. Aquat. Organ,
2013, 105(3):193-202.
[42] DHARMARATNAM A, SUDHAGAR A, DAS S, et al ..
Immune gene expression and protective effects in goldfish
(Carassius auratus L.) immunized with formalin-inactivated
cyprinid herpesvirus-2 (CyHV-2) vaccine [J/OL]. Microbiol.
Pathog., 2022, 164:105452 [2022-08-15]. https://doi.org/10.1016/j.
micpath.2022.105452.
[43] SHEN Z, JIANG Y, LU J, et al .. Application of a monoclonal
antibody specific for the ORF92 capsid protein of Cyprinid
herpesvirus 2 [J]. J. Virol. Methods, 2018, 261:22-27.
[44] KONG S Y, JIANG Y S, WANG Q, et al .. Detection methods of
Cyprinid herpesvirus 2 infection in silver crucian carp
(Carassius auratus gibelio) via a pORF72 monoclonal antibody [J].
J. Fish Dis., 2017, 40(12):1791-1798.
[45] DU M, CHEN M, SHEN H, et al .. CyHV-2 ORF104 activates
the p38 MAPK pathway [J]. Fish Shellfish Immun., 2015, 46(2):
268-273.
[46] WU R H, ZHANG Q, LI Y. Development, characterization of
monoclonal antibodies specific for the ORF25 membrane
protein of Cyprinid herpesvirus 2 and their applications in
immunodiagnosis and neutralization of virus infection [J/OL].
Aquaculture, 2020, 519:734904 [2022-08-15]. https://doi.org/
10.1016/j.aquaculture.2019.734904.
[47] GAO W, WEN H, WANG H, et al .. Identification of structure
proteins of Cyprinid herpesvirus 2 [J/OL]. Aquaculture, 2020,
523:735184 [2022-08-15]. https://doi.org/10.1016/j.aquaculture.
2020.735184.
[48] ZHOU Y, JIANG N, MA J, et al .. Protective immunity in gibel
carp, Carassius gibelio of the truncated proteins of Cyprinid
herpesvirus 2 expressed in Pichia pastoris [J]. Fish Shellfish
Immun., 2015, 47(2):1024-1031.
[49] DONG Z R, MU Q J, KONG W G, et al.. Gut mucosal immune
responses and protective efficacy of oral yeast Cyprinid herpesvirus
2 (CyHV-2) vaccine in Carassius auratus gibelio [J/OL]. Front.
Immunol., 2022, 13:932722. https://doi.org/10.3389/fimmu.2022.
932722.
[50] KRISHNAN B R. Current status of DNA vaccines in veterinary
medicine [J]. Adv. Drug Deliver Rev., 2000, 43(1):3-11.
[51] YUAN X M, SHEN J Y, PAN X Y, et al .. Screening for
protective antigens of Cyprinid herpesvirus 2 and construction
of DNA vaccines [J/OL]. J. Viro Methods, 2020, 280:113877
[2022-08-15]. https://doi.org/10.1016/j.jviromet.2020.113877.
[52] CAO Z W, LIU S J, NAN H, et al .. Immersion immunization
with recombinant baculoviruses displaying Cyprinid herpesvirus 2
membrane proteins induced protective immunity in gibel carp [J].
Fish Shellfish Immun., 2019, 93:879-887.
[53] ZHANG T, GU Y, LIU X, et al .. Incidence of Carassius auratus
gibelio gill hemorrhagic disease caused by CyHV-2 infection
can be reduced by vaccination with polyhedra incorporating
antigens [J/OL]. Vaccines, 2021, 9(4):9040397 [2022-08-15].
https://doi.org/10.3390/vaccines9040397.
[54] FRANCIS M J. Recent advances in vaccine technologies [J].
Vet Clin. N Am-Small, 2018, 48(2):231-241.
[55] 貢成良,曹广力,胡小龙,等.基于杆状病毒表达系统制备包
裹鲤疱疹病毒II 型抗原的多角体的方法:CN106834352A
[P].2017-06-13.
[56] 翟秋明,胡小龙,张星,等.一种纳米晶体包裹CyHv-2核酸亚
单位疫苗的制备方法:CN114854789A[P].2022-08-05.
[57] PAN J B, WANG Y Q, ZHANG C, et al .. Antigen-directed
fabrication of a multifunctional nanovaccine with ultrahigh
antigen loading efficiency for tumor photothermalimmuotherapy
[J/OL]. Adv. MaterNLM, 2018, 30(8): 4408
[2022-08-15]. https://doi.org/10.1002/adma.201704408.
[58] DAR A H, RASHID N, MAJID I, et al .. Nanotechnology
interventions in aquaculture and seafood preservation [J]. Crit.
Rev. Food Sci., 2020, 60(11):1912-1921.
[59] CHAN F, YONG J L, BIJAN E F, et al .. Emerging vaccine
nanotechnology: from defense against infection to sniping
cancer [J]. Acta Pharm. Sin. B, 2022, 12(5):2206-2223.
[60] HUO X C, FAN C J, AI T S, et al .. The combination of
molecular adjuvant CCL35.2 and DNA vaccine significantly
enhances the immune protection of Carassius auratus gibelio
against CyHV-2 infection [J/OL]. Vaccines, 2020, 8(4):
8040567 [2022-08-15]. https://doi.org/10.3390/vaccines8040567.
[61] LIU L F, GAO S, LUAN W M, et al .. Generation and functional
evaluation of a DNA vaccine co-expressing Cyprinid
herpesvirus 3 envelop protein and carp interleukin-1 beta [J].
Fish Shellfish Immun., 2018, 80:223-231.
(責任编辑:张冬玲)

