囊性纤维化儿童营养状况与临床特征和肺功能的相关性分析
李东丹 申月琳 王美辰 杨文利 夏露露 张雨晴 赵顺英 闫洁
(国家儿童医学中心/首都医科大学附属北京儿童医院 1.临床营养科;2.呼吸二科,北京 100045)
囊性纤维化(cystic fibrosis, CF)是一种严重的、进展性的多系统受累的常染色体隐性遗传病,由CF跨膜传导调节蛋白(cystic fibrosis transmembrane conductance regulator, CFTR)缺陷导致。儿童CF 临床特征主要包括进行性阻塞性肺病、鼻窦炎、胰腺分泌功能不全、营养不良,以及CF相关性肝病、糖尿病等。近几十年来,由于新生儿筛查的早期诊断、肺部疾病优化治疗以及终末期肺病的肺移植等诊治方面的不断进展,CF 患者的生存率已显著提高[1]。目前国内针对儿童CF 的研究较少,多数样本量小,且主要侧重于呼吸系统疾病治疗及影像学特征方面的研究,对营养问题的关注度相对不够,而营养不良和生长障碍在CF 儿童中十分常见,与疾病进展、发病率和病死率增加等密切相关。因此,鉴于目前国内缺乏CF 患儿营养状况相关研究及其对疾病发展、预后的重要性,本研究回顾性分析我院收治的CF 患儿的临床资料,对患儿营养状态及临床特征、肺功能等情况进行分析,旨在提高临床医师对儿童CF的认识及CF营养管理的重视,以期改善患儿肺功能、生长发育及预后等。
1 资料与方法
1.1 研究对象
选取首都医科大学附属北京儿童医院2016年1月—2023 年6 月确诊的52 例CF 患儿为研究对象。CF 诊断标准[2]:(1)存在呼吸、消化、内分泌、生殖系统等1 个或多个特征性表现:(2)具有CF家族史;(3)新生儿筛查试验阳性;(4)汗液氯离子浓度≥60 mmol/L;(5)CFTR基因存在复合杂合致病突变;(6)汗液氯离子浓度≥30 mmol/L 且CFTR 功能障碍。其中满足(1)~(3)中至少1条,加上(4)~(6)中至少1 条即可诊断为CF。本研究经我院医学伦理委员会审批([2022]-E-152-R)。
1.2 资料收集
收集患儿临床资料,包括姓名、性别、年龄、体重、身高、母亲孕产史、既往史、家族史、体格检查、临床表现,以及实验室检查、基因检测、汗液试验、胰腺影像学、肺功能检查等结果。
1.3 营养风险筛查
应用改良儿科营养不良评估筛查工具(Screening Tool for Assessment for Malnutrition in Pediatrics, STAMP)进行营养风险筛查,STAMP 总评分为疾病因素、营养摄入情况、生长情况三者之和[3]。STAMP 总评分0~1 分为无/低营养风险,2~3 分为中度营养风险,≥4 分为高度营养风险(表1)。

表1 儿科患者营养异常风险改良STAMP评分表[3]
1.4 营养状况评价
根据2006 版世界卫生组织儿童及青少年生长发育标准评定[5],0~5 岁儿童采用WHO Anthro 软件、>5 岁儿童采用WHO AnthroPlus 软件计算年龄别体重指数(body mass index, BMI) 的Z 评分,BMI Z 评分>-2~-1 为轻度营养不良,>-3~-2 为中度营养不良,≤-3为重度营养不良[6],其中<2岁早产儿采用校正年龄。营养不良发生率=轻度营养不良例数+中度营养不良例数+重度营养不良例数)/总例数。
1.5 营养干预治疗
所有患儿在评估营养状况的基础上强化营养干预,给予高能量饮食,力求患儿达到每日推荐热量(正常儿童能量需求的120%~150%)[7],治疗膳食摄入不足者根据情况口服补充肠内营养制剂,临床疑诊胰腺外分泌功能不全的情况下给予诊断性胰酶替代治疗,依据儿童CF指南[7]根据年龄个体化给予维生素D、维生素A、维生素E 等脂溶性维生素及锌制剂补充治疗。
1.6 统计学分析
采用SPSS 20.0 统计软件进行数据分析。正态分布计量资料以均值±标准差(±s)表示,组间比较采用两样本t检验。非正态分布计量资料以中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用Wilcoxon秩和检验。计数资料以例数和百分率(%)表示,组间比较采用χ2检验。相关性分析采用Pearson 相关分析。P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
共纳入52例CF患儿,其中男童25例(48%),女童27 例(52%),年龄7 月龄至17 岁,平均(9±4)岁;病程1 个月至12 年,平均(51±37)个月;临床表现以呼吸系统症状为主50 例(96%),消化系统症状为主2 例(4%);同时存在消化及呼吸系统症状13例(25%),合并变异性支气管肺曲霉病16例(31%),合并CF相关肝病9例(17%),合并CF相关糖尿病2例(4%),合并胆石症1例(2%)。父母为近亲结婚2例(4%)。
2.2 营养风险情况
52例CF儿童改良STAMP营养风险筛查结果显示,高度营养风险者35例(67%),其中4分8例,5分1例,6分20例,8分6例;中度营养风险者17例(33%),均为3分。
2.3 营养状况评价
采用BMI Z 评分对52 例患儿的营养状态进行评定,结果显示营养正常者18例(35%),营养不良者34例(65%),其中轻度营养不良12例,中度营养不良10例,重度营养不良12例。
2.4 营养相关指标及辅助检查
52 例CF 患儿血清前白蛋白、白蛋白、总蛋白、尿素氮、肌酐、谷丙转氨酶、甘油三酯、总胆固醇、高密度脂蛋白、血清钾、血清钠、脂肪酶、淀粉酶、血红蛋白、红细胞计数、淋巴细胞计数等,均出现不同比例的升高和降低(表2)。大便常规示脂肪球阳性8 例(15%);胰腺超声示胰腺影像学改变35 例(67%)。36 例年龄>6 岁CF患儿完成肺功能检测,肺功能异常者22 例(61%)。
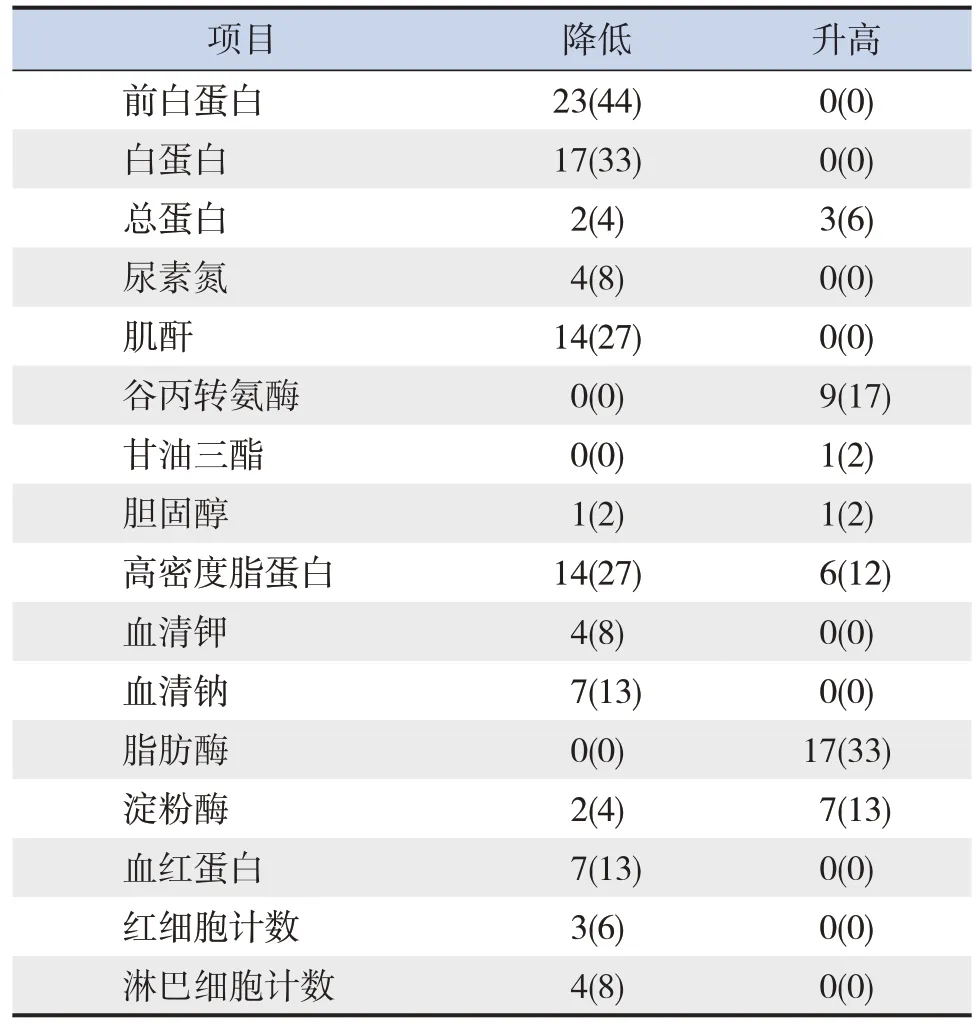
表2 52例CF患儿营养相关指标及辅助检查结果[例(%)]
2.5 营养干预情况
52 例CF 患儿均给予膳食指导,除1 例肥胖患儿外,其他均给予高热量治疗饮食,其中23 例(45%)饮食干预后能量摄入仍未达标,遂额外补充口服肠内营养制剂(整蛋白高能量密度配方9例,短肽含中链甘油三酯高能量密度配方14 例);36例(69%)临床疑诊胰腺外分泌功能不全,但由于实验室条件限制未能行胰腺外分泌功能检测,给予诊断性胰酶替代治疗,并同时补充维生素D、维生素A、维生素E 等脂溶性维生素及锌制剂等治疗。
2.6 营养不良组与营养正常组的临床特征比较
与营养正常组患儿比较,营养不良组患儿病程更长,合并消化系统症状比例更高,血清白蛋白水平更低(P<0.05)。两组患儿性别、年龄、血清总蛋白、前白蛋白、血红蛋白、汗液氯离子浓度、住院次数、曲霉菌感染方面比较差异无统计学意义(P>0.05)。见表3。

表3 营养不良组与营养正常组患儿的临床特征分析
2.7 营养不良组与营养正常组的肺功能比较
营养不良组患儿第1 秒用力呼气量(forced expiratory volume in first second, FEV1)占预测值百分比(FEV1%pred)、第1 秒用力呼气量/用力肺活量(forced expiratory volume in one second to forced vital capacity, FEV1/FVC)、用力呼出25%肺活量的呼气流量(forced expiratory flow at 25% of forced vital capacity exhaled, FEF25) 占 预 计 值 百 分 比(FEF25%pred)、用力呼出50%肺活量的呼气流量(forced expiratory flow at 50% of forced vital capacity exhaled, FEF50)占预测值百分比(FEF50%pred)、用力呼出75%肺活量的呼气流量(forced expiratory flow at 75% of forced vital capacity exhaled, FEF75)占预测值百分比(FEF75%pred)、最大呼气中期流量(maximal mid-expiratory flow, MMEF)占预测值百分比(MMEF%pred)均低于营养正常组(P<0.05)。两组患儿用力肺活量(forced vital capacity, FVC)占预测值百分比(FVC%pred)、呼气流量峰值(peak expiratory flow, PEF) 占 预 测 值 百 分 比(PEF% pred)比较差异无统计学意义(P>0.05)。见表4。
表4 营养不良组与营养正常组的肺功能比较 (± s)

表4 营养不良组与营养正常组的肺功能比较 (± s)
注:[FVC%pred]用力肺活量占预测值百分比;[FEV1%pred]第1 秒用力呼气量占预测值百分比;[FEV1/FVC]第1 秒用力呼气量/用力肺活量;[PEF%pred]呼气流量峰值占预测值百分比;[FEF25%pred]用力呼出25%肺活量的呼气流量占预测值百分比;[FEF50%pred]用力呼出50%肺活量的呼气流量占预测值百分比;[FEF75%pred]用力呼出75%肺活量的呼气流量占预测值百分比;[MMEF%pred]最大呼气中期流量占预测值百分比。
P值0.060 0.011 0.003 0.112 0.038 0.015 0.009 0.010项目FVC%pred FEV1%pred FEV1/FVC PEF%pred FEF25%pred FEF50%pred FEF75%pred MMEF%pred营养正常组(n=14)95±18 89±21 94±6 80±21 76±23 66±25 49±26 61±27营养不良组(n=22)83±16 69±16 83±12 66±17 57±19 44±21 27±14 37±19 t值-1.882-2.548-2.953-1.590-2.077-2.434-2.596-2.564
2.8 CF患儿营养不良严重程度与肺功能相关性
将BMI Z评分与肺功能指标进行相关性分析,结果显示CF患儿BMI Z评分与FEV1%pred、FEV1/FVC、FEF25%pred、 FEF50%pred、 FEF75%pred、 MMEF%pred均呈显著正相关(P<0.05),见图1。

图1 CF患儿BMI Z评分与肺功能指标相关性分析 [BMI]体重指数;[FEV1%pred]第1秒用力呼气量占预测值百分比;[FEV1/FVC]第1 秒用力呼气量/用力肺活量;[FEF25%pred]用力呼出25%肺活量的呼气流量占预测值百分比;[FEF50%pred]用力呼出50%肺活量的呼气流量占预测值百分比;[FEF75%pred]用力呼出75%肺活量的呼气流量占预测值百分比;[MMEF%pred]最大呼气中期流量占预测值百分比。
3 讨论
CF是位于7号染色体CFTR基因突变引起的单基因遗传病,根据缺陷类型分为6 类,Ⅰ~Ⅲ类突变通常导致严重的多系统器官受累[8]。CF 的多系统器官受累常对患儿的营养状况产生不良影响。目前评估CF 儿童营养状态应用最广泛的指标是BMI Z 评分及身高别体重(weight for length, WFL)的Z评分。研究显示BMI Z评分可能比WFL Z评分更适于评估及发现CF 患儿营养不良状态[9]。本研究采用BMI Z 评分对CF 患儿营养状况进行评估,营养不良发生率为65%。Dhochak 等[10]研究显示CF儿童营养不良的发生率以及随访1年和2年的发生率分别为65.5%、54.1%和57.3%。另一项研究显示婴儿CF 中重度营养不良发生率高达89%,病死率达37%[11]。美国有报道CF患儿营养不良多为1岁以下和10岁以上儿童,除早期发育迟缓,青春期也常对CF 儿童成长造成“第二次打击”[12]。因此,应尤其重视CF 婴儿期、青春期及诊断初期的营养筛查评估。CF 患儿通过生命早期及整个儿童期和青春期的积极营养干预实现WFL 和BMI 大于第50 百分位数,可以防止疾病进展,提高患儿生存率[13]。
本研究发现营养不良在CF 患儿中十分普遍,有研究显示CF患儿营养不良风险与年龄呈正相关,年龄越大风险越高,女童更加明显[14]。而本研究结果显示,营养不良患儿病程更长、合并消化系统症状比例更高,而与营养正常患儿在年龄及性别上无显著差异。存在消化系统症状的患儿更容易发生营养不良,可能由于这些患儿大都合并胰腺外分泌功能不全,是CF 患儿营养不良的一个重要促成因素。因此,应更加关注胰腺外分泌功能不全患儿的营养问题,注意在高能量饮食的基础上,同时给予胰酶替代疗法和脂溶性维生素补充等。
CF患者的营养状况与不良临床结局显著相关。CF 肺部疾病进展及肺功能可能是患者生存率的最重要预测因子[15]。本研究显示营养不良CF 患儿FEV1%pred、FEV1/FVC 明显低于营养正常患儿,且其与营养不良严重程度呈显著正相关。CF 基金会数据也表明,BMI百分位数高的儿童具有更好的肺功能,青春期BMI 快速下降是肺功能下降的预测因素之一,并与病死率增加有关[16]。Sanders等[17]研究显示WFL 及BMI 高于第50 百分位数的CF 患儿具有更好的FEV1%pred,2 岁之前WFL 高于第50百分位数患儿6岁时的FEV1%pred更高,早期营养干预可能影响最终的肺健康。Ashkenazi等[18]研究显示CF 儿童期营养状况与成年期FEV1呈正相关,10 岁时BMI 评分低于-0.75 是成年期肺移植的危险因素。另外,研究显示6岁前生长曲线参数一直高于第50 百分位数,其FEV1%pred 表现最高,低于第50 百分位数患儿FEV1%pred 比前者降低近10%[19],因此,推荐遵循CF营养指南建议的生长发育轨迹,持续保持CF患儿BMI在第50百分位数以上仍是重要营养干预目标,尽可能避免经历追赶线性生长。
CF 患者反复肺部感染及肺功能下降可导致营养状况恶化,营养不良也会导致肺部问题加剧。积极的营养干预可以减少肺部感染的频率及肺功能改善。一项研究显示营养不良的CF 患者肺功能明显降低,BMI Z 评分改善后患者FEV1%pred 由89.28%±33.08% 增 加 至103.43%±43.58%[20]。Libeert等[21]研究显示给予肠内营养治疗后CF患者的BMI Z评分明显改善,肺功能下降有所减少。另一研究显示CF 患者肠内营养治疗1 年内肺功能显著提高,并与肺功能长期稳定有关[22]。因此,对于CF 患儿应积极开展以维持良好的营养和保护肺功能为营养目标的治疗。但在胰腺功能充足的CF患者中,随着BMI 的增加,FEV1%pred 的增益较小,而超重/肥胖则可能与较低的肺功能有关[23]。
本研究也存在明显不足,虽然对52例CF患儿均给予了膳食指导,但未能对患儿进行长期营养状态及肺功能监测及随访,如果能在给予饮食营养干预后,对患儿进行定期的营养状况及肺功能监测,并根据患儿营养状态的改善情况,进一步分析与肺功能相关性将更加有意义,为弥补缺陷,希望今后可以开展前瞻性研究来进一步完善。
总之,CF 儿童营养不良发生率较高,营养状况不佳与肺功能下降密切相关。儿童专科医生在实际临床工作中,应密切监测CF儿童的营养状况,积极营养干预改善患儿预后。
作者贡献声明:李东丹负责研究设计及实施;申月琳负责分析/解释数据;王美辰负责统计分析;杨文利、夏露露负责采集数据;张雨晴参与研究实施;赵顺英、闫洁负责对文章的知识性内容作批评性审阅。
利益冲突声明:所有作者均声明不存在利益冲突。
——肺活量测定用于无症状吸烟者气道阻塞筛查

