血塞泰对缺血性脑卒中大鼠STIM1、Orai1蛋白表达的影响
郑钰 张逸凡 王子焱 刘承鑫 任欣 聂子星 郭志华 申思


本文引用: 鄭 钰, 张逸凡, 王子焱, 刘承鑫, 任 欣, 聂子星, 郭志华, 申 思. 血塞泰对缺血性脑卒中大鼠STIM1、Orai1蛋白表达的影响[J]. 湖南中医药大学学报, 2024, 44(4): 557-564.
〔摘要〕 目的 研究血塞泰对缺血性脑卒中(ischemic stroke, IS)大鼠基质相互作用分子1(stromal interaction molecule 1, STIM1)及钙释放激活钙通道蛋白1(calcium release-activated calcium channel protein 1, Orai1)的影响。方法 选取60只SPF级雄性SD大鼠,随机分为假手术组10只、造模组50只,采用线栓法制备大脑中动脉栓塞(medial cerebral artery occlusion, MCAO)模型。采用随机数字表法将造模成功的41只大鼠分为模型组、血塞泰低剂量组(12.6 g/kg)、血塞泰中剂量组(25.2 g/kg)、血塞泰高剂量组(50.4 g/kg)和阿司匹林肠溶片组(18 mg/kg),其中血塞泰低剂量组9只,其余每组各8只;假手术组和模型组给予等量生理盐水灌胃。每组连续干预7 d。采用改良神经功能损伤评分(modified Neurological Severity Score, mNSS)评估各组大鼠神经功能损伤情况,TTC染色法检测大鼠脑组织的梗死面积,ELISA法测定大鼠血清中的白细胞介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)含量,RT-PCR检测脑组织中STIM1、Orai1 mRNA的表达,免疫共沉淀检测脑组织STIM1、Orai1的蛋白相对表达水平。结果 与假手术组相比,模型组大鼠mNSS评分增加(P<0.01),脑梗死率增加(P<0.01),血清IL-6、TNF-α含量增加(P<0.01),脑组织STIM1、Orai1 mRNA表达水平和蛋白相对表达水平升高(P<0.01)。与模型组相比,血塞泰各剂量组和阿司匹林肠溶片组大鼠mNSS评分下降(P<0.05),血清IL-6、TNF-α含量下降(P<0.01),脑组织STIM1、Orai1 mRNA表达水平下降(P<0.01);血塞泰中、高剂量组和阿司匹林肠溶片组大鼠脑梗死率下降(P<0.01),脑组织STIM1、Orai1的蛋白相对表达水平降低(P<0.05,P<0.01)。与阿司匹林肠溶片组相比,血塞泰低剂量组脑梗死率增加(P<0.01),血清IL-6、TNF-α含量增加(P<0.01),脑组织STIM1、Orai1 mRNA表达水平增加(P<0.05);血塞泰中剂量组血清IL-6、TNF-α含量明显增加(P<0.01),脑组织STIM1、Orai1 mRNA表达水平下降(P<0.05,P<0.01);血塞泰高剂量组脑梗死率下降(P<0.01),血清IL-6、TNF-α含量明显下降(P<0.01),脑组织STIM1、Orai1 mRNA表达水平明显下降(P<0.01)。与血塞泰低、中剂量组相比,血塞泰高剂量组mNSS评分下降(P<0.05,P<0.01),脑梗死率下降(P<0.01),血清IL-6、TNF-α含量下降(P<0.01),脑组织STIM1、Orai1 mRNA表达水平下降(P<0.01)。结论 血塞泰能够抑制STIM1、Orai1的表达及结合,减轻炎症反应,改善MCAO大鼠神经功能缺损与降低神经元损伤,从而发挥抗IS的作用。
〔关键词〕 缺血性脑卒中;血塞泰;基质相互作用分子1;钙释放激活钙通道蛋白1;炎症
〔中图分类号〕R278 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.04.005
Effects of Xuesaitai on protein expressions of STIM1 and Orai1 in ischemic stroke rats
ZHENG Yu1,2, ZHANG Yifan1,2, WANG Ziyan1,2, LIU Chengxin1,2, REN Xin1,3, NIE Zixing1,2, GUO Zhihua1,2,3*, SHEN Si1,3*
1. The First Clinical School of Chinese Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410007, China;
2. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 3. The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China
〔Abstract〕 Objective To study the effects of Xuesaitai on expressions of stromal interaction molecule 1 (STIM1) and calcium release-activated calcium channel protein 1 (Orai1) in ischemic stroke (IS) rats. Methods A total of 60 SPF-grade male SD rats were randomized into sham-operated group (n=10) and model group (n=50). A middle cerebral artery occlusion (MCAO) model was prepared by thread embolism. A total of 41 successfully modeled rats were randomly subdivided into model group, low-, medium-, and high-dose (12.6 g/kg, 25.2 g/kg, 50.4 g/kg) Xuesaitai groups, and enteric-coated aspirin tablets group (18 mg/kg), with nine rats in low-dose Xuesaitai group and eight rats in each of the other groups. The sham-operated and model groups were given an equal volume of normal saline by gavage for continuous seven days. The modified Neurological Severity Score (mNSS) was used to assess the neurological damage in rats from each group, TTC staining was used to determine the infarct area of rat brain tissue, ELISA was used to measure the levels of interleukin-6 (IL-6) and tumor necrosis factor-α (TNF-α) in rat serum, RT-PCR was used to check the mRNA expressions of STIM1 and Orai1 in brain tissue, and immunoprecipitation method was used to determine the relative protein expression levels of STIM1 and Orai1 in the brain tissue. Results Compared with the sham-operated group, the model group showed increased mNSS scores (P<0.01), enlarged infarct area (P<0.01), elevated serum levels of IL-6 and TNF-α (P<0.01), and higher mRNA and relative protein expression levels of STIM1 and Orai1 in the brain tissue (P<0.01). Compared with the model group, the rats in each dose group of Xuesaitai as well as enteric-coated aspirin tablets group showed decreased mNSS scores (P<0.05), reduced serum levels of IL-6 and TNF-α (P<0.01), and decreased mRNA expression levels of STIM1 and Orai1 in the brain tissue (P<0.01). Additionally, the rats in the medium- and high-dose Xuesaitai groups, and enteric-coated aspirin tablets group exhibited decreased infarct area (P<0.01) and reduced relative protein expression levels of STIM1 and Orai1 in the brain tissue (P<0.05, P<0.01). The high-dose Xuesaitai group exhibited lower cerebral infarct rate (P<0.01), significantly reduced serum levels of IL-6 and TNF-α (P<0.01), and significantly decreased mRNA expression levels of STIM1 and Orai1 in the brain tissue (P<0.01). Compared with the low- and medium-dose Xuesaitai groups, the high-dose Xuesaitai group exhibited reduced mNSS scores (P<0.05, P<0.01), lower cerebral infarct rate (P<0.01), reduced serum levels of IL-6 and TNF-α (P<0.01), and decreased mRNA expression levels of STIM1 and Orai1 in the brain tissue (P<0.01). Conclusion Xuesaitai can inhibit the expression and binding of STIM1 and Orai1, alleviate the inflammatory response, relieve neurological deficits, and reduce neuronal damage in MCAO rats, thus exerting an anti-IS effect.
〔Keywords〕 ischemic stroke; Xuesaitai; stromal interaction molecule 1; calcium release-activated calcium channel protein 1; inflammation
缺血性脑卒中(ischemic stroke, IS)是指由于脑血管阻塞导致脑部血液供应不足而引起的脑功能障碍的疾病,是脑血管疾病中最常见的严重表现,也是导致残疾和死亡的主要原因之一[1-2]。恢复闭塞动脉血流是挽救IS患者受损组织的首要前提,其次是抗血小板、抗凝血、保护神经、改善血流等辅助治疗[3]。血小板活化在IS的发生和发展过程中起着重要作用,并在IS后带来多种危害,包括血栓形成、再灌注损伤和炎症反应[4-5]。实现血小板活化的主要途径包括细胞内储存的Ca2+释放和细胞外Ca2+进入,这些过程会导致细胞内Ca2+浓度升高,从而触发血小板活化[6-7]。钙库操作性钙离子通道(store-operated calciumentry, SOCE)是调节细胞内钙离子平衡的关键机制。基质相互作用分子1(stromal interaction molecule 1, STIM1)和钙释放激活钙通道蛋白1(calcium release-activated calcium channel protein 1, Orai1)是SOCE的核心组成部分,它们通过相互作用共同调节储存钙通道的开放,以确保细胞内Ca2+的平衡[8]。研究表明,STIM1/Orai1是激动剂诱发血小板Ca2+内流和病理性血栓形成的关键途径[9]。小鼠血小板中STIM1或Orai1的缺乏会导致SOCE缺乏,并降低激动剂刺激后细胞质内Ca2+浓度,抑制血栓形成[10]。
此外,IS后脑组织损伤会引发炎症反应,炎症细胞通过浸润受损脑组织,释放炎症介质,破坏血脑屏障,导致颅内压增高和脑死亡[11]。血小板活化和炎症反应在IS后相互影响。血小板活化可以促进白细胞介素-1(interleukin-1, IL-1)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)等炎症介质释放,导致炎症反应,而炎症反应则可以进一步激活血小板和加剧脑损伤。
中医在防治IS方面有着悠久的历史。中药治疗IS具有多个靶点、多种途径和协同作用的优势,较传统抗血小板药物出血风险小。血塞泰是郭志华教授的经验方,主要用于治疗IS。前期的临床研究结果显示,血塞泰在IS患者的治疗中表现出显著的临床疗效,可明显改善患者的临床症状、提高其生活质量[12-13]。然而,目前尚不清楚血塞泰在IS治疗中的细胞分子生物学作用机制。本研究利用大脑中动脉栓塞(medial cerebral artery occlusion, MCAO)大鼠模型,以STIM1、Orai1的表达为切入点,探究血塞泰的潜在作用机制,为血塞泰的临床应用提供新的研究证据。
1 材料和方法
1.1 实验动物
60只SPF级雄性SD大鼠,6~8周龄,体质量280~300 g,由湖南斯莱克景达实验动物有限公司提供,实验单位使用许可证编号:SYXK(湘)2020-0010,动物合格证号:SCXK(湘)2019-0004。将大鼠置于不锈钢顶格栅聚丙烯笼中饲养,标准条件下饲养,温度保持在23~26 ℃,湿度为50%~70%,通风良好,模拟12 h昼夜交替,标准饲料喂养[饲料种类:普通大小鼠维持饲料,来源:湖南嘉泰实验动物有限公司,合格证号:SCXK(湘)2020-0006],自由进食及饮水。本实验由湖南中医药大学第一附属医院实验动物伦理委员会审查并批准,伦理批准号:ZYFY20210813-15。
1.2 实验药物
阿司匹林肠溶片(拜耳医药保健有限公司,规格:100 mg,国药准字:HJ20160685)。钩藤10 g、石菖蒲10 g(湖南仁上药业股份有限公司,批号:2023012401、2023020601);红景天10 g、杜仲15 g(湖南衡岳中药饮片有限公司,批号:23021901、23040901);僵蚕15 g、丹参10 g、天麻15 g、葛根15 g、白术10 g(湖南中医药大学第一附属医院,批号:NG23022703、HH23031601、SL23033103、HQ23020601、NG230413?01);法半夏10 g(四川新荷花中药饮片股份有限公司,批号:D2302017);川芎10 g(安徽亳药千草国药股份有限公司,批号:202302072);炙甘草10 g(长沙新林制药有限公司,批号:230101)。所有药材等比例混合,按10倍水量煎药后过滤,再加入8倍水量煎,合并两次煎出的药液,放入4 ℃冰箱储存备用。
1.3 主要试剂
(0.38±0.02) mm線栓(北京西浓科技有限公司,批号:2838-A4);RNA提取液、RIPA裂解液、PVDF膜、ECL试剂盒、吐温-20、TBS缓冲液、抗体孵育盒、SDS-PAGE凝胶制备试剂盒(武汉赛维尔生物科技有限公司,批号:G3013、G2002、WGPVDF45、G2014-50ML、GC204002-100ml、G0001-2L、G9055-4、G2003-50T);IL-6 ELISA检测试剂盒、TNF-α ELISA检测试剂盒(江苏晶美生物科技有限公司,批号:J3066-A、J3056-A);ORAI1抗体(武汉三鹰生物技术有限公司,批号:14442-1-ap);辣根过氧化物酶-山羊抗小鼠、辣根过氧化物酶-山羊抗兔、ACTIN抗体(武汉赛维尔生物科技有限公司,批号:GB23301、GB23303、GB11001);STIM1抗体(英国Abcam PLC公司,批号:ab57834)。
1.4 主要仪器
LEICA 819型徕卡刀片(上海徕卡仪器有限公司);TG16W型微量高速离心机(长沙湘智离心机仪器有限公司);HT-111B型恒温摇床(上海赫田科学仪器有限公司);SMV-3500型涡旋混匀仪(武汉赛维尔生物科技有限公司);D3024R型台式高速冷冻离心机(北京DRAGONLAB公司);6100型化学发光仪(上海Clinx公司);CFX Connect型荧光定量PCR仪(美国Bio-Rad公司);RT-6100型酶标仪(深圳雷杜生命科学股份有限公司)。
2 方法
2.1 模型建立与评价
参考文献[14]建立MCAO大鼠模型。完成7 d的适应性喂养后,开始制备MCAO模型。术前12 h禁食,不禁水。随机抽取50只SD大鼠,用2%戊巴比妥钠腹腔注射麻醉。仰卧位固定大鼠,备皮,沿颈正中线切开皮肤1~1.5 cm,钝性分离,分离出右侧颈总动脉(common carotid artery, CCA)、颈外动脉(external carotid artery, ECA)和颈内动脉(internal car?otid artery, ICA),结扎CCA和ECA,将栓线插入CCA,当栓线标记点至ECA与ICA分叉处(插入20 mm)时,系牢栓线,于颈部皮肤切口处涂抹青霉素,缝合,术后保温。其余10只大鼠作为假手术组,在切开颈部皮肤后,消毒并缝合伤口,不插入线栓。所有大鼠于术后6 h可进食、进水。麻醉清醒24 h后,采用改良Zea-Longa评分法对大鼠的神经功能损伤进行评估,评分为1~3分判定为造模成功[14]。
2.2 动物分组与给药
依照随机数字表法将成功造模的41只大鼠分为模型组,血塞泰低、中、高剂量组,阿司匹林肠溶片组,其中血塞泰低剂量组9只,其余每组各8只。从麻醉清醒24 h后开始,每天在固定时间点灌胃1次。根据人和大鼠的体表面积折算法[15],阿司匹林肠溶片组灌胃18 mg/kg;血塞泰低、中、高剂量组分别灌胃12.6、25.2、50.4 g/kg。假手术组和模型组,给予等量的生理盐水进行灌胃。连续干预7 d后取材。
2.3 神经功能缺损评分评估神经功能损伤情况
在治疗7 d后,采用改良神经功能损伤评分(modified Neurological Severity Score, mNSS)评估大鼠的神经功能损伤情况[16]。mNSS包括运动、感觉、平衡木、异常反射四项测试。分数最高为18分,最低为0分,分数越高代表神经功能受损越严重。
2.4 TTC染色法评估脑组织的梗死面积
第7天灌胃后,所有大鼠禁食不禁水12 h。每组选择3只大鼠,取脑组织置于-20 ℃冰箱,冰冻30 min后切片。将切片放入2% TTC染液中,在37 ℃避光条件下染色30 min,之后使用移液枪吸出TTC染色液,接着加入4%多聚甲醛固定液固定24 h。拍照获取图像后,使用Image J软件分析脑组织梗死率。脑梗死率(%)=梗死组织总面积/脑组织面积×100%。
2.5 ELISA测定血清TNF-α、IL-6的含量
取大鼠腹主动脉血置于采血管中,室温下静置30 min,以4 ℃、3 000 r/min、离心10 min(离心半径7 cm),吸取上清液于EP管中。使用IL-6、TNF-αELISA检测试剂盒测定相关指标。测量标准孔和样品孔中的OD值,样品浓度通过标准曲线计算得出。
2.6 RT-PCR检测脑组织STIM1、Orai1 mRNA的表达
使用TRIzol试剂提取大鼠梗死侧脑组织总RNA,并使用超微量紫外分光光度计测量总RNA浓度。使用逆转录试剂盒,在25 ℃保温5 min,42 ℃保温30 min,85 ℃保温5 s的条件下,将RNA逆转录为cDNA,然后进行RT-qPCR扩增。反应條件为:95 ℃进行30 s,95 ℃进行15 s,60 ℃进行30 s,共进行40个循环。用GAPDH作为内参,引物由武汉赛维尔生物科技有限公司合成,引物序列及片段长度详见表1。使用2-ΔΔCt方法分析相应的基因表达结果。
2.7 免疫共沉淀检测脑组织STIM1、Orai1的蛋白表达水平
预先制备大鼠梗死侧脑组织的蛋白裂解液。用protein A/G珠子及IgG,以4 ℃、2 000 r/min离心5 min(离心半径7 cm),收集上清液,采用BCA法测定蛋白浓度。适当稀释后,加入STIM1、Orai1抗体,4 ℃缓慢旋转混合孵育过夜;第二天,加入protein A/G珠子,4 ℃旋转混合孵育2 h,4 ℃、2 000 r/min离心5 min(离心半径7 cm)后弃上清液,收集免疫沉淀复合物。向沉淀蛋白中加入80 μL 1×还原型上样缓冲液,100 ℃煮沸处理10 min,4 ℃、1 000 r/min离心5 min(离心半径7 cm),收集上清液。从上清液中取10 μL样品,进行检测。
2.8 统计学分析
使用SPSS 25.0统计软件进行数据统计。各组实验结果以“x±s”表示。对于满足正态分布和方差齐性的数据,使用单因素方差分析进行组间比较,采用最小显著性差异法进行各组间的两两比较。对于不满足方差齐性的数据,采用秩和检验进行分析。以P<0.05表示差异有统计学意义。
3 结果
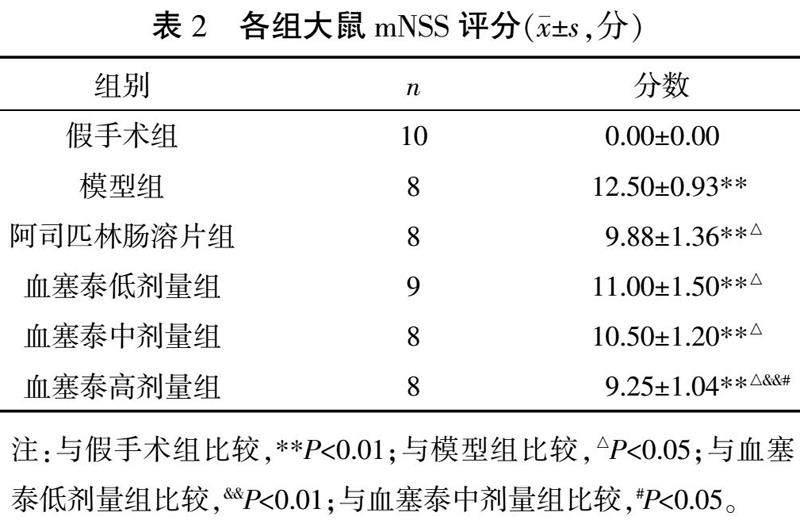
3.1 各组大鼠mNSS评分情况
与假手术组相比,其余各组mNSS评分明显增高(P<0.01);与模型组相比,血塞泰各剂量组和阿司匹林肠溶片组mNSS评分降低(P<0.05);与血塞泰低、中剂量组相比,血塞泰高剂量组mNSS评分降低(P<0.05,P<0.01)。详见表2。
3.2 各组大鼠脑梗死率
与假手术组相比,其余各组脑梗死率显著增加(P<0.01);与模型组相比,血塞泰中、高剂量组和阿司匹林肠溶片组脑梗死率顯著下降(P<0.01);与阿司匹林肠溶片组相比,血塞泰低剂量组脑梗死率显著增加(P<0.01),血塞泰高剂量组脑梗死率显著下降(P<0.01)。血塞泰各剂量组脑梗死率随含药浓度增高而降低(P<0.01)。详见图1、表3。
3.3 各组大鼠血清IL-6、TNF-α水平
与假手术组相比,其余各组血清IL-6、TNF-α含量显著升高(P<0.01);与模型组相比,血塞泰各剂量组和阿司匹林肠溶片组血清IL-6、TNF-α含量显著降低(P<0.01);与阿司匹林肠溶片组相比,血塞泰低、中剂量组血清IL-6、TNF-α含量显著升高(P<0.01),血塞泰高剂量组血清IL-6、TNF-α含量显著降低(P<0.01)。血塞泰各剂量组血清IL-6、TNF-α含量随含药浓度增高而降低(P<0.01)。详见表4。
3.4 各组大鼠脑组织STIM1、Orai1 mRNA表达水平
与假手术组相比,其余各组脑组织STIM1、Orai1 mRNA表达水平显著升高(P<0.01);与模型组相比,血塞泰各剂量组和阿司匹林肠溶片组脑组织STIM1、Orai1 mRNA表达水平显著降低(P<0.01);与阿司匹林肠溶片组相比,血塞泰低剂量组脑组织STIM1、Orai1 mRNA表达表达水平升高(P<0.05),血塞泰中、高剂量组脑组织STIM1、Orai1 mRNA表达水平降低(P<0.05,P<0.01)。血塞泰各剂量组脑组织STIM1、Orai1mRNA表达水平随含药浓度增高而降低(P<0.01)。详见表5。
3.5 各组大鼠脑组织STIM1、Orai1蛋白相对表达水平
与假手术组相比,模型组、阿司匹林肠溶片组和血塞泰低剂量组脑组织STIM1、Orai1蛋白相对表达水平升高(P<0.05,P<0.01);与模型组相比,血塞泰中、高剂量组和阿司匹林肠溶片组脑组织STIM1、Orai1蛋白相对表达水平降低(P<0.05,P<0.01);与阿司匹林肠溶片组相比,血塞泰高剂量组脑组织Orai1蛋白相对表达水平降低(P<0.05);与血塞泰低剂量组相比,血塞泰中、高剂量组脑组织STIM1、Orai1蛋白相对表达水平降低(P<0.05,P<0.01)。详见图2、表6。
4 讨论
IS属于中医学“中风”的范畴,病机可概括为风、火、痰、瘀、虚5个方面。中医理论认为,痰和瘀贯穿于中风发病的全过程。痰、瘀留滞于脏腑经络,导致气机运行失畅。气不顺则生风,风邪裹挟痰、瘀上犯于脑络血管及肢体经络、蒙蔽神窍,继而导致中风的发生。因此,中风的治疗多采用息风化痰通络法[17-18]。血塞泰由僵蚕、丹参、天麻、钩藤、石菖蒲、红景天、川芎、葛根、白术、半夏、杜仲、炙甘草12味药组成。方中僵蚕息风止痉、化痰通络,丹参活血化瘀,天麻平肝息风,三者风、痰、瘀并治,共为君药;钩藤清热平肝,石菖蒲豁痰开窍,红景天养血活血,川芎为“血中气药”,助以丹参、红景天活血之效,共为臣药;佐以葛根解肌升阳、通利经脉,白术、半夏祛湿化痰,杜仲补益肝肾;使以炙甘草补中益气、调和诸药。全方共奏祛风化痰、活血通络之功。药理研究表明,天麻素可延长凝血时间,降低血栓形成风险[19]。天麻中的对羟基苯甲醇可通过抑制家兔血小板细胞外Ca2+内流和细胞内Ca2+释放,防止血小板聚集[20]。石菖蒲挥发油有降低血小板活性、抗血小板聚集、防止血栓形成的作用[21]。丹参酮ⅡA可抑制红细胞聚集、促进血液循环、抵抗血小板黏附、防止血栓形成[22]。王新东等[23]研究发现,含有丹参酮ⅡA的中药制剂黄芪丹参水煎液可抑制大鼠心肌组织中STIM1的表达。侯培媚等[24]研究发现,僵蚕提取物能促进全脑缺血再灌注大鼠大脑皮质区域抗炎因子的表达,并能恢复神经元损伤和行为功能。葛根素可改善MCAO大鼠的神经功能、脑梗死面积和脑水肿体积[25]。以上说明血塞泰具有减轻IS后神经元损伤、抑制血小板活化的潜力。
IS是最常见的脑血管疾病之一,全世界每年约有110多万人死于IS,IS对人类健康造成严重危害[26]。血小板活化会诱发IS[27],在IS急性期,联合使用抗血小板药物可以有效预防IS的再次发生[28]。细胞内Ca2+增加是血小板活化的必要条件[29]。SOCE的核心蛋白STIM1和Orai1通过允许细胞外Ca2+进入细胞内,参与调节血小板活化。GROSSE等[30]研究发现,STIM1激活的小鼠具有更高的Ca2+水平和循环血小板预激活,证实STIM1能触发血小板活化。缺乏Orai1的小鼠血小板SOCE受损,血小板的黏附及促凝作用下降[31]。阿司匹林可以通过阻断血小板激活因子血栓素A2的合成,抑制血小板活化[32]。研究证实,阿司匹林能够阻断及逆转STIM1-Orai1的相互作用[33],其代谢产物水杨酸盐可抑制SOCE[34]。此外,应激和坏死的神经元通过释放损伤相关分子模式,上调炎症介质的表达[35]。炎症介质如TNF-α、IL-6等能够驱动免疫细胞浸润缺血脑组织,而免疫细胞的募集又会进一步促进炎症介质的释放,最终损害血脑屏障,加速脑损伤[36]。抑制MCAO大鼠IL-6、TNF-α的释放可以保护血脑屏障,减轻脑水肿[37]。
脑缺血、缺氧和能量代谢紊乱会导致神经元内质网Ca2+耗竭。STIM1属于SOCE的Ca2+传感器,当内质网Ca2+储存耗尽时,STIM1从内质网转移到细胞膜,与细胞膜上的Orai1相互作用,激活Ca2+内流[38]。SOCE通道过度激活,会引发神经元兴奋性毒性,导致神经元凋亡和神经功能障碍[39]。研究证实,IS大鼠海马组织中STIM1和Orai1蛋白表达和细胞内Ca2+浓度均增加,抑制STIM1的表达可减少神经元的凋亡[40]。缺乏STIM1和Orai1骨髓嵌合体的小鼠在MCAO诱导后24 h的脑组织梗死体积显著降低[8]。
本研究发现,与模型组相比,血塞泰中、高剂量组大鼠mNSS评分、脑组织梗死面积降低;血塞泰低剂量组大鼠mNSS评分下降;血塞泰各剂量组大鼠脑组织STIM1、Orai1 mRNA表達水平降低;血塞泰中、高剂量组大鼠脑组织STIM1和Orai1的结合度下降。说明血塞泰可改善IS后脑组织损伤面积和mNSS评分,下调STIM1和Orai1的表达,抑制STIM1和Orai1的结合,从而发挥抗IS的作用。本实验ELISA结果显示,与模型组相比,血塞泰各剂量组大鼠血清IL-6、TNF-α水平下降,表明血塞泰能够减轻IS后的炎症反应。
综上所述,血塞泰能够抑制STIM1、Orai1的表达及结合度,减轻炎症反应,改善MCAO大鼠神经功能缺损与降低神经元损伤,从而发挥抗IS的作用。本研究为血塞泰的临床应用提供了证据,与治疗IS的传统西药相比,血塞泰在治疗IS方面具有安全性高、疗效显著的特点。但考虑到中药的作用机制通常是涉及多靶点、多通道和多层次的综合调控,对于血塞泰治疗IS的深入作用机制仍需进一步研究。
参考文献
[1] PAUL S, CANDELARIO-JALIL E. Emerging neuroprotective stra?tegies for the treatment of ischemic stroke: An overview of clini?cal and preclinical studies[J]. Experimental Neurology, 2021, 335: 113518.
[2] TUO Q Z, ZHANG S T, LEI P. Mechanisms of neuronal cell death in ischemic stroke and their therapeutic implications[J]. Medicinal Research Reviews, 2022, 42(1): 259-305.
[3] MENDELSON S J, PRABHAKARAN S. Diagnosis and management of transient ischemic attack and acute ischemic stroke: A review[J]. JAMA, 2021, 325(11): 1088-1098.
[4] BLADOWSKI M, GAWRYS J, GAJECKI D, et al. Role of the platelets and nitric oxide biotransformation in ischemic stroke: A translative review from bench to bedside[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020: 2979260.
[5] CHENG Q, WANG M, JIN R, et al. Blocking of PI3-kinase beta protects against cerebral ischemia/reperfusion injury by reducing platelet activation and downstream microvascular thrombosis in rats[J]. Scientific Reports, 2023, 13: 2030.
[6] AMBILY A, KAISER W J, PIERRO C, et al. The role of plasma membrane STIM1 and Ca(2+)entry in platelet aggregation. STIM1 binds to novel proteins in human platelets[J]. Cellular Signalling, 2014, 26(3): 502-511.
[7] DONG M, ZHENG N, REN L J, et al. Increased expression of STIM1/Orai1 in platelets of stroke patients predictive of poor outcomes[J]. European Journal of Neurology, 2017, 24(7): 912-919.
[8] MAMMADOVA-BACH E, NAGY M, HEEMSKERK J W M, et al. Store-operated calcium entry in thrombosis and thrombo-inflammation[J]. Cell Calcium, 2019, 77: 39-48.
[9] LOPEZ J J, ALBARR?N L, JARD?N I, et al. Filamin A modulates store-operated Ca2+ entry by regulating STIM1 (stromal interaction molecule 1)-Orai1 association in human platelets[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2018, 38(2): 386-397.
[10] LPEZ E, GMEZ-GORDO L, CANTONERO C, et al. Stanniocalcin 2 regulates non-capacitative Ca2+ entry and aggregation in mouse platelets[J]. Frontiers in Physiology, 2018, 9: 266.
[11] LI C, SUN T, JIANG C. Recent advances in nanomedicines for the treatment of ischemic stroke[J]. Acta Pharmaceutica Sinica B, 2021, 11(7): 1767-1788.
[12] 郭志华, 宾晓芳, 毛湘屏, 等. 血塞泰治疗脑梗死恢复期风痰瘀阻证临床研究[J]. 中国实用医药, 2010, 5(26): 40-41.
[13] 申 思, 郭志华, 李 雅, 等. 血塞泰对急性脑梗死风痰瘀阻证患者hs-CRP的影响[J]. 山西中医学院学报, 2013, 14(3): 28-30.
[14] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.
[15] 贺石林, 王 键, 王净净. 中医科研设计与统计学[M]. 长沙: 湖南科学技术出版社, 2001: 48-49.
[16] DUAN C Y, WANG H B, JIAO D, et al. Curcumin restrains oxidative stress of after intracerebral hemorrhage in rat by activating the Nrf2/HO-1 pathway[J]. Frontiers in Pharmacology, 2022, 13: 889226.
[17] 刘红豆, 宋 卫, 杨美霞, 等. 祛风化痰汤治疗缺血性中风病急性期风痰阻络证的临床研究[J]. 中西医结合心脑血管病杂志, 2021, 19(20): 3597-3600.
[18] 刘长英, 于 姚, 张根明, 等. 基于数据挖掘中风病风痰瘀阻证用药规律的文献研究[J]. 世界中西医结合杂志, 2021, 16(3): 401-404, 409.
[19] JEON Y D, LEE J H, PARK M R, et al. Gastrodia elata blume and Zanthoxylum schinifolium siebold & zucc mixed extract suppress platelet aggregation and thrombosis[J]. Medicina, 2021, 57(10): 1128.
[20] 郭營营, 蒋 石, 林 青, 等. 天麻中对羟基苯甲醇抗血小板聚集的作用及机制研究[J]. 时珍国医国药, 2014, 25(1): 4-6.
[21] 石坚宏, 李瑞芝, 杨元宵, 等. α-细辛醚、β-细辛醚改善Aβ25-35诱导的PC12细胞损伤及机制[J]. 浙江大学学报(医学版), 2021, 50(5): 591-600.
[22] 徐青云, 苗 琦, 李文武, 等. 益气活血类方药调控血管稳态抗缺血性脑中风的作用机制研究进展[J]. 中医药学报, 2023, 51(10): 120-124.
[23] 王新东, 祁晓霞, 卞 勇, 等. 黄芪丹参水煎液抑制ISO诱导的大鼠心肌重构及其下调STIM1, TRPC1, CaN和NFATc3表达的机制[J]. 中国中药杂志, 2017, 42(14): 2738-2743.
[24] 侯培媚, 徐 昊, 李泽康, 等. 僵蚕提取液促进小胶质细胞极化改善全脑缺血再灌注大鼠神经元损伤及行为学功能[J]. 中国中药杂志, 2023, 48(6): 1589-1596.
[25] HE H Y, GUO T, ZHANG P Y, et al. Puerarin provides a neuroprotection against transient cerebral ischemia by attenuating autophagy at the ischemic penumbra in neurons but not in astrocytes[J]. Neuroscience Letters, 2017, 643: 45-51.
[26] JIANG Y, LIU Z Q, LIAO Y, et al. Ischemic stroke: From pathological mechanisms to neuroprotective strategies[J]. Frontiers in Neurology, 2022, 13: 1013083.
[27] MEZA H T, GIL ? L, SALDA?A A S, et al. Ischaemic stroke in the time of coronavirus disease 2019[J]. European Journal of Neurology, 2020, 27(9): 1788-1792.
[28] KAMAROVA M, BAIG S, PATEL H, et al. Antiplatelet use in ischemic stroke[J]. The Annals of Pharmacotherapy, 2022, 56(10): 1159-1173.
[29] LOPEZ J J, SALIDO G M, ROSADO J A. Cardiovascular and hemostatic disorders: SOCE and Ca2+ handling in platelet dysfunction[J]. Advances in Experimental Medicine and Biology, 2017, 993: 453-472.
[30] GROSSE J, BRAUN A, VARGA-SZABO D, et al. An EF hand mutation in Stim1 causes premature platelet activation and bleeding in mice[J]. The Journal of Clinical Investigation, 2007, 117(11): 3540-3550.
[31] YANG L L, OTTENHEIJM R, WORLEY P, et al. Reduction in SOCE and associated aggregation in platelets from mice with platelet-specific deletion of Orai1[J]. Cells, 2022, 11(20): 3225.
[32] MOUSTAFA B, TESTAI F D. Navigating antiplatelet treatment options for stroke: Evidence-based and pragmatic strategies[J]. Current Neurology and Neuroscience Reports, 2022, 22(11): 789-802.
[33] WANG Y S, HUANG N K, LIN Y C, et al. Aspirin and Sulindac act via different mechanisms to inhibit store-operated calcium channel: Implications for colorectal cancer metastasis[J]. Biomedecine & Pharmacotherapie, 2022, 145: 112476.
[34] FUJIKAWA I, ANDO T, SUZUKI-KARASAKI M, et al. Aspirin induces mitochondrial Ca2+ remodeling in tumor cells via ROS-depolarization-voltage-gated Ca2+ entry[J]. International Journal of Molecular Sciences, 2020, 21(13): 4771.
[35] IADECOLA C, BUCKWALTER M S, ANRATHER J. Immune responses to stroke: Mechanisms, modulation, and therapeutic pote?ntial[J]. The Journal of Clinical Investigation, 2020, 130(6): 2777-2788.
[36] 李 琬, 刘炳周, 鞠建明, 等. 中风瘀热方对缺血性脑卒中模型大鼠的干预作用及机制[J]. 中国药房, 2023, 34(13): 1601-1605.
[37] LIU M, XU Z P, WANG L, et al. Cottonseed oil alleviates ischemic stroke injury by inhibiting the inflammatory activation of microglia and astrocyte[J]. Journal of Neuroinflammation, 2020, 17(1): 270.
[38] YE J J, LI M F, LI Q, et al. Activation of STIM1/Orai1-mediated SOCE in sepsis-induced myocardial depression[J]. Molecular Medicine Reports, 2022, 26(2): 259.
[39] CASTILLO J, LOZA M I, MIRELMAN D, et al. A novel mechanism of neuroprotection: Blood glutamate grabber[J]. Journal of Cerebral Blood Flow and Metabolism, 2016, 36(2): 292-301.
[40] 李 航, 熊 波, 文远超, 等. 沉默Orai1通过调控内质网应激抑制急性脑梗死大鼠海马神经元凋亡[J]. 中国免疫学杂志, 2021, 37(9): 1035-1040.
〔基金项目〕国家自然科学基金(81673955);湖南省卫生健康委科研计划项目(202203074016);湖南省研究生科研创新项目(CX20230832)。
〔通信作者〕*申 思,女,硕士,主治医师,E-mail:472075891@qq.com;郭志华,男,博士,教授,主任医师,博士研究生导师,E-mail:guozhihua112@163.com。

