3 种多糖对猪肉糜脯中游离态和结合态杂环胺及品质的影响
刘超峰 肖燃 杜明静 杜庆飞 陈从贵

摘 要:探讨桑葚多糖、壳聚糖、草菇多糖3 种多糖对猪肉糜脯中杂环胺(heterocyclic aromatic amines,HAAs)形成及物理品质的影响。结果表明:猪肉糜脯中共检出9 种游离态HAAs和6 种结合态HAAs;添加桑葚多糖和壳聚糖可以显著抑制9H-吡啶并[3,4-b]吲哚(9H-pyrido[3,4-b]indole,Norharman)、1-甲基-9H-吡啶并[3,4-b]吲哚(1-methyl-9H-pyrido[3,4-b]indole,Harman)、3-氨基-1,4-二甲基-5H-吡啶并[4,3-b]吲哚(3-amino-1,4-dimethyl-5H-pyrido[4,3-b]indole,Trp-P-1)、2-氨基-3,4-二甲基咪唑并[4,5-?]喹啉、2-氨基-3,8-二甲基咪唑并[4,5-?]喹喔啉(2-amino-3,8-dimethyl-imidazo[4,5-f]quinoxaline,MeIQx)5 种游离态HAAs和Norharman、Harman、Trp-P-1、MeIQx、2-氨基-1-甲基-6-苯基咪唑并[4,5-b]吡啶5 种结合态HAAs的生成(P<0.05),且桑葚多糖抑制效果更佳;抑制蛋白质氧化是多糖减少猪肉糜脯中HAAs生成的最主要途径,其次为抑制脂质氧化和Maillard反应途径;桑葚多糖和壳聚糖可能通过清除2,2-联氮-雙(3-乙基-苯并噻唑啉-6-磺酸)阳离子自由基、抑制蛋白质氧化、脂质氧化和Maillard反应,进而减少猪肉糜脯加工过程中游离态和结合态HAAs的生成,且桑葚多糖对猪肉糜脯的色泽和质构均无显著影响。由此可见,桑葚多糖具有提升猪肉糜脯质量安全的应用潜力,可促进传统肉制品产业高质量发展。
关键词:猪肉糜脯;杂环胺;桑葚多糖;壳聚糖;草菇多糖
Effects of Three Polysaccharides on Free and Bound Heterocyclic Aromatic Amines and Quality Attributes of Dried Minced Pork Slices
LIU Chaofeng1,2, XIAO Ran1,2, DU Mingjing1,2, DU Qingfei1,3,*, CHEN Conggui1,2,*
(1. School of Food and Biological Engineering, Hefei University of Technology, Hefei 230601, China;2. Key Laboratory for Animal Food Green Manufacturing and Resource Mining of Anhui Province, Hefei 230601, China;3. School of Biological Science and Food Engineering, Chuzhou University, Chuzhou 239000, China)
Abstract: The effects of mulberry polysaccharide, chitosan, and straw mushroom polysaccharide on the formation of free and bound heterocyclic aromatic amines (HAAs), physicochemical and textural quality attributes in dried minced pork slices (DMS) were investigated. The results showed that 9 free HAAs and 6 bound HAAs were detected in DMS. Addition of mulberry polysaccharide or chitosan could significantly inhibit the formation of 5 free HAAs, 9H-pyrido[3,4-b]indole (Norharman), 1-methyl-9H-pyrido[3,4-b]indole (Harman), 3-amino-1,4-dimethyl-5H-pyrido[4,3-b]indole (Trp-P-1), 2-amino-3,4-dimethyl-imidazo[4,5-f]quinoline (MeIQ) and 2-amino-3,8-dimethyl-imidazo[4,5-f]quinoxaline (MeIQx); and 5 bound HAAs, Norharman, Harman, Trp-P-1, MeIQx and 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (P < 0.05), mulberry polysaccharide being more effective. Inhibition of protein oxidation could be the most important pathway for polysaccharides to reduce HAAs in DMS, followed by lipid oxidation and Maillard reaction. Mulberry polysaccharide and chitosan could inhibit protein oxidation, lipid oxidation and Maillard reaction and scavenge 2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) cation radical, thus inhibiting the generation of free and bound HAAs during thermal processing of DMS. Neither the color nor texture of DMS was significantly affected by mulberry polysaccharide. These findings implied that mulberry polysaccharide has the potential to improve the quality and safety of DMS, which will promote the high-quality development of the traditional meat industry.
Keywords: dried minced-pork slice; heterocyclic aromatic amines; mulberry polysaccharide; chitosan; straw mushroom polysaccharide
DOI:10.7506/rlyj1001-8123-20240204-034
中图分类号:TS251.6 文献标志码:A 文章编号:1001-8123(2024)02-0035-07
引文格式:
刘超峰, 肖燃, 杜明静, 等. 3 种多糖对猪肉糜脯中游离态和结合态杂环胺及品质的影响[J]. 肉类研究, 2024, 38(2): 35-41. DOI:10.7506/rlyj1001-8123-20240204-034. http://www.rlyj.net.cn
LIU Chaofeng, XIAO Ran, DU Mingjing, et al. Effects of three polysaccharides on free and bound heterocyclic aromatic amines and quality attributes of dried minced pork slices[J]. Meat Research, 2024, 38(2): 35-41. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20240204-034. http://www.rlyj.net.cn
雜环胺(heterocyclic aromatic amines,HAAs)是蛋白质类食品在高温加工过程中产生的一类致癌和致突变性化合物[1],肉制品中HAAs可以分为游离态和结合态2 种[2]。猪肉脯作为一种营养丰富、深受消费者喜爱的传统中式肉制品[3],其生产过程中的高温烤制等环节均可能产生HAAs等有害物质[4]。在稳定猪肉脯质量的前提下,有效减少猪肉脯中HAAs的生成量对传承创新传统肉制品、满足人们高质量的饮食需求十分必要。
自由基途径和羰基途径是形成HAAs的2 个重要途径[5]。有研究结果显示,抗氧化剂可通过清除自由基抑制HAAs形成[6],也可通过抑制蛋白质和脂质氧化降低HAAs含量[7]。多糖作为一类高分子聚合物,广泛存在于植物、动物和微生物体内,具有增强免疫力、抗氧化、降血脂等多种生物活性[8]。近年来,随着研究的不断深入,发现一些多糖具有抑制HAAs形成的潜力[9]。Zhang Nana等[10]研究发现,添加壳聚糖可以抑制烤牛肉中HAAs的形成;Ai Jian[11]、Sangthong[12]等研究发现,植物源桑葚多糖和微生物源草菇多糖均具有良好的抗氧化能力。基于这2 种多糖的抗氧化能力和食用安全性,有可能为抑制猪肉脯加工过程中HAAs的形成提供安全、可行的技术途径,但关于这2 种多糖抑制HAAs生成的文献仍旧较少。
本研究以猪肉糜脯为研究对象,探讨3 种生物来源多糖(桑葚多糖、壳聚糖和草菇多糖)对猪肉糜脯中HAAs形成、猪肉糜脯色泽和质构的影响,并通过测定猪肉糜脯中的Maillard反应、硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值、羰基含量以及多糖的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率和2,2-联氮-双(3-乙基-苯并噻唑啉-6-磺酸)(2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除率,进一步分析3 种多糖对HAAs生成的影响,旨在进一步提升猪肉脯的质量安全,促进传统肉制品产业高质量、可持续发展。
1 材料与方法
1.1 材料与试剂
冷鲜猪后腿肉、猪肥膘、蔗糖、味精购于合肥合家福超市,猪后腿、猪肥膘由宿州福润肉类食品有限公司生产。
红曲红(食品级)、复合磷酸盐(纯度99%,食品级) 浙江一诺生物科技有限公司;桑葚多糖、壳聚糖、草菇多糖(纯度均为60%,食品级) 河南信阳沐凡生物科技有限公司;鱼露(纯度98.6%,食品级) 山东日鑫水产有限公司;11 种HAAs标准品(混合标准溶液,质量浓度均为100 μg/mL),包括9H-吡啶并[3,4-b]吲哚(9H-pyrido[3,4-b]indole,Norharman)、1-甲基-9H-吡啶并[3,4-b]吲哚(1-methyl-9H-pyrido[3,4-b]indole,Harman)、2-氨基-3,4-二甲基咪唑并[4,5-?]喹啉(2-amino-3,4-dimethyl-imidazo[4,5-f]quinoline,MeIQ)、2-氨基-3,8-二甲基咪唑并[4,5-?]喹喔啉(2-amino-3,8-dimethyl-imidazo[4,5-f]quinoxaline,MeIQx)、2-氨基-3,7,8-三甲基咪唑并[4,5-?]喹喔啉(2-amino-3,7,8-trimethyl-imidazo[4,5-f]quinoxaline,7,8-DiMeIQx)、2-氨基-3,4,8-三甲基咪唑并[4,5-?]喹喔啉(2-amino-3,4,8-trimethyl-imidazo[4,5-f]quinoxaline,4,8-DiMeIQx)、2-氨基-1-甲基-6-苯基咪唑并[4,5-b]吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine,PhIP)、2-氨基-3-甲基咪唑并[4,5-f]喹喔啉(2-amino-3-methylimidazo[4,5-f]quinoxaline,IQx)、2-氨基-3,4,7,8-四甲基咪唑并[4,5-?]喹喔啉(2-amino-3,4,7,8-tetramethyl-imidazo[4,5-f]quinoxaline,4,7,8-TriMeIQx)、2-氨基-9H-吡啶并[2,3-b]吲哚(2-amino-9H-pyrido[2,3-b]indole,AαC)和3-氨基-1,4-二甲基-5H-吡啶并[4,3-b]吲哚(3-amino-1,4-dimethyl-5H-pyrido[4,3-b]indole,Trp-P-1) 广州佳途科技股份有限公司;Oasis MCX固相萃取小柱(3 cc/60 mg) 美国Waters公司;乙腈、甲醇、冰醋酸、醋酸铵、正己烷(均为色谱级) 上海麦克林生化有限公司;三氯乙酸、硫代巴比妥酸(均为分析纯) 国药集团化学试剂(上海)有限公司;ABTS阳离子自由基清除能力检测试剂盒 北京索莱宝科技有限公司。
1.2 仪器与设备
QSJ-B02R1碎肉机 佛山小熊厨房电器有限公司;Varioskan Flash全波长酶标仪 美国Bio-Tek仪器公司;DHG-9070A电热鼓风干燥箱 浙江纳德科学仪器有限公司;CKTF-25G电烤箱 佛山市伟仕达电器实业有限公司;FA25均质机 上海弗鲁克科技发展有限公司;ZE-7000电色色差仪 日本色电工业株式会社;TA-XT Plus物性测试仪 英国Stable Micro System公司;液相色谱-四极杆静电场轨道阱质谱联用仪 美国赛默飞世尔公司;UV-6000PC紫外-可见分光光度计 上海元析仪器有限公司;F98荧光分光光度计 上海棱光技术有限公司。
1.3 方法
1.3.1 猪肉糜脯的制备
参考崔萃[13]的方法,去除猪后腿肉中的可见脂肪和结缔组织,然后将猪后腿肉与猪肥膘按质量比8.5∶1.5混合,用绞肉机绞成肉糜;按照肉糜脯配方将相关原辅料混合、加入到腌制袋中,静置60 min后,再将腌制好的混合肉糜平铺于带孔筛板上,厚度约3 mm,摊平后放入烘箱中65 ℃烘干5 h;烘干后的样品置于220 ℃烤箱中烤制5 min(每30 s翻面1 次),然后冷却至室温(约25 ℃),用食品级聚乙烯袋真空包装。一部分猪肉糜脯样品于-20 ℃贮藏,在10 d内进行游离态和结合态HAAs、Maillard反应程度、脂质与蛋白质氧化特性测定;另一部分室温贮藏,2 d内进行质构和色泽测定。
猪肉糜脯配方(以猪肉糜质量计):22%蔗糖、1.2%味精、5.0%鱼露、0.15%复合磷酸盐、0.02%红曲红、15%蛋液、1%甘油、0.5%多糖。对照组不添加多糖。
1.3.2 猪肉糜脯中游离态和结合态HAAs测定
游离态和结合态HAAs的提取按照Li Xuefei等[14]的方法。准确称取4.000 g猪肉糜脯样品、6 mL超纯水和10 mL乙腈置于50 mL离心管中,在10 000 r/min下均质1 min;然后加入10 mL正己烷,涡旋1 min并超声30 min,4 ℃、10 000×g离心10 min;取出离心后上清液中的乙腈层置于另一玻璃试管中;重复上述提取步骤2 次,收集乙腈层用于固相萃取和游离态HAAs测定。将离心管中的沉淀物装入厚壁耐压管中,加入30 mL盐酸溶液(6 mol/L)混合,氮气吹扫1 min;在90 ℃下水解24 h后,4 ℃、12 000×g离心10 min,收集上清液,稀释10 倍后进行固相萃取,用于测定结合态HAAs。
采用Waters Oasis MCX固相萃取柱进行固相萃取,具体操作如下:活化(甲醇、超纯水和0.1 mol/L盐酸溶液各3 mL)→上样(全部样液)→淋洗(0.1 mol/L盐酸溶液和甲醇各3 mL)→洗脱(甲醇、氨水体积比9∶1,6 mL),用氮气吹干洗脱液,并将其重新溶解于400 μL甲醇,用0.22 μm有机滤膜过滤后用于分析。
HAAs的检测按照丁晓倩[15]的方法并略做改动。液相色谱条件:Zorbax SB-C18色谱柱(50 mm×2.1 mm,1.8 μm),柱温40 ℃;流动相A为10 mmol/L乙酸-乙酸铵缓冲溶液(pH 2.9),流动相B为乙腈,流速0.3 mL/min;梯度洗脱程序为:0~1 min,95% A;1~8 min,95%~85% A;8~11 min,85%~73% A;11~13 min,73%~45% A;13~13.5 min,45%~73% A;13.5~14 min,73~95% A;14~15 min,95% A。质谱条件:喷雾电压3.5 kV,毛细管温度320 ℃,去溶剂温度300 ℃;Full MS正离子模式一级全扫描范围50~750 m/z,分辨率70 000。每个样品重复测定3 次。
1.3.3 猪肉糜脯中Maillard反应程度测定
参照Geng Jieting等[16]的方法,称取5.000 g粉碎后的猪肉糜脯样品,置于50 mL具盖离心管中,加入10 mL超纯水和10 mL 20%(m/m)三氯乙酸溶液,15 000 r/min均质1 min,4 ℃、5 000×g离心10 min,取上清液通过0.22 μm滤膜过滤,收集滤液,用超纯水稀释10 倍,使用酶标仪测定420 nm波长处的吸光度,以A420 nm表示Maillard反应程度。每个样品重复测定3 次。
1.3.4 猪肉糜脯中脂质与蛋白质氧化特性测定
参照GB 5009.181—2016《食品安全国家标准 食品中丙二醛的测定》中的分光光度法测定TBARS值,反映样品脂质氧化程度,结果以丙二醛质量计。参照Cheng Jingrong等[17]的方法测定样品中蛋白质的羰基含量,反映蛋白质氧化程度,结果以蛋白质量计。每个样品测定均重复3 次。
1.3.5 多糖DPPH自由基和ABTS阳离子自由基清除率测定
参照Zhou Shiyang等[18]的方法,將4 mL多糖溶液(质量浓度0.5 mg/mL)与4 mL DPPH自由基溶液(0.1 mmol/L)混匀,避光静置1 h后,于515 nm波长处测定吸光度,记为A2;将4 mL蒸馏水与4 mL DPPH自由基溶液(0.1 mmol/L)混匀,在相同条件下测定吸光度,记为A1。按下式计算DPPH自由基清除率。每个样品重复测定3 次。
使用检测试剂盒测定ABTS阳离子自由基清除率。每个样品重复测定3 次。
1.3.6 猪肉糜脯色泽测定
参照崔萃[13]的方法,使用色差仪测定,测定条件为C/2(光源C,视角范围2°),测试区域直径30 mm。用0-CAL板和标准白板(X=92.95,Y=95.00,Z=112.02)校准,测定猪肉糜脯亮度值(L*)、红度值(a*)和黄度值(b*)。每个样品重复测定6 次。
1.3.7 猪肉糜脯质构测定
参照罗琦等[19]的方法,将猪肉糜脯分切成方块状(10 mm×10 mm×2 mm),室温下用圆柱形探头(P36/R)进行压缩模式测试,以硬度、弹性、咀嚼性和内聚性反映质构参数。物性仪检测参数为:测前速率0.5 mm/s、测试速率0.5 mm/s、测后速率5 mm/s;压缩形变量60%;触发力20 g。每个样品重复测定9 次。
1.4 数据处理
采用IBM SPSS 26.0软件(SPSS Inc.,Chicago,Illinois,USA)进行数据统计及Pearson相关性分析,实验结果表示为平均值±标准差;组间比较采用单因素方差分析法中的Duncans多重检验法,P<0.05表示差异显著。采用Origin 2022软件(Northampton,MA,USA)绘图。
2 结果与分析
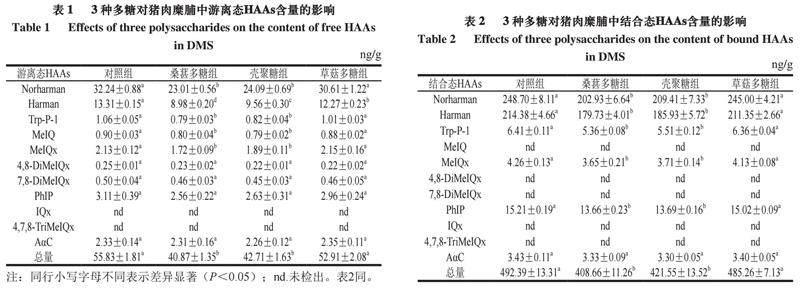
2.1 3 种多糖对猪肉糜脯中游离态HAAs的影响
由表1可知,猪肉糜脯中共检出9 种游离态HAAs,对照组中游离态HAAs总量达到(55.83±1.81)ng/g,各游离态HAAs含量为(0.25±0.01)~(32.24±0.88)ng/g;从游离态HAAs总量看,与对照组相比,添加桑葚多糖、壳聚糖和草菇多糖对猪肉糜脯中总游离态HAAs的抑制率分别为26.80%、23.50%和5.23%;其中,桑葚多糖和壳聚糖对总游离态HAAs的抑制效果均显著(P<0.05),而草菇多糖对其抑制效果不显著。由此可知,3 种多糖中,植物源的天然桑葚多糖显示出最强的抑制猪肉糜脯中游离态HAAs产生的能力。
与对照组相比,添加桑葚多糖和壳聚糖可以显著降低猪肉糜脯中游离态Norharman、Harman、Trp-P-1、MeIQ、MeIQx的含量(P<0.05),且桑葚多糖对Harman的抑制效果显著优于壳聚糖(P<0.05);而草菇多糖仅显著减少游离态Harman含量(P<0.05)。在对照组中,Norharman和Harman占据总游离态HAAs的81.59%,桑葚多糖对游离态Norharman和Harman的抑制率分别为28.63%和32.53%,壳聚糖对二者的抑制率分别为25.28%和28.17%,而草菇多糖对二者的抑制率分别为5.06%和7.81%。桑葚多糖对游离态Trp-P-1、MeIQ、MeIQx的抑制率分别为25.47%、11.11%和19.25%,壳聚糖对三者的抑制率分别为22.64%、12.22%和11.27%,草菇多糖对三者无显著影响。3 种多糖对游离态4,8-DiMeIQx、7,8-DiMeIQx、PhIP和AαC均无显著抑制效果。Zhang Lang等[20]研究发现,黄原胶和羧甲基纤维素钠可通过捕获生成Norharman和Harman所需的前体物质有效抑制烟熏鸡腿中這2 种游离态HAAs的形成。本研究中,3 种多糖对Norharman和Harman的抑制效果也可能与其捕获前体物质有关;而3 种多糖对HAAs抑制效果不同,可能与其在猪肉糜脯加工过程中对自由基的清除能力、抑制蛋白和脂质氧化能力不同有关。
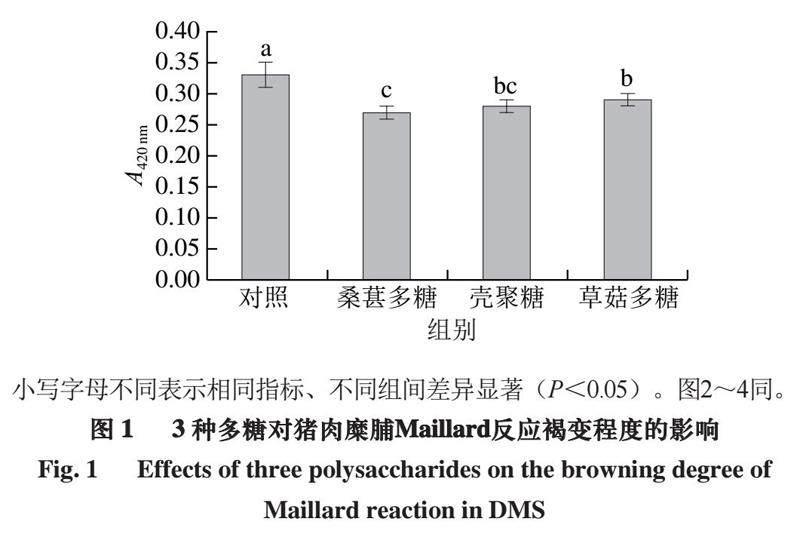
2.2 3 种多糖对猪肉糜脯中结合态HAAs的影响
由表2可知,猪肉糜脯中共检出6 种结合态HAAs,对照组中结合态HAAs总量高达(492.39±13.31)ng/g,各结合态HAAs含量为(3.43±0.11)~(248.70±8.11)ng/g;
从结合态HAAs总量看,与对照组相比,桑葚多糖和壳聚糖均显著减少总结合态HAAs含量(P<0.05),且桑葚多糖对总结合态HAAs的抑制率为17.00%,高于壳聚糖的14.39%;而草菇多糖对总结合态HAAs无显著抑制作用,抑制率仅为1.45%。Xu Yan等[21]研究发现,桑叶提取物通过抑制蛋白质和脂质氧化将肉饼中结合态HAAs总量从1 935.65 ng/g降至1 663.76 ng/g;Xu Yan等[7]研究还发现,清除自由基也可产生抑制结合态HAAs生成的效果。本研究中,3 种多糖可能通过清除自由基、抑制脂质和蛋白质氧化等途径不同程度抑制了结合态HAAs的形成。
与对照组相比,添加桑葚多糖和壳聚糖可显著降低猪肉糜脯中结合态Norharman、Harman、Trp-P-1、MeIQx、PhIP的含量(P<0.05),且桑葚多糖组与壳聚糖组间无显著差异(P>0.05);而草菇多糖对检测到的6 种结合态HAAs均无显著影响。在对照组中,结合态Norharman和Harman占据总结合态HAAs的94.05%;桑葚多糖对结合态Norharman和Harman的抑制率分别为18.40%和16.16%,壳聚糖对二者的抑制率分别为15.79%和13.27%,而草菇多糖对二者的抑制率仅分别为1.50%和1.41%。3 种多糖对结合态AαC均无显著抑制效果。
2.3 3 种多糖对猪肉糜脯Maillard反应程度的影响
由图1可知,与对照组相比,添加3 种多糖均会显著降低猪肉糜脯加工过程中的褐变程度(P<0.05)。褐变程度与Maillard反应产生的类黑素有关,是对Maillard反应程度的反映[22];而Maillard反应也与HAAs的形成有关[23];此外,有研究显示,多糖可与蛋白质之间形成交
联网络,产生空间位阻效应,掩盖部分Maillard反应所需的反应基团,进而减弱Maillard反应程度[24]。由此可以推测,添加的3 种多糖可能通过与猪肉糜脯中的蛋白质发生交联作用,减弱加工过程中的Maillard反应程度,显示出较低的褐变程度,这不仅影响猪肉糜脯的色泽,也显著降低了游离态和结合态HAAs生成量(表1、2),尤其是桑葚多糖添加组。
2.4 3 种多糖对猪肉糜脯TBARS值和羰基含量的影响
由图2可知,与对照组相比,添加桑葚多糖的猪肉糜脯TBARS值显著降低(P<0.05);而添加壳聚糖和草菇多糖的实验组TBARS值无显著变化(P>0.05)。Xu Liang等[25]研究发现,桑葚提取物可以显著抑制肉糜热加工过程中的脂质氧化作用;Liu Fang等[26]研究发现,脂质氧化程度的降低可以减少体系中产生的自由基数量。在本研究中,桑葚多糖可能通过抑制猪肉糜脯加工过程中的脂质氧化减少产生自由基的数量,进而产生抑制HAAs生成的效果。
与对照组相比,添加桑葚多糖和壳聚糖的猪肉糜脯中羰基含量显著降低(P<0.05),而草菇多糖对猪肉糜脯中的羰基含量无显著影响。羰基含量是反映蛋白质氧化程度的指标,而羰基含量的变化可能会引起加工过程中醛类物质的相关变化,进而影响HAAs生成,甲醛、乙醛、苯乙醛等醛类物质都是生成HAAs的中间体[27];蛋白质氧化还会导致蛋白质结构产生相应变化,暴露出结合态HAAs和游离态HAAs之间的特定结合位点,进而促进结合态HAAs产生[21]。此外,蛋白质氧化产生的羰基化合物也可参与Maillard反应,导致HAAs等有害物的产生[28]。
由此可以推测,桑葚多糖和壳聚糖可能通过抑制猪肉糜脯加工过程中的蛋白质氧化减少羰基化合物和醛类物质的生成,进而起到抑制HAAs生成的效果。
2.5 3 种多糖的DPPH自由基和ABTS阳离子自由基清除率
由图3可知,桑葚多糖组的DPPH自由基清除率显著高于壳聚糖和草菇多糖组(P<0.05),达62.93%;壳聚糖和草菇多糖组的DPPH自由基清除率无显著差异,分别为54.41%和57.15%。桑葚多糖和壳聚糖组的ABTS阳离子自由基清除率均显著高于草菇多糖组(P<0.05),分别为41.55%和39.12%;草菇多糖组的ABTS阳离子自由基清除率为34.05%。Zamora等[5]研究发现,抗氧化剂可以通过清除反应过程中产生的自由基,抑制HAAs形成。添加桑葚多糖和壳聚糖能够显著抑制猪肉糜脯中HAAs生成,可能与2 种多糖具有清除DPPH自由基和ABTS阳离子自由基的能力有关。
2.6 HAAs与3 种多糖抗氧化性和美拉德反应程度的相关性分析
通过Pearson相关性分析(表3)可知,3 种多糖的DPPH自由基清除率与游离态HAAs、结合态HAAs均呈负相关(P>0.05);ABTS阳离子自由基清除率与游离态的Norharman、Harman及结合态的Harman、Trp-p-1均呈极显著负相关(P<0.01),而与游离态的Trp-p-1、HAAs总量及结合态的Norharman、PhIP、HAAs总量均呈显著负相关(P<0.05);5 种游离态HAAs(Norharman、Harman、Trp-p-1、MeIQ、MeIQx)及其总量以及5 种结合态HAAs(Norharman、Harman、Trp-p-1、MeIQx、PhIP)及其总量,均与TBARS值、羰基含量和Maillard反应程度呈极显著正相关(P<0.01),尤其是羰基含量与5 种游离态HAAs、5 种结合态HAAs的相关系数均超过0.92。由此说明,抑制蛋白质氧化是多糖抑制猪肉糜脯中HAAs的最主要途径,其次为抑制脂质氧化和Maillard反应,多糖的ABTS阳离子自由基清除能力对游离态和结合态HAAs均有显著影响;桑葚多糖和壳聚糖可能通过清除ABTS阳离子自由基、抑制Maillard反应(图1)和蛋白质及脂质氧化(图2),进而抑制猪肉糜脯加工过程中游离态和结合态HAAs的生成。
2.7 3 种多糖对猪肉糜脯色泽的影响
肉制品的色泽对消费者的视觉吸引力有重要作用[29]。由图4可知,与对照组相比,添加的3 种多糖均可不同程度提高猪肉糜脯的L*,且壳聚糖组的提升效果显著(P<0.05);3 種多糖对猪肉糜脯的a*均无显著影响(P>0.05);添加壳聚糖和草菇多糖可显著提高猪肉糜脯的b*(P<0.05)。蛋白质氧化会导致蛋白质产生交联聚集,进而通过影响光的反射直接影响食品的表面色泽[30]。本研究中添加的多糖可能通过影响猪肉糜脯的蛋白质氧化,从而提高猪肉糜脯的L*;而草菇多糖导致猪肉糜脯b*增加可能与其本身具有棕黄色有关。
2.8 3 种多糖对猪肉糜脯质构的影响
质构特性是评价肉类产品质量的重要因素[31]。由表4可知,与对照组相比,添加的3 种多糖均可不同程度降低猪肉糜脯的硬度和内聚性,且壳聚糖组和草菇多糖组的降低程度显著(P<0.05);3 种多糖对猪肉糜脯的弹性均无显著影响(P>0.05);壳聚糖会显著降低猪肉糜脯的咀嚼性(P<0.05)。可见,添加0.5%桑葚多糖对猪肉糜脯的硬度、弹性和咀嚼性无显著影响(P>0.05),可基本保持猪肉糜脯加工过程中的质构稳定性。有研究表明,猪肉脯的水分含量与其硬度、咀嚼性呈显著负相关[32];多糖结构中富含羟基,与水分子的亲和力较强,且多糖可以减少蛋白质因疏水相互作用而引起的分子间聚集效应,也有利于束缚水分子[33],这些因素可能是添加多糖导致猪肉糜脯硬度和咀嚼性降低的原因。
3 结 论
猪肉糜脯中共检出9 种游离态HAAs和6 种结合态HAAs,添加桑葚多糖和壳聚糖可以显著抑制猪肉糜脯中游离态HAAs和结合态HAAs的生成(P<0.05),且桑葚多糖可能通过清除ABTS阳离子自由基、抑制蛋白质氧化、脂质氧化和Maillard反应抑制猪肉糜脯热加工过程中游离态和结合态HAAs生成。此外,桑葚多糖对猪肉糜脯色泽和质构也无显著影响,在改善猪肉脯质量安全方面显示出较大的应用潜力。这些结果对有效减少猪肉糜脯中HAAs生成量、满足消费者高质量饮食需求、促进传统肉制品产业高质量发展等具有积极的推动作用。然而,多糖如何影响猪肉糜脯中HAAs的具体生成途径,其本身体系还尚不明确,有待进一步深入研究。
參考文献:
[1] Bylsma L C, Alexander D D. A review and meta-analysis of prospective studies of red and processed meat, meat cooking methods, heme iron, heterocyclic amines and prostate cancer[J]. Nutrition Journal, 2015, 14(1): 125-143. DOI:10.1186/s12937-015-0111-3.
[2] Szterk A. Chemical state of heterocyclic aromatic amines in grilled beef: evaluation by in vitro digestion model and comparison of alkaline hydrolysis and organic solvent for extraction[J]. Food and Chemical Toxicology, 2013, 62: 653-660. DOI:10.1016/j.fct.2013.09.036.
[3] 崔萃, 谢婷婷, 周宇, 等. 祁门红茶对传统猪肉脯感官品质及风味的影响[J]. 肉类研究, 2022, 36(5): 54-61. DOI:10.7506/rlyj1001-8123-20220225-010.
[4] 程轶群, 雷阳, 周兴虎, 等. 传统肉制品中杂环胺研究进展[J]. 食品科学, 2022, 43(5): 316-327. DOI:10.7506/spkx1002-6630-20200927-338.
[5] Zamora R, Hidalgo F J. Formation of heterocyclic aromatic amines with the structure of aminoimidazoazarenes in food products[J]. Food Chemistry, 2020, 313: 126-128. DOI:10.1016/j.foodchem.2019.126128.
[6] Vitaglione P, Fogliano V. Use of antioxidants to minimize the human health risk associated to mutagenic/carcinogenic heterocyclic amines in food[J]. Journal of Chromatography B, 2004, 802(1): 189-199. DOI:10.1016/j.jchromb.2003.09.029.
[7] Xu Y, Huang T R, Huang Y Q, et al. Effect of mulberry leaf (Morus alba L.) extract on the quality and formation of heterocyclic amines in braised muscovy duck[J]. Food Control, 2024, 156: 110137. DOI:10.1016/j.foodcont.2023.110137.
[8] Fernandes P A R, Coimbra M A. The antioxidant activity of polysaccharides: a structure-function relationship overview[J]. Carbohydrate Polymers, 2023, 314: 120965. DOI:10.1016/j.carbpol.2023.120965.
[9] Zhang N N, Zhao Y L, Fan D M, et al. Inhibitory effects of some hydrocolloids on the formation of heterocyclic amines in roast beef[J]. Food Hydrocolloids, 2020, 108: 106073. DOI:10.1016/j.foodhyd.2020.106073.
[10] Zhang N N, Zhou Q, Zhao Y L, et al. Chitosan and flavonoid glycosides are promising combination partners for enhanced inhibition of heterocyclic amine formation in roast beef[J]. Food Chemistry, 2022, 375: 131859. DOI:10.1016/j.foodchem.2021.131859.
[11] Ai J, Bao B, Battino M, et al. Recent advances on bioactive polysaccharides from mulberry[J]. Food and Function, 2021, 12(12): 5219-5235. DOI:10.1039/D1FO00682G.
[12] Sangthong S, Pintathong P, Pongsua P, et al. Polysaccharides from Volvariella volvacea mushroom: extraction, biological activities and cosmetic efficacy[J]. Journal of Fungi, 2022, 8(6): 572. DOI:10.3390/jof8060572.
[13] 崔萃. 变温热风干燥与祁门红茶在传统猪肉脯中的应用研究[D]. 合肥: 合肥工业大学, 2023: 12. DOI:10.27101/d.cnki.ghfgu.2022.000542.
[14] Li X F, Yang Z L, Deng J Y, et al. Effect of quercetin and oil water separation system on formation of β-carboline heterocyclic amines during frying process of braised chicken drumsticks[J]. Current Research in Food Science, 2023, 6: 100406. DOI:10.1016/j.crfs.2022.100406.
[15] 丁晓倩. 多酚对羊肉炭烤过程杂环胺形成的抑制作用[D]. 北京: 中国农业科学院, 2021: 15-17. DOI:10.27630/d.cnki.gznky.2021.000507.
[16] Geng J T, Takahashi K, Kaido T, et al. Relationship among pH, generation of free amino acids, and Maillard browning of dried Japanese common squid Todarodes pacificus meat[J]. Food Chemistry, 2019, 283: 324-330. DOI:10.1016/j.foodchem.2019.01.056.
[17] Cheng J R, Liu X M, Zhang Y S, et al. Protective effects of Momordica grosvenori extract against lipid and protein oxidation-induced damage in dried minced pork slices[J]. Meat Science, 2017, 133: 26-35. DOI:10.1016/j.meatsci.2017.04.238.
[18] Zhou S Y, Huang G L, Chen G Y. Extraction, structural analysis, derivatization and antioxidant activity of polysaccharide from Chinese yam[J]. Food Chemistry, 2021, 361: 130089. DOI:10.1016/j.foodchem.2021.130089.
[19] 羅琦, 陈俊, 周宇, 等. 添加赖氨酸的猪肉脯在不同干燥温度下的质构稳定性[J]. 肉类研究, 2023, 37(5): 24-30. DOI:10.7506/rlyj1001-8123-20230116-007.
[20] Zhang L, Xia X F, Sun F D, et al. Inhibitory effects of hydrocolloids on the formation of heterocyclic aromatic amines in smoked chicken drumsticks and the underlying mechanism[J]. Food Hydrocolloids, 2022, 133: 107940. DOI:10.1016/j.foodhyd.2022.107940.
[21] Xu Y, Cheng Y Q, Zhu Z S, et al. Inhibitory effect of mulberry leaf (Morus alba L.) extract on the formation of free and bound heterocyclic amines in pan-fried muscovy duck (Cairina moschata) patties[J]. Food Control, 2023, 144: 109359. DOI:10.1016/j.foodcont.2022.109359.
[22] Klomklao S, Benjakul S, Visessanguan W, et al. Effects of the addition of spleen of skipjack tuna (Katsuwonus pelamis) on the liquefaction and characteristics of fish sauce made from sardine (Sardinella gibbosa)[J]. Food Chemistry, 2006, 98(3): 440-452. DOI:10.1016/j.foodchem.2005.06.013.
[23] Edna H P T, Liang Z J, Zhang P Z, et al. Formation mechanisms, detection methods and mitigation strategies of acrylamide, polycyclic aromatic hydrocarbons and heterocyclic amines in food products[J]. Food Control, 2024, 158: 110236. DOI:10.1016/j.foodcont.2023.110236.
[24] Mousa R M A. Simultaneous inhibition of acrylamide and oil uptake in deep fat fried potato strips using gum Arabic-based coating incorporated with antioxidants extracted from spices[J]. Food Hydrocolloids, 2018, 83: 265-274. DOI:10.1016/j.foodhyd.2018.05.007.
[25] Xu L, Zhu M J, Liu X M, et al. Inhibitory effect of mulberry (Morus alba) polyphenol on the lipid and protein oxidation of dried minced pork slices during heat processing and storage[J]. LWT-Food Science and Technology, 2018, 91: 222-228. DOI:10.1016/j.lwt.2018.01.040.
[26] Liu F, Dai R T, Zhu J Y, et al. Optimizing color and lipid stability of beef patties with a mixture design incorporating with tea catechins, carnosine, and α-tocopherol[J]. Journal of Food Engineering, 2010, 98(2): 170-177. DOI:10.1016/j.jfoodeng.2009.12.023.
[27] Yan Y, Zhou Y Q, Huang J J, et al. Influence of soybean isolate on the formation of heterocyclic aromatic amines in roasted pork and its possible mechanism[J]. Food Chemistry, 2022, 369: 130978. DOI:10.1016/j.foodchem.2021.130978.
[28] Lu F, Kuhnle G K, Cheng Q F. Vegetable oil as fat replacer inhibits formation of heterocyclic amines and polycyclic aromatic hydrocarbons in reduced fat pork patties[J]. Food Control, 2017, 81: 113-125. DOI:10.1016/j.foodcont.2017.05.043.
[29] Turgut S S, I??k?? F, Soyer A. Antioxidant activity of pomegranate peel extract on lipid and protein oxidation in beef meatballs during frozen storage[J]. Meat Science, 2017, 129: 111-119. DOI:10.1016/j.meatsci.2017.02.019.
[30] Li F F, Zhong Q, Kong B H, et al. Deterioration in quality of quick-frozen pork patties induced by changes in protein structure and lipid and protein oxidation during frozen storage[J]. Food Research International, 2020, 133: 109142. DOI:10.1016/j.foodres.2020.109142.
[31] Zhao C Q, Shu L, Lu Z Y, et al. Optimization of pork jerky fermentation with Lactobacillus bulgaricus[J]. Journal of Food Safety, 2018, 38(1): e12406. DOI:10.1111/jfs.12406.
[32] Jeong K, O H, Shin S Y, et al. Effects of sous-vide method at different temperatures, times and vacuum degrees on the quality, structural, and microbiological properties of pork ham[J]. Meat Science, 2018, 143: 1-7. DOI:10.1016/j.meatsci.2018.04.010.
[33] 張正敏, 崔萃, 宋玉申, 等. 海藻糖部分替代蔗糖对猪肉脯品质特性的影响[J]. 肉类研究, 2020, 34(12): 37-42. DOI:10.7506/rlyj1001-8123-20201218-291.
基金项目:安徽省科技重大专项(202003a06020029)
第一作者简介:刘超峰(1998—)(ORCID: 0009-0005-6400-4013),男,硕士研究生,研究方向为肉制品安全。E-mail: 1123008549@qq.com
*通信作者简介:杜庆飞(1986—)(ORCID: 0000-0003-4326-4703),男,讲师,博士研究生,研究方向为肉制品质量安全。E-mail: duqingfei2019@qq.com
陈从贵(1963—)(ORCID: 0000-0001-7011-0406),男,教授,硕士,研究方向为肉制品加工及副产物综合利用。E-mail: chencg1629@hfut.edu.cn

