黄刺多糖中单糖含量与体外降血糖活性相关性分析
岳庆明,韩丽娟,邓永蓉,马娜娜,赵玉欣
(青海大学农牧学院,青海 西宁 810016)
黄刺,学名直穗小檗(Berberis dasystachyaMaxim.),是青藏高原一种药食两用的植物浆果资源。目前,市场上黄刺浆果相关产品有“三刺果汁[1]”“三刺果粉[2]”“三刺面霜[3]”等。黄刺果实中富含多种生物活性物质,如小檗碱、植物甾醇、有机酸、黄酮、多糖和多酚等,一直以来备受科学界关注。黄刺多糖(Berberi dasystachyapolysaccharides,BDPs)作为一种功能性植物多糖,具有抗肿瘤、降血糖及抗氧化活性等功能[3-5]。
韩丽娟等[5]研究发现黄刺果粉可改善糖尿病大鼠血液中的葡萄糖水平,并对血清及组织中的氧化应激酶和丙二醛(malondialdehyde,MDA)具有调节作用。本课题组前期研究表明,分级醇沉的BDPs在抗氧化活性和降血糖活性方面具有良好效果[6]。Zhou Wen等[7]研究表明,超滤BDPs可有效改善2型糖尿病大鼠症状,提高机体抗氧化能力,调节氧化应激水平,通过逆转2型糖尿病大鼠肠道菌群失调和代谢紊乱,调节代谢产物-肠道微生物的相互作用达到治疗2型糖尿病目的。BDPs作为功能性多糖,其降血糖效果显著。α-葡萄糖苷酶作为消化酶将淀粉和双糖转化为葡萄糖,加速葡萄糖生成速率;α-淀粉酶作为淀粉水解酶,水解后产生的糊精、葡萄糖等产物可导致2型糖尿病发生,针对两种酶的抑制剂可延缓葡萄糖生成速率,抑制肠道消化吸收降低餐后血糖水平[8],因此检测这两种体外酶抑制率可作为主要的体外降血糖活性评价体系。谭西等[9]研究表明,多糖的降血糖活性与多糖结构密切相关。研究表明,不同产地的植物多糖中单糖含量及单糖组成不同且导致其生物活性会有所差异[10]。目前,国内外对不同产地BDPs其体外降血糖活性的比较及其单糖含量与体外降血糖活性相关性研究鲜有报道。
You Shu等[11]研究表明,身体各组织长期暴露在高水平游离脂肪酸(或棕榈酸)和葡萄糖条件下会对身体组织造成严重损伤,称为糖脂毒性损伤,尤其对胰岛β细胞损伤更为严重。高糖高脂引起的糖脂毒性(glucolipotoxicity,GLTy)是导致β细胞凋亡和氧化应激发生的罪魁祸首,进而导致β细胞功能受损。因此,预防胰岛β细胞免受GLTy引起的氧化应激和细胞凋亡对阻止2型糖尿病进展至关重要[12]。通过无毒无害天然活性物质保护已受GLTy损伤的胰岛β细胞,进而有效提高胰岛细胞存活率达到治疗和预防2型糖尿病效果迫在眉睫。课题组前期研究发现,BDPs可提高H2O2诱导损伤的胰岛细胞抗氧化酶活性,降低活性氧(reactive oxygen species,ROS)和MDA水平,进而达到保护氧化损伤胰岛细胞的作用[4]。然而,鲜见关于BDPs对GLTy诱导损伤的胰岛细胞活性的报道。
本实验以青海省5 个不同产地黄刺浆果为研究对象,超声辅助热水浸提不同产地BDPs,首先对其理化性质及单糖组成、含量进行对比分析研究;其次,通过建立高糖高脂双诱导剂联合诱导RIN-m5F胰岛细胞GLTy模型,测定不同产地BDPs干预后细胞增殖活性、ROS、肿瘤坏死因子(tumor necrosis factor,TNF)-α水平;最后采用Pearson相关性分析方法,对不同产地BDPs单糖含量与降血糖活性、胰岛细胞增殖活性、ROS及TNF-α间的相关性进行分析。以期明确黄刺单糖含量与体外降血糖活性相关性,为药食同源黄刺浆果在降血糖方面开发利用及其构效关系的深入研究提供理论依据。
1 材料与方法
1.1 材料与试剂
黄刺浆果采自青海省周边州县互助县(BDPs-I)、大通县(BDPs-II)、循化县(BDPs-IV)、湟源县(BDPs-V)及西宁市(BDPs-III),采摘时间为2021年8月下旬—10月上旬果实成熟期。
RIN-m5F胰岛细胞(胰岛β细胞瘤细胞)赛百慷生物技术股份有限公司;石油醚、无水乙醇、正丁醇、氯仿、甲醇(均为分析纯)国药集团化学试剂有限公司;三氟乙酸(色谱纯)上海安谱生物科技有限公司;α-淀粉酶、α-葡糖糖苷酶 上海源叶生物科技有限公司;细胞计数试剂盒(cell counting kit-8,CCK-8)生工生物工程(上海)股份有限公司;RPMI-1640培养基 上海逍鹏生物科技有限公司;胎牛血清 浙江天杭生物科技股份有限公司;ROS检测试剂盒、TNF-α检测试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
QYLDZ-6真空冷冻干燥机 上海乔跃电子有限公司;UV-2600紫外-可见分光光度计 日本岛津企业有限公司;Reacti-thermo氮气吹扫仪、ICS5000离子色谱仪、酶标仪、热重仪、U3000液相色谱仪 美国Thermo Fisher Scientific公司;SU8220冷场发射扫描电子显微镜 日本日立有限公司;BSC-1304IIA2生物安全柜 苏州安泰空气技术有限公司;AE31E倒置生物显微镜 麦克奥迪实业集团有限公司;HF90二氧化碳培养箱 上海力申科学仪器有限公司;H1850医用离心机 长沙湘仪离心机仪器有限公司;Optilab T-rEX示差检测器、DAWN HELEOS II激光光散射检测器 美国怀亚特科技公司。
1.3 方法
1.3.1 BDPs提取
不同产地黄刺干果→粉碎过筛(100 目)→石油醚脱脂(40 ℃,料液比1∶5)→85%(V/V)乙醇溶液脱单糖(50 ℃,料液比1∶3)→超声热水浸提(80 ℃,料液比1∶30)→Sevag法除蛋白→D101大孔树脂脱色→透析袋除小分子物质→80%(V/V)乙醇溶液醇沉(4 ℃,静置过夜)→冷冻干燥→得不同产地黄刺粗多糖。由图1可见,相同条件下由不同产地黄刺干果制备的多糖组织形态存在较大差异,BDPs-I和BDPs-IV整体呈现细小颗粒状和细腻粉末状,BDPs-II以轻盈絮状物为主,而BDPs-III和BDPs-V中呈大小不一的沙粒状,说明黄刺粗多糖最终外貌形态与产地存在较大关联。

图1 不同产地BDPs外貌形态Fig.1 Pictures of BDPs from different geographical origins
1.3.2 BDPs化学成分测定
分别采用苯酚-硫酸法[13]、硫酸-咔唑法[14]、DNS试剂法[15]、考马斯亮蓝法[16]测定BDPs中的多糖、糖醛酸、还原糖和蛋白质量分数。
1.3.3 单糖组成分析
精确称量BDPs样品5 mg至色谱瓶,加入1mL 2mol/L三氟乙酸酸溶液,121 ℃加热2 h。氮气吹干,加入甲醇清洗吹干,重复操作2~3 次,加入无菌水溶解待测。采用离子色谱系统,色谱柱DionexTMCarboPacTMPA20(150 mm×3.0 mm,10 μm),进样量为5 μL。流动相A为0.1 mol/L NaOH溶液,流动相B为0.1 mol/L NaOH和0.2 mol/L NaAc混合液;流速0.5mL/min;柱温为30 ℃;洗脱梯度程序:0~30 min,95%~80% A、5%~20% B;30.1~45 min,60% A、40% B;45.1~60 min,95% A、5% B。
1.3.4 单糖含量测定
采用外标法定量,通过配制不同浓度标样制定标准曲线。线性关系信息如表1所示,再以样品中各单糖对应的峰面积代入标准曲线计算质量浓度,进一步计算各单糖含量。单糖含量(W)计算如式(1)所示:
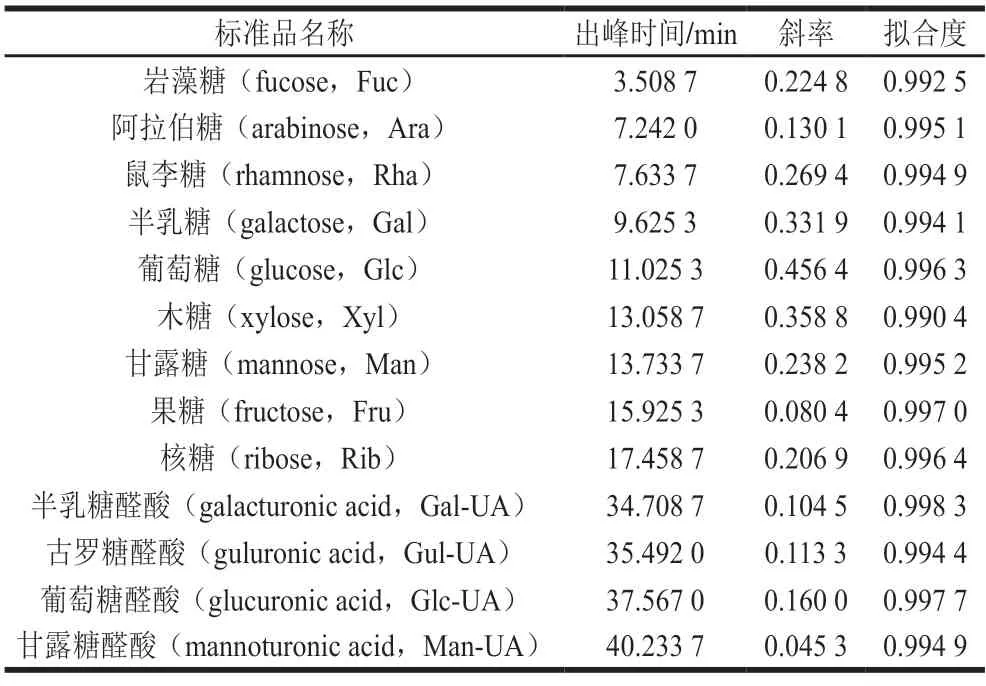
表1 单糖含量标准曲线参数Table 1 Standard curve parameters for determination of monosaccharide contents
式中:c为通过标准曲线计算的质量浓度/(μg/mL);V为样品提取液体积/mL;F为稀释因子;M为样品称取总量/mg。
1.3.5 BDPs分子质量测定
采用凝胶色谱仪、激光散射仪和示差检测器连用测定BDPs分子质量。将样品溶解在0.1 mol/L NaNO3溶液(含质量分数0.02% NaN3)中,终质量浓度为1 m g/m L,通过孔径为0.4 5 μ m 的过滤器过滤后上机检测。采用凝胶排阻色谱柱O h p a k S B-805 HQ(300 mm×8 mm)和Ohpak SB-803 HQ(300 mm×8 mm)串联,柱温45 ℃,进样量100 μL,流动相0.02% NaN3溶液和0.1 mol/L NaNO3溶液,流速0.6 mL/min,0~75 min内等度洗脱[17]。
1.3.6 BDPs初级结构表征
1.3.6.1 紫外光谱分析
将BDPs配制成质量浓度为1 mg/mL的溶液,用紫外-可见分光光度计在波长200~800 nm范围内进行全波长扫描[18]。
1.3.6.2 傅里叶变换红外光谱分析
将干燥的多糖粉末与KBr按1∶5的比例充分研磨混合后压片,用傅里叶变换红外光谱仪在4 000~400 cm-1范围内进行扫描[19]。
1.3.6.3 扫描电子显微观察
将表面涂有薄层金的BDPs在电子显微镜系统下扫描观察[20]。
1.3.6.4 刚果红试验
精确称取BDPs配制成3 mg/mL的多糖溶液,取1 mL BDPs溶液与0.2 mmol/L刚果红溶液等体积混合,之后分别加入1 mol/L NaOH溶液控制最终溶液中NaOH浓度为0~0.5 mol/L,在200~600 nm下进行全波长扫描测定其最大吸收波长[21]。
1.3.7 BDPs热重分析
准确称取定量的BDPs多糖,使用热重仪在氮气环境下将多糖温度由25 ℃升高到900 ℃,升温速率为10 ℃/min,进行热重分析[22]。
1.3.8 BDPs体外降血糖活性测定
1.3.8.1α-葡萄糖苷酶抑制活性分析
参考文献[23]稍作改动,配制质量浓度分别为16、8、4、2、1、0.5 mg/mL的BDPs溶液,同时配制2 U/mL的α-葡萄糖苷酶。按表2添加各试剂,利用酶标仪在405 nm处测量吸光度。通过式(2)计算α-葡糖苷酶的抑制率:

表2 α-葡萄糖苷酶抑制率测定体系Table 2 Preparation of reaction systems for α-glucosidase inhibitory assay
式中:A1为空白组的吸光度;A2为空白对照组的吸光度;A3为样品组的吸光度;A4为样品对照组的吸光度。
1.3.8.2α-淀粉酶抑制活性分析
参考文献[24]稍作改动,配制质量浓度分别为16、8、4、2、1、0.5 mg/mL的BDPs溶液及15 U/mLα-淀粉酶溶液。按表3添加各试剂,利用酶标仪在540 nm处测定吸光度。按式(3)计算α-淀粉酶的抑制率:
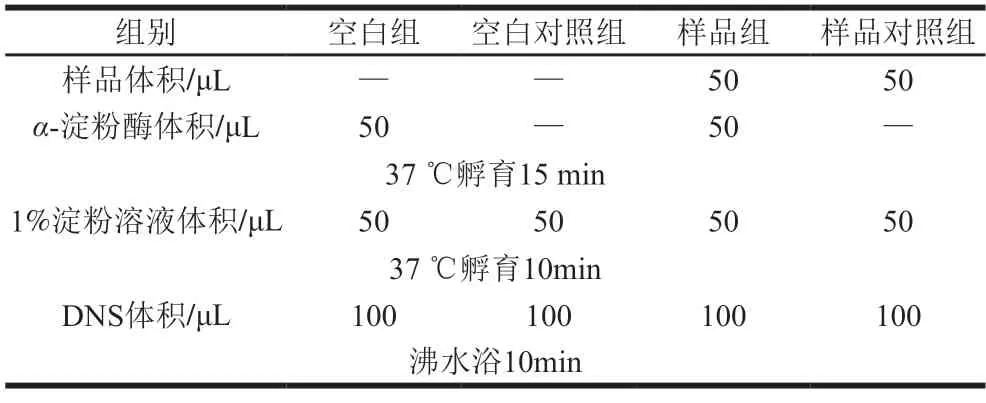
表3 α-淀粉酶抑制率测定体系Table 3 Preparation of reaction systems for α-amylase inhibitory assay
式中:A1为空白组的吸光度;A2为空白对照组的吸光度;A3为样品组的吸光度;A4为样品对照组的吸光度。
1.3.9 细胞实验
RIN-m5F细胞在标准细胞培养条件下(5% CO2、37 ℃)在含有10%(V/V)胎牛血清、1%(V/V)双抗(100 U/mL青霉素和100 μg/mL链霉素)的完全培养基中生长直至细胞贴壁。在细胞密度达到80%~90%时,用0.25%胰蛋白酶消化后进行传代、冻存及后续铺板实验。
1.3.10 GLTy诱导RIN-m5F细胞凋亡模型建立
前期课题组分别成功建立了45 mmol/L高糖诱导胰岛细胞和0.2 mmol/L高脂诱导胰岛细胞的单一诱导RIN-m5F细胞毒性模型。在此基础上混合两种单一诱导剂溶液,使双诱导剂中高糖终浓度为22.5 mmol/L,高脂终浓度为0.1 mmol/L进行共同诱导,通过控制时间(12、24、36、48 h)确定最终RIN-m5F细胞GLTy模型。
1.3.11 不同产地BDPs对GLTy细胞损伤的保护作用研究
1.3.11.1 实验分组
空白对照组:无细胞+完全培养基;正常对照组(NC):细胞+完全培养基;模型组(MC):细胞+完全培养基+双诱导剂;BDPs干预组:细胞+完全培养基+0.062 5 mg/mL BDPs溶液+双诱导剂。
按细胞分组,使用对数生长期内RIN-m5F胰岛细胞,以1×105cells/mL的密度将细胞接种于96 孔板,加入100 μL完全培养基铺板使细胞贴壁,之后弃去培养基,NC组加入完全培养基,其余组别均加入双诱导剂经细胞建模后,再此弃去培养基,NC组和MC组重新加入新完全培养基,其余多糖干预组加入BDPs多糖进行干预。每组做6 个复孔平行,培养24 h后进行后续实验。
1.3.11.2 不同产地BDPs干预后细胞增殖活性测定
按1.3.11.1 节实验分组处理细胞,待细胞处理完成后,采用CCK-8法测定细胞存活率,每孔加入100 μL CCK-8溶液(V(CCK-8试剂)∶V(无血清培养基)=1∶10),于37 ℃细胞培养箱中孵育0.5 h,在450 nm处测定吸光度,通过式(4)计算测定经不同产地BDPs干预后细胞存活率:
式中:A1为NC、MC、BDPs干预组的吸光度;A2为空白对照组的吸光度;A3为NC组的吸光度。
1.3.11.3 不同产地BDPs干预后细胞胞内ROS水平和TNF-α水平测定
按1.3.11.1节实验分组处理细胞,通过2’,7’-二氯荧光素双乙酸盐荧光探针法测定ROS水平,参照酶联免疫吸附测试试剂盒说明书测定各组细胞上清液中TNF-α水平。
1.3.11.4 细胞形态观察
按1.3.11.1节实验分组接种细胞至6 孔板处理细胞,通过倒置显微镜观察细胞数量及生长状态,10 倍镜下观察并留取图像[4]。
1.4 数据处理与统计分析
2 结果与分析
2.1 BDPs的化学组成分析
5 种BDPs中的蛋白质、还原糖、多糖及糖醛酸质量分数结果如表4所示,BDPs中化学组成存在一定的差异。其中BDPs-I中多糖质量分数显著高于其他产地多糖,为58.41%(P<0.05)。BDPs-II中糖醛酸质量分数为62.22%,显著高于其他产地多糖(P<0.05),但与BDPs-IV 中糖醛酸质量分数差异并不显著。BDPs-III和BDPs-IV中蛋白质量分数显著低于其他多糖(P<0.05),均为0.22%,5 种BDPs中蛋白质量分数均在0.22%~0.40%之内,说明蛋白质去除较干净。BDPs-III中还原糖质量分数高达0.67%,且与其他BDPs差异显著(P<0.05)。由此可知,通过超声辅助热水浸提同一提取方法所得不同产地BDPs化学组成均存在显著差异。
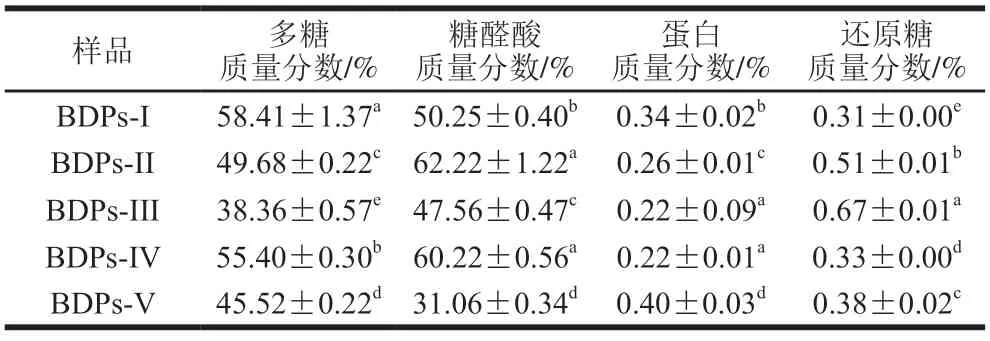
表4 不同产地BDPs化学组成Table 4 Chemical compositions of BDPs from different regions
2.2 BDPs的单糖组成及含量分析
采用Thermo IC5000离子色谱系统,利用电化学检测器对BDPs单糖组成进行分析检测。BDPs单糖组成离子色谱图如图2所示,结果表明各产地BDPs中共有单糖含有8 种,分别是Fuc、Rha、Gal、Glc、Xly、Man、Glc-UA、Gal-UA。其中BDPs-III和BDPs-V单糖组成中比其他3 个样品多含有一种Ara。由此可知不同产地BDPs中多糖组成存在差异。
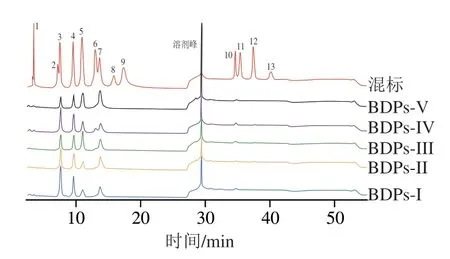
图2 不同产地BDPs单糖组成离子色谱图Fig.2 Ion chromatograms of monosaccharide compositions of BDPs from different regions
由表5可知,BDPs-I、BDPs-II、BDPs-IV样品单糖组成一致,均由8 种单糖组成,但各单糖组分所占百分比却大相径庭。而BDPs-III和BDPs-V多糖样品由Fuc、Ara、Rha、Gal、Glc、Xly、Man、Glc-UA、Gal-UA 9 种单糖组成,各单糖组分所占百分比也不相同;通过比较其他3 种多糖样品发现,Ara仅存在于BDPs-III和BDPs-V中,且BDPs-III中Ara含量是BDPs-V的2 倍。由此可知不同产地黄刺粗多糖中单糖含量存在较大差异,推测可能与黄刺浆果产地海拔、气候条件、生长环境等不同有着密不可分的关系。
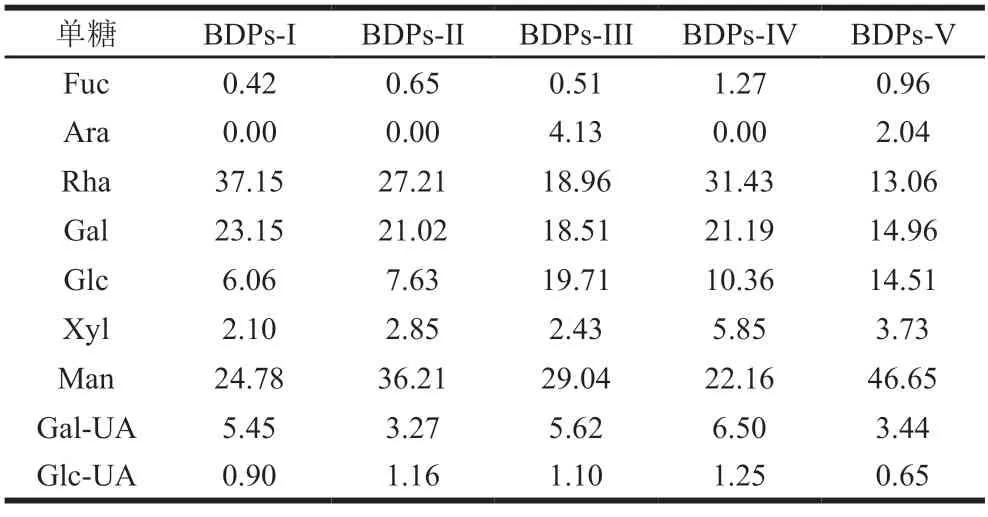
表5 不同产地BDPs单糖含量占比Table 5 Monosaccharide contents in BDPs from different regions%
2.3 BDPs的分子质量分析
结合图3分子质量分析图和表6分子质量分布表可知,BDPs-III重均分子质量最小(8.673 kDa),BDPs-IV重均分子质量最大(1 322.854 kDa)。说明BDPs分子质量大小受到产地影响较大,推测可能与产地海拔、环境气候、年降雨质量等外界因素有较大关联。
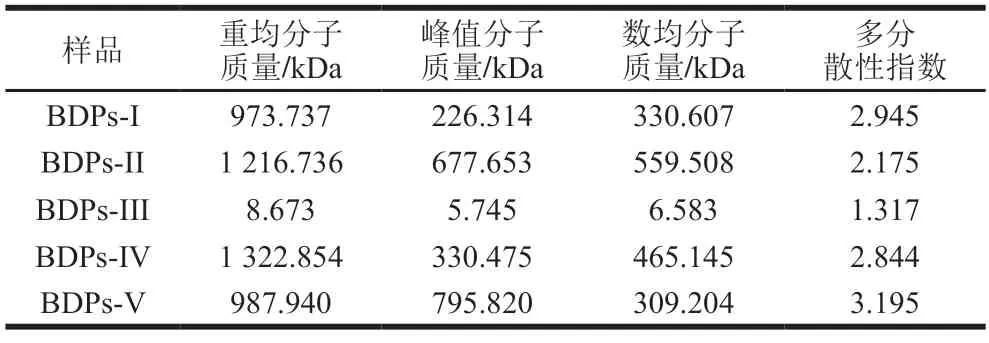
表6 不同产地BDPs分子质量分布Table 6 Molecular mass distribution of BDPs from different regions
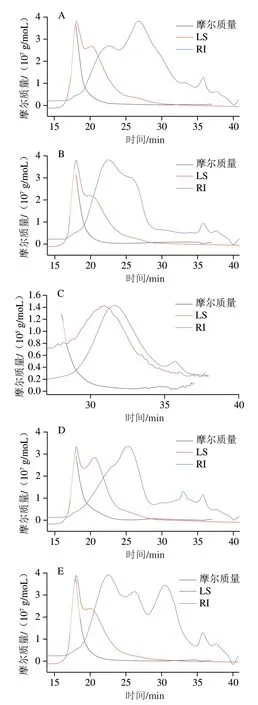
图3 BDPs分子质量分析图Fig.3 Molecular mass analysis of BDPs
2.4 BDPs的初级结构表征
2.4.1 紫外光谱分析
如图4所示,对BDPs进行紫外光谱扫描,发现BDPs均在200 nm左右波长处有强烈吸收峰,为多糖特征峰;在260 nm和280 nm左右处有较弱吸收峰,表明BDPs中可能均存在少量蛋白质及核酸,与蛋白质含量测定的结果一致。
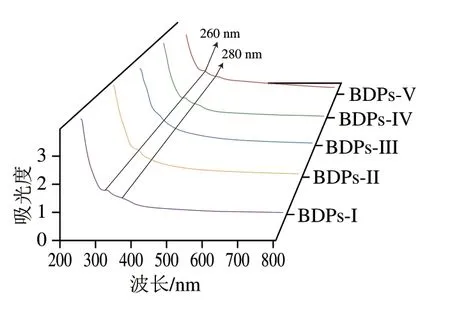
图4 不同产地BDPs紫外光谱图Fig.4 Ultraviolet spectra of BDPs from different regions
2.4.2 红外光谱分析
如图5所示,在3 432 cm-1左右显现出1 个宽而强的吸收峰,此峰是由多糖分子间亦或是分子内因O—H的伸缩振动引起的。而在2 928 cm-1附近的吸收峰为烷基C—H的伸缩振动引起的[18]。在1 746 cm-1和1 616 cm-1附近出现弱吸收峰表明多糖中存在酯羰基(—CO—)和羧基(COO—)[4]。此外,在1 442 cm-1附近存在吸收峰,推测BDPs中含有糖醛酸[20],这与粗多糖中糖醛酸含量测定结果相一致。1 248 cm-1处出现的吸收峰可能是由C—O糖苷键的伸缩振动引起的[25],1 070 cm-1和1 024 cm-1处波峰表明黄刺粗多糖中存在吡喃糖,而779 cm-1处波峰显示的信号表明吡喃糖是以β型结构存在于BDPs中[5]。通过红外光谱分析发现不同产地BDPs糖苷键连接方式一致,均由β-糖苷键连接且是具有吡喃糖环骨架构型的杂多糖。
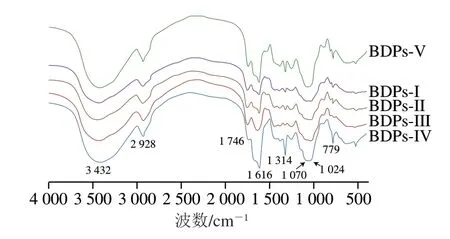
图5 不同产地BDPs红外光谱图Fig.5 Infrared spectra of BDPs from different regions
2.4.3 扫描电子显微镜观察分析
由图6可知,BDPs结构形态呈现一定的差异性,BDPs-I以片状结构组成,表面较为平整且结构疏松,存在孔洞(图6A)。BDPs-II存在条带状结构,有细微裂缝(图6B)。BDPs-III表面整体较为光滑,但存有细微裂缝(图6C),推测由于较小的分子质量赋予了BDPs-III较为细腻光滑的外貌形状。BDPs-IV表面粗糙、凹凸不平,呈石泥堆积状(图6D),由此推测可能是由于BDPs-IV拥有较大的分子质量有关。BDPs-V表面无孔洞及裂缝,且有大小不一颗粒状存在(图6E)。扫描电子显微镜发现不同产地BDPs外貌形态差异明显,造就该现象的原因可能与BDPs分子质量大小有密不可分的关系。

图6 不同产地黄刺粗多糖扫描电子显微镜图Fig.6 Scanning electron micrographs of BDPs from different regions
2.4.4 刚果红试验结果
由图7可以看出,随着NaOH浓度的增大,BDPs刚果红试剂作用产生络合物的最大吸收波长均呈现连续下降的趋势,造成这种结果的原因可能是因为BDPs结构复杂,分子质量大,在水溶液中呈现无规卷曲构象,说明BDPs均不具备三螺旋结构。
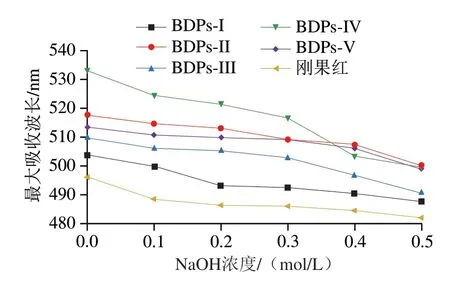
图7 不同NaOH浓度下BDPs与刚果红络合物的最大吸收波长Fig.7 Maximum absorption wavelengths of BDPs and Congo red complex at different NaOH concentrations
2.5 BDPs热稳定性结果分析
如图8所示,BDPs在50~850 ℃范围间其热稳定性效果均存在较大差异。BDPs-I、BDPs-II、BDPs-IV在整体温度范围内其热解过程分为2 个阶段,其中BDPIII和BDPs-V在整体温度范围内其热解过程分为3 个阶段。BDPs-I~BDPs-V样品第一阶段质量损失率依次为7.12%、7.68%、9.26%、9.47%、9.55%,第一阶段最大质量损失速率分别出现在97.92、97.74、101.61、97.73、99.34 ℃。这一阶段损失了样品中水分,表明样品中含有不同含量的结合水以及部分吸附水[22]。其次也印证了由于多糖相对稳定的结构进一步造就了多糖在50~200 ℃范围内保持相对稳定,同时说明该温度范围的热处理不会引起多糖的热分解,说明BDPs可应用于巴氏杀菌食品、药品等需高温处理的领域[26]。该阶段BDPs-I质量损失最低,损失率为7.12%。说明第一阶段中BDPs-I中水分含量较低,其稳定性较好。
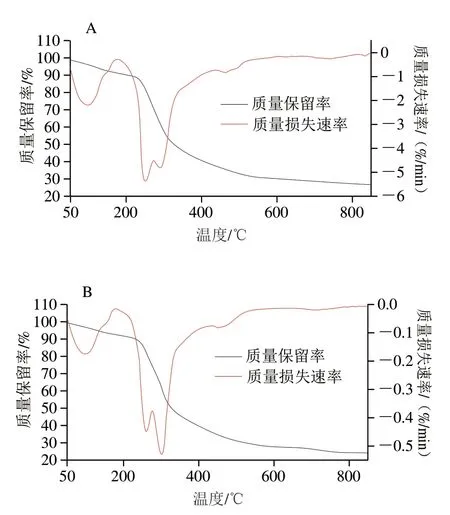
图8 不同产地BDPs热稳定性Fig.8 Thermal stability of BDPs from different regions
第二阶段BDPs-I~BDPs-V样品质量损失率依次为66.17%、68.25%、61.23%、64.37%、65.51%,该阶段最大质量损失速率分别出现在BDPs-I:252.57;BDPs-II:300.32 ℃;BDPs-III:303.81 ℃;BDPs-IV:247.59 ℃;BDPs-V:303.81 ℃。表明不同产地BDPs样品第二阶段发生热解的温度点各不相同,且各温度点相差较大,其发生热解温度点跨度范围为237.98~460.12 ℃。推测该阶段是由于高温热解过程使得BDPs样品中多糖糖苷键断裂而造成的一次较大的质量损失。
样品BDPs-III和BDPs-V第三阶段热解过程分别为587.22~845.83 ℃和543.36~845.93 ℃,该阶段样品质量损失率分别为5.26%和7.05%,最大质量损失速率出现在699.12 ℃和688.80 ℃。推测可能是样品中色素以及未去除干净的杂质在688 ℃以上高温条件下发生的热解而造成的较小的质量损失,由此说明BDPs-III和BDPs-V中含有少量杂质。
2.6 BDPs的体外降血糖活性
BDPs对α-葡萄糖苷酶抑制率见图9a。在实验质量浓度范围内(0.5~16 mg/mL),虽然BDPs对α-葡萄糖苷酶抑制效果显著低于阿卡波糖阳性组(P<0.05),但其对α-葡萄糖苷酶仍具有较强的抑制能力,且抑制率与样品质量浓度呈正相关。BDPs-III对α-葡萄糖苷酶抑制能力较其他产地BDPs强,于16 mg/mL质量浓度下其抑制率为66.56%(P<0.05)。不同产地BDPs对α-葡萄糖苷酶半抑制浓度(half-maximal inhibitory concentration,IC50)值由小到大依次为BDPs-III(3.717 mg/mL)<BDPs-V(14.556 mg/mL)<BDPs-I(15.701 mg/mL)<BDPs-II(17.155 mg/mL)<BDPs-IV(17.697 mg/mL)。由此可见,BDP-III对于α-葡萄糖苷酶抑制能力强于其他产地BDP,该结果与Ji Xiaolong等[27]所报道的低分子质量的多糖由于其分子内氢键较弱,会有更多的游离氨基和羟基,更利于多糖发挥生物活性的结论一致。
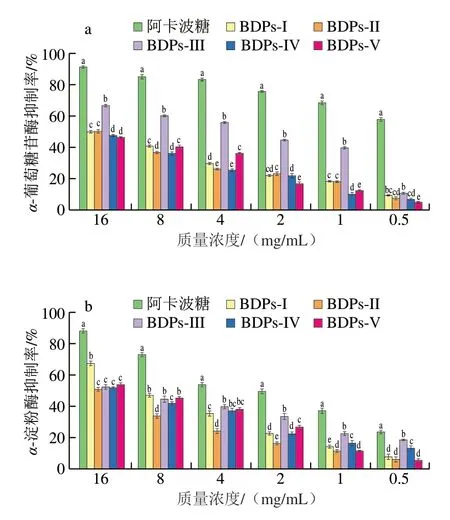
图9 不同产地BDPs体外降血糖活性Fig.9 In vitro hypoglycemic activitiesof BDPs from different regions
BDPs对α-淀粉酶活性抑制率测定见图9b。在实验质量浓度范围内(0.5~16 mg/mL),虽然BDPs对α-淀粉酶抑制效果显著低于阿卡波糖阳性组(P<0.05),但其对α-淀粉酶表现较好的抑制能力,且抑制率与样品质量浓度之间存在一定的剂量依赖关系。在低质量浓度范围(0.5~4 mg/mL)内,BDPs-III对α-淀粉酶抑制能力显著优于其他产地样品,在高质量浓度范围(8~16 mg/mL)内,BDPs-I对α-淀粉酶抑制能力显著优于其他产地样品。在最大质量浓度条件下,BDPs-I对α-淀粉酶抑制率显著优于其余样品,其最大抑制率为67.41%(P<0.05),其余4 种BDPs样品抑制率彼此并无统计学差异(P>0.05)。其中不同产地BDPs对α-淀粉酶IC50值按序依次为BDPs-I(9.875 mg/mL)<BDPs-V(10.056 mg/mL)<BDPs-III(11.782 mg/mL)<BDPs-IV(13.208 mg/mL)<BDPs-II(16.264 mg/mL)。由此可见BDPs-I对于α-淀粉酶抑制效果最优。
2.7 不同产地BDPs对RIN-m5F胰岛细胞的保护作用
2.7.1 建立GLTy胰岛细胞模型
由图10可知,当诱导剂浓度不变(葡萄糖终浓度为22.5 mmol/L,棕榈酸终浓度为0.1 mmol/L),高糖高脂双诱导剂作用12 h后,细胞存活率相比NC组显著上升(P<0.05)。之后随着建模时间延长,相比NC组细胞存活率显著降低(P<0.01)。当诱导剂不变,双诱导剂作用24 h后,细胞存活率为(53.3±5.01)%,显著低于NC组(P<0.01),且其值接近50%,后续可采用该条件建立GLTy胰岛细胞模型。随着后续时间延长至36~48 h后发现细胞存活率显著低于NC组,且值远小于50%,故不考虑其作为GLTy胰岛细胞模型建模条件。
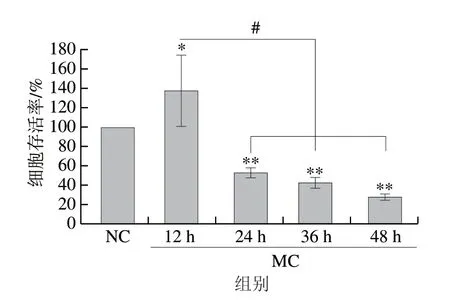
图10 结合高糖高脂双诱导RIN-m5F细胞GLTy模型筛选Fig.10 Determination of culture time for induction of GLTy in RIN-m5F cells by glucose and palmitic acid
2.7.2 BDPs对GLTy诱导胰岛细胞活性影响
如图11所示,通过高糖高脂联合诱导24 h后,与NC组相比,MC组细胞存活率显著降低(P<0.05),说明GLTy细胞模型具有一定的可靠性和稳定性。通过不同产地BDPs干预后,细胞存活率均显著高于MC组细胞(P<0.01),同时经不同产地BDPs干预后,细胞存活率均高于NC组细胞(P>0.05),其中BDPs-I组细胞存活率高达(105.47±3.32)%。由此可知不同产地BDPs对GLTy诱导的胰岛损伤细胞均具有促进胰岛细胞生长作用,其中BDPs-I其增殖效果最优。
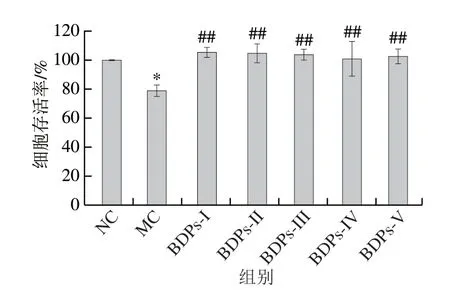
图11 BDPs对RIN-m5F胰岛细胞的增殖活性Fig.11 Proliferation-promoting effect of BDPs on RIN-m5F cells subjected to glucolipotoxicity
2.7.3 BDPs对GLTy诱导胰岛细胞ROS和TNF-α水平影响
如图12所示,高糖高脂的糖脂毒性作用于细胞后,细胞内ROS和TNF-α水平明显增加,显著高于NC组(P<0.01)。经过不同产地BDPs组干预24 h后,细胞内ROS和TNF-α水平相比模型组有显著下降趋势(P<0.05)。不同产地BDPs干预后可抑制ROS和TNF-α产生,其ROS抑制效果按优劣排序依次为:BDPs-V>BDPs-I>BDPs-IV>BDPs-III>BDPs-II;其TNF-α抑制效果按优劣排序依次为:BDPs-I>BDPs-V>BDPs-II>BDPs-III>BDPs-IV。通过对ROS和TNF-α抑制优劣可知,不同BDPs对ROS和TNF-α抑制产生效果存在较大差异,其中BDPs-V对ROS水平的抑制产生作用最强,BDPs-I对TNF-α水平的抑制效果最优。由此说明高糖高脂诱导细胞使胞内ROS和TNF-α水平升高,经不同产地BDPs干预后可以降低GLTy损伤的RIN-m5F细胞内ROS和TNF-α水平,可抑制GLTy造成的细胞氧化损伤。
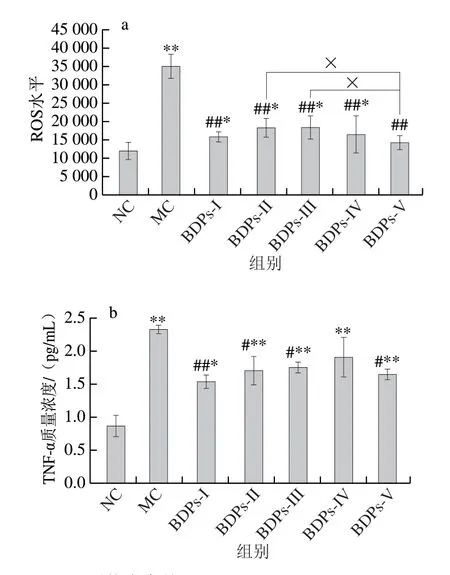
图12 BDPs对ROS水平(a)和TNF-α质量浓度(b)的影响Fig.12 Effects of BDPs on ROS levels (a) and TNF-α concentrations (b)
2.7.4 细胞形态学观察
如图13所示,未经处理的NC组RIN-m5F胰岛细胞整体呈聚集圆球状或梭状;经高糖高脂诱导24 h后MC组RIN-m5F胰岛细胞发生皱缩及细胞溃烂导致细胞凋亡,细胞密度逐渐降低等细胞形态变化。然而经过不同产地BDPs干预后,细胞形态逐渐恢复,细胞密度明显增加,细胞边界逐渐变圆滑。这表明不同产地BDPs对受损胰岛细胞具有促进细胞增殖、抗糖脂毒性能力。

图13 BDPs干预后的RIN-m5F细胞形态图Fig.13 Morphological changes of RIN-m5F cells after BDP interventions
2.8 相关性分析
通过化学方法测定不同产地中多糖、糖醛酸、蛋白及还原糖质量分数,结合各产地单糖组成进行相关性分析,结果如图14a所示,仅有Man与多糖、糖醛酸质量分数间呈现较强的正相关性,相关系数分别为0.52、0.54,其中多糖质量分数与Fuc、Xyl、Glc-UA等单糖存在较强的负相关性,Glc、Gal-UA与糖醛酸质量分数呈现较强的负相关性。除Fuc、Xly与蛋白质量分数呈现较强的负相关性外,其余单糖与蛋白质量分数间相关性较弱。还原糖质量分数与单糖组成间存在较强的相关性,尤其是Fuc、Xly、Glc-UA,其与还原糖呈现较强的正相关性,相关系数均大于0.66,其余单糖与还原糖间存在较弱的相关性。
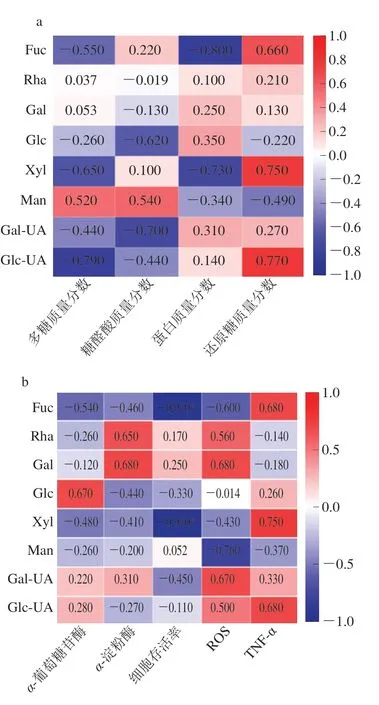
图14 多糖化学组成、降血糖活性与单糖组成相关性热图Fig.14 Heatmaps of correlation between monosaccharide composition and chemical composition and hypoglycemic activity
为探明BDPs中单糖质量分数与降血糖活性间的关系,将二者数据进行相关性分析研究。如图14b所示,BDPs中单糖含量与降血糖活性具有较强的相关性。其中α-葡萄糖苷酶与Glc呈现正相关性,Gal、Rha两种单糖与α-淀粉酶具有正相关关系,相关系数均在0.65以上,说明当多糖中存在Rha、Gal、Glc等单糖有助于提高其降血糖能力。除此之外,与α-葡萄糖苷酶呈现正相关性的单糖还有Gal-UA和Glc-UA,其余单糖与α-葡萄糖苷酶和α-淀粉酶呈现负相关性且相关性均不显著。细胞增殖活性与Man、Rha和Gal呈现正相关性,其相关系数分别为0.052(P>0.05)、0.17(P>0.05)和0.25(P>0.05),其余单糖与细胞增殖活性均呈现负相关性,其中Fuc和Xly与细胞增殖活性呈现较强的显著负相关性,其相关系数均为-0.91(P<0.05)。细胞ROS水平与单糖Rha、Gal、Glc、Gal-UA、Glc-UA等单糖及糖醛酸含量呈现正相关性,其中与Gal-UA、Gal正相关性较强,相关系数均在0.67以上(P>0.05),与其余单糖呈现负相关性尤其与Man间负相关较强。细胞TNF-α水平与Fuc、Glc、Xly、Gal-UA、Glc-UA等单糖及糖醛酸含量呈现正相关性,其中Fuc、Xly、Gal-UA具有较强的正相关性,相关系数均大于0.68(P>0.05),与其余单糖呈现负相关性。由此说明BDPs降血糖活性、细胞增殖活性、ROS水平及TNF-α水平与单糖组成之间存在较强的相关性。
3 讨论
本研究中,首先采用化学方法对不同产地BDPs进行化学成分测定说明不同产地黄刺粗多糖中化学组成含量存在较大差异;不同产地粗多糖中单糖组成存有差异。表明各样品间化学组成和单糖组成及含量与样品产地、生长环境、果实品质等因素息息相关[28]。于小芳[29]、黄国英[30]等也证实多糖化学组成和单糖组成及含量与其产地有较大关系。
在一定实验质量浓度范围内,5 个产地黄刺粗多糖对α-葡萄糖苷酶和α-淀粉酶均有抑制能力,但抑制率均小于阿卡波糖对照组,这可能是与BDPs为粗多糖有关,因多糖未进行纯化处理故而导致生物活性不高。李井雷等[31]研究羊肚菌胞外多糖体外降血糖结果,显示该多糖对α-淀粉酶及α-葡萄糖苷酶抑制率均小于阿卡波糖对照组,在高浓度下抑制率分别达到20%和40%左右,而黄刺粗多糖在高质量浓度下抑制率可达60%左右,说明BDPs降血糖活性优于羊肚菌胞外多糖,而黄刺粗多糖纯化后的降血糖活性有待进一步研究。Ji Xiaolong等[27]报道,多糖的降血糖活性与多糖分子质量大小和单糖组成复杂程度有着直接关系,表明多糖分子质量越小,单糖组成种类越多会使得多糖具有更高降血糖活性,这也可能是BDPs拥有较高的降血糖活性的原因之一。
胰岛细胞的GLTy是导致其功能障碍的重要原因之一,其与炎症因子,氧化应激等密切相关[32],因此,预防胰岛细胞凋亡及促进胰岛细胞增殖、抑制胰岛细胞氧化应激降低炎症因子水平是防治糖尿病的有效途径之一。长期暴露于高水平高糖高脂中的胰岛β细胞会发生胰岛细胞损伤,同时ROS水平及TNF-α显著升高[33],这与本文研究结果一致。胡朝恩等[34]发现高糖高脂造成的GLTy会使胰岛细胞产生大量炎症因子和免疫因子,抑制胰岛β细胞增殖,导致胰岛β细胞功能障碍。本研究中发现结合高糖高脂联合诱导可成功建立胰岛β细胞损伤模型细胞活性,与模型组相比,经BDPs干预后细胞存活率显著上升,ROS和TNF-α水平显著下降,其中BDPs-I展现了最优的增殖活性,最大程度降低了TNF-α水平。BDPs-I相比其他产地BDPs样品对受损胰岛β细胞具有更强的增殖作用,同时通过降低ROS和TNF-α水平缓解胰岛细胞凋亡,从而达到保护胰岛细胞免受GLTy侵扰的目的。
已有研究表明,植物多糖的单糖组成及含量与生物活性有着密不可分的关系,倪力军等[35]研究发现8 种多糖样品中,除Glc以外其余单糖与抗氧化活性均具有较强的相关性。党参多糖对HepG2的细胞活性与其单糖的种类存在相关性,发现含有Gal-UA相对较高的党参多糖其细胞活性较强[36]。因此,为探究BDPs中单糖含量与降血糖活性间的相关性,本研究通过Pearson相关性分析方法分析BDPs与降血糖活性间的相关性研究,发现Rha、Gal与降血糖活性相关检测指标(α-淀粉酶抑制率)呈现较强的正相关,推测多糖中含有的Rha、Gal、Gal等单糖有助于提高降血糖能力。Xly与细胞存活率呈现负相关性,其余单糖与细胞存活率相关性较弱,由此推测BDPs其较高的细胞增殖活性可能与多糖高级结构及复杂连接方式有关。Man与ROS呈现较强的负相关,说明Man可有助于抑制ROS积累,提高ROS清除效率,对GLTy损伤的细胞起到较强的保护作用。
4 结论
不同产地BDPs在初级结构表征、体外降血糖活性及细胞水平均存在较大的差异,其中BDPs-I具有优良的化学组成、单糖组成及含量,体现了较优的体外降血糖活性。通过促进细胞增殖、降低ROS水平和TNF-α水平达到保护胰岛细胞因受GLTy而造成的细胞凋亡,筛选出最佳产地样品为BDPs-I。BDPs中单糖含量Rha、Gal与降血糖活性(α-淀粉酶抑制率)存在较强的正相关性,Man与ROS呈现较强的负相关关系。本研究为BDPs在糖尿病治疗中的应用提供了一定依据,为BDPs在GLTy胰岛凋亡模型引起的糖尿病防治中的推广应用奠定了基础。

