盐霉素体外对猪流行性腹泻病毒的抑制效果
马亚娟,苏 恺,林依丹,王亚文,张亚楠,袁洪兴,袁 晨*,宋勤叶*
(1.河北农业大学动物医学院,保定 071000;2.馆陶县农业农村局,邯郸 057750)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的一种肠道传染性疾病[1],该病毒可感染所有年龄段的猪,但7日龄以内的仔猪最易感,主要引起仔猪急性腹泻、呕吐、脱水甚至死亡,发病率和死亡率可高达100%。自2010年以来,PEDV变异毒株引起的仔猪腹泻呈现新的流行特征,即使免疫过PED疫苗的猪场也未能幸免,给养猪业造成了巨大的经济损失,因此,当务之急是采取有力的措施加强对PED的防控。
目前PED的防控除了加强饲养管理外,主要以疫苗预防为主,但由于病毒的高变异性,现有疫苗已不能提供足够的保护力,因此,开发可抑制PEDV感染的药物迫在眉睫。PEDV与经典冠状病毒生命周期一致[2-3],该病毒的S蛋白与宿主细胞表面的受体结合并吸附,从而启动病毒粒子的生命周期[4-5]。PEDV基因组与细胞核糖体结合后翻译非结构蛋白(non-structural protein 1-16,nsp1-16)和逆转录复合物(reverse transcription complex,RTC),不连续的基因组可翻译结构蛋白:纤突蛋白(spike protein,S蛋白)、膜蛋白(membrane protein,M蛋白)、包膜蛋白(envelope protein,E蛋白)、核衣壳蛋白(nucleocapsid protein,N蛋白)和辅助蛋白(ORF3蛋白)。与N蛋白结合的病毒基因组在内质网-高尔基体中间区室(ERGIC)进行组装并进入含有病毒结构蛋白(S、E和M蛋白)的ERGIC膜,导致成熟病毒体的形成,完成病毒粒子的复制过程,最后病毒粒子经细胞膜以胞吐的方式释放到细胞外,又可开始新一轮的感染[6]。尽管目前国内外科研者针对PEDV生命周期的不同阶段已发现多种能够抑制PEDV活性的抗病毒药物,但多数正处于实验室的研究阶段,尚未获得批准。
盐霉素(salinomycin,SLM)又名沙利霉素,是1968年首次由日本科研株式会社发现的一元羧酸聚醚类广谱抗生素[7-8],其对癌症[9-10]、球虫原虫[11]、革兰阳性细菌和耐药菌株[12]都具有抑制活性。SLM作用之多的原因可能是因为其可以参与多种信号通路的调节,例如,抑制Wnt/β-catenin信号通路[13]和丝裂原活化蛋白激酶(MAPK)通路[14],启动细胞的自噬[15],降低三磷酸腺苷(ATP)的水平,促进活性氧(ROS)的产生[16],触发DNA损伤和预防DNA修复[17],抑制核转录因子(NF-κB)信号通路[18]。以上信号通路与病毒感染靶细胞后的增殖密切相关,说明SLM可能是一种抗病毒候选药物,然而SLM对PEDV的抑制效果尚不清楚。
本研究旨在探索SLM体外对PEDV的抑制效果及其对病毒复制周期的影响,为SLM作为一种新的抗PEDV药物的开发提供理论支持,并为后期SLM抑制PEDV感染机制的研究奠定基础。
1 材料与方法
1.1 细胞、病毒和主要试剂
非洲绿猴肾细胞(Vero)、PEDV CV777毒株均由本实验室保存。MEM培养基购自Gibco公司;胎牛血清(FBS)、胰酶(TRYPSIN/EDTA)购自Multicell公司;PEDV N蛋白单克隆抗体由本实验室制备并保存;小鼠抗GAPDH单克隆抗体、ECL化学发光超敏显色试剂盒购自翌圣公司;HRP-山羊抗小鼠IgG(H+L)购自博奥龙公司;CCK-8试剂盒购自Biosharp公司;2×AugeGreen Master Mix购自UE公司;盐霉素购自MCE公司。
1.2 病毒滴度的测定
将Vero细胞接种于96孔细胞培养板,置于37 ℃ 5% CO2细胞培养箱中,待细胞长到90%后,每孔接种100 μL倍比稀释(10-2~10-7)的PEDV病毒液,接毒后72 h统计细胞病变效应(cytopathic effect,CPE)。用Reed-Muench两式法计算病毒滴度(TCID50)。
1.3 病毒生长曲线的测定
将Vero细胞接种于细胞培养皿,待细胞长到90%,将细胞上清液换为维持液培养12 h,吸出细胞上清液,用0.01 mol·L-1pH 7.2~7.4的PBS洗涤细胞,然后感染0.5 MOI PEDV,对照组加入等量维持液,37 ℃孵育2 h后更换新维持液继续培养,最后收集感染后1、12、24、48、60 h的病毒液,测定病毒的TCID50。
1.4 RT-qPCR
使用Trizol法提取总RNA,取病毒液和TriQuick Reagent混匀后静置,加入三氯甲烷分离有机相和无机相,离心后取上清,加入等量异丙醇萃取RNA,使用经DEPC水处理的75%酒精洗去残留的异丙醇,加入9.5 μL无RNA酶水重悬管底核酸,按试剂盒说明书进行反转录后,使用SYBE Green染料法检测。其中,RT-qPCR反应体系如下:1 μL cDNA,10 μL 2×AugeGreen qPCR Master Mix,上、下游引物各0.5 μL,8 μL无菌纯化水。扩增条件为酶激活95 ℃ 120 s;然后采用三步法,即95 ℃ 5 s,56 ℃ 5 s,72 ℃ 25 s,共进行45次循环,每个样品重复3次。
1.5 免疫印迹(Western blot)
待Vero细胞长满单层后首先用PEDV感染或SLM处理细胞,然后用预冷的PBS洗涤细胞,再用含有蛋白酶抑制剂混合物的细胞裂解缓冲液裂解,4 ℃离心后收集上清液,加入上样缓冲液,混匀后105 ℃变性10 min,然后用SDS-PAGE分离蛋白样品,并转移到PVDF膜上,再用含有5%脱脂奶粉的TBST溶液在室温将PVDF膜封闭2 h,然后加入PEDV N蛋白单克隆抗体(1∶500)、小鼠抗GAPDH单克隆抗体(1∶10 000)4 ℃孵育过夜,再用TBST洗涤PVDF膜,然后加入HRP-山羊抗小鼠IgG(1∶10 000)室温孵育1.5 h,再次洗膜后用ECL发光液检测目的蛋白。
1.6 间接免疫荧光试验(indirect immunofluorescent assay,IFA)
将Vero细胞接种于96孔细胞培养板,待单层细胞长到90%后用PBS洗涤细胞并分组,首先用冰冷的甲醇于-20 ℃固定细胞10 min,然后用PBS洗涤,使用2% BSA-PBS溶液37 ℃封闭1 h,然后弃上清,加入PEDV N蛋白单克隆抗体(1∶200)37 ℃孵育1 h,再用PBS洗涤后加入FITC标记的山羊抗小鼠IgG(1∶500)37℃孵育45 min,再次用PBS洗涤后加入DAPI染色溶液(Bisben Iimde)室温避光显色,洗涤后拍干,最后用荧光显微镜观察结果并拍照,使用Image J统计阳性细胞率。阳性细胞率(%)=阳性细胞数/总细胞数×100。
1.7 半数细胞毒性浓度(CC50)的测定
待96孔细胞培养板中长满单层Vero细胞后用PBS洗涤,并分组,然后用不同浓度SLM处理细胞,并设置只含营养液而没有细胞的孔作为空白对照,继续培养24 h。根据增强型CCK-8细胞活性试剂盒说明书,每孔加入10 μL工作液后再置于37 ℃孵育1 h,最后使用酶标仪读取OD450 nm值。
细胞活力(%)=(OD450 nm天然产物孔-OD450 nm空白对照)/(OD450 nm阴性对照-OD450 nm空白对照)×100。将细胞活力与药物浓度的数据导入到GraphPad Prism 5.0中,使用Analyze下的transform功能,转换成细胞活力与lg(药物浓度)的关系,进一步使用Analyze下的XY analyses的Nonlinear regression非线性拟合功能,利用log (inhibitor) vs. response-Variable slope (four parameters)选项,得到拟合曲线和CC50值。
1.8 半数抑制浓度(IC50)的测定
待96孔细胞培养板中长满单层的Vero细胞后用PBS洗涤细胞,然后用不同浓度SLM处理细胞,每个浓度重复8个孔,每孔加入100 μL含有相应SLM浓度的维持液预处理细胞1 h,弃掉孔内液体,再用含有0.2 MOI PEDV和相应SLM浓度的混合液处理细胞1 h,并设置仅含有维持液的阴性对照孔和仅接毒不加药的阳性对照孔,最后将孔内液体更换为含有相应SLM浓度的维持液继续培养72 h,肉眼观察CPE并统计。
抑制率(%)=(1-FL天然产物孔/FL阴性对照)×100。将抑制率与药物浓度的数据导入到GraphPad Prism 5.0中,使用Analyze下的transform功能,转换成抑制率与lg(药物浓度)的关系,进一步使用Analyze下的XY analyses的Nonlinear regression非线性拟合功能,利用lg (inhibitor) vs. response-Variable slope (four parameters)选项得到拟合曲线和IC50值。
1.9 SLM对PEDV增殖的抑制作用
将Vero细胞接种于24孔细胞培养板,待长满单层细胞后,弃上清,用PBS洗涤细胞加入含有不同SLM浓度(0.05、0.5、5 μmol·L-1)的维持液,在37 ℃培养箱预处理细胞1 h,随后用PBS洗涤细胞,再用0.2 MOI PEDV感染细胞1 h,然后将病毒液更换为含有相应SLM浓度的维持液,继续培养24 h,收集细胞上清液测定TCID50,提取核酸和蛋白用于测定病毒N基因水平和N蛋白含量,IFA观察病毒分布并计算阳性细胞率。
1.10 SLM对PEDV复制周期的影响
1.10.1 SLM对病毒粒子的作用 将Vero细胞接种于12孔细胞培养板,待细胞长到90%后,将以下四管溶液(A:0.2 MOI PEDV和5 μmol·L-1SLM混合液,B:0.2 MOI PEDV稀释液,C:维持液,D:5 μmol·L-1SLM稀释液)各设置两组,分别放置在培养箱中作用3 h和5 h,将以上溶液接种于Vero细胞,然后置于37 ℃孵育1 h,用PBS洗涤细胞,再加入维持液继续培养12 h,然后收集病毒液,提取核酸,RT-qPCR检测PEDVN基因的mRNA水平。通过比较SLM处理组与PEDV感染组的PEDVN基因mRNA水平的高低,判断SLM是否对PEDV病毒粒子具有直接灭活作用。
1.10.2 SLM对病毒吸附的影响 将Vero细胞接种到12孔细胞培养板,待细胞长到90%后,用含有0或5 μmol·L-1SLM的维持液在37 ℃预处理细胞1 h,然后用含有0.2 MOI PEDV和相应SLM浓度的混合液在4 ℃处理细胞15、30和60 min,再用冰冷的PBS洗涤后收集细胞,提取核酸,使用RT-qPCR检测细胞中PEDVN基因的mRNA水平。通过比较同一时间段SLM处理组与PEDV感染组的PEDVN基因mRNA水平的相对高低,判断SLM是否影响病毒的吸附。
1.10.3 SLM对病毒入胞的影响 将Vero细胞接种到12孔细胞培养板,待细胞长到90%后,首先将细胞板放入4 ℃预冷,然后用0.2 MOI PEDV在4 ℃感染细胞2 h,再更换含有0或5 μmol·L-1SLM的维持液,37 ℃继续孵育0.5、1和 2 h,用预冷的PBS洗涤细胞,以去除未入胞的病毒,最后收集细胞,提取核酸,使用RT-qPCR检测PEDVN基因的mRNA水平。通过比较SLM处理组与PEDV感染组的PEDVN基因mRNA水平的相对高低,判断SLM是否影响PEDV的入胞。
1.10.4 SLM对病毒复制的影响 将Vero细胞接种于12孔细胞培养板,待细胞长到90%后,将细胞上清液更换为含有0.2 MOI PEDV的维持液,在37 ℃培养箱中孵育1 h,用PBS洗涤细胞后补充维持液,继续在37 ℃培养箱中培养,在接毒后4 h将培养基更换为含有0或5 μmol·L-1SLM的维持液,置于37 ℃继续孵育2、4和6 h,然后用PBS洗涤细胞,收集细胞后提取RNA,并反转录成cDNA,RT-qPCR检测PEDVN基因的mRNA水平。通过比较SLM处理组与PEDV感染组的PEDVN基因mRNA水平的相对高低,判断SLM是否影响病毒的复制。
1.10.5 SLM对病毒释放的影响 将Vero细胞接种于12孔细胞培养板中,待细胞长到90%后,用0.2 MOI PEDV在37 ℃感染细胞1 h,然后更换为维持液继续培养10 h,再将培养基更换为含有0或5 μmol·L-1SLM的维持液继续孵育0.5、1和2 h后收集样品,提取核酸,RT-qPCR检测PEDVN基因的mRNA水平。通过比较SLM处理组与PEDV感染组的PEDVN基因mRNA水平的相对高低,判断SLM是否影响PEDV的释放。
1.11 统计学分析
所有试验至少重复3次,使用SPSS 26软件对数据进行统计分析,并使用GraphPad Prism 5.0软件作图,结果表示为平均值±标准偏差。使用单因素方差分析(ANOVA)检查组间差异的统计显著性。图中星号表示有显著差异(*.P<0.05表示差异显著;**.P<0.01表示差异非常显著;***.P<0.001表示差异极显著;ns代表差异不显著)。
2 结 果
2.1 PEDV的TCID50及其在Vero细胞上的生长曲线
用Reed-Muench两式法测定PEDV感染Vero细胞不同时间的TCID50,绘制病毒生长曲线,结果如图1所示,PEDV感染细胞后24 h病毒滴度最高,约107.7·0.1 mL-1,随后病毒滴度缓慢下降,感染后60 h的TCID50约107.2·0.1 mL-1。
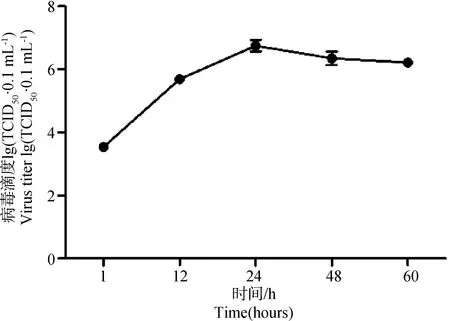
图1 PEDV在Vero细胞上的生长曲线Fig.1 Growth curve of PEDV on Vero cells
2.2 CC50和IC50
为了确定后期试验所使用的SLM浓度,首先使用CCK-8试剂盒测定不同SLM浓度下的细胞活力,结果表明SLM的CC50为7.698 μmol·L-1(图2A);经统计不同浓度SLM处理组的CPE,结果表明SLM对PEDV的IC50为1.617 μmol·L-1(图2B)。同时,经CCK-8试剂盒测定所用SLM浓度(0.05、0.5、5 μmol·L-1)处理后的细胞活力,结果如图2C所示,以上浓度的SLM对Vero细胞活力无影响。

A. CC50的测定;B. IC50的测定;C. SLM对Vero细胞活力的影响A. Determination of CC50; B. Determination of IC50;C. Effects of SLM on Vero cell viability图2 SLM对Vero和PEDV的影响Fig.2 The impact of SLM on Vero and PEDV
2.3 SLM对PEDV增殖的抑制作用
如图3A所示,为PEDV感染和SLM作用示意图,为了进一步确认SLM对PEDV增殖的影响,使用RT-qPCR、病毒滴度测定、Western blot、IFA多种技术进行检测。Western blot和RT-qPCR结果显示,与PEDV感染组相比,SLM能够显著降低PEDV N蛋白和N基因的表达和转录(P<0.01)
(图3B和C)。病毒滴度的结果显示,与PEDV感染组相比,SLM可以显著降低病毒含量(P<0.01)(图3D)。IFA的结果表明,PEDV感染组的绿色阳性细胞最多,而随着SLM含量的增加,阳性细胞逐渐减少(图3E);与PEDV感染组相比,不同浓度SLM(0.05、0.5、5 μmol·L-1)处理组的阳性细胞率均显著降低,且差异极显著(P<0.001)(图3F)。
2.4 SLM对PEDV复制周期的影响
2.4.1 SLM不能直接作用于PEDV SLM和PEDV直接作用的方式如图4A所示,RT-qPCR测定各组的核酸含量并进行统计学分析,结果如图4B所示,分别比较SLM与PEDV作用不同时间段后的结果,SLM处理组与PEDV感染组的病毒mRNA水平在统计学上差异不显著(P>0.05),表明SLM不能直接作用于PEDV。

A. 病毒感染和药物作用示意图;B. RT-qPCR检测PEDV感染和SLM处理后N基因水平A. Schematic diagram of viral infection and drug action;nB. The N gene level was detected by RT-qPCR after PEDV infection and SLM treatment图4 SLM对PEDV病毒粒子的影响Fig.4 Effect of SLM on PEDV
2.4.2 SLM不影响PEDV吸附 SLM作用于PEDV吸附阶段的过程如图5A所示,在病毒吸附的同时加入SLM,孵育相应的时间后SLM处理组与PEDV感染组相比,PEDVN基因mRNA水平没有显著差异(P>0.05)(图5B),表明SLM对PEDV的吸附没有显著影响。
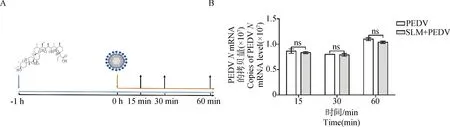
A. 病毒感染和药物作用示意图;B. RT-qPCR检测PEDV吸附阶段加入SLM后PEDV N基因水平A. Schematic diagram of viral infection and drug action; B. The PEDV N gene level was detected by RT-qPCR after the addition of SLM in PEDV adsorption stage图5 SLM对PEDV吸附Vero细胞的影响Fig.5 Effect of SLM on PEDV adsorption of Vero cells
2.4.3 SLM不影响PEDV入胞 如图6A所示,在PEDV入侵细胞阶段加入SLM,孵育相应的时间后SLM处理组与PEDV感染组相比,细胞内PEDVN基因mRNA水平无显著差异(P>0.05)(图6B),表明SLM对PEDV的入胞没有显著影响。

A. 病毒感染和药物作用示意图;B. RT-qPCR检测PEDV入胞阶段加入SLM后PEDV N基因水平A. Schematic diagram of viral infection and drug action; B. The PEDV N gene level was detected by RT-qPCR after the addition of SLM in PEDV entry stage图6 SLM对PEDV入侵Vero细胞的影响Fig.6 Effect of SLM on PEDV entry Vero cells
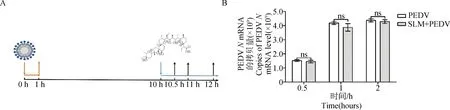
2.4.4 SLM抑制PEDV复制阶段 SLM作用于PEDV复制阶段的过程如图7A所示,在病毒复制阶段加入SLM,孵育4或6 h后,SLM处理组与PEDV感染组之间PEDVN基因的mRNA水平差异显著(P<0.05)(图7B),病毒滴度的结果表明在病毒复制阶段加入SLM可以显著降低细胞内病毒粒子的数量(P<0.05)(图7C),以上结果均表明SLM影响PEDV的复制阶段。

A. 病毒感染和药物作用示意图;B. RT-qPCR检测PEDV复制阶段加入SLM后PEDV N基因水平;C. 病毒粒子释放水平A. Schematic diagram of viral infection and drug action; B. The N gene level was detected by RT-qPCR after the addition of SLM in PEDV replication stage; C. Level of virion release图7 SLM对PEDV在Vero细胞中复制的影响Fig.7 Effect of SLM on PEDV replication in Vero cells
2.4.5 SLM不影响PEDV释放 如图8A所示,在PEDV释放阶段加入SLM,孵育相应时间后SLM处理组与PEDV感染组之间的病毒含量没有显著差异(P>0.05)(图8B),表明SLM对PEDV的释放没有显著影响。
A. 病毒感染和药物作用示意图;B. RT-qPCR检测PEDV释放阶段加入SLM后N基因水平A. Schematic diagram of viral infection and drug action; B. The N gene level was detected by RT-qPCR after the addition of SLM in PEDV release stage图8 SLM对PEDV从Vero细胞释放的影响Fig.8 Effect of SLM on PEDV release from Vero cells
3 讨 论
PED一直是困扰养猪业的一大问题,尽管疫苗免疫是防控PEDV感染的有效措施,但随着PEDV变异株的出现,经典PEDV毒株的疫苗根本无法控制新毒株的致病性[19]。同时临床上尚无治疗PEDV感染的特效药,但现已发现有效的抗病毒药物可以在预防性治疗中发挥重要作用,因此,临床上迫切需要开发抗PEDV药物。回顾文献可知,PEDV吸附和侵入靶细胞的时间为30~60 min,PEDV侵入细胞完成一个生命周期大约需要6 h[20]。已有研究者针对病毒感染过程中的各个阶段筛选或设计了新型抗病毒药物。例如,槲皮素(quercetin)可以通过抑制PEDV 3C样蛋白酶(3C-like protease,3CLpro)的活性来抑制PEDV在Vero细胞中的复制[21],甘草中的甘草甜素(glycyrrhizin,GLY)提取物可以通过依赖HMGB1/TLR4-MAPK p38途径来阻止高迁移率族蛋白B1(HMGB1)与Toll样受体4(Toll-like receptor 4,TLR4)的结合,从而抑制PEDV的感染[22]。金鸡宁(cinchonine)可以对PEDV生命周期的早期阶段表现出显著的抗病毒活性[23],醉鱼草皂苷(buddlejasaponin) IVb主要抑制PEDV的复制和释放阶段[24],表没食子儿茶素没食子酸酯(epigallocatechin-3-Gallate)可以抑制PEDV吸附、入侵和复制等生命环节[25],Griffithsin通过抑制PEDV的吸附来抑制病毒的感染[26],番茄碱(tomatidine)可通过靶向3CLpro并抑制其蛋白活性来减少PEDV的复制[27]。在本研究中,作者发现SLM以剂量依赖的方式显著抑制PEDV的复制,基于病毒生命周期筛选抗病毒药物,为其后期抗病毒机制的研究奠定了基础。
药物对病毒的抑制作用不仅与药物作用机制有关,还与病毒增殖特性有关。SLM对甲型和乙型流感病毒表现出一致的抑制作用,其主要作用于流感病毒生命周期的早期阶段,在流感病毒侵入过程中限制了病毒核蛋白(NP)的核迁移,进而破坏内体酸化。同时SLM能够阻断病毒基质蛋白2(M2)的质子通道活性,因此,SLM可以通过影响流感病毒脱壳的关键步骤进而抑制病毒增殖[28]。PEDV与流感病毒同属于RNA病毒,其复制过程相似,SLM是否也通过该机制抑制PEDV增殖还有待探究。Wnt/β-catenin信号通路属于Wnt经典信号通路,该通路在细胞迁移、遗传稳定性和凋亡中具有重要作用[29-30]。据报道,多种病毒在感染宿主细胞后均可激活Wnt/β-catenin信号通路,使β-catenin的含量增加,进而影响病毒的增殖[31]。Zhu等[32]发现,当β-catenin的含量受到抑制后,可降低牛疱疹Ⅰ型病毒(BoHV-1)的增殖。左叶雯[31]研究发现细胞内β-catenin表达量增加后,进而抑制N蛋白的表达发挥抗PEDV的作用。SLM是Wnt/β-catenin信号传导的有效抑制剂,可以通过阻断Wnt/β-catenin通路抑制肿瘤的生长[33],因此,SLM可能通过调控β-catenin发挥抗病毒作用。
PEDV属于冠状病毒科、冠状病毒属,目前治疗冠状病毒感染的药物主要包括广谱抗病毒药、靶向病毒核酸的抗病毒药和靶向病毒关键复制酶的抗病毒药等。聚醚离子载体属于广谱抗病毒药,据报道,其对人体免疫缺陷病毒1型(human immunodeficiency virus type 1,HIV-1)[12]、流感病毒(influenza virus,IV)[28]、寨卡病毒(Zika virus,ZV)[34]和严重急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)[35-37]具有抗病毒活性。SLM是一种聚醚离子载体类的广谱抗生素,已经是欧洲食品和药品管理局(EFSA和EMEA)批准用于动物饲料的药物,在正常的喂养剂量下,SLM不会在动物中引起明显的异常,在动物的治疗水平上通常是安全有效的[38]。SLM常用于动物饲料中,以预防球虫病,提高家禽和牛的饲料效率,还可作为仔猪、育肥猪的新一代离子型促生长剂,其作用机制主要是通过干扰有害微生物,进而改善饲料转化率,提高营养物质的吸收,SLM对动物机体来说是相对安全的,严格控制其用量即可发挥预防疾病的作用,方便临床应用[38-39]。与开发新的抗病毒治疗化合物相比,药物再利用是一种有价值的战略,因为其成本更低,审批时间更快。因此,选取SLM作为PEDV的治疗药物进行研究大大缩短了新药研发周期,节省了人力、物力、财力。
本研究以PEDV感染Vero细胞为体外模型,在病毒生命周期的吸附、入侵、复制和释放四个不同阶段添加SLM,发现SLM显著抑制PEDV在Vero细胞中复制的过程,而对病毒吸附、入侵和释放阶段没有显著的影响。此外,SLM体外抑制PEDV复制的机制和SLM在体内的抗PEDV效果需进一步探讨。本研究结果为PEDV的防治提供新的策略。
4 结 论
SLM以剂量依赖的方式显著抑制PEDV在Vero细胞上的增殖,并且其主要作用于PEDV的复制阶段,而对PEDV的吸附、入侵和释放阶段没有显著影响。

