外源维生素E和硒调控动物精液品质的研究进展
魏雅婷,徐泽君,陈虹宇,王献伟,陈其新*,刘深贺*
(1.河南农业大学动物科技学院,郑州 450046;2.河南省畜牧技术推广总站,郑州 450008)
优良的公畜精液是实现高质量育种和提高后代生产力的基础。然而,当低温、应激、疾病等不良因素造成动物机体或精子本身的氧化与抗氧化系统失衡时,易产生氧化应激,损伤睾丸功能、精子质膜、DNA完整性和线粒体功能,导致精液品质降低[1]。畜禽机体内具有一定的酶类抗氧化物质,通过清除过量产生的ROS保护精子细胞结构和功能的稳定,主要包括超氧化物歧化酶(superoxide dismutase, SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px),SOD的活性反映了机体清除自由基的能力,GSH-Px主要存在于线粒体中用于清除过氧化氢和脂质过氧化物(lipid peroxidation, LPO)[2]。抗氧化剂具有调节各种抗氧化酶,清除过量的ROS,改善精液品质的作用[3],因此,各种外源抗氧化剂被添加到动物日粮或精液稀释液中,其中维生素E和硒作为常见的两种抗氧化剂被广泛研究和使用[4-5]。本文综述了单独或联合使用维生素E和硒在调控公畜(禽)精液品质上的应用效果及调控机制,旨在为维生素E和硒的产业化应用提供理论依据和现实参考。
1 维生素E和硒的生理功能
维生素E又名生育酚,具有抗氧化、调节免疫系统、诱导细胞凋亡、参与铁代谢和甾体生成等功能[6]。维生素E苯环上存在一个可提供单电子具有还原性的羟基,当过量产生的ROS引发细胞膜多不饱和脂肪酸发生脂质氧化时,维生素E能够阻断ROS的链式反应,发挥抗氧化作用[7-8]。硒是GSH-Px的重要组成部分,每分子中含有4个硒原子,该酶对于机体抗癌、抗氧化、免疫和衰老起着重要调控作用[9]。硒通过各种含硒酶及硒蛋白发挥效应,参与细胞抗氧化的硒酶主要有GSH-Px,此外抗氧化酶还包括SOD、过氧化氢酶(catalase, CAT)和硫氧还蛋白过氧化物酶等[10]。
维生素E和硒能构建一个完整的抗氧化系统,二者在生理功能上存在协同关系(表1)。在细胞中,硒对维生素E的再生有促进作用,Ebeid等[11]试验证明0.3 mg·kg-1有机硒和250 mg·kg-1维生素E组合使用时,有机硒促进维生素E在獭兔机体内再合成。维生素E再生涉及的一些酶,如GSH-Px的合成依赖硒的参与,硒是GSH-Px表达的辅助因子之一[12-13],硒含量较低时GSH-Px的活性会快速下降,GSH-PxmRNA的表达量也随之下降,反之mRNA的表达量升高[10]。此外,硒是胰腺维持正常生理功能必需的微量元素,胰腺分泌的胰蛋白酶和胰脂肪酶可消化脂肪,间接促进脂溶性维生素E的吸收[14]。维生素E与硒有相似的生理功能,但二者作用部位不同,不可相互替代,维生素E主要在细胞外阻断ROS的链式反应,硒则以GSH-Px作为进入睾丸细胞的载体,清除进入细胞内的ROS以及细胞自身过量产生的ROS,故维生素E相当于机体抗氧化系统的第一道防线,硒则为第二道防线[15]。维生素E和硒在保护细胞生物膜免受氧化应激损伤、减缓睾丸氧化应激和清除自由基方面具有协同作用[16],但如果一种供给量低于临界值,另一种即使过量也不能缓解氧化应激症状[14]。

表1 维生素E和硒协同作用关系Table 1 Synergistic relationship between vitamin E and selenium
2 外源维生素E和硒调控动物精液品质应用效果
2.1 稀释液中添加维生素E和硒调控畜禽精液品质
动物精液具有抗氧化应激系统,包括酶促和非酶促抗氧化剂[17],精清中含有CAT、SOD、GSH-Px、维生素A、维生素E、维生素C、尿酸、谷胱甘肽及类胡萝卜素等天然抗氧化剂[18],然而精液在冻精生产过程中,低温平衡和精液冻融时精子代谢会产生大量的ROS,原精进行稀释后导致精清中天然抗氧化剂浓度降低,内源性防御系统不足以对抗过量产生的ROS,造成精液品质下降,甚至使其丧失正常受精能力,精子氧化应激是造成冻后精子活力下降的重要原因[19]。
大量研究证明,在稀释液中添加维生素E和硒能够降低精液冷冻保存过程中ROS 的生成,并维持精液抗氧化系统的平衡,提高精液冷冻保存的质量。例如,陈晓英等[20]在娟姗牛精液稀释液中添加0.03 mg·mL-1维生素E,在4 ℃的环境中保存48 h后,娟姗牛精子活力、精子顶体完整率显著提高。Zhu等[21]在兔的精液稀释液中添加200 μm·mL-1维生素E类似物,抑制冻融过程中过量产生的ROS,提高精子冻后活力、质膜和顶体的完整性。然而,郭良勇等[22]研究发现稀释液中添加维生素E对精液的保存质量无明显改善,但可显著减少丙二醛(malondialdehyde, MDA)含量和增强精液中总抗氧化能力(total antioxidant capacity, T-AOC)。Espina-vila[23]等试验表明,在5 ℃冷藏环境中,精液稀释液中添加10 mg·mL-1维生素E对精子质膜完整性和通透性有保护作用,但对精子运动性无明显影响。在精液生产中,硒和维生素E对精液品质的作用效果相似,Nateq等[24]证实公羊精液稀释液中添加1 μg·mL-1纳米硒溶液能够显著提高精子活力和质膜完整性,并降低MDA含量。Khalil等[25]指出,公牛精液稀释液添加0.5或1 μg·mL-1纳米硒能够改善精子活力、质膜完整性以及精浆抗氧化应激的能力,使精子的畸形率显著下降。同样,维生素E和硒联合添加也具有提高畜禽精液品质的作用效果。例如,杨文瑾[26]在牛精液常规卵黄冷冻稀释液中添加 0.5、0.75、1 μL·10 mL-1亚硒酸钠+维生素E制剂,冻融后的精子畸形率下降,添加1 μL·10 mL-1时精子顶体完整率上升,低剂量(<1 μL·10 mL-1)添加时显著改善精子存活率,使精子在体外37 ℃环境中的存活时间由7 h延长至8.5 h。Kowalczyk等[4]试验证明,大松鸡精液稀释液中添加1 mg·mL-1有机硒和8 mg·mL-1维生素E,相比于对照组,在4 ℃条件下保存24 h后,精液活精子百分比提升2.3%。
当维生素E和硒过量添加时会对精液品质造成危害。例如,当在山羊鲜精中添加3 mg·mL-1维生素E时,高水平维生素E可能抑制了铜、铁的性能进而影响精子活力和密度[27]。同样,公牛精液中添加1.5 μg·mL-1纳米硒不仅降低精清中GSH-Px活性,而且增加了LPO水平和硒毒性[28],当超过一定限度后,硒添加浓度越高对精液的危害越大[29]。通过在不同动物品种的精液稀释液中,添加不同浓度的外源维生素E和硒进行浓度梯度试验及添加效果的比较研究(表2),发现虽然最适添加水平不尽相同,但二者单独或联合使用均可缓解精子氧化应激,主要表现在提高精子活力、保护精子顶体膜的完整性。
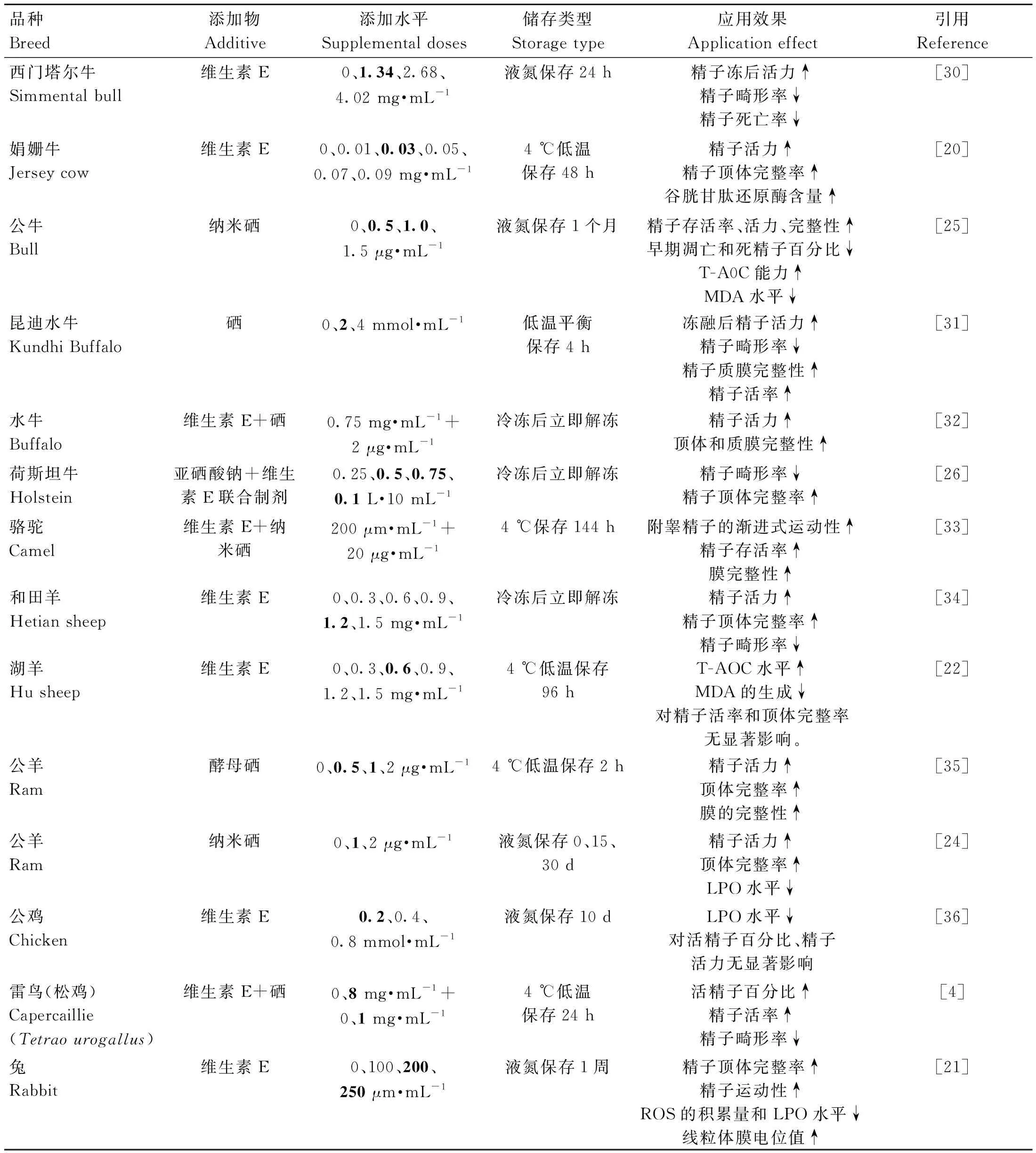
表2 精液稀释液中添加外源维生素E和硒对动物精液品质的影响Table 2 Effects of adding exogenous vitamin E and selenium in semen diluent on semen quality
2.2 日粮添加维生素E和硒改善畜禽精液品质
2.2.1 维生素E 睾丸内精子发生和甾体形成产生的少量ROS对精子获能、顶体反应和精卵结合是有利的,但过量ROS生成会降低膜的流动性、损伤蛋白质,危害睾丸正常的生理功能[37]。日粮中添加维生素E可增强睾丸细胞膜和线粒体膜的抗氧化能力,抑制睾丸内ROS的过量产生,进而改善睾丸生理功能。例如,Yue等[38]在绵羊日粮中添加200 IU的维生素E后睾丸细胞膜和线粒体膜中SOD、GSH-Px活性增强、MDA水平降低。在附睾抗氧化系统中维生素E同样发挥着重要作用,小鼠体内缺乏维生素E导致附睾中氧化应激相关基因的表达降低,补充维生素E后附睾内谷胱甘肽s-转移酶(GST)、GSH-Px的表达增加了50%以上[39]。Zhu等[40]研究发现,波尔山羊日粮中添加80和320 IU·kg-1维生素E使其睾丸重量增加,生精细胞的数量和密度以及曲精细管和附睾小管的直径都相应增加,表明日粮中适量添加维生素E促进动物睾丸的发育和精子发生,类似的结论在公猪[41]、小鼠[42]、鸡[43]等其他动物上也得到了证实(表3)。

表3 日粮中添加或皮下注射维生素E和硒改善畜禽精液品质的应用效果Table 3 Effect of dietary supplementation or subcutaneous injection of vitamin E and selenium on improving semen quality of livestock and poultry
2.2.2 硒 硒对公畜睾丸功能、精子发生、性激素合成及抗氧化酶的活性有着重要影响[44-45]。大鼠日粮缺硒导致精子在附睾中成熟发生缺陷,附睾中精子尾部表现出一系列鞭毛缺失现象以及线粒体鞘过早终止[46]。Mojapelo和Lehloenya[47]给萨能山羊仔畜饲喂亚硒酸钠后,使其更早达到初情期,单次射精量、精子活力、精液密度、山羊体重及睾丸尺寸显著增加。Chen等[48]在公鸡含250 mg·L-1氯化汞日粮中添加10 mg·kg-1的亚硒酸钠,可抑制氧化汞应激产生的ROS,降低MDA水平,使血睾屏障支持细胞的膜表面蛋白表达增加,睾丸SOD、GSH-Px以及T-AOC水平也相应增加。应注意,日粮中硒过量添加会沉积于动物附睾中,破坏附睾和精细胞的微观结构,由于硒的毒性及其进入血液循环和组织的速度使得其应用受到限制[49],因此毒性更小、更有益的纳米硒颗粒成为当前的研究热点。
2.2.3 维生素E和硒联合应用 Jerysz和Lukaszewicz[50]对3岁龄的公鹅每千克饲粮补饲0.3 mg硒和100 mg维生素E,相比于对照组,试验组的公鹅射精量增加1.5倍,精子密度提高1.7倍,精子畸形率降低4.3%~50%,LPO水平降低12倍。金海峰[10]饲喂30日龄公羔羊,每千克饲粮添加0.3 mg硒和 100 IU维生素E降低了精子畸形率,GSH-Px和T-AOC水平显著高于对照组,并增强了精浆抗氧化酶系活性。皮下和(或)肌肉注射维生素E和硒对畜禽精液品质也具有改善作用。例如,Mahmoud等[51]对1.5~2岁的公羊1周两次皮下注射维生素E和硒联合制剂(450 mg维生素E,5 mg硒),显著增加了公羊左右睾丸的宽度和长度,附睾和阴囊的周长,且提高了公羊射精量、精子活力和密度,并降低精子畸形率。Ozer Kaya等[52]对公羊肌肉注射维生素E 300 mg·kg-1和硒5 mg·kg-1,精液中异常精子率下降,这与Safa等[53]在公鸡上得出的结论一致。此外,公羊精浆精氨酸酶活性、精液体积、精子活力和浓度较对照组均提高,精浆一氧化氮水平和精液pH降低。综上所述,一定剂量的维生素E 和硒联合使用可提高畜禽生殖性能。
当公畜(禽)处于热应激状态时,严重影响其生殖性能,表现为性欲减退、射精量减少、精子活力降低、畸形率升高以及精子质膜完整性下降等[54-55]。日粮中联合添加维生素E和硒可缓解热应激造成的公畜精液品质下降。例如,施力光等[56]在海南黑山羊热应激状态下,每千克饲粮补饲硒 0.5 mg和维生素E 100 mg,与对照组相比,添加二者并没有显著影响山羊射精量,但能显著提高山羊的精子密度和精子活力,极显著降低精子畸形率,精浆中GSH-Px、CAT、T-AOC的表达活性增强,精子代谢过程中MDA的产生量减少,显著降低了精浆热休克蛋白HSP70和HSP90 mRNA的表达水平。Hosny等[12]在日粮含硒 0.34 mg·kg-1的基础上额外添加0.3 mg·kg-1纳米硒,大幅度缓解了公兔热应激,提高了公兔抗热应激能力和繁殖性能。Ebeid[55]证实单独饲喂公鸡0.3 mg·kg-1有机硒或200 mg·kg-1维生素E提升了热应激状态下精子密度和活力,降低了死精率,当二者组合饲喂显著提高了精浆GSH-Px活性,提升了精液品质。Butt等[57]试验发现,热应激下每天饲喂公牛6 000 IU维生素E和3 g硒,可改善公牛精液品质和提高睾酮水平,但其代谢产热并没有降低。基于以上研究,表明饲粮中添加维生素E与有机硒具有协同作用,可改善精浆抗氧化能力,从而缓解热应激造成动物精液品质的下降[58](表3),但二者组合最适添加剂量目前没有确切定论。
3 维生素E和硒抗氧化调控机理
睾丸功能障碍是造成精液品质下降的主要原因,ROS引起的氧化应激可激活抗氧化酶防御系统,同时调控多种抗氧化信号通路、离子通路,保护细胞免受氧化损伤。
3.1 CATSPER离子通道
CatSper(cation channel of sperm)基因是编码离子通道蛋白的基因家族之一,包括成孔蛋白CATSPER1-4和多个辅助亚基。CatSper是精子细胞膜上最重要的钙离子通道,在人、马、鼠、羊、猪精子中特异性表达,主要分布在精子颈部、尾部和细胞质滴上,对于调节精子运动和受精过程起着重要作用[61-63]。CatSper1和CatSper2定位于精子尾部的线粒体上,对精子运动起重要作用[64]。CatSper3和 CatSper4定位于精子头部,影响精子超活化和顶体反应等功能[65]。CatSper是哺乳动物精子细胞膜上实现精子超激活的重要Ca2+通道,通过对生理配体的响应来调节精子的关键生理过程,包括精子获能、超激活、顶体反应和趋化性[66-67]。镉诱导细胞产生过量ROS,镉处理的小鼠体内CatSper离子通道的电流降低,CatSper亚基的表达水平下降,说明氧化应激抑制了CatSper亚基表达水平[68]。硒和维生素E可通过调节CatSper基因表达,抵抗衰老小鼠体内过量产生的ROS,改善老年鼠精液品质。Mohammadi等[69]在老年鼠腹腔注射维生素E 106 mg·kg-1,收集老年鼠左侧睾丸和附睾尾检测CatSper基因的表达情况,发现精子头部和精子中部CatSper1和CatSper2染色强度增加,维生素E上调了老年鼠的CatSper1和CatSper2基因表达,提高了精子的活力、数量、存活率且降低畸形率。同样老年鼠腹腔中注射0.2 mg·kg-1亚硒酸钠也具有上调CatSper基因表达、提高精子活力、改善精子形态和存活率的作用[70]。目前对于CatSper的研究正处于探索阶段,已知CatSper1和CatSper2对男性生育能力是不可或缺的,剔除CatSper1和CatSper2后影响精子的活力和运动性[71],CatSper基因可作为精子运动和精子功能的候选基因,从而用于选择优良种公畜。下一步应深入研究CatSper离子通道在调节精子运动、获能和顶体反应的作用及机制,为后续抗氧化剂的开发研究及治疗公畜不育提供重要的理论基础。
3.2 Nrf2-keap1-ARE通路
Nrf2(nuclear factor erythroid related factor-2,Nrf-2)是机体抗氧化和细胞防御系统的关键调节因子,通过激活细胞内解毒酶和一些抗氧化蛋白调节机体抗氧化系统[48]。Nrf2对于血睾屏障和睾丸组织功能有重要作用,如糖尿病小鼠的精子发生障碍与其睾丸中Nrf2的表达降低存在密切关系[72]。在机体稳态状态下,Nrf2与其抑制剂Keap1(kelch-like ech-associated protein 1,Keap1)结合位于细胞质中,当发生氧化应激时,ROS刺激Nrf2与keap1分离,Nrf2被磷酸化后进入细胞核中与抗氧化元件(ARE)结合,调节ARE启动子的基因表达,上调抗氧化基因、II期解毒酶(如GST)的转录和合成,从而维持细胞氧化还原稳态和蛋白质稳态[73-75]。
李可欣等[76]在体外培养的绵羊睾丸间质细胞中添加2 μmol·L-1的亚硒酸钠,睾丸间质细胞中GSH-Px和SOD的活性增强,并激活Nrf2通路以抵抗氧化应激。随着亚硒酸钠浓度的升高,Keap1活性及其mRNA和蛋白的表达水平下降,促使Keap1释放Nrf2进入细胞核与ARE结合。当亚硒酸钠添加量为8 μmol·L-1时,细胞中Nrf2、血红素加氧酶(HO-1)和醌氧化还原酶-1(NQO-1)的mRNA和蛋白表达呈升高趋势,表明亚硒酸钠可通过激活Nrf2-Keap1-ARE信号通路调控绵羊睾丸间质细胞的抗氧化能力[77](图1)。Fang等[74]研究表明维生素E抑制镉诱导的氧化应激,保护大鼠肝脏功能并激活Nrf2通路抵抗ROS。Liu等[78]证实,维生素E促进大鼠血睾屏障支持细胞相关蛋白ZO-1、Occludin、N-cadherin和β-catenin的表达,激活Nrf2通路以缓解PM2.5引起的氧化应激损伤。维生素E和硒协同促进抗氧化途径Nrf2-Keap1-ARE的表达机制目前还存在争议[74,79],部分学者认为维生素E和硒通过激活Nrf2,上调下游基因NQO1、HO-1、谷氨酰半胱氨酸连接酶催化亚基(GCLM)、谷氨酸半胱氨酸连接酶修饰亚基(GCLC)的表达,刺激颗粒细胞增殖和甾体生成,减少细胞凋亡、缓解内质网应激[80]。相反,Burk等[81]研究发现,乏硒会影响Nrf2-Keap1-ARE诱导的抗氧化酶表达,但是缺乏维生素E却不会,由此认为维生素E和硒的氧化防御机制是相互独立的。Nrf2的激活可作为治疗睾丸功能障碍的靶点,由于血睾屏障阻碍了Nrf2激活剂进入睾丸发挥作用,未来纳米载体的抗氧化物质(如纳米硒)在穿越血睾屏障方面具有巨大潜力,下一步应着力研究不同抗氧化剂之间是否具有协同通路以及二者发挥作用的机理。

红线为下调作用,黑色箭头为上调作用The red lines indicate down-regulation, and the black arrows indicate up-regulation图1 维生素E和硒调控Nrf2-Keap1-ARE通路抵抗氧化应激[72, 81]Fig.1 Vitamin E and selenium regulate the Nrf2-Keap1-ARE pathway against oxidative stress[72, 81]
4 展 望
日粮或稀释液中单独或联合添加维生素E和硒均对调控动物精液品质有着积极作用。维生素E和硒在日粮和稀释液中最佳添加剂量一直存在争议,可能是由于不同动物品种遗传因素、个体差异、精子结构差异、动物体内抗氧化剂的基础浓度或状态、添加物的物理状态差异(粒径、孔径、表面电荷)、饲养管理水平和冷冻精液的储存时间等因素造成。维生素E和硒调控动物精液品质的具体机制以及二者之间发挥协同作用的通路尚存在分歧。下一步应深入研究维生素E、硒调控公畜(禽)生殖系统的机制,并借助具有高吸附能力、高吸收利用效率的纳米载体开发具有协同作用的复合型抗氧化剂,以期指导生产实践。

