食源性多肽的降血压作用及其机制研究进展
王宝贝
张 慧1,3
刘宇松1
陈洪彬1,2
郭凤仙1,2
郑宗平1,2
(1. 泉州师范学院海洋与食品学院福建省海洋藻类活性物质制备与功能开发重点实验室,福建 泉州 362000;2. 近海资源生物技术福建省高校重点实验室,福建 泉州 362000;3. 福建农林大学食品科学学院,福建 福州 350002)
高血压是一种全球性的高发性心血管疾病,是引起中风、心肌梗死、心脏病等并发症的主要危险因素。当前,全球高血压人数已超过10亿人,其中中国高血压患者占比高达23.2%。并且,这个数字还在持续增加,预计2025年全球高血压人数将达到16亿人[1-2]。人体主要通过肾素—血管紧张素—醛固酮系统(the renin angiotensin aldosterone systemm,RAAS)和激肽—一氧化氮系统(kinin-nitric oxide system,KNOS)共同调节血液循环维持血管系统的血压[3]。其中,RAAS控制血管收缩程度,KNOS控制血管舒张程度。当前临床上治疗高血压的药物多为针对RAAS靶点开发,比如:卡托普利、依那普利和赖诺普利等治疗高血压的药物正是血管紧张素-Ⅰ-转换酶(angiotensin-I-converting enzyme,ACE)抑制剂[4],阿利吉仑则是通过抑制肾素活性来降低血压[5]。这些化学合成的药物多有一定的不良反应,长期使用会引起干咳、皮疹、味觉障碍、肾功能损伤等症状[6]。
生物活性肽由短的氨基酸序列组成,结构简单、生物穿透性好、易于被细胞吸收,且不容易与其他药物分子结合而产生不良反应。研究[6]表明,许多食源性蛋白来源的多肽具有抗氧化、抗菌、降血压、降血脂等生物活性。自20世纪80年代报道牛酪蛋白酶解物中具有ACE抑制活性可以用于预防或者治疗高血压后,降血压肽开始受到关注,关于降血压肽的筛选鉴定、制备、作用机制和产品开发等的研究越来越多。中国对降血压肽的研究起步较晚,继国家“九五”规划将降血压肽列入攻关课题之后,科研工作者对降血压肽开展了广泛的研究[7]。分别在中国知网及Web of Science上检索2000年以来文中出现“降血压肽”和“antihypetension peptide”的文章,汇总如图1所示。可见,2006年以后国内外有关降血压肽的研究报道快速增加,2011年以后每5年发表的文章数量保持在700篇左右。说明自2006年以来,国内外学者对降血压肽的研究一直保持较高的热度。

图1 2000年以来国内外发表降血压肽相关论文情况
降血压肽的来源广泛,陆生动植物、水生动植物等均有发现具有降血压功效的多肽(表1)。
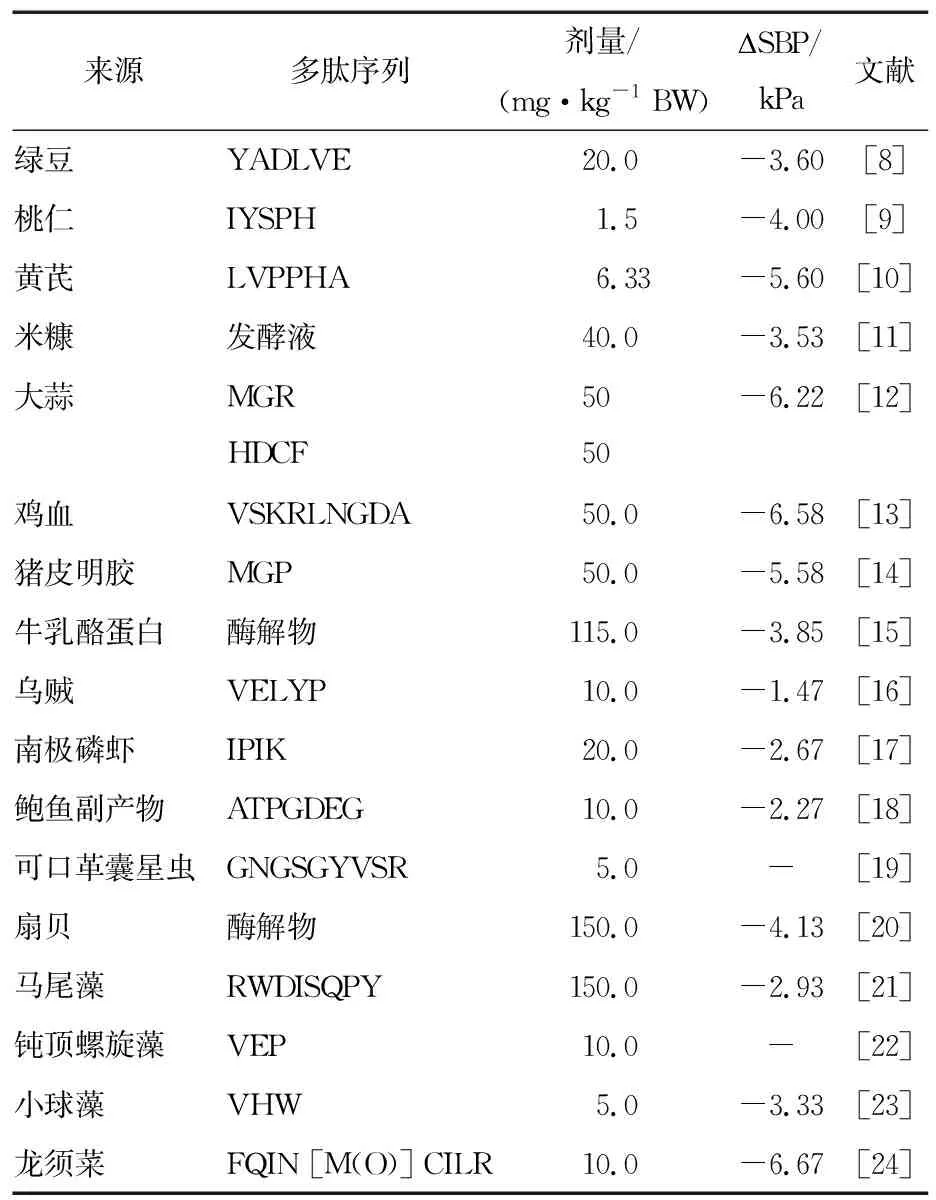
表1 多肽的降血压作用效果
当前,已有大量具有降血压活性的生物肽被分离鉴定,部分已被证实能够有效降低自发性高血压大鼠(spontaneous hypertensive rats,SHR)的血压,比如Pan等[22]从螺旋藻蛋白水解物中分离纯化得到两条三肽(IQP和VEP)对自发性高血压大鼠具有明显的降血压作用。来源于牛奶酪蛋白的IPP、VPP和LPP(俗称乳源三肽)已通过临床试验,被证实能够有效降低高血压患者的血压,并且对正常血压者的血压无影响[25]。天然来源的降血压肽因为来源丰富、毒副作用小而引起了广泛关注。虽然近年来关于降血压肽的制备、分离鉴定等的研究报道已有不少[26-28],但对这些多肽降血压机制的归纳总结却较少。文章对近年来天然来源的降血压肽的作用机制进行归纳总结,以期为今后开发降血压肽的相关产品提供参考。
1 以RAAS系统通路为靶点调节血压
1.1 ACE/Ang Ⅱ/AT1R信号通路
RAAS系统首先将肾脏中的肾素原转化为肾素,并将其释放到血液中。然后,血液中的肾素刺激血管紧张素原使其释放血管紧张素Ⅰ (angiotensin Ⅰ,Ang Ⅰ),Ang Ⅰ经ACE催化裂解为具有活性的Ang Ⅱ,Ang Ⅱ与其Ⅰ型受体(angiotensin Ⅱ type 1 receptor,AT1R)结合引起血管收缩[29](图2)。Ang Ⅱ还能刺激肾上腺皮质球状带分泌醛固酮,增加肾脏循环血量,进而导致血压升高[30]。过度活跃的RAAS系统是引起原发性高血压的主要原因。减少血管收缩因子Ang Ⅱ的生成是治疗原发性高血压的常用方法。因此,Ang Ⅱ生成的两个关键酶,肾素和ACE,常被作为食源性降高血压多肽的靶点。此外,由于Ang Ⅱ需要与其受体AT1R结合才能发挥收缩血管的作用,因此AT1R抗结剂可以通过阻碍Ang Ⅱ与其受体结合,起到降血压的功效。

图2 RAS和KNOS对血压的调节机制
1.1.1 抑制ACE活性 ACE是一种锌金属蛋白酶,不仅可以刺激Ang Ⅰ生成Ang Ⅱ引起血压收缩,还能使缓激肽失活减少NO的生成,减弱血管扩张能力。抑制ACE不仅可以减少Ang Ⅱ的生成缓解血管收缩,还有利于NO的生成促进血管舒张,起到降血压的双重效果。因此,ACE常被作为临床上治疗高血压的靶点。目前报道的食源性抗高血压肽多是以ACE作为靶点,其来源广泛。马尾藻[21]、南极磷虾[17]、鲍鱼副产物[18]等来源的ACE抑制肽均被证实能不同程度地降低SHR大鼠的血压。比如,来源于新西兰白兔肉的一种ACE抑制四肽WGAP,其对ACE的半抑制浓度(half maximal inhibitory concentration,IC50)为140.70 μmol/L。将其给高血压大鼠灌胃,剂量100 mg/kg,4 h后高血压大鼠的收缩压和舒张压分别降低了5.69,3.81 kPa[31]。Krichen等[32]从虾蛋白中分离鉴定出4种ACE抑制肽,分别为SSSKAKKMP、HGEGGRSTHE、WLGHGGRPDHE和WRMDIDGDIMISEQEAHQR。
多肽的一级结构即氨基酸序列是决定其ACE抑制活性的重要因素。C末端含Val、Trp、Ile、Phe、Met、Tyr和Ala等疏水氨基酸或芳香族氨基酸的多肽往往表现出更好的ACE抑制活性[36]。Chen等[37]从核桃蛋白中筛选到3种新的ACE抑制肽(GVVPHN、EHSLDPLK和KTLLNFGPN),其中ACE抑制活性最高的多肽GVVPHN,疏水氨基酸物质的量分数高达50%。这也表明疏水性作用力在抑制肽和ACE分子的相互作用中起着重要作用。Xie等[23]从小球藻中筛选了两条具有高ACE抑制活性的多肽TTW和VHW,其IC50值分别为(0.61±0.12),(0.91±0.31) μmol/L,这两条多肽的C末端均为色氨酸。此外,分子量大小是影响多肽生物活性的另一因素。与大分子肽相比,小分子肽更容易与ACE活性位点结合形成复合物,更有效地抑制ACE活性[38]。
1.1.2 抑制肾素活性 虽然抑制ACE可以较好地降低高血压,但会引起Ang Ⅰ的积累导致激肽代谢紊乱,进而使患者产生口干、血管神经性水肿等副作用。分泌肾素是RAAS调控血压的第一步,是诱导血管紧张素原释放Ang Ⅰ的关键步骤。抑制肾素活性可以从源头上减少Ang Ⅱ的生成,避免抑制ACE引起的副作用。已有研究发现,菜籽粕[39]、火麻籽[40]、亚麻籽[41]、豌豆[42]等植物种子来源的生物活性肽具有抑制肾素活性的功效。何荣[43]从菜籽粕蛋白中分离得到一条抑制肾素催化活性的四肽(RALP),体外IC50为(0.97±0.04) mmol/L。用其给SHRs灌胃24 h,剂量30 mg/kg BW,可以使大鼠收缩压降低2.13 kPa。此外,动物肌肉、血清蛋白、藻类[44]等来源的多肽也被发现具有抑制肾素活性的功效。Lafarga等[45]用木瓜蛋白酶水解牛血清蛋白,其中相对分子质量<1 000的蛋白水解物可以使SHRs的收缩压在8 h内降低(4.30±0.48) kPa。进一步对该水解物进行质谱分析,从中筛选得到一条对肾素活性有很好抑制功效的三肽,其对肾素的半抑制浓度为(7.29±0.16) mmol/L,该多肽同时对ACE-I也有抑制作用。Fitzgerald等[44]用木瓜蛋白酶水解红藻(Palmariapalmata)蛋白,并从中分离出具有抑制肾素活性和ACE活性的多肽IRLIIVLMPILHA。该多肽可以使SHRs大鼠的收缩压降低4.40 kPa,其降血压效果比卡托普利更佳[45]。
肾素是由335个氨基酸组成的糖基化天冬氨酸蛋白酶,具有高度的专一性,仅以肾素原作为底物[46]。肾素抑制肽一般是通过与肾素的天冬氨酸残基(Asp32、ASP35)或活性位点S3的亚基结合,起到抑制其活性的作用。研究[41]表明,多肽的N末端为亮氨酸、异亮氨酸、缬氨酸等脂肪族氨基酸残基或者是C末端为苯丙氨酸、色氨酸、酪氨酸Tyr等芳香族氨基酸残基的小分子肽肾素抑制活性更佳。这可能与肾素的独特空间结构有关,其C端和N端结构域形成一个深邃的裂缝,与该位点结合的多肽相对分子质量足够小才能进入裂缝。He等[39]从油菜籽中分离得到了3条活性较佳的肾素抑制肽均为小分子的二肽,Leu-Tyr,Ile-Trp和Thr-Phe,其半抑制浓度分别为1.8,2.3,3.7 mmol/L。目前被报道物质中活性最佳的肾素抑制肽的体外半抑制浓度为0.054 mmol/L,也是小分子的三肽(Trp-Tyr-Thr),来自于火麻仁籽[47]。此外,研究[48]表明,疏水性较强的多肽也具有很好的抑制肾素活性,疏水性作用力也是抑制肽与肾素结合的重要相互作用力之一,一些疏水性较强的多肽也表现出很好的肾素抑制活性,比如Gly-His-Ser,其IC50为1.09 mmol/L。疏水性较强的抑制肽可能更倾向于通过ACE/Ang Ⅱ/AT1R信号通路调节血压。
1.1.3 抑制AT1R或激活AT2R 由于肾素原在与细胞表面受体结合时也能表现出与肾素类似的活性,因此抑制肾素活性并无法完全抑制Ang Ⅱ的形成。在RAAS的下游,Ang Ⅱ的Ⅰ型受体(AT1R)和Ⅱ型受体(angiotensin Ⅱ type 2 receptor,AT2R)负责调节生理效应,Ang Ⅱ通过AT1R在循环系统内发挥收缩血管的作用,通过AT2R调节血管扩张的同时抑制肾小球旁细胞肾素的合成[49]。选择性阻断AT1R可以从Ang Ⅱ的终端抑制其诱导血管收缩,并且不会引起与缓激肽降解相关的副作用。这种能选择性阻断AT1R的物质被称作Ang Ⅱ受体拮抗剂(Ang Ⅱ receptor blockers,ARB),临床上使用的氯沙坦正是利用这一原理来治疗高血压。食源性多肽除了通过抑制ACE、肾素活性降低高血压外,还可以通过直接阻断AT1R起到降血压的作用。Chen等[50]发现,蛋清水解物可有效降低SHRs的血压,并从该蛋清水解物中分离鉴定得到其抗高血压的主要成分为多肽ITKPNDVYS,该多肽通过降低血管平滑肌细胞AT1R水平达到降低血压的功效。另外,Cao等[51]发现,牛骨明胶的碱性蛋白酶水解物不仅能直接抑制ACE活性,还能使心肌组织中的AT1R下调、AT2R上调,通过抑制ACE/Ang Ⅱ/AT1R通路和激活Ang Ⅱ/AT2R通路的共同作用,使成年雄性SHRs大鼠的血压降低。
1.2 激活ACE2/Ang (1-7)/MasR信号通路
ACE2是ACE的一种同源酶,该酶不仅能够催化Ang Ⅱ降解为Ang (1-7),Ang (1-7)通过Mas受体(mas receptor,MasR)起血管舒张作用[4],还能催化Ang Ⅰ生成Ang (1-7)的前体Ang(1-9),进而形成更多的MasR[52],该通路被称为ACE2/Ang (1-7)/MasR信号通路。可见,提高ACE2的表达可以减少Ang Ⅱ的积累降低血管收缩程度,还能通过MasR的过表达促进血管舒张,达到双重的降血压效果。ACE2自2000年被发现以来,即引起广泛关注,被认为是治疗高血压的有效靶点之一。已有研究[52-53]发现,食源性多肽可以通过刺激ACE2和MasR的转录表达水平降低SHRs血压。钝顶螺旋藻中分离得到的多肽Ile-Gln-Pro和Val-Glu-Pro可以通过上调ACE2和MasR的mRNA水平而降低SHRs的血压[22]。Liao等[53]从血清蛋白中分离得到一种三肽(IRW)可以有效降低SHRs的血压。进一步研究发现,该多肽可以促进ACE2和MarS的表达,同时排除了该多肽对ACE, AT1R和AT2R的作用,从而确定IRW确实是通过激活ACE2/Ang (1-7)/MasR信号通路降低SHRs的血压。IRW在体内作为ACE2激活剂的机制包括增强内皮依赖性血管松弛和减少血管炎症。
2 以KNOS通路为靶点调节血压
KNOS是控制血管舒张程度的调节系统。如图2所示,在血管内皮中,缓激肽激活一氧化氮合成酶(endothelial nitric oxide synthasee,eNOS)催化精氨酸生成NO,NO激活鸟苷酸环化酶催化三磷酸鸟苷(guanosine triphosphate,GTP)生成5′-环鸟苷酸(5′-cyclic-guanosine monophosphate,cGMP)并激活cGMP依赖性激酶,进而诱导血管舒张[54]。可见,提高eNOS活性可以直接提高NO的生成量,进而促进血管舒张,达到降低血压的目的。eNOS的活性受到其序列中某些氨基酸残基的磷酸化和去磷酸化的影响。研究[55]发现,心血管疾病患者体内的eNOS起催化作用的丝氨酸残基的磷酸化水平较低,且其MAPK、蛋白激酶B、细胞外调节蛋白激酶和钙离子/钙调蛋白依赖性蛋白激酶II(Ca2+/calmodulin-dependent protein kinase II,CaMK-II)等eNOS相关的磷酸化激酶水平也很低。因此,理论上通过修饰eNOS这些位点可以提高其活性。
2.1 PI3K /Akt/eNOS 信号通路
研究[4]表明,磷脂酰肌醇-3-磷酸激酶(phosphatidylinositiol-3-phosphate kinase,PI3K)可以激活Akt,磷酸化eNOS的催化残基(Ser1 177或Ser1 179)提高eNOS的活性,从而诱导血管内皮平滑肌松弛,降低血压,此即“PI3K /Akt/eNOS 信号通路”(图3)。来源于牙鲆鱼糜的3种肽IVDR、WYK和VASVI能促进Akt和eNOS的磷酸化,显著促进人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)中NO的生成。将上述多肽给SHRs口服,可以有效降低SHRs的血压,发挥抗高血压活性[56]。Lin等[57]从牦牛乳酪蛋白中分离出的肽KYIPIQ也能通过提高eNOS活性促进HUVECs中NO的释放,起到血管舒张的作用。Carrizzo等[58]发现,来源于螺旋藻的肽GIVAGDVTPI能引起离体SHRs肠系膜动脉的血管舒张。使用药理抑制剂在功能和分子水平上对细胞内通路进行表征,结果表明,GIVAGDVTPI作用于PI3K/Akt细胞内信号通路促进eNOS磷酸化,增加NO释放。另外,抑制eNOS可消除GIVAGDVTPI诱发的SHRs和Wistar-Kyoto正常大鼠的血管舒张,表明NO是GIVAGDVTPI诱发血管舒张的决定因素。

图3 PI3K/Akt/eNOS信号通路和L型Ca2+通道的阻断机制
2.2 PPAR-γ/caspase3/MAPK/eNOS信号通路
研究[59]发现,过氧化物酶体增殖剂激活受体(peroxisome proliferator-activated receptor-γ,PPAR-γ)的活化,能够减轻氧化应激和炎症,抑制血管收缩以及α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、RhoA、活性半胱天冬酶-3的表达,同时提高eNOS水平,促进血管舒张,该机制称作“PPAR-γ/caspase3/MAPK/eNOS信号通路”(图4)。因此,PPAR-γ被视为血压调节的新靶点。Ngo等[60]用鳐鱼皮明胶碱性蛋白酶水解物给SHRs灌胃20 d后,发现大鼠的收缩压(systolic blood pressure,SBP)显著降低。进一步研究发现该水解物通过激活PPAR-γ抑制内皮素-1(endothelin-1,ET-1)、α-SMA、RhoA、活性半胱天冬酶-3和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)的表达,进而使肺中eNOS活性增强。此外,从水解物中分离的两种肽LGPLGHQ和MVGSAPGVL还具有明显的ACE抑制作用。可见,鳐鱼皮明胶水解物是通过PPAR-γ/caspase3/MAPK/eNOS信号通路和ACE抑制途径共同发挥抗高血压作用。

图4 PPAR-γ对血压的调节机制
2.3 阻断L型Ca2+通道
钙通道功能是血管肌膜兴奋的基础,并赋予血管显著的电压敏感性。细胞内Ca2+与钙调蛋白(calmodulin,Cd)形成Ca2+-Cd复合物,该复合物通过抑制eNOS刺激血管收缩。因此,阻断L型Ca2+通道抑制钙流入细胞内,可以减少Ca2+-Cd复合物的生成,从而抑制血管收缩,达到降低血压的目的[61],如图3所示。伍强[62]发现灵芝菌丝ACE抑制肽通过促进eNOS磷酸化生成NO,NO自由扩散至邻近的血管平滑肌细胞中,结合并激活NO受体——可溶性鸟苷酸环化酶(soluble guanylyl cyclase,sGC),进而催化GTP生成第二信使cGMP,cGMP进一步激活PK-G,从而激活细胞膜上钙泵,导致胞内游离Ca2+排除胞外,发挥降血压功效。因此,抗高血压肽作为钙通道阻滞剂与血管壁和心肌中的电压门控钙通道相互作用,导致血管扩张[63]。
3 抑制内皮素转换酶活性
ET-1的过度表达是动脉粥样硬化和高血压等心血管疾病的内源性因素之一。ET-1可以促使血管收缩,尤其是引起冠状动脉的强烈收缩,进而引起血压升高。肾上腺素、ACE、胰岛素及血管内皮细胞的氧化损伤或物理损伤都能促进ET-1的产生[64]。内皮素转换酶(endothelin converting enzyme,ECE)在血压调节中起着至关重要的作用,其催化大分子内皮素生成ET-1,ET-1与ET受体结合后诱导包括血管收缩在内的一系列生理效应。因此,ECE抑制剂和ET受体竞争剂可以作为治疗高血压治疗的靶点。已有研究[65-66]从鲣鱼肉、牛肉及乳铁蛋白等的多肽水解物中发现具有ECE抑制活性的多肽,可以通过抑制ECE来减少ET-1的释放。Zheng等[21]从马尾藻中分离得到一种多肽(RWDISQPY),发现其可以通过抑制ACE活性或保护血管内皮细胞免受氧化应激来减少ET-1的分泌,从而发挥抗高血压作用。Zhao等[64]分别用50,100,200 μmol/L的南极磷虾多肽(AKP1、AKP3、AKP6和AKP7)处理HUVECs 24 h,HUVECs中ET-1的生成显著降低,NO的生成以浓度依赖性方式显著增加。以上均表明多肽可能通过影响ET-1和NO系统来发挥抗高血压作用。
4 结论和展望
食源性降血压肽在治疗和预防高血压方面的作用在人体内、体外已得到了不同程度的验证。食源性降血压肽主要通过基于肾素—血管紧张素—醛固酮系统的ACE/Ang Ⅱ/AT1R信号通路和ACE2/Ang (1-7)/MasR信号通路,以及以激肽—一氧化氮系统通路为靶点的PI3K/Akt/eNOS信号通路、PPAR-γ/caspase3/MAPK/eNOS信号通路和L型Ca2+通道调节血压。此外,也有部分多肽通过抑制内皮素转换酶活性降低血压。降血压肽的效果和作用机制主要取决于其氨基酸序列,而氨基酸序列主要决定于原料的种类和多肽的制备方法等。当前关于多肽作用机制的研究多是以单一多肽为研究对象,对混合多肽的作用机制的研究较少。鉴于多肽通过不同信号通路调节血压,今后可以理性设计复配多肽使之同时作用于2条或者2条以上的信号通路,研究其降血压功效是否得到增强。

