水飞蓟素对S. aureus ATCC25923生物膜及其毒力因子的影响
王嘉康
唐浩国
陈 静
司启贺
申茹晓
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
金黄色葡萄球菌(Staphylococcusaureus)作为一种常见的食源性致病菌,可引起人类和动物的感染和食物性中毒[1]。随着抗生素的使用,多重耐药性金黄色葡萄球菌的传播正在以惊人的速度增加[2]。金葡菌生物膜能够帮助细菌抵御宿主免疫系统,更容易产生耐药菌株,甚至多重耐药菌株,这些耐药菌株是导致慢性感染的主要病源,给人类和家畜的生命健康和食品安全造成极大的危害[3]。
生物膜由细菌群落和细胞外基质(extracellular matrix,ECM)构成,是细菌黏附于物体的表面,通过分泌多糖、蛋白质、糖蛋白、糖脂和细胞外DNA(eDNA)等形成的高度组织化的膜样聚合物[4-5],具有极强的黏附性和抗逆性,能够帮助细菌很好地适应周围的环境[6]。自然环境中大多数细菌都能以生物膜的形式存在,生物膜能够黏附在宿主的组织表面,一旦组织细胞受损,致病菌能够不断释放毒素引发感染,并且可能进入机体内随血液流动播散,导致全身性感染[7]。
苯甲酸、苯甲酸钠、山梨酸、山梨酸钾、丙酸钙等化学防腐剂虽能够有效抑制食源性致病菌的生长,但它同时也对人体健康和环境造成一定威胁。因此,植物源天然防腐剂的开发和应用成为当下研究的热点之一[8-10]。水飞蓟素是从水飞蓟果实及种子中提取的一类二氢黄酮醇与苯丙素衍生物缩合而成的黄酮木脂素类成分,因其安全无毒、无刺激性且具有抗炎保肝、抗氧化等优点[11-12],在食品保健[13-15]、医药[16]、化妆品[17]等行业得到广泛关注和应用。研究拟探究水飞蓟素对金黄色葡萄球菌生物膜的影响,以期为植物源活性物质的进一步利用提供理论依据。
1 材料与方法
1.1 材料与仪器
水飞蓟素:纯度80%,西安云悦生物科技有限公司;
二甲基亚砜(DMSO)、结晶紫:分析纯,天津市科密欧化学试剂有限公司;
胰酪大豆胨琼脂培养基、胰蛋白胨大豆肉汤培养基:北京奥博星生物技术有限责任公司;
脑心浸出液肉汤(BHI):青岛海博生物技术有限公司;
噻唑蓝(MTT):纯度≥98%,北京索莱宝科技有限公司;
金黄色葡萄球菌(StaphylococcusaureusATCC25923,ATCC29213,ATCC6538):中国普通微生物菌种保藏管理中心;
紫外—可见分光光度计:UV2400型,上海舜宇恒平科学仪器有限公司;
离心机:TDZ5-WS型,湖南湘仪实验室仪器开发有限公司;
真空冷冻干燥机:ALPHA 1-2 LD plus型,德国Christ公司;
傅立叶变换中远红外光谱仪:IFS 125HR,德国Bruker公司;
多功能酶标仪:Infinite E Plex型,上海Tecan实验器材有限公司。
1.2 最小抑菌质量浓度(MIC)的测定
采用Fei等[18]的方法,MIC为肉眼看不见细菌菌落生长的最低浓度,所有试验平行3次。
1.3 S. aureus ATCC25923产膜能力鉴定
采用Tremblay等[19]的方法,结晶紫染色生物膜后,使用酶标仪于OD490 nm测OD值;判断标准:以OD490 nm<0.11为阴性株,0.11
1.4 结晶紫染色研究水飞蓟素对S. aureus ATCC25923生物膜的抑制及清除作用
1.4.1 对S.aureusATCC25923生物膜的抑制作用 将制备好的含有不同浓度水飞蓟素的菌悬液分别加入到96孔板中,每孔200 μL,以对应浓度的含有水飞蓟素的无菌培养液作为阴性对照。将96孔板置于37 ℃培养箱中培养24 h后用酶标仪测定630 nm处的吸光度。移除菌悬液,PBS轻柔漂洗3次,在60 ℃烘箱中干燥20 min。在每个孔中加入250 μL质量分数为1%的结晶紫溶液,37 ℃下染色5 min,用蒸馏水轻柔漂洗3次,在60 ℃烘箱中干燥20 min。加入250 μL体积分数为33%的醋酸溶液溶解生物膜上结合的结晶紫染料,5 min后在酶标仪上测定570 nm处的吸光度,所有试验平行3次。相对生物膜形成能力以生物膜形成指数表示[20],生物膜形成指数按式(1)计算。
B=(S-C1)/(G-C2),
(1)
式中:
B——生物膜形成指数;
S——染色后OD570 nm值;
C1——染色后空白对照OD570 nm值;
G——培养后OD630 nm值;
C2——培养后空白对照OD630 nm值。
1.4.2 对S.aureusATCC25923成熟生物膜的清除作用
于96孔板上每孔加入1×108CFU/mL的菌悬液200 μL,静置培养24 h形成成熟生物膜后弃去培养液,注入新的培养液与不同浓度的水飞蓟素药液。阴性对照组依旧使用培养液进行处理。37 ℃静置培养24 h后,PBS洗去浮菌,使用结晶紫定量染色法观察生物膜的剩余量,所有试验平行3次。按式(2)计算生物膜清除率[21]。
(2)
试中:
B——生物膜清除率,%;
c1——各处理组OD570 nm值;
c2——对照组OD570 nm值。
“拓基础、强根基、淡专业、重运用、灵考核”五位一体的人才培养模式是一个有机整体,不可分开运用与理解,但是各个部分的侧重点又各不相同。
1.5 MTT染色法检测水飞蓟素对生物膜代谢的影响
参照Jadhav等[22]的方法,使用MTT染色法检测水飞蓟素对生物膜代谢的影响。所有试验平行3次。
1.6 水飞蓟素对S. aureus ATCC25923毒力因子的影响
1.6.1 对S.aureusATCC25923溶血活性的影响 参照徐云凤[23]37-41的方法测定水飞蓟素对金黄色葡萄球菌溶血活性的影响。溶剂组为阳性对照,无菌液组为阴性对照,所有试验平行3次。
1.6.2 对S.aureusATCC25923凝固酶效价的影响 参照徐云凤[23]37-41的方法测定水飞蓟素对金黄色葡萄球菌凝固酶效价的影响。使用冻干血浆测定细菌凝固酶效价,6 h内间隔0.5 h观察一次结果,若出现凝固现象,即为阳性,否则为阴性。所有试验平行3次。
1.7 光学显微镜观察水飞蓟素对S. aureus ATCC25923生物膜的影响
取不同浓度水飞蓟素处理的菌悬液1 mL加入6孔板中,同时放入已灭菌的盖玻片,置于37 ℃培养箱中培养24 h。采用结晶紫染色法在光学显微镜下观察水飞蓟素对生物膜的影响。所有试验平行3次。
1.8 傅里叶红外光谱分析
参照Padmavathi等[24]的方法并稍作修改,采用傅里叶红外光谱法(fourier transform infrared spectrometry,FT-IR)对水飞蓟素处理的金黄色葡萄球菌成分变化进行测定。
1.9 数据处理
所有试验重复3次,试验结果使用SPSS 19.0统计软件分析和处理数据,采用Tukey法进行差异显著性检验,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 产膜能力的鉴定
结晶紫染色后,S.aureusATCC25923生物膜在490 nm处的OD值为1.704±0.133,大于1.5,根据Tremblay等[19]的判断标准,试验采用的菌株为高产膜菌株。
2.2 MIC的测定
如表1所示,对照组均有菌落生长,但在水飞蓟素质量浓度为0.5~1.0 mg/mL的培养基上,S.aureusATCC25923均无菌落生长,证明水飞蓟素对ATCC25923的MIC为0.5 mg/mL。与二氢杨梅素(MIC为1.25 mg/mL)和藤茶提取物(MIC为6.3 mg/mL)以及大蒜水提物(MIC为24.0 mg/mL)对金黄色葡萄球菌的抑菌活性相比[25-26],水飞蓟素的抑菌能力具有明显优势。

表1 水飞蓟素对S. aureus ATCC25923的最小抑菌浓度†
2.3 水飞蓟素对S. aureus ATCC25923生物膜的抑制及清除作用

*表示与对照组相比具有显著差异,P<0.05;**表示与对照组相比具有极显著差异,P<0.01
由图1可以看出,水飞蓟素可以显著抑制金黄色葡萄球菌ATCC25923生物膜的形成,且呈现一定的剂量依赖性,其中对照组的生物膜形成指数为2.679,1/2MIC和MIC浓度的生物膜形成指数为0.566和0.271,相比于对照组分别下降了78.9%和90.0%,具有极显著差异。而低浓度的水飞蓟素对生物膜形成的抑制作用较小。霍佳楠等[27]研究发现,1/16MIC浓度下的蒲公英水提物可诱导金黄色葡萄球菌生物膜的形成,使生物膜生成量增加,但高浓度的蒲公英水提物可显著抑制金黄色葡萄球菌生物膜的形成。崔海英等[28]研究发现,0.1%丁香精油对金黄色葡萄球菌生物膜的抑制率达到99.73%。与其他天然产物相比,水飞蓟素对金黄色葡萄球菌生物膜形成的抑制作用较为显著。
2.3.2 对S.aureusATCC25923成熟生物膜的清除作用
在细菌生物膜成熟之后,加入不同浓度的水飞蓟素处理,结晶紫染色后,使用酶标仪测定其对生物膜的清除能力,结果如图2所示。

*表示与对照组相比具有显著差异, P<0.05;**表示与对照组相比具有极显著差异,P<0.01
由图2可以看出,较高浓度的水飞蓟素对成熟生物膜具有良好的清除作用,其中1/4MIC、1/2MIC和MIC浓度的生物膜清除率分别为16.6%,46.4%,89.2%,而1/16MIC浓度的清除率仅有0.16%,与对照组相比差异不显著。在李虹[29]的研究中,最小生物膜抑制浓度(MBIC)下的环二肽处理金黄色葡萄球菌8 h,其生物膜清除率达到59.17%。试验结果说明水飞蓟素具有较好的生物膜清除作用,且呈现一定的剂量依赖性。
2.4 水飞蓟素对生物膜内细菌代谢的抑制作用
MTT可作用于活细胞线粒体中的呼吸链,在琥珀酸脱氢酶和细胞色素C的作用下,外源性MTT还原为水不溶性的蓝紫色结晶并沉积在细胞中,而死细胞无此功能。
二甲基亚砜(DMSO)能溶解细胞中的蓝紫色结晶,用多功能酶标仪在570 nm处测定其光吸收值,可间接反映活细胞代谢情况。如图3所示,当水飞蓟素浓度达到1/4MIC时就能显著抑制生物膜内细菌的代谢,随着水飞蓟素浓度的增加,抑制作用逐渐增强,MIC浓度的抑制率达到85.5%。此试验结果与结晶紫染色法测定水飞蓟素对生物膜形成的抑制作用有较高的一致性。
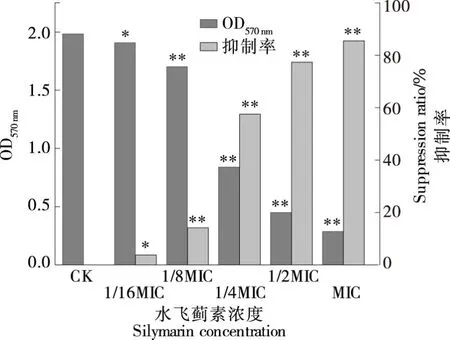
*表示与对照组相比具有显著差异,P<0.05;**表示与对照组相比具有极显著差异,P<0.01
2.5 光学显微镜观察水飞蓟素对生物膜的抑制作用
将盖玻片用结晶紫染色后,放在光学显微镜下观察,结果如图4、图5所示。
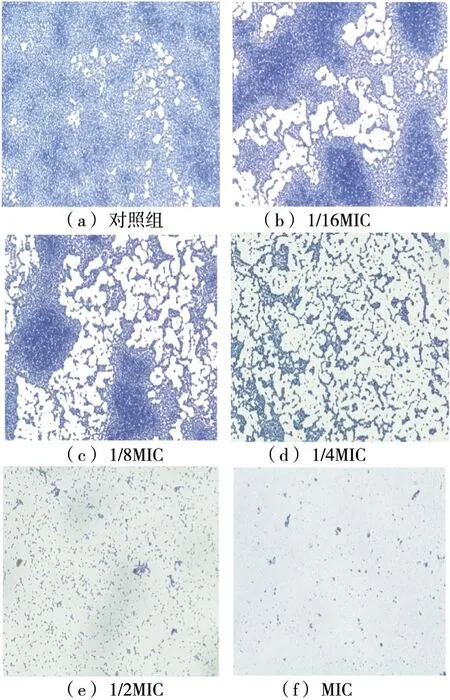
图4 水飞蓟素对S. aureus ATCC25923生物膜的影响

*表示与对照组相比具有显著差异,P<0.05;**表示与对照组相比具有极显著差异,P<0.01
低浓度的水飞蓟素对生物膜的抑制作用较弱,高浓度的水飞蓟素能够显著抑制S.aureusATCC25923生物膜的生长,在MIC浓度下仅有极少量的生物膜形成,生物膜覆盖率仅为9.5%。这与结晶紫法检测结果高度一致。
2.6 对溶血活性的影响
金黄色葡萄球菌溶血因子已被证明可影响多种人类细胞类型,包括上皮细胞、内皮细胞、T细胞、单核细胞和巨噬细胞,同时还可裂解哺乳动物的红细胞和中性粒细胞(PMN)[30],β-溶血素还可以通过内皮细胞抑制白细胞介素-8(IL-8)的表达,这些有助于金黄色葡萄球菌的逃逸和诱导生物膜形成[31]。试验采用无菌脱纤维羊血,使用多功能酶标仪检测OD450 nm处吸光值来测定水飞蓟素对S.aureusATCC25923溶血因子表达的影响,结果如图6所示。

不同大写字母表示组间具有显著差异(P<0.05)
由图6可以看出,水飞蓟素处理组的溶血活性与阳性对照组相比显著降低,当水飞蓟素浓度达到1/8MIC时可以显著抑制S.aureusATCC25923溶血因子的表达,且浓度达到1/4MIC时的溶血活性与无菌空白对照组相当。
2.7 凝固酶效价的测定
金黄色葡萄球菌凝固酶能够与凝血酶原以及其他几种血浆蛋白结合,形成血纤蛋白凝块,触发血纤蛋白原向血纤蛋白转化,进而增加金黄色葡萄球菌细胞表面的血纤维蛋白凝块,抑制吞噬作用[32]。试验采用冻干兔血浆来测定金黄色葡萄球菌凝固酶的表达,结果如表2所示。

表2 对凝固酶表达的影响†
由表2可知,对照组在0.5 h后出现凝固现象,1 h后完全凝固,1/8MIC组在5.5 h后完全凝固,而1/4MIC组在4 h后已完全凝固,1/2MIC以及MIC组分别在2.5 h和4 h开始出现凝固现象,且一直处于半凝固状态。说明水飞蓟素可以显著抑制S.aureusATCC25923凝固酶的表达,但未表现出明显的剂量依赖性。
2.8 FT-IR分析


图7 傅里叶红外分析
2.9 水飞蓟素对S. aureus ATCC25923生物膜的作用机制
如图8所示,在金黄色葡萄球菌生物膜形成的4个阶段中,水飞蓟素可以作用于细菌增殖聚集阶段抑制初期生物膜的形成,也可作用于成熟生物膜形成阶段,清除已形成的生物膜。同时水飞蓟素还可在很大程度上抑制金黄色葡萄球菌溶血因子以及凝固酶等毒力因子的表达。

图8 水飞蓟素对S. aureus ATCC25923生物膜及毒力因子影响机制
3 结论
采用结晶紫法探究了水飞蓟素对S.aureusATCC25923生物膜形成的抑制以及对成熟生物膜的清除作用,0.5倍和1倍最小抑菌质量浓度下的水飞蓟素处理对生物膜的抑制率分别达到78.9%和90%,清除率分别达到46.4%和89.2%。同时采用MTT染色法测定水飞蓟素对生物膜内活菌代谢的影响,结果显示亚抑制浓度下的水飞蓟素能够显著抑制生物膜内细菌的代谢能力。在Jadhav等[22]的研究中,使用MTT染色法检测处蓍草精油可以显著抑制单增李斯特菌生物膜内活菌的代谢能力。后续试验中,采用结晶紫染色在光学显微镜下进一步观察水飞蓟素对金黄色葡萄球菌生物膜的影响,以更直观地呈现水飞蓟素对细菌生物膜的影响。之后针对S.aureusATCC25923溶血活性以及凝固酶的表达进行探究,发现低浓度的水飞蓟素可以显著抑制其溶血因子及凝固酶的表达,在徐云风[23]37-41关于安石榴苷对金黄色葡萄球菌抑制作用的研究中显示,低剂量的安石榴苷可以抑制其毒力因子的表达,但未表现出明显的剂量依赖性。傅里叶红外光谱分析结果显示,在水飞蓟素处理后,与金黄色葡萄球菌蛋白质、脂肪酸、水合作用等相关吸收峰强度明显减弱,这也揭示了水飞蓟素可能通过影响细菌水合,蛋白质合成来影响细菌表面疏水性、黏附性、毒力因子的表达,从而抑制其生物膜形成的潜在机制。
综上所述,水飞蓟素对金黄色葡萄球菌的生物膜形成具有很好的抑制以及清除作用,同时能够显著抑制其毒力因子的表达。

