糖尿病痛性周围神经病变与中枢神经系统研究进展
程炎培 高 凌
糖尿病及其最常见的并发症神经病变(diabetic peripheral neuropathy,DPN)在全球流行。2019 年全球糖尿病患者为4.6亿,预计到2030年将增至5.8亿,其中T2DM患者占50%以上[1,2]。
糖尿病神经病变包含一组不同的临床综合征,这些综合症是根据神经系统模式来分类的。糖尿病神经病变分为弥漫性神经病变、单神经病变、神经根或神经丛病变。而弥漫性神经病变又分为DPN和自主神经病变。DPN包括小纤维、大纤维和混合纤维神经病变,自主神经病变包括心脏自主神经病变、胃肠道自主神经病变和泌尿生殖道自主神经病变等。单神经病变可累及单脑神经或周围神经,同时累及多个单神经的神经病变为多发性单神经炎,需与多发性神经病变相鉴别。神经根或神经丛病变常见的为神经丛神经病变和胸神经根病变。在上述类型中,DPN为最常见的类型[3]。
DPN被定义为一种对称的、长度依赖的感觉运动多神经病变,由慢性高血糖和其他心血管危险因素继发的代谢和微血管改变所致[4]。研究发现,许多分子途径与功能性神经损伤和病理性神经改变相关,包括但不限于多元醇途径激活、氧化应激、蛋白激酶C激活和晚期糖基化终产物形成[5]。然而,高血糖和临床DPN之间的确切因果关系是不确定的。既往研究认为,高血糖和血管危险因素会激活有害的通路,最终导致微血管内皮、神经支持细胞和神经轴突的下游损伤[6]。近年来研究表明,这些损伤事件可能通过产生活性氧和线粒体功能障碍导致神经元死亡[7]。尽管我们对DPN复杂性的理解在过去10年中有了快速的发展,但1型和2型糖尿病神经病变的独特机制仍然未知[8]。
对于DPN患者来说,一部分会发展为无痛性神经病变,增加了足溃疡和截肢的风险,还有相当一部分患者将会发展成慢性疼痛状态[9]。与无痛性DPN患者比较,痛性DPN患者还可能导致不同程度的身体残疾、抑郁、焦虑、失眠等,生活质量较差。尽管痛性和无痛性DPN患者的临床表现上有差异,但两者在神经学检查上几乎没有明显的区别[10]。为了探讨痛性神经病变产生的原因,一些研究进一步探索了痛性DPN患者的中枢系统改变。
一、痛性DPN的外周变化
DPN的特征包括周围神经系统的免疫细胞浸润、髓鞘丢失、施万细胞死亡和轴突损伤[11]。与无痛性DPN患者比较,痛性DPN患者有更严重的角膜小纤维损伤、轴突肿胀以及神经纤维再生水平的增加[12~14]。
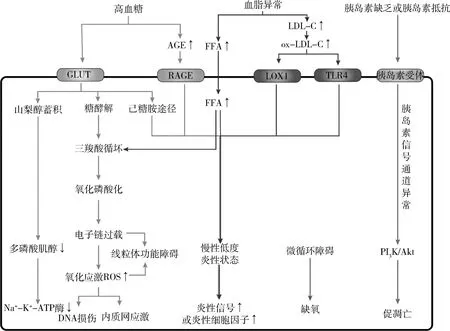
图1 糖尿病神经病变的发病机制
葡萄糖通过多元醇途径代谢,途径中包括醛糖还原酶和山梨醇脱氢酶两种主要酶,它们负责过量葡萄糖的代谢[15]。在高血糖状态下,过量的葡萄糖通过这一途径被消耗,导致还原型辅酶Ⅱ水平升高和发生氧化应激反应[16]。这种改变与线粒体功能障碍一起损害施万细胞功能,导致髓鞘形成受损,轴突神经营养支持异常,因此使轴突功能丧失[17]。此外,由于山梨醇和果糖浓度的增加,可以导致肌醇外排减少、ATP合成抑制以及Na+和K+ATP酶活性降低等。另一方面,由于神经结构退化,引起轴突神经胶质功能障碍和神经转导速度降低。高血糖状态还引起谷胱甘肽还原途径的下调,导致自由基和过氧化物的积累,从而加重神经损伤[18]。
高血糖诱导的炎性反应激活蛋白激酶C(protein kinase C,PKC)信号通路,进而使存在于Aδ和C纤维(传递疼痛的神经纤维)质膜中的瞬态感受器电位阳离子通道(transient receptor potential cation channel, subfamily V, member 1,TRPV1)磷酸化。TRPV1的磷酸化导致痛觉感受器的超敏反应,并在低于阈值的刺激下引起疼痛,导致痛觉过敏[19]。
在糖尿病患者中,晚期糖基化终产物(advanced glycation end products,AGEs)及其受体(receptor for AGE,RAGE)的积累发生在葡萄糖和其他糖进行非酶反应时,该反应改变了脂类和蛋白质的结构和功能[20]。AGE-RAGE在内皮细胞和施万细胞中的存在已得到证实。高水平的AGEs通过NF-κB的p65亚基的升高引起糖尿病神经病变,从而引发有髓神经元的炎症和损伤[21]。NF-κB p65亚基的过表达进一步导致炎性脱髓鞘和氧化-亚硝化应激,从而引起神经纤维和向神经组织供血的血管损伤,导致血液供应受损和炎性介质(前列腺素和缓激肽)释放升高。这一系列反应增加了对有害刺激的敏感度,导致神经性疼痛[22]。
免疫细胞的增加和炎性细胞因子的释放也可导致感觉过敏。其中小胶质细胞是中枢神经系统中的神经免疫细胞,周围神经损伤后脊髓内的小胶质细胞可被激活,释放促炎性介质,从而增强中枢疼痛信号。同时,小胶质细胞可能通过损伤调节功能,改变抑制和兴奋之间的平衡,从而导致神经性疼痛[23]。
此外,慢性高血糖和脂质代谢紊乱,改变了神经内微循环的血流动力学,导致神经灌注损伤,从而引起与产生或调节疼痛有关的血管活性神经递质的释放以及交感神经的去支配,进一步导致血流重分布[24]。从神经内膜分流的血液会增加神经外膜的血流量,导致更高的氧饱和度,而神经内的缺氧进一步恶化。感觉轴突更容易受到神经内缺氧的影响,这反过来导致离子通道功能障碍和疼痛信号的增加[25]。血液动力学因素也可能在神经性疼痛中发挥重要作用。
二、痛性神经病变的中枢证据
过去DPN被认为是一种周围神经疾病,但近年来出现了越来越多的中枢神经系统累及的证据[26]。这表明中枢神经系统的改变在其发病机制中也起着至关重要的作用。对疾病发病机制的探索将有助于成功解决DPN从预防到治疗的难题[8]。
1.痛性DPN的脊髓改变:目前先进的神经成像技术为DPN患者的中枢系统改变提供了有价值的见解。在一项初步研究中,Eaton等[2]利用磁共振成像(magnetic resonance imaging,MRI)技术探讨了DPN中脊髓的受累情况。研究人员发现与健康对照组比较, DPN患者的颈椎和上胸椎区域有广泛的病变。
为了进一步探究周围神经的损伤与中枢系统改变的因果关系,另一项研究将纳入的1型糖尿病患者分为无DPN、亚临床DPN和DPN 3个亚组,在第2、3颈椎水平进行脊髓面积测量。同时将糖尿病亚组测量结果与健康对照组和遗传性感觉运动神经病变(hereditary sensory and motor neuropathy,HSMN)患者(该病只影响周围神经系统和血管因素,没有涉及其发病机制)进行比较。该研究清楚地表明,脊髓萎缩是一个早期过程,即在DPN的早期阶段,就可能发生广泛的甚至不可逆转的损伤。研究还表明,随着DPN的进展,脊髓面积持续减少,且与神经病变严重程度存在显著相关性。研究中,HSMN组受试者脊髓区域面积正常,这反驳了DPN周围神经损伤引起继发性脊髓“萎缩”的假说[27]。这项临床研究的结果表明,糖尿病的损害可能是全身性的,会同时影响周围和中枢神经系统。
DPN的脊髓改变反映了上行脊髓-皮质感觉通路改变的性质和程度[28]。在一项初步研究中比较了连接脑干和感觉皮质(通过丘脑)的神经纤维总数,发现DPN患者的连接神经纤维较健康对照组多,表明中枢神经系统的参与不仅限于第一级(脊髓丘脑)神经元,还包括第二级(丘脑皮质)神经元[29]。另一项研究中,基于神经束扩散张量成像,DPN组的上行感觉传导通路分数各向异性值(fraction anisotropy, FA)明显低于无DPN组和对照组。FA值越低,说明沿神经轴突内扩散受限越少,提示微结构完整性受损[30]。这同样表明DPN的轴突变性不仅发生在第一级神经元,还扩展到第二级和第三级神经元,而且中枢轴突损伤的严重程度与周围神经病变的严重程度相关。
对于DPN患者出现异常疼痛和痛觉过敏的现象,Jia 等[31]利用fMRI观察腰椎脊髓功能在电刺激下的激活状态,发现DPN患者的激活主要见于第12胸椎节段,且信号改变百分率高于健康人群(8.40% vs 4.02%)。该研究推测,脊髓神经元兴奋性刺激的改变是由于神经元合成的增加、轴突运输的增加以及刺激引起的P物质从初级传入端释放所造成的。此外,本研究发现,信号变化百分比与血液中葡萄糖、总胆固醇的水平呈正相关。
2.痛性DPN的丘脑改变:丘脑接收来自脊髓的感觉信号,并将这些信号加工、调制并传输到更高的大脑中枢。Sorensen等[32]在一项比较研究中,对26例糖尿病患者和14例健康对照者的3个脑区(丘脑、前扣带皮质和背外侧前额叶皮质)进行了氢质子磁共振波普(proton magnetic resonance spectroscopy,H-MRS)研究。其中糖尿病患者又分为疼痛性DPN和无痛性DPN两亚组进行比较。研究表明,与没有疼痛症状的受试者比较,有疼痛症状的受试者中丘脑N-乙酰-L-天门冬氨酸(N-acetyl-L-aspartic acid,NAA)显著减少,即痛性DPN患者中也伴有丘脑神经元功能障碍。
在另一项研究中,Myria等[33]运用磁共振波普与传统的点分辨光谱序列(point resolved spectroscopy,PRESS)结合,发现与健康对照组比较,痛性DPN患者右丘脑内存在更高的谷氨酰胺(Glx)/γ-氨基丁酸(GABA)。总的来说,研究结果提示,在痛性DPN患者中,疼痛处理网络中的兴奋/抑制发生了改变,这一发现在其他慢性疼痛状态中也有报道[34]。Glx水平的改变可能部分解释了镇痛药如普瑞巴林在减轻痛性DPN症状中的作用模式,Glx/GABA的变化一定程度证实了在DPN引起异位痛和痛觉过敏的情况下,丘脑对疼痛刺激处理的改变发挥重要作用。
3.痛性DPN的大脑皮质改变:上述研究的结果表明,糖尿病的代谢损伤对整个神经系统有广泛的影响。为了探究DPN患者大脑中是否存在异常,一项基于H-MRS的研究以NAA共振作为神经元功能的替代标志物,来探究糖尿病引起的周围感觉神经损伤是否伴有丘脑神经元功能障碍[35]。研究发现,长回波时间(echo time,TE)条件下,与无DPN患者和健康对照组比较,DPN患者组下丘脑NAA显著减少,这与神经元和轴索损失或神经元活力和功能的丧失有关。同时数据还表明,短TE信号下,NAA与反映DPN严重程度的神经生理标志物(总体神经病变综合评分和个别神经功能试验)之间密切相关。Dinesh等[36]利用MRI检测大脑结构差异,发现相较于单纯糖尿病和健康人群来说,DPN患者灰质体积显著减少,主要局限于与感觉相关的区域(初级感觉皮质和边缘上回),且体积与神经病变呈正相关。在另一项研究中同样发现,与单纯糖尿病患者比较,DPN患者脑灰质体积异常减少,减少区域包括双侧中央后回及丘脑,而与健康对照组比较,DPN患者脑灰质体积异常减少的区域包括双侧中央前回、中央后回、额上回和丘脑[37]。
另一项研究使用T1加权MRI和弥散张量成像数据,对一组2型糖尿病周围神经病变患者的灰质和白质进行了结构分析[38]。与健康对照组比较,DPN患者在大脑皮质和深部灰质核(如中央前和后回、中央旁小叶、岛叶、前扣带回和丘脑)的形态学以及皮质下白质(如皮质脊髓束、棘丘脑束和丘脑皮质突出纤维)的微结构上均有显著差异。这些研究提示,在无痛和疼痛的DPN中,感觉、运动及疼痛调节相关通路均受损。此外,对汇总数据进行探索性多模态相关分析显示,DPN患者FA降低,表明白质的微结构发生改变,而灰质厚度与FA呈显著正相关,灰质表面积与FA呈显著负相关。因此推断DPN患者的灰质形态改变与白质微结构异常密切相关。
Li等[39]利用功能磁共振成像(functional magnetic resonance imaging,fMRI)进一步研究了DPN患者和单纯糖尿病患者在热刺激下大脑活动的变化。他们发现,DPN患者对温度刺激的反应不仅表现在参与感觉通路的脑区(右岛叶、左尾状核、额回和扣带皮质),而且在与认知相关的脑区中(右颞叶、左海马和左梭状回)也表现出较强的激活。说明与DPN相关的中枢神经系统损伤可能不仅仅局限于运动和感觉相关的皮质,而在认知相关的大脑区域中也有累及。
既往研究发现,DPN导致感觉皮质灰质体积减少,表明患者的大脑在疾病过程中产生了形态学改变[36,40]。Dinesh等[9]为了进一步探索感觉表型与DPN大脑结构和功能变化之间的关系,通过多模态磁共振脑成像发现在1型痛性DPN感觉减退组患者中,S1区皮质厚度减少以及S1区感觉处理存在重新映射。面部和嘴唇区域皮质对强直性热刺激的反应强度与S1区的皮质厚度以及慢性神经性疼痛严重程度呈负相关。这表明,皮质厚度的减少会导致存活神经元的减少和整体痛觉的降低。此外,S1区结构和功能改变的程度与神经病变的严重程度以及强直性热诱发疼痛强度评级的大小有关。这项研究表明,在DPN病变过程中,大脑具有动态可塑性,周围的有害刺激可能诱导轴突变性和异常活动。这反过来可能导致我们观察到,与感觉通路相连的大脑区域结构也发生改变。相反,运动系统的结构改变可能反映了慢性疼痛患者的一种保护策略,以防止或减少痛感。
高级脑中枢参与疼痛的定位以及对疼痛刺激的行为、认知和情绪反应(如前扣带回、杏仁核、岛叶皮质)。Keisuke等[41]利用基于体素分析的碘-123-N-异丙基-碘多巴安非他明单光子发射计算机断层扫描,发现与无痛的DPN患者比较,痛性DPN患者右侧前扣带皮质的脑血流量明显增加,左侧腹侧纹状体的脑血流量明显减少。观察到的前扣带回的改变可能意味着DPN患者前额叶皮质-前扣带回-内侧丘脑环的失调,导致与异位痛相关的不愉快感水平增加。这些发现为与糖尿病神经性疼痛相关的脑病理生理学提供了新的见解。
4.痛性神经病变的海马改变: Li等[39]利用fMRI检测热刺激下DPN患者与无DPN患者大脑区域血氧水平的变化,发现在与认知相关的脑区(右颞叶、左海马、左梭状回),DPN患者表现出更强的激活。这表明与DPN相关的中枢神经系统损害可能不局限于运动和感觉相关的皮质区域。认知相关的大脑区域,如海马和梭状回,也受到DPN引起的功能变化的影响。
5.痛性DPN的功能连接改变:一项临床神经影像学研究发现,与非痛性DPN患者比较,痛性DPN患者的腹外侧导水管周围灰质功能连通性发生增强,且其程度与自发性疼痛及痛觉过敏引起的皮质反应程度呈正相关。这项研究认为,腹外侧导水管周围灰质介导的下行疼痛调节系统(脑干-皮质下-皮质网络)功能障碍可能反映了一种基于大脑的疼痛促进机制,即下行疼痛调节系统的异常不仅可能导致疼痛抑制减弱,还可能导致疼痛信号增强[42]。
Chao等[29]应用扩散纤维束成像技术评估丘脑和下丘脑的结构连接以及边缘区介导的伤害性和自主神经反应。与非痛性DPN和健康对照组比较,痛性DPN组右侧杏仁核、丘脑和下丘脑的结构连接显著降低,在周围神经小纤维变性程度更严重的患者中,结构连通性的改变更明显。此外,下丘脑和前扣带皮质的结构连接减少导致了自主神经紊乱,临床表现为心率变异性的降低。该研究表明,大脑结构连接的改变可能是适应周围神经损伤可塑性的表现,并且也证明了边缘回路断开与糖尿病疼痛和自主神经紊乱之间的病理生理联系。
三、展 望
糖尿病的发生率正上升到流行病的程度。糖尿病神经病变是糖尿病的一种常见并且负担重的复杂并发症,需要进行仔细的评估和及时的处理。它的预防和管理很大程度上依赖于早期血糖控制和多因子干预,以及对症治疗[43]。但是,在糖尿病慢性并发症患者数量急剧上升的今天,对于如何治疗DPN,当下还没有行之有效的方法。
目前有关中枢神经系统的研究表明,DPN患者的脊髓、大脑皮质等出现了影像学改变,其中痛性DPN患者出现了丘脑功能的改变、脑血流量的增加及功能连接的减少等,这些方面较单纯糖尿病和无痛性DPN患者展现出尤为显著的差异。这可以帮助我们更好地理解DPN疼痛症状的主要病理生理机制,从而改善未来DPN的治疗策略。
利益冲突声明:所有作者均声明不存在利益冲突。

