PGRN、SIRT3、sICAM-1水平变化与重症肺炎患儿肺部感染评分的相关性
王宇艳,王书华,孙文武
(南阳市第一人民医院 儿童重症监护室,河南 南阳 473000)
肺炎为呼吸系统的多发病、常见病,据调查,7%~13%肺炎可演变为重症肺炎,尤其在自身免疫力不足、病毒流行患儿中,重症肺炎患病率明显增加[1]。现代医学认为,自身氧化应激性损伤或炎症反应是引起肺炎进展的关键因素,但缺乏具体相关因子机制研究。颗粒蛋白前体(PGRN)是一种糖基化蛋白,参与机体胚胎发育、组织修复及炎症反应等多种生理病理过程,在多种感染性疾病中呈高表达[2-3]。沉默信息调节因子相关酶3(SIRT3)属线粒体脱乙酰酶,临床实践显示,SIRT3缺乏可通过介导肺泡上皮细胞线粒体DNA损伤促进肺纤维化[4]。sICAM-1能够反映体内炎症反应程度,评估感染性疾病病情严重程度[5]。为进一步揭示重症肺炎患儿血清PGRN、SIRT3、sICAM-1水平变化及临床意义,本研究尝试探讨各指标水平与重症肺炎患儿肺部感染评分的相关性,旨在为临床准确评估病情变化、预测预后提供可靠的血清学指标,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年2月至2021年12月南阳市第一人民医院收治的98例重症肺炎患儿为观察组,另取同期98例普通肺炎患儿为对照组。观察组男58例,女40例;年龄5~13岁,平均(8.51±1.17)岁;患病季节:春夏21例,秋冬77例;体温38.1~40.1℃,平均(38.77±0.21)℃;机械通气:是25例,否73例。对照组男65例,女33例;年龄5~14岁,平均(8.73±1.25)岁;患病季节:春夏28例,秋冬70例;体温38.0~40.1℃,平均(38.71±0.20)℃;机械通气:是30例,否68例。两组一般资料(性别、年龄、患病季节、体温、机械通气)比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
纳入标准:符合普通肺炎和重症肺炎相关诊断标准[6],X线检查可见肺炎影像学特征;痰培养阳性;能配合进行潮气呼吸肺功能检测;患儿监护人均知情,签署同意书。
排除标准:伴有其他感染性疾病;合并其他肺部疾病;存在血液系统疾病、自身免疫性疾病;支气管畸形、异物吸入;有呼吸系统发育不良、支气管哮喘等;严重肝、肾等脏器功能不全;参与本研究前接受免疫制剂、抗生素、激素等相关药物治疗的患儿。
1.3 方法
均于入院时采集2 mL指尖血,置于离心管,室温条件下静置30 min,离心处理,离心时间15 min,离心半径10 cm,离心速率3 000 r/min,取上清液,置于低温环境待检。采用酶联免疫吸附法测定血清PGRN、SIRT3、sICAM-1水平,试剂盒购自上海康朗生物科技有限公司,所有操作步骤严格遵循试剂盒说明书。
以肺功能仪(型号:MasterScreen PFT System,生产公司:德国耶格医疗器械有限公司)测定潮气量(VT)、呼吸频率(RR)、呼气时间(Te),计算达峰时间/呼气时间(TPTEF/Te)、达峰容/潮气量(VPTEF/VT)。
肺部感染评分(CPIS)包括体温、白细胞、氧合情况、气道分泌物、细菌培养结果及肺部浸润阴影等,总分12分,分值越高,提示病情越重。
1.4 观察指标
①比较两组血清PGRN、SIRT3、sICAM-1水平及肺功能指标(VT、TPTEF/Te、VPTEF/VT)、CPIS评分;②血清PGRN、SIRT3、sICAM-1水平与肺功能指标、CPIS评分相关性;③血清PGRN、SIRT3、sICAM-1水平联合检测对重症肺炎的诊断价值。
1.5 统计学方法
采用统计学软件SPSS 22.0处理数据,符合正态分布的计量资料以均数±标准差()描述,组间比较采用独立样本t检验,组内比较采用配对样本t检验;计数资料用以百分率(%)表示,用χ2检验;相关性采用Pearson线性相关法分析;预测价值采用受试者工作特征(ROC)曲线分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组各指标水平比较
与对照组相比,入院时观察组血清PGRN、sICAM-1水平较高,SIRT3水平较低,差异有统计学意义(P<0.05)。见表1。
表1 两组血清各指标水平比较 (n=98,)

表1 两组血清各指标水平比较 (n=98,)
2.2 两组肺功能指标及CPIS评分比较
入院时,观察组VT、TPTEF/Te、VPTEF/VT较对照组低,CPIS评分较对照组高,差异有统计学意义(P<0.05)。见表2。
表2 两组肺功能指标及CPIS评分比较 (n=98,)
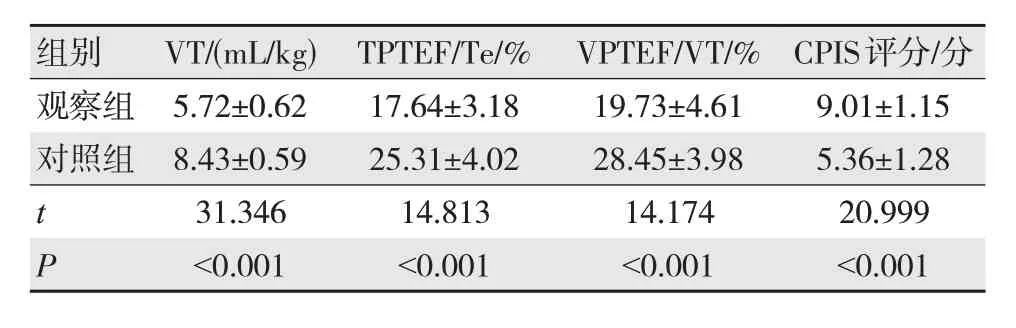
表2 两组肺功能指标及CPIS评分比较 (n=98,)
2.3 相关性分析
入院时血清PGRN、sICAM-1水平与VT、TPTEF/Te、VPTEF/VT呈负相关,与CPIS评分呈正相关,差异有统计学意义(P<0.05);入院时血清SIRT3水平与VT、TPTEF/Te、VPTEF/VT呈正相关,与CPIS评分呈负相关,差异有统计学意义(P<0.05)。见表3。

表3 相关性分析
2.4 ROC分析
以重症肺炎患儿为阳性标本,以普通肺炎患儿为阴性样本,绘制ROC曲线。结果显示,入院时血清PGRN、SIRT3、sICAM-1水平联合诊断儿童重症肺炎的AUC为0.797,最佳敏感度、特异度分别为92.86%、66.33%。见表4。

表4 ROC分析
3 讨论
重症肺炎是小儿常见呼吸道感染性疾病,起病急,进展快,常累及其他身体系统,严重时可危及患儿生命[7]。现阶段,临床对于重症肺炎治疗已取得较大进步,但其患病率、病死率仍居高不下,据调查,重症肺炎患者28 d病死率约38.32%[8]。因此,临床亟需寻找早期预测重症肺炎患儿的生物学指标以及时干预、改善预后。
相关研究表明,肺炎严重程度与促炎因子释放具有相关性[9]。sICAM-1是一种黏附分子,主要表达于上皮、淋巴、血管内皮细胞表面,机体出现炎症时,细胞表面脱落sICAM-1增加[10]。据此可推测,重症肺炎患儿sICAM-1表达异常升高可能与上皮、淋巴、血管内皮细胞损伤,导致损伤细胞及炎症浸润细胞大量释放组胺、白三烯有关。陈少全等[11]报道称,与健康人群相比,普通肺炎、重症肺炎患儿sICAM-1均明显升高,其中重症肺炎患儿升高幅度更大,这说明sICAM-1高表达是肺炎病情加重主要原因。SIRT3是Sirtuin家族的重要成员,正常生理状态下合成稳定,在炎症-氧化应激损伤状态下异常表达[12]。一项基础研究发现,SIRT3表达随着慢性阻塞性肺疾病急性加重期大鼠病情恶化呈明显下调趋势[13]。这主要与SIRT3缺乏能通过促进锰超氧化物歧化酶分泌,减弱其活性,导致气道上皮细胞氧化应激损伤加重有关。另有研究指出,机体发生急性炎症反应时,PGRN可通过代偿性升高抑制炎症级联反应[14]。PGRN属于自分泌抗炎蛋白,在不同炎症反应中发挥促炎/抗炎作用,其大量表达会生成多种生物活性物质,损伤肺实质,对气道炎症具有重要促进作用。李玉华等[15]研究发现,肺炎病情进展过程中,PGRN可加快巨噬细胞迁移,促进炎性因子表达,加重气道和肺部炎症反应,破坏肺部组织、结构,损伤肺功能,影响预后。本研究数据显示,观察组血清PGRN、sICAM-1水平高于对照组,SIRT3水平低于对照组,提示PGRN、sICAM-1、SIRT3可能参与重症肺炎病理生理过程,临床可在疾病早期动态监测血清各指标水平变化情况,为评估病情变化、预测预后改善提供有效信息。
CPIS是一项综合临床评分手段,常用于评估某些疾病中患者的预后水平。随着肺炎患者CPIS评分升高,其呼吸机、重症病房治疗时间及住院时间延长,病死率亦随之升高。本研究数据表明,血清PGRN、SIRT3、sICAM-1水平与VT、TPTEF/Te、VPTEF/VT、CPIS评分具有相关性,由此可见,各指标在重症肺炎发生发展中扮演重要角色。在此基础上,本研究首次尝试探讨各指标水平联合诊断重症肺炎的价值,结果发现,血清PGRN、SIRT3、sICAM-1水平预测儿童重症肺炎的AUC均在0.6以上,提示均具有一定预测效能。特别是各指标联合预测的AUC最大,为0.797,预测效能进一步升高,可为临床早期诊断重症肺炎提供更准确参考依据。
综上可知,血清PGRN、SIRT3、sICAM-1水平变化与重症肺炎患儿病情显著相关,联合检测对预测重症肺炎具有一定诊断价值,可作为病情评估和预后判断有效指标。但本研究纳入样本量偏少,代表性有限,未来尚需开展多中心、大样本研究来进一步验证。

