利用计算模拟技术建立头孢呋辛酯片体内、外相关性溶出度评价方法
彭洁?洪建文?肖慧?郭英豪?李佩?罗嘉琳?李何杏?丁子珊?陈涛
摘要:目的 利用计算模拟技术,探索建立前体药物头孢呋辛酯片的体内外相关性预测模型,用于仿制药生物等效性评估。方法 参考文献中头孢呋辛酯片口服给药后的PK数据,结合参比制剂的血药浓度数据,利用GastroPlusTM软件搭建头孢呋辛酯片药代动力学模型;结合原研制剂在不同溶出条件、4种溶出介质(pH1.2盐酸溶液、pH4.0醋酸盐缓冲溶液、pH6.8磷酸盐缓冲溶液和水)中的体外溶出行为,筛选适宜的溶出条件;将在不同溶出介质中得到的溶出曲线作为体内释放曲线,预测头孢呋辛酯片在体内PK参数并与参比制剂的临床实测数据进行比较,探讨头孢呋辛酯片体内外相关的溶出度方法。结果 成功建立了头孢呋辛酯片体内外相关的溶出度方法:桨法,转速为55 r/min,以pH4.0醋酸盐缓冲液900 mL为溶出介质。结论 所建立的头孢呋辛酯片药代动力学预测模型,可用于仿制药的生物等效性虚拟评估,为该药物的质量与疗效一致性评价提供了新思路。
关键词:计算模拟技术;头孢呋辛酯片;溶出曲线;体内外相关性模型;仿制药
中图分类号:R978.1文献标志码:A
Establishing a dissolution evaluation method for cefuroxime axetil tablets for in vitro-in vivo correlation by using computer simulation technology
Abstract Objective This study explored and established an in vitro-in vivo correlation predictive model for the precursor drug cefuroxime axetil tablets by using computer simulation technology, which was used for the bio-equivalence evaluation of generic drugs. Methods According to the PK parameters from the literature of cefuroxime axetil after oral administration, combining with the data of plasma concentration for reference preparation, GastroPlusTM software was used to establish a pharmaceutical model of cefuroxime axetil tablets. Based on the dissolution behavior in different conditions of dissolution, and in four dissolution media (pH 1.2 hydrochloride acid solution, pH 4.0 acetate buffer solution, pH 6.8 phosphate buffer solution, and water), suitable dissolution conditions were selected. The PK parameters of cefuroxime axetil tablets were predicted using the dissolution curves obtained in various dissolving media as in vivo release curves. These were then compared with the clinical data of the reference preparation, and a dissolution method for cefuroxime axetil tablets for in vitro-in vivo correlation was investigated. Results The dissolution method of cefuroxime axetil tablets for in vitro-in vivo correlation was successfully established by using the paddle method, with a rotational speed of 55 revolutions per minute and a 900 mL dissolution medium of pH 4.0 acetate buffer solution. Conclusion The pharmaceutical prediction model of cefuroxime axetil tablets could be used for virtual evaluation of the bio-equivalence and provided a new idea for evaluating the consistency between the quality and efficacy of the drug.
Key words Computer simulation technology; Cefuroxime axetil tablets; Dissolution curves; The model of IVIVC; Generic drug
頭孢呋辛酯(cefuroxime axetil)为头孢呋辛的乙酰氧基乙酯,属于第二代口服头孢菌素前药。其片剂为国家基本药物,也是国家医保目录品种[1]。该品种由葛兰素(Glaxo Smith Kline, GSK)公司研制开发,1987年在英国首次上市,我国仿制药自2000年开始上市。国家药品监督管理局网站显示,国内有头孢呋辛酯片批文25个,涉及15家生产企业,共有3个规格(0.125、0.25和0.5 g)。本品属于BCS4类品种,不符合生物等效性豁免要求[2],需采用人体生物等效性试验(BE试验)判定仿制药与原研药的一致性。目前国内已有多家企业的产品通过仿制药质量与疗效一致性评价。然而受原辅料供应等影响,当生产工艺发生变更时,可能引起生物等效性的变化,而仅比较制剂的溶出特性和溶出曲线的相似性判断生物等效性是否改变,具有一定的局限性[3-4]。
近年来计算模拟技术为药品质量的评价提供了新途径。GastroPlusTM软件是一款模拟预测药物在体内的吸收速度和程度的软件,它利用药物体外的理化性及生物药剂学数据,基于高级房室吸收模型(ACAT模型)或生理药动学模型(PBPK模型),预测药物在动物及人体内的药动学过程;通过建立制剂的体内外相关性模型,指导并建立有区分力的溶出度方法,辅助考察参比制剂与受试制剂在体内是否生物等效。本文以头孢呋辛酯片(250 mg)为例,采用计算模拟技术,通过体外数据模拟药物在体内的释放过程,建立头孢呋辛酯片体内外相关性模型,为评估该产品工艺变更对生物等效性的影响提供依据,为该产品的市场监管和质量控制提供参考。
1 仪器与试药
1.1 仪器
LC 20AT高效液相色谱仪(日本岛津公司),Ecosil C18键合硅胶柱 (200 mm×4.6 mm,5 ?m) 色谱柱;UV-2600可见紫外分光光度计(日本岛津公司);RC806D智能溶出仪溶出度仪(天大天发科技有限公司); RCZ-8B智能溶出仪溶出度仪(天大天发科技有限公司); AT7X智能溶出仪(瑞士SOTAX公司)溶出度仪ZKT-7F 真空脱气仪(天大天发科技有限公司);CP225D型电子分析天平(德国赛多利斯公司) ;GsatroPlusTM软件(美国Simulations Plus Inc.,Version 9.7) ;ADMET PredictorTM软件(美国Simulations Plus Inc.,Version 9.0)。
1.2 试药
盐酸、醋酸钠、冰醋酸、磷酸二氢钾、氢氧化钠、磷酸二氢铵均为国产分析纯试剂;乙腈、甲醇为色谱纯,水为纯化水。
1.3 样品
头孢呋辛酯对照品(中国食品药品检定研究院,批号:130492-201703,82.5%);头孢呋辛酯片参比制剂(GSK公司,C578403、C578404、C587488、C591899、C593856、C614697、C724000),头孢呋辛酯片仿制药(A公司,工艺改进前样品,批号:B20120909、B20120910;工艺改进后样品,批号A160104;B公司,批号: 12043201;C公司,批号:1810011),规格均为0.25 g;头孢呋辛酯原料(D公司,12074-698)。
2 方法
2.1 头孢呋辛酯溶解度的测定
取8支具塞试管,加入过量头孢呋辛酯原料,分别精密加入5 mL pH1.0,pH2.0,pH3.0,pH4.0,pH5.0,pH6.0和pH7.0的溶出介质,摇匀,密塞,置37 ℃水浴中震荡,直至形成过饱和溶液;滤过,取续滤液20 μL注入高效液相色谱仪,照《中国药典》2020年版二部头孢呋辛酯含量测定方法测定,计算各溶液中头孢呋辛酯的浓度。
2.2 头孢呋辛酯片体内 PK 模型的搭建
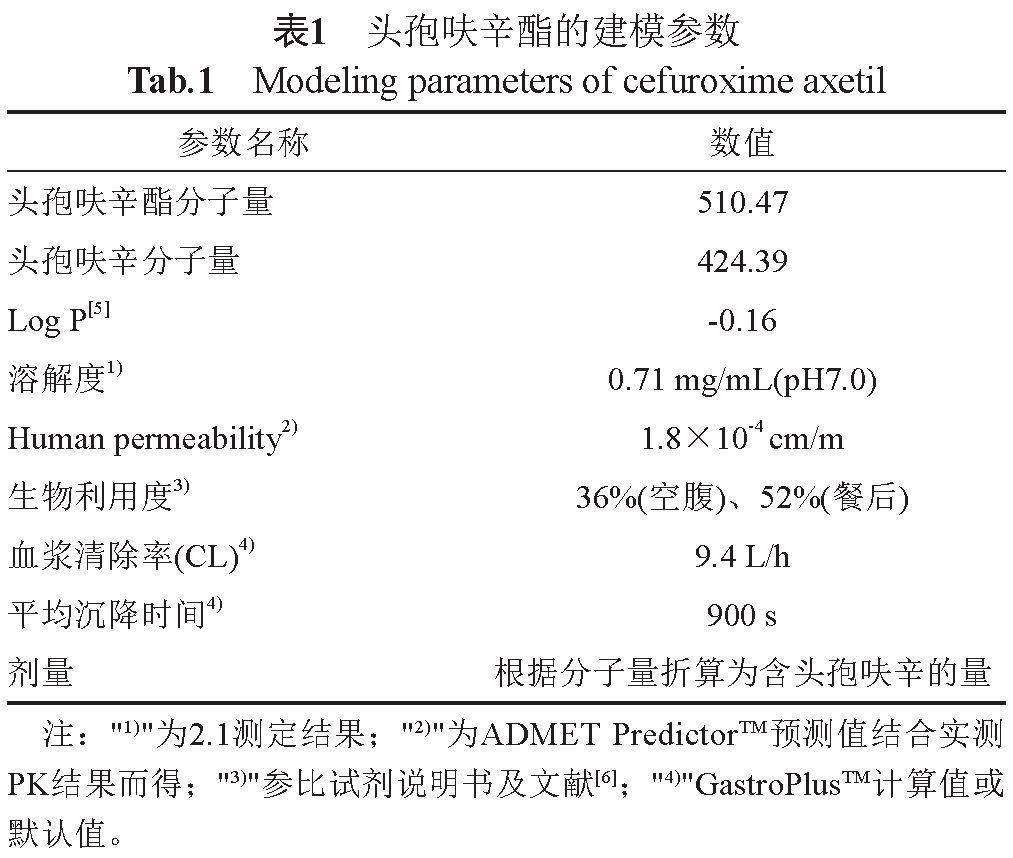
由文献、产品说明书及软件基于结构式的预测结果,收集头孢呋辛酯片建模所需的渗透性、溶解度、生物利用度等各种理化及生物药剂学参数(表1)。头孢呋辛酯为前体药物,经胃肠道快速吸收后,在肠黏膜中被非特异性酯酶水解成为头孢呋辛,经门静脉快速释放进入循环系统,其体内处置过程由头孢呋辛获得。头孢呋辛在人体内表现为二房室的分布特征。根据文献中头孢呋辛(500 mg)静脉给药的数据[6-8],采用GastroPlus的PKPlus模块,进行房室模型的拟合,获得体内处置过程的PK参数。按文献中口服给药后的PK数据[6-8],结合A公司提供的头孢呋辛酯片(250 mg)中国人口服给药参比制剂后的血药浓度数据,搭建口服给药的体内PK模型。
2.3 体外溶出试验
取本品各12片,以pH1.2盐酸溶液、pH4.0醋酸盐缓冲液、pH6.8磷酸盐缓冲液和水为溶出介质;体积900 mL;采用桨法;参比制剂转速为50及55 r/min,仿制药转速为55 r/min;于5、10、15、30、45、60 min
取液5 mL,滤过;精密量取续滤液5 mL,置50 mL
量瓶中,加相应溶出介质稀释至刻度,摇匀。每个时间点取样后,回补5 mL溶出介质。分别取上述溶液适量,以溶出介质为空白,在278 nm的波长处分别测定吸光度,计算累积溶出量。
2.4 体外溶出条件的评估
采用Johnson模型模拟药物制剂在体内的释放过程,预测头孢呋辛酯片在体内按不同体外溶出曲线释放时的PK结果,比较其与临床实测PK结果的吻合度,确定与体内释放过程最相关的体外溶出条件。
3 结果与讨论
3.1 头孢呋辛酯的溶解度
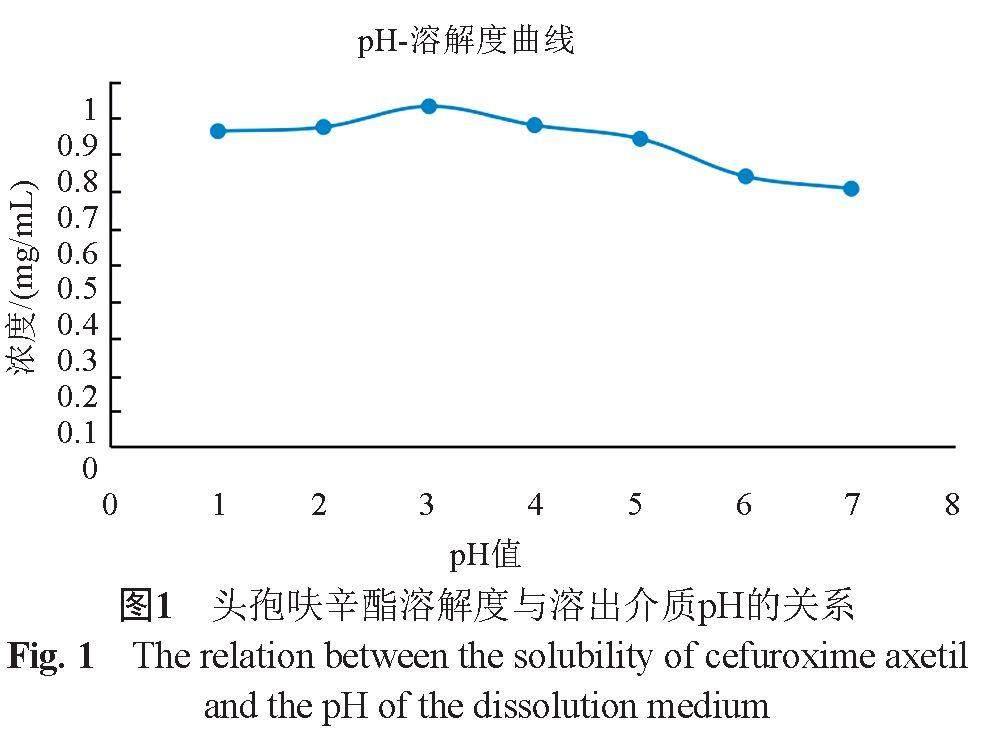
头孢呋辛酯原料在pH1.0~pH7.0溶出介质的溶解度为0.71~0.93 mg/mL(图1),与日本橙皮书中20 ℃, pH1.2、pH4.0和pH6.8溶出介质及水中的溶解度分别为0.74、0.85、0.72与0.72 mg/mL基本一致;提示其属于非pH依赖性药物。
3.2 头孢呋辛酯片的体内 PK 模型
搭建口服给药的体内PK模型。空腹和餐后状态下的预测曲线与实际曲线分别的吻合程度良好(图2),拟合度(R2)分别为0.961和0.996,Cmax、Tmax和AUC等主要PK参数的预测值与实测值均较为接近(表2)。
3.3 体外溶出曲线比较
参比制剂在50 r/min条件下测定,仅在介质为水的条件下,15 min的溶出量达到85%;且发现溶出至30 min时,在各介质中的溶出量已基本到达平台期(图3a),但部分批次样品的批内溶出量差异较大,RSD大于10%,不满足相似因子(f2)法中“自第2个时间点至最后时间点溶出结果的相对偏差≤10%”的要求。当转速提升至55 r/min时,参比制剂在4种介质中的溶出均较快,多批次产品在15 min内的平均溶出量均基本大于15%(图3b),且批次内各片溶出量的差异明显缩小。此外,参比制剂在pH1.2盐酸溶液及水中的稳定性较好,表现为平台期的溶出量稳定;而在pH4.0醋酸盐缓冲液和pH6.8磷酸盐缓冲液中,平台期的溶出量略有下降,尤其是在pH6.8磷酸鹽缓冲液中。因而,选择在转数为55 r/min的条件下比较仿制品与参比制剂溶出曲线的差异。
比較诸仿制药与参比制剂溶出曲线的差异(图4):企业A工艺改进前的产品仅在盐酸溶液中的溶出较好,在其余3个介质中溶出量均较低,并在pH4.0醋酸盐缓冲液和pH6.8磷酸盐缓冲液中伴有一定程度的降解;采用f2因子法计算,在pH1.2盐酸溶液、pH4.0醋酸盐缓冲液、pH6.8磷酸盐缓冲液和水中的计算值分别为66、48、60和57;在pH4.0醋酸盐缓冲液中存在不相似情况。产品经工艺改进后,企业A产品的溶出速度有所提升;各仿制药与参比制剂在15 min内的溶出量均在85%以上。
3.4 体外溶出条件的评估
分别选择参比制剂转数为50和55 r/min时的诸溶出曲线作为体内释放曲线,利用上述模型预测其相应的PK曲线(表3),此时,发现他们与临床实测的PK参数及血药浓度曲线均具有较好的一致性, 但55 r/min
时溶出曲线的预测结果拟合度稍高(表4),提示转数为55 r/min溶出条件与体内更相关。
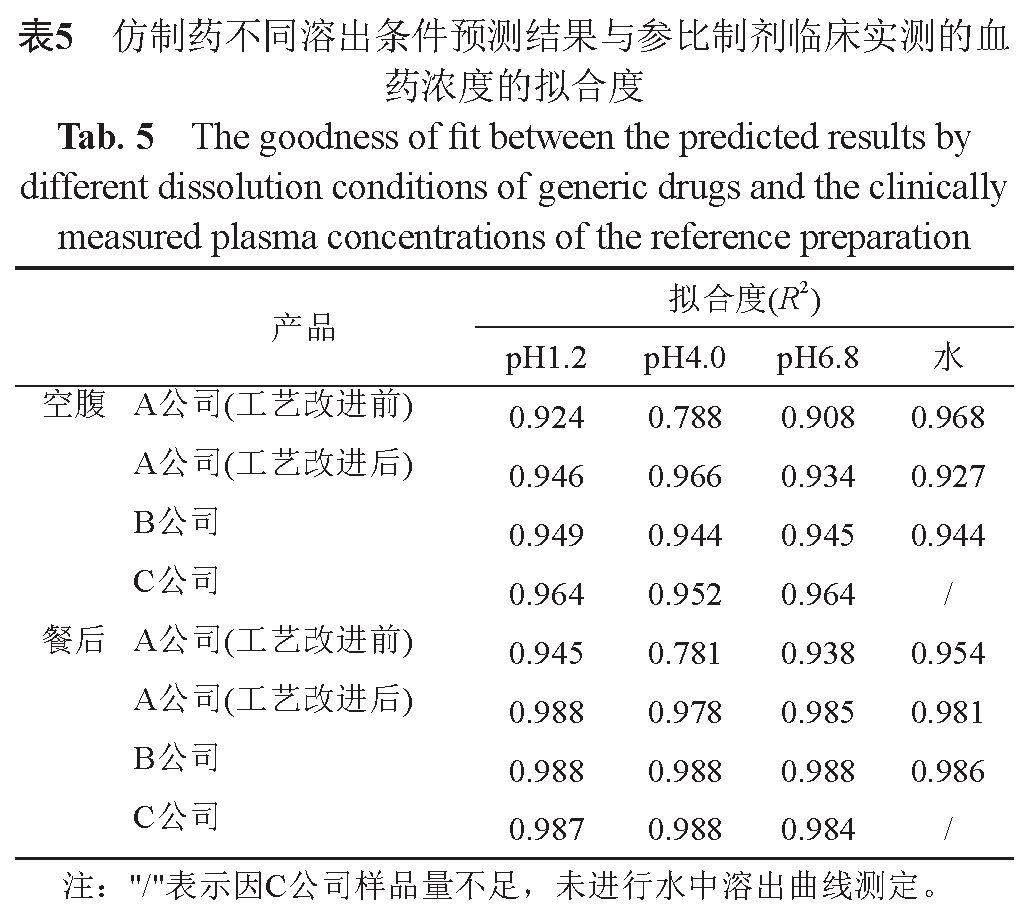
利用上述模型对诸仿制药进行预测。结果显示,企业A工艺改进前的样品,以pH4.0醋酸盐缓冲液的溶出曲线作为体内释放曲线进行预测,预测结果与参比制剂临床实测血药浓度曲线的吻合度差(图5),其余产品各介质溶出曲线的预测结果与参比制剂实测血药浓度曲线的吻合度较好(表5),提示以pH4.0醋酸盐缓冲液为溶出介质的溶出度测定方法为体内外相关的溶出度方法。
比对CDE网站《上市药品目录集》产品信息,经工艺改进后的A公司、B公司以及C公司产品均与参比制剂生物等效,与模型预测结果一致。目前国内外药典均采用盐酸溶液作为溶出介质对本品进行溶出度检查,其结果可能不能真实反映产品体内的释放情况。
4 结论
本文采用GastroPlus的PKPlus模块,按文献中口服给药后的PK数据,结合A公司提供的头孢呋辛酯片(250 mg)参比制剂后的口服给药血药浓度数据,搭建了头孢呋辛酯片口服给药的体内PK模型。利用所建立的模型,将头孢呋辛酯片在不同溶出介质中的溶出曲线作为体内释放曲线,预测其在体内的药时曲线并与参比制剂的临床实测血药浓度曲线进行比较,结合对诸仿制药与参比制剂溶出曲线差异的比较,认为以pH4.0醋酸盐缓冲液为溶出介质的溶出度测定方法为体内外相关的溶出度方法。目前国内外药典均采用盐酸溶液作为溶出介质进行溶出度检查,其结果可能不能真实反映产品体内的释放情况。
在仿制药质量与疗效一致性评价的过程中,在《人体生物等效性试验豁免指导原则》[2]中推荐采用相似因子(f2)法对仿制制剂和参比制剂的溶出曲线进行相似性判定,但其无法直接与BE试验对接,使得应用范围受限。采用计算机模拟技术建立的头孢呋辛酯片(250 mg)体内外相关性评价模型,通过体外数据预测药物体内释放过程,可以辅助进行生物等效性的评估,为评价仿制药的内在质量提供了新思路。
参 考 文 献
彭洁, 洪建文. 头孢呋辛酯片国内外质量现状分析[J]. 国外医药(抗生素分册), 2019, 40(2): 139-143.
总局关于发布人体生物等效性试验豁免指导原则的通告(2016年第87号)[EB/OL]. https://www.cfdi.org.cn/resource/news/9701.html
潘瑞雪, 余方键, 邹文博, 等. 用GastroPlus软件模拟技术评价头孢地尼胶囊制剂的有效性[J]. 中国新药杂志, 2014, 23(13): 1506-1513.
张锦琳, 李岩, 陈涛, 等. 以兰索拉唑肠溶胶囊为例探索模型引导的仿制药等效性替代方法[J]. 药学与临床研究, 2022, 30(1): 1-7.
Drug bank数据库(2023-7-5)[EB/OL].https://go.drugbank.com/drugs/DB01112.
Finn A, Straughn A, Meyer M, et al. Effect of dose and food on the bioavailability of cefuroxime axetil[J]. Biopharm Drug Dispos, 1987, 8: 519-526.
Stuart M, Harding P, Williams E, et al. Pharmacology of cefuroxime as the 1-acetoxyethyl ester in volunteers[J]. Antimicrob Agents Chemother, 1984: 78-82.
Peter E, O Williams, Stuart M, et al. The absolute bioavailability of oral cefuroxime axetil in male and female volunteers after fasting and after food[J]. JAC, 1984, 13: 191-196.

