浸渍冷冻对皇冠梨质地的影响
张晓敏,年 蕊,王 娅,熊雪凤,尤开艳,朱丹实,赵国苍,李 伟,曹雪慧,*
(1.渤海大学食品科学与工程学院,辽宁锦州 121013;2.云南会泽县道成开发投资集团有限公司,云南曲靖 654200)
梨被誉为百果之宗,不仅风味浓郁,爽脆多汁,而且营养丰富,深受人们喜爱[1]。皇冠梨是河北省林科院杂交培育而成的优良品种,属白梨系统(Pyrus bretschneideriRehd),果实呈椭圆形或圆形,肉质洁白细腻,爽口多汁,风味浓郁[2],且营养丰富,含有多种人体必需的营养物质[3-4],深受消费者欢迎。但皇冠梨贮藏期短、易软化、常温下贮藏20 d 便会导致商品及食用价值降低[5]。低温是延长果蔬采后贮藏期的有效方法之一,但随着贮藏时间的延长,果皮表面会出现淡褐色病斑和果心褐变等问题,严重影响梨的品质,造成商品价值损失[6-8]。
冷冻是水果长期保存的常用方法,被广泛应用于食品加工行业[9]。冷冻过程中,随着食品温度的降低,食品基质中的细胞溶液被冷却到初始冰点,温度进一步下降,促使水分子形成冰晶。结晶过程中水分子的迁移导致渗透压升高,进一步增强了细胞膜的渗透性,从而引起冷冻产品的微观结构改变。解冻后造成细胞壁断裂、塌陷,导致组织膨胀和软化,食品品质的降低。尤其是水分含量较高的水果,冻融后,水果的质地品质明显降低[10]。冷冻食品品质与冷冻速率密切相关。因缓慢冻结过程形成较大的细胞外冰晶体,导致食品组织细胞微观结构损坏更加严重,极大降低食品品质[11];而快速冻结因较高的传热传质速率、较小的水迁移率和低渗透压,使细胞内外产生分布均匀且细小的冰晶,对食品微观结构破坏较小[9,12]。
浸渍冷冻(immersion freezing,IF)技术是基于热传导从产品中除去热量的速冻技术[13],冷冻速率远高于空气冻结[14-15]。在整个食物冷冻过程中实现瞬时和均匀的成核,形成细小冰晶,降低对食品的损伤,而浸渍液中的溶质一定程度上可以影响产品的感官特性。LIANG 等[15]研究表明,荔枝浸渍冷冻速度是空气冻结的10 倍,同时浸渍冷冻样品果实微观结构完整。YANG 等[16]研究结果表明-30 ℃浸渍冷冻速率分别比-18 ℃和-50 ℃空气冻结速率高11.5 和4.7倍,微观结构、质地和持水能力等各项物理指标上均接近液氮冷冻。浸渍冷冻技术依托于载冷剂,载冷溶液的选择是浸渍冷冻技术的关键环节。盐类、糖类和醇类物质通常被用作浸渍冻结的载冷剂。钙盐能够减缓果胶和半纤维素多糖的解聚,维持果蔬的硬度[17-20]。海藻糖是常用做冷冻保护剂,聚赖氨酸是一种绿色安全的食品保鲜剂[21]。
本实验以皇冠梨为研究对象,通过改变冷冻温度及浸渍液种类,探究浸渍冷冻对鲜切皇冠梨质地的影响。对硬度、果胶等物质变化情况以及微观结构的分析,揭示浸渍冷冻过程中,冻结温度及浸渍液种类对梨果实质地的影响,为进一步提高冷冻水果品质提供参考。
1 材料与方法
1.1 材料与仪器
皇冠梨 采摘于辽宁省锦州市三屯梨园。运送至实验室后,挑选无损伤,无病虫害的梨,存放在4 ℃条件下冷藏48 h 后进行处理,使其初始冷冻温度保持一致;海藻糖、聚赖氨酸、无水氯化钙 食品级,河南万邦实业有限公司;硝酸 分析纯,锦州古城化学试剂有限公司;30%过氧化氢 分析纯,天津市风船化学试剂科技有限公司;无水乙醇 分析纯,福晨(天津)化学试剂有限公司;硫酸 分析纯,国药集团化学试剂有限公司;咔唑 分析纯,天津化学试剂厂;半乳糖醛酸、溴化钾(KBr) 分析纯,阿拉丁试剂公司;冰乙酸 分析纯,天津市恒兴化学试剂有限公司;无水乙酸钠 分析纯,天津光复精细化工研究所。
BCD-408WBPBUI 冰箱 海尔电器有限公司;DW-86L 828J Haier 超低温冰箱 海尔生物医疗股份有限公司;TP700-8 数据记录仪 深圳市拓普瑞电子有限公司;TA-XT-plus 物性测试仪 英国Stable Micro Systems 公司;海能SH220F 石墨消解仪 海能未来技术集团股份有限公司;ICPE 9820 型电感耦合等离子体发射光谱 日本岛津;Evolution 201 紫外-可见分光光度计、Biofuge Stratos 高速冷冻离心机 美国Thermo;HH-4 型数显恒温水浴锅 上海力辰邦西仪器科技有限公司;FT-IR650 型傅里叶红外变换光谱仪 天津港东科技有限公司;XE-70 原子力显微镜 韩国Park Systems 公司;S-4800 型场发射扫描电镜 日本日立公司。
1.2 实验方法
1.2.1 分组及处理 实验所用载冷剂分为2 种:单一浸渍液为30% CaCl2;复合浸渍液为30% CaCl2+4%海藻糖+0.05%聚赖氨酸。浸渍液置于-20 ℃和-40 ℃冰箱中。
随机选取冷藏保存的皇冠梨,使用切割器手工切割成长宽高约为1.5 cm 左右的果块。果块浸入浸渍液中进行浸渍冷冻,将电热偶插入果块的中心,记录整个冷冻过程中果块的温度变化。当果块中心温度达到-18±1 ℃时,冻结完成。将冻结完成的果块表面浸渍液擦干,装入密封袋中并做好标记,放入-20±1 ℃冰箱保存72 h。在4 ℃恒温箱中解冻6 h后进行指标测定。图1 所示是本试验处理方式示意图。本试验有4 种不同处理方法:-20IF(-20 ℃单一浸渍液冷冻);-20IF-T(-20 ℃复合浸渍液冷冻);-40IF(-40 ℃单一浸渍液冷冻),-40IF-T(-40 ℃复合浸渍液冷冻)。另取4 ℃冷藏的新鲜皇冠梨进行同样切割处理,作为对照组,即CK。
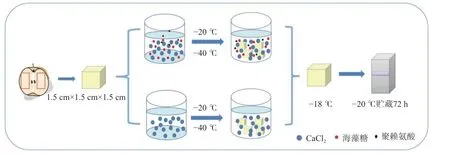
图1 处理方法示意图Fig.1 Processing method diagram
1.2.2 冻结曲线测定 使用TP 700-8 数据记录器测量果块中心的温度变化。将探针插入果块中心,记录整个冷冻过程中果块的温度变化[15]。当果块的中心温度达到-18±1 ℃时,冷冻完成。
1.2.3 硬度测定 参考XU 等[22]的方法略有修改。采用TA-XT-plus 物性测试仪测定解冻后梨块硬度。参数设置如下:P/50 探头,测前、测试和测后速度均为1.00 mm/s,触发力5 g,压缩量30%。
1.2.4 钙含量测定 采用电感耦合等离子体发射光谱ICPE 9820 进行测定。参考SILVA 等[23]方法略有修改。取1 g 研磨均匀的样品放入300 mL 消化管中,加入4 mL HNO3,冷消化2 h 后,加1 mL 30%H2O2,放入石墨消解仪中180 ℃消解30 min,直至样品完全消解。消解液用超纯水定容至50 mL,进行后续测定。ICP OES 参数包括:等离子体气体流量10 L/min,辅助气流量0.6 L/min,载气流量0.7 L/min,射频功率为1.2 kW,测定波长369.847 nm。
1.2.5 果胶含量测定 参考曹建康等[24]方法测定。
1.2.6 傅里叶红外光谱测定 参考潘润森等[25]方法略有修改,采用傅里叶红外变换光谱仪分析果胶官能团的变化。将1 mg 冷冻干燥后的水溶性果胶样品与100 mg 干燥后的KBr 混合并研磨均匀。取混合样品,用压片机压制成薄膜,在波长范围为4000~400 cm-1,分辨率为4 cm-1下进行扫描。
1.2.7 原子力显微镜测定 采用XE-70 原子力显微镜进行测定。参考ZHANG 等[19]方法。吸取10 μL制得的水溶性果胶样品溶液滴在清洁干净的载波片上,待完全干燥后采用非接触模式测定样品的微观形貌。
1.2.8 微观结构测定 采用扫描电子显微镜(SEM)进行微观结构检测。将冷冻干燥后的梨片用导电胶固定在铝制的圆盘上,进行镀金处理。将镀金完成后样品放入扫描电子显微镜中进行测定。
1.3 数据处理
实验数据为3 次重复试验的平均值,结果以平均值±标准差表示。采用IBM SPSS 25.0 软件对数据进行Duncan 检验和单因素方差分析(ANOVA),使用Origin 2021 软件制图。
2 结果与分析
2.1 浸渍冷冻对梨冻结曲线的影响
冻结速率是影响冷冻产品的关键因素之一[15]。缓慢冻结会形成分布不均的细胞外大冰晶而造成食品结构损伤;而快速冻结在较高的冻结速率下,更易形成细小且分布均匀的冰晶,对食品微观结构破坏较小。图2 显示了梨在 -20IF、-20IF-T、-40IF 和 -40IF-T浸渍冷冻期间的中心温度-时间分布曲线。从图2可以看出,冻结曲线可分为三个阶段:预冷阶段(4~-2 ℃);相变阶段(-2~-5 ℃);深冻阶段(-5~-18 ℃)[26]。相变阶段是最大冰晶形成区,在此阶段去除果实中的潜热,80%的水会在该阶段形成冰晶[27]。其中,-20IF 样品的冷冻时间最长,为475 s,-40IF-T 样品的冻结时间最短。与-20IF 处理组相比,-40IF-T 的冻结时间缩短了69.47%。在图2 中可以观察到,-20IF 及-20IF-T 处理组的相变阶段比-40 ℃温度下浸渍冻结处理组的持续时间更长,这也导致-20 ℃温度下样品冷冻时间更长。较低的冻结温度产生更快的传热,从而提升了冻结速率[28]。细胞内外冰晶的形成主要取决于冷冻速率,快速的冻结速率可以使细胞内的温度急剧下降,导致细胞内溶液与平衡浓度显著不同,从而增加了细胞内成核的概率,产生许多细小的冰晶,缩短了冻结时间[29]。在相同浸渍冷冻温度下,各处理组间冻结时间无显著差异(P>0.05),但复合浸渍冷冻组冻结时间较单一浸渍冷冻处理组低。这可能是浸渍液中添加的海藻糖和聚赖氨酸有助于冻结速率的提高。表明在不改变冻结温度前提下,使用多元浸渍液在一定程度上能够缩短冻结时间。
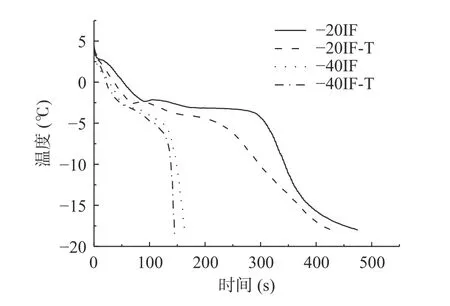
图2 浸渍冷冻对梨冻结曲线的影响Fig.2 Effect of immersion freezing on freezing curve of pear
2.2 浸渍冷冻对梨硬度的影响
冷冻食品的质地与冷冻过程中形成的冰晶大小密切相关。冻结过程中形成的冰晶尺寸越小,分布越均匀,对组织细胞的微观结构破坏越小,质地保存的会更好[30]。图3 显示了皇冠梨冻融后的硬度值,以此来反映其质地的变化。由图3 可知,经冷冻处理后,果实硬度值较CK 组相比显著降低(P<0.05),且各浸渍冷冻处理组间硬度值存在显著性差异(P<0.05)。冻融后梨块的硬度值大小为 -40IF-T 组 >-40IF 组>-20IF-T 组>-20IF 组。表明在冻结过程中,较低的环境冷冻温度,能降低冻结过程中结晶和再结晶对梨组织微观结构的影响,有效保持冷冻食品的硬度。SOUSA 等[31]也指出冷冻速率在维持冷冻食品质地方面的重要作用。较低的冻结温度能够加速食品中热量传递,提高冻结速率,缩短冻结时间,从而促进更加细小且分布均匀的冰晶产生,对细胞组织产生更小的伤害。其解冻后,能够保持较高的硬度值。同时浸渍液中Ca2+也会渗透进样品内部,Ca2+能与去甲基酯化的果胶骨架相互作用,促进果胶-Ca2+网络的形成,从而增强细胞壁的力学性能,增强果实的质地[32-33]。同一冷冻温度下复合浸渍液浸渍冷冻处理组硬度值均高于单一浸渍液浸渍冷冻处理组。这可能是由于复合浸渍液中添加的海藻糖与聚赖氨酸起到保护质地的作用。在浸渍冷冻过程中,样品与浸渍液直接接触,浸渍液中海藻糖和聚赖氨酸会附着及渗透进样品内部。冷冻保护剂通过保护脂膜的完整性[34],降低体系中水分的流动,抑制大冰晶的形成,起到维持冷冻产品质地的作用。
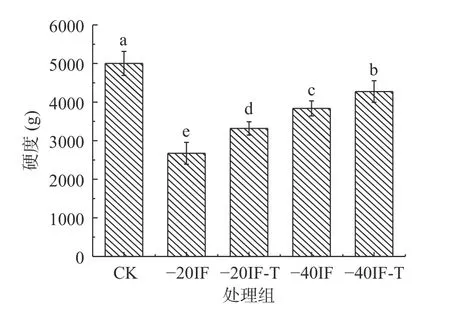
图3 浸渍冷冻对梨硬度的影响Fig.3 Effect of immersion freezing on hardness of pear
2.3 浸渍冷冻对梨钙含量的影响
钙离子在果实的营养和生理过程中起着重要的作用。使用含钙盐的浸渍溶液不仅可以维持产品品质,还可提高食品中钙含量。钙盐广泛应用于果蔬食品加工,钙离子是植物细胞壁中必需的矿物成分之一,它与植物组织细胞壁上的果胶相互作用,形成果胶酸钙复合物,增强细胞结构,赋予细胞壁抗性并防止其降解,用于维持产品的微观结构特征[32,35]。而Ca2+大量渗透可能会造成细胞间隙、细胞壁和细胞腔内可见钙的沉积,导致细胞结构的破坏。图4 所示,是浸渍冷冻处理后梨块中钙离子含量的变化情况。与CK 组相比,浸渍冷冻处理后皇冠梨中钙含量显著升高(P<0.05)。这是由于在浸渍冷冻过程中样品与含钙浸渍液直接接触,浸渍液中的溶质渗透进梨果实内部,从而引起样品中钙含量明显的升高。-40IF 及-40IF-T 处理组中钙含量显著低于-20IF 及-20IF-T处理组样品中钙含量(P<0.05)。其中,-40IF-T 处理组钙含量最低,较-20IF 及-20IF-T 处理组钙含量分别降低了50.73%、48.01%。这可能是由于-40 ℃的冻结温度更低,冻结速率更快,缩短了样品与浸渍液的接触时间,从而降低了钙离子向样品中的迁移。钙离子可以增加细胞结构的硬度,但在冷冻过程中,冻结速率对食品细胞结构的损伤程度更为主要,因此,-20℃浸渍处理组硬度更低一些。而同一冻结温度下,复合浸渍液浸渍冷冻样品与单一浸渍液浸渍冷冻样品中钙含量也存在较小的差异。这可能是由于复合浸渍冷冻处理组中海藻糖及聚赖氨酸的添加与Ca2+抢占渗透通道,在一定程度上抑制了Ca2+向果实内部的渗入;同时,海藻糖和聚赖氨酸的添加也加速了冻结速率,减少了传质时间。研究表明[36],使用三元或更复杂的溶液来代替二元溶液可以限制溶质增益。
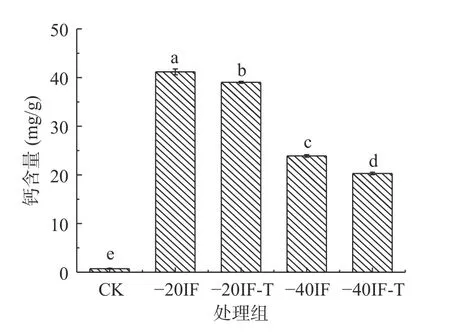
图4 浸渍冷冻对梨钙含量的影响Fig.4 Effect of immersion freezing on calcium content of pear
2.4 浸渍冷冻对梨果胶含量的影响
果实软化与细胞壁多糖的变化密切相关,而果胶是组成细胞壁的重要成分之一。果胶成分发生的一系列变化及降解会导致细胞壁结构的松动和减弱,从而导致果实的硬度降低[37]。原果胶分解为可溶性果胶及果胶酸等物质会导致果实软化。图5 显示了鲜梨及不同浸渍冷冻条件下果实中果胶含量的变化情况。从图5 中可知,各冻结处理组的果胶含量均存在显著性差异(P<0.05)。与CK 组相比,经浸渍冷冻处理后,各处理组的原果胶及总果胶含量显著下降(P<0.05),水溶性果胶含量显著上升(P<0.05)。这表明冻结处理对梨果实中果胶有显著的影响,冷冻导致果实的细胞壁受到损伤,造成细胞壁结构降解及果胶损失。原果胶向水溶性果胶及果胶酸等物质转变,使得水溶性果胶含量升高。同时果胶含量的变化与冻结样品硬度值的变化趋势相一致,这也说明了果实软化与果胶物质变化密切相关。冻结处理组中,-40IF-T原果胶和总果胶含量最高,分别为16.16%、18.30%;其次是-40IF 处理组,分别为15.36%、17.67%;与-20IF 相比,-40IF-T 水溶性果胶含量降低了31.85%。这表明,冻结速率的提高能够有效降低组织细胞的损伤,抑制原果胶的降解及果胶物质的流失,保持细胞壁的坚挺状态,维持解冻后果实硬度品质。冷冻草莓研究结果也表明,快速冻结在一定程度上抑制了原果胶分解[38]。同一冻结温度下,较单一浸渍冷冻处理组相比,复合浸渍冷冻组的原果胶含量较高,水溶性果胶含量较低。这表明使用多元载冷剂或在载冷剂中添加冷冻保护剂在一定程度上可以抑制细胞壁多糖的降解。
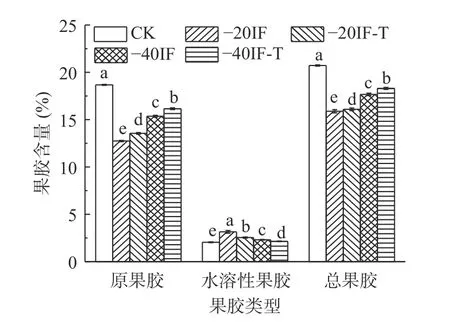
图5 浸渍冷冻对梨果胶含量的影响Fig.5 Effect of immersion freezing on gum content of pear
2.5 浸渍冷冻对梨水溶性果胶红外光谱及显微结构的影响
傅里叶红外光谱是分析多糖分子结构的重要工具,分子结构的变化会在吸收峰的位置及强度上有所体现。新鲜及不同浸渍冷冻处理后梨水溶性果胶傅里叶红外光谱如图6 所示。在3300~3500 cm-1处的宽拉伸峰代表了羟基的振动,在2929 cm-1左右处观察到的小吸收峰是由于C-H 伸缩振动产生的[39]。在1747 cm-1处的吸收峰由于酯羰基的C=O 键的伸缩振动,1610 cm-1处的是不对称羧基(COO-)伸缩振动,这两处的吸收峰面积可以来预测甲酯化程度[40]。在钙浸渍处理草莓[25,41]研究中指出,低酯化度有利于钙离子与水溶性果胶交联,从而抑制其分解。1400 cm-1处吸收峰表示C-H 键的伸缩振动,在1101 cm-1处的吸收峰是由于果胶糖基残基的吡喃糖环的拉伸振动[42]。图6 显示了不同处理组的水溶性果胶的特征吸收峰。经冻结处理后2929 cm-1处吸收峰较CK 组有所减小,3435 cm-1处的峰没有明显变化。与CK 组1101.35 cm-1处吸收峰相比,浸渍冷冻处理组在该处的吸收峰均向左偏移,同时峰强度有所减弱。与CK 组相比,-20IF、-20IF-T、-40 F 和-40IF-T 处理组1747 cm-1处只能观察到微弱的吸收峰,近乎趋近于直线增长,但各冷冻处理组红外光谱图未有新增的峰。这表明浸渍冻结处理后对梨果实中水溶性果胶结构没有影响。各处理组之间水溶性果胶红外光谱图没有明显的差异。这表明不同温度冷冻处理及海藻糖和聚赖氨酸的添加对水溶性果胶的结构没有明显的影响。冷冻梨解冻后发生软化,且伴随汁液损失,导致各果胶含量发生变化。但傅里叶红外光谱测定水溶性果胶化学结构中各官能团吸收峰与新鲜样品中并无区别,可能冻结没有改变梨水溶性果胶的化学结构。
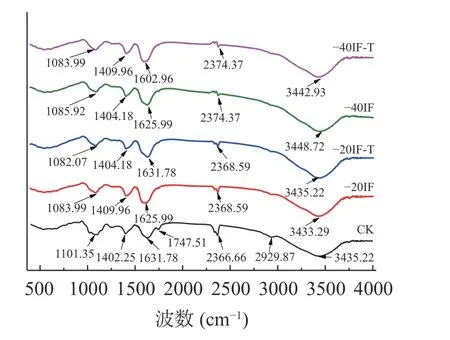
图6 不同浸渍冷冻条件下梨水溶性果胶傅里叶红外光谱图Fig.6 Fourier infrared spectra of water-soluble pectin of pear under different immersion freezing conditions
原子力显微镜(AFM)作为一种成像工具可以来观察水果和蔬菜中食物大分子和胶体的变化[43]。如图7 所示是新鲜果实及不同浸渍冷冻处理条件下梨水溶性果胶的原子力显微图像。从图7 可以观察到云母片上的水溶性果胶聚合物是许多小的椭圆形。IMAIZUMI 等[44]报道了猕猴桃中水溶性果胶聚合物也是类似结构。与新鲜的皇冠梨相比,冷冻处理后AFM 图中圆点分布更密集,更加聚集,但水溶性果胶高度略有降低。这可能是由于冻结处理导致果实软化,在酶作用下原果胶向水溶性果胶转化,造成样品中水溶性果胶含量上升[45],在显微镜下呈现成片聚集分布状态。
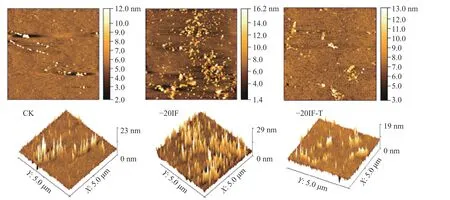
图7 浸渍冷冻条件下梨水溶性果胶原子力显微图Fig.7 AFM diagram of pear soluble pectin under immersion freezing condition
2.6 浸渍冷冻对梨微观结构的影响
除物理化学性质外,细胞的微观结构图也可反映果实受到的机械损伤。缓慢的冻结速率会产生较大的冰晶对食物组织造成不可逆的损伤,而快速的冻结速率通常可以通过产生细小且均匀的冰晶来保持食物的微观结构。如图8 可知,不同处理条件下,梨果实细胞的微观结构存在明显差异。新鲜梨(CK)的细胞结构分明,纹理清晰,细胞孔洞大小较为一致,排列规律,细胞结构完整。而经过冷冻处理后的各组细胞结构都受到一定的破坏,细胞孔洞呈现大小不一,细胞撕裂,还存在部分坍塌。经-20IF 处理的样品微观结构中细胞孔径最大,组织塌陷、收缩最为严重,-20IF-T 处理组次之。-40IF 及-40IF-T 处理均具有比-20IF 及-20IF-T 处理组更完整的微观结构。这可能是因为-40 ℃冻结条件下冻结速率快,相变时间短可以促进样品中可冻结的水分快速转化为冰晶[46]。较高的热传递促进大量细小冰晶形成,对组织细胞造成的损伤较小。从而降低了因细胞壁改性引起的细胞壁损伤和组织撕裂等现象,因此,样品的微观结构较为完整。可见,冻结食品微观结构的变化与冻结温度密切相关。SOPHIE 等[10]研究了苹果组织在三种不同温度下冷冻后的细胞结构的变化,结果表明较低的冻结温度下细胞损伤较小,在土豆[47]、萝卜[48]等研究中显示了相同的结果。在相同冻结温度下,其冻结速率没有较大差异,但复合浸渍冷冻处理组SME 图像较单一浸渍冷冻组细胞结构完整,组织塌陷少。这表明所选用的复合浸渍液能保持冷冻食品的微观结构。这可能是由于海藻糖能够防止大冰晶的生长,保护细胞结构在冷冻过程中不受冰晶损伤。

图8 浸渍冷冻对梨微观结构的影响(130×)Fig.8 Effect of immersion freezing on microstructure of pear (130×)
3 结论
本试验研究了浸渍冷冻对鲜切皇冠梨质地的影响。结果表明:-40 ℃复合浸渍冻结处理更好地维持梨果实的硬度,抑制原果胶的分解及水溶性果胶含量的升高,降低果实内部果胶的损失,维持了细胞壁原有的结构。-40 ℃浸渍冷冻处理组中,梨细胞的微观结构更接近新鲜果实,细胞结构清晰,排布更为规律,无明显细胞塌陷。同时能够抑制冻结过程中浸渍液溶质向梨中的渗透。综上所述,降低冷冻温度及复合载冷剂的使用有利于抑制解冻后皇冠梨质地的软化,维持果实细胞原有结构,降低冷冻过程中浸渍液溶质的大量渗透,减少过量外源物质对细胞的损伤。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

