QuEChERS-超高效液相色谱-串联质谱法测定茶叶中47 种农药残留
刘华文,邓美晴,陈北燕
(1.广西-东盟食品检验检测中心,广西南宁 530029;2.广西医科大学,公共卫生学院,广西南宁 530022;3.南宁市卫生学校,广西南宁 530409)
我国茶叶有着悠久的历史,其本身具有抗氧化、抗菌、抗癌和抗炎作用,还能降低血压,减少胆固醇和心血管疾病的患病风险[1]。我国茶叶种植存在过量使用农药的情况,且使用的大多数是化学类农药[2]。此类农药作用单一无法达到大规模的病虫治理,且使害虫的抗药性不断提高,从而促使茶农使用复配农药,造成农药残留现象愈发严重[3-5]。此外,发达国家对进口产品的检验标准不断提高,而我国的茶叶因农药残留不达标而被阻止出口。茶叶中农药残留超标已成为中国茶叶出口最主要的技术性贸易壁垒[6]。目前,各国在茶叶产品中农药残留的监测重点是制定各种农药的最大残留限量(Maximum residue limit,MRL)和开发准确快速的定性、定量分析方法[7]。我国从2005 年起开始对茶叶产品中农药的MRL 做出强制性要求限制,但仍不及欧盟等发达国家的要求。
目前研究较为深入、使用最广泛的茶叶农药残留检测技术主要有气相色谱法、气相色谱-串联质谱法、液相色谱法、液相色谱-串联质谱法[8]等;前处理方法有超声提取法[9]、均质提取法[10]、索氏提取法、固相萃取法[11]等。大多前处理方法操作繁琐,试剂消耗量较大。QuEChERS 方法是近年来国际上最新发展起来的一种快速样品前处理技术[12],因其具有快速(Quick)、简单(Easy)、便宜(Cheap)、有效(Effective)、可靠(Rugged)、安全(Safe)的特点而得名[13-16]。QuEChERS 法分为提取和净化两部分:使用适宜的溶剂提取待测物,并针对杂质选用适宜的净化剂,一般常用的净化剂有N-丙基乙二胺(PSA)、十八烷基键合硅胶(C18)、石墨化碳黑(Graphitizing of carbon black,GCB)等。由于茶叶基质复杂,采用常用净化剂进行净化,净化结果不彻底,会存在基质干扰现象[17-18]。多壁碳纳米管(MWCNTs)[19-20]是一种新型碳纳米材料,由多层石墨片卷曲而成的碳纳米管,层与层之间呈无序排列,具有比表面积大、化学稳定性好、吸附能力强等优点。通过向吸附剂中加入多壁碳纳米管,改进QuEChERS 法对茶叶的净化能力,液质联用法进行检测的研究鲜有报道。因此,本研究将QuEChERS 技术和多壁碳纳米管净化剂相结合,采用超高效液相色谱-串联质谱法检测茶叶中农药残留,建立一种快速、简便、高效的检测茶叶中多种农残的方法,为茶叶农药的使用、监管提供技术及数据支持。
1 材料与方法
1.1 材料与仪器
空白茶叶 购于本地有机茶社;待测茶叶100 份,包含绿茶20 份、红茶20 份、白茶10 份、黑茶25 份、花茶25 份,分别购自广西各地;47 种农药标准物质分别为毒虫畏、甲拌磷、甲拌磷砜、甲拌磷亚砜、甲基异柳磷、特丁硫磷、特丁硫磷砜、特丁硫磷亚砜、克百威、硫环磷、甲基硫环磷、甲胺磷、乐果、灭线磷、内吸磷、水胺硫磷、氧乐果、乙酰甲胺磷、灭多威、辛硫磷、吡虫啉、敌百虫、多菌灵、甲萘威、茚虫威、啶虫脒、噻虫胺、噻虫啉、噻虫嗪、噻嗪酮、喹螨醚、噻螨酮、乙螨唑、除虫脲、啶氧菌酯、呋虫胺、氟虫脲、唑虫酰胺、甲氨基阿维菌素甲酸盐、醚菊酯、吡唑醚菌酯、杀虫威、杀螟松、氟虫腈砜、氟虫腈、氟虫腈亚砜、氟甲腈 纯度均大于99%,德国Dr Ehrenstorfer 公司;乙腈、甲酸、甲醇 色谱纯,德国默克公司;乙酸铵 色谱纯,天津市光复精细化工研究所;QuEChERS 提取盐包 含6 g 无水硫酸镁和1.5 g 无水乙酸钠,美国Waters 公司;多壁碳纳米管 MWCNTs,成都中科时代纳能科技有限公司;N-丙基乙二胺 PSA,天津博纳艾杰尔科技有限公司;十八烷基键合硅胶 C18,广州沃恩生物科技有限公司;实验室用水 超纯水。
1290 超高效液相色谱仪 美国Agilent 公司;TRIPLE QUAD 5500 三重四极杆串联质谱仪(配备AB SCIEX 数据处理软件、电喷雾源) 美国AB SCIEX 公司;MS303TS 型电子天平 梅特勒-托利多仪器(上海)公司;Multi Reax 涡旋仪 德国Heidolph 公司;Shaker SA320 振荡器 日本YAMATO公司;X3R 高速冷冻离心机 美国热电Thermo 公司;Gradient A10 Milli-Q 超纯水机 美国Millipore 公司。
1.2 实验方法
1.2.1 样品前处理 提取:精密称取粉碎茶叶样品2.000 g(精确至0.001 g)于50 mL 离心管中,加入5 mL 水浸泡30 min,接着加入15 mL 1% 乙酸乙腈溶液,在涡漩仪上涡漩振荡提取25 min(450 次/min),然后加入QuEChERS 盐析剂(1.5 g 乙酸钠,6 g 无水硫酸镁),立即摇匀,置于振荡器上剧烈振荡3 min(450 次/min),以10000 r/min 离心5 min,上清液待净化。
净化:取上清液8 mL,转移到含有1200 mg 无水硫酸镁、50 mg MWCNTs、100 mg PSA 和100 mg C18的净化管中,涡漩2 min(450 次/min),以10000 r/min 离心5 min,精密吸取上清液2 mL,氮吹至近干,甲醇定容1 mL,过0.22 μm 有机滤膜,供UPLC-MS/MS 分析。
1.2.2 标准溶液配制 准确称取适量标准物质,根据标准物质的溶解性选用甲醇或乙腈分别配制成1 mg/mL 的标准储备液,-20 ℃保存。分别适量移取一定体积的各标准储备液于同一10 mL 容量瓶中,乙腈定容至刻度,得到10 μg/mL 的混合标准溶液,再精密量取1 mL 混合标准溶液于100 mL 容量瓶中,乙腈稀释定容至刻度得到0.1 μg/mL 混合标准使用液,用于绘制标准曲线。
称取空白基质样品,按“1.2.1”处理后,得到空白基质溶液。分别精密吸取混合标准使用液0、0.02、0.05、0.1、0.5、1.0 mL,用空白基质溶液配制成浓度为0、2、5、10、50、100 ng/mL 系列基质混合标准工作曲线。
1.2.3 超高效液相色谱条件 色谱柱:InertsilTMODS-3 色谱柱(3 μm,2.1 mm×150 mm);流动相:A 为0.1%甲酸水,B 为甲醇。梯度洗脱程序:0~1.5 min,97%A;1.5~2.5 min,85%A;2.5~9 min,50%A;9~11 min,30%A;11~13 min,2%A;13~13.1 min,97% A;13.1~15 min,97% A;流速:300 μL/min;柱温:35 ℃;进样量:2.0 μL。
1.2.4 质谱条件 离子源:电喷雾离子源(ESI);扫描方式:正、负离子同时扫描;检测模式:多反应监测(Multiple reaction monitoring,MRM);电喷雾电压:5500 V 和-4500 V,雾化气(氮气)压力:55 psi;辅助气压力:60 psi;气帘气(氮气)压力:30 psi;碰撞气(氮气)压力:7 psi;离子源温度:550 ℃;扫描时间:60 ms;碰撞室入口电压:7 V;碰撞室出口电压:12 V;各目标化合物的质谱采集参数见表1。
表1 47 种农药的多反应监测扫描模式的质谱参数Table 1 MRM mass spectrometric parameters of 47 kinds of pesticides
1.3 数据处理
分别利用Analyst Software 和MutiQuant 3.0.2软件(AB SCIEX)进行数据采集及处理,Excel 2013进行数据汇总和分析。
2 结果与分析
2.1 提取液的优化
目前,农药残留的提取溶剂主要有乙腈、乙酸乙酯、丙酮、甲醇、甲苯、正己烷和石油醚[21-24]等。茶叶基质比较复杂,使用乙酸乙酯、丙酮、甲醇等作为提取溶剂时,提取液颜色很较深,提取物也更多,不利于后续净化。而乙腈作为提取溶剂,因其极性较强,对于油性物质如蜡、脂肪、油性色素等不易提取出,可减小杂质的干扰,最适于提取各种极性的农药残留,且仅加入盐便可实现与水相的分离[25]。在乙腈中加入少量有机酸,可防止部分农药分解及调节pH,因此加入1%乙酸[26]。对于含水量低的样品,通过先向样品中添加一定量的水,可弱化分析物与样品基质之间的相互作用,使待分析物更易在萃取分配过程中被充分提取。通过UPLC-MS/MS 全扫描得到的总离子流图显示,乙酸乙腈提取的共萃物少(图1)。因此,本研究采用加入5 mL 超纯水润湿茶叶后加入15 mL 1%乙酸乙腈作为提取溶剂。
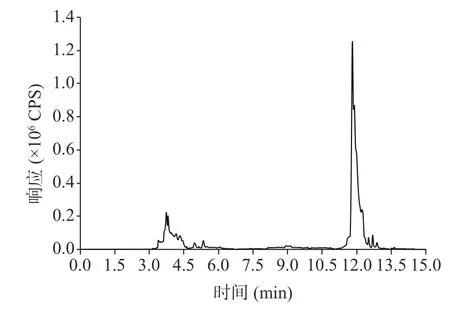
图1 1%乙酸乙腈作为提取溶剂的总离子流图Fig.1 TIC of 1% acetic acid acetonitrile as solvents for extraction
2.2 净化条件的优化
茶叶基质复杂,富含色素、茶多酚、生物碱、咖啡碱和脂肪酸等物质,水分含量极低[27]。茶叶样品经过有机溶剂提取后,样液多呈深红色,若不采取方法对提取液进行净化,直接进仪器分析,既污染色谱柱和离子源,又影响仪器的响应,干扰检测的灵敏度和准确性[28]。常见的净化剂有无水硫酸镁、MWCNTs、GCB、C18、PSA 等。提取时加入无水硫酸镁能除去茶叶中的水分,保证其他净化填料的吸附效果[29],同时避免水分损害仪器和毛细柱,降低柱效。PSA 的表面键合极性官能团,具有极性吸附作用和弱阴离子交换功能,对样品基质中的有机酸、极性色素、糖类等杂质吸附能力较强[30-31]。相反,C18可去除酯类和脂肪等非极性干扰物的影响。GCB 具有片状结构,是一种非极性吸附剂,对含苯环官能团的化合物有较强的吸附作用,可有效去除具有平面结构的甾醇和色素杂质,但也会对平面结构的有机氯农药进行吸附,导致有机氯农药回收率降低。相比于GCB,MWCNTs的空心柱状结构对农药吸附作用很小,对色素的吸附能力更强,更易获得较高的回收率。因此本实验选取无水硫酸镁、PSA、C18、MWCNTs 作净化剂,比较不同配比的净化效果。取8 mL 提取液,固定加入1200 mg 无水硫酸镁,分别考察PSA 添加量为50、100、200、300、400、600 mg 的回收率,在PSA 添加量为100 mg 时,各农药的平均回收率为73.2%~110.1%;固定1200 mg 无水硫酸镁、100 mg PSA 用量,比较MWCNTs 添加量为50、100、200、300、400、600 mg 的回收率,在MWCNTs 添加量为50 mg时,各农药的平均回收率为68.0%~111.7%;固定1200 mg 无水硫酸镁、100 mg PSA、50 mg MWCNTs用量,比较C18添加量为50、100、200、300、400、600 mg 的回收率,在C18添加量为100 mg 时,各农药回收率为73.4%~114.3%。最终净化配比为无水硫酸镁1200 mg、MWCNTs 50 mg、PSA 100 mg、C18100 mg(图2)。
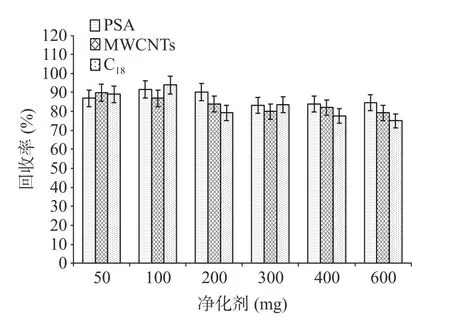
图2 不同净化条件的回收率Fig.2 Recovery rate of different purification conditions
2.3 质谱条件的优化
将各农药配制成0.05 μg/mL 的混合标准溶液。用蠕动泵直接注入质谱仪,采用正、负离子扫描模式,优化锥孔电压使母离子响应丰度最大且稳定,同时优化碰撞能量,选取响应丰度较高、易得到、出峰稳定的碎片离子作为子离子,并将母离子和子离子组成离子对。具体质谱参数见表1。
2.4 液相色谱条件的优化
在优化的质谱条件下,考察不同色谱柱不同流动相对目标物质谱信号的影响。本实验对比了四种色谱柱,ACQUITY UPLC BEH C18色谱柱(1.7 μm,2.1 mm×150 mm)、ATLANTIS T3色谱柱(3 μm,2.1 mm×150 mm)、INERTSILTMODS-3 色谱柱(3 μm,2.1 mm×150 mm)、CAPCELL PAK BBH C18色谱柱(3 μm,2.1 mm×150 mm)。甲酸和乙酸铵具有增强目标化合物离子化程度和改善峰形的作用[14],因此,分别考察0.1%甲酸水-甲醇、0.1%甲酸水-乙腈、5 mmol/L 乙酸铵溶液-乙腈几种流动相对目标化合物的影响。对比图3A~D,同种流动相下ACQUITY UPLC BEH C18色谱柱、Atlantis T3色谱柱、CAPCELL PAK BBH C18色谱柱、INERTSILTM ODS-3 色谱柱,使用INERTSILTMODS-3 色谱柱的色谱图目标化合物响应均高于其它3 根色谱柱;对比图3D~F,同种色谱柱中的三种流动相体系出峰均良好,间距适宜。使用INERTSILTMODS-3 色谱柱,对比0.1%甲酸水-甲醇流动相体系和5 mmol/L 乙酸铵溶液-乙腈流动相体系,杀虫威、除虫脲在5 mmol/L 乙酸铵溶液-乙腈流动相中出现杂峰,特丁硫磷砜在0.1%甲酸水-甲醇流动相中响应值较高。使用INERTSILTMODS-3 色谱柱,对比0.1%甲酸水-甲醇和0.1%甲酸水-乙腈流动相,提取目标化合物离子对,结果显示使用0.1%甲酸水-甲醇体系时绝大部分化合物的响应都高于0.1%甲酸水-乙腈体系。因此,选用INERTSILTMODS-3 色谱柱和0.1%甲酸水-甲醇体系。
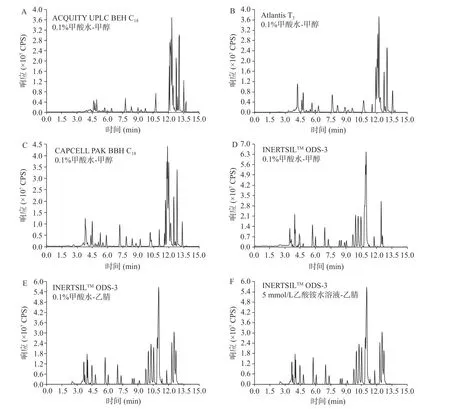
图3 不同色谱柱和流动相的色谱图Fig.3 Chromatogram of different chromatographic columns and mobile phases
2.5 基质效应
基质效应(Matrix effect,ME)是指样品中除待测物以外的组分,常常对分析物的分析过程有明显的干扰,并影响分析结果的准确性。基质效应可用以下公式计算:
式中,ME 为基质效应;A 为溶剂标准曲线的斜率;B 为基质匹配标准曲线的斜率。若ME<0.8,则表现为基质抑制效应,ME>1,则为基质增强效应,ME=0.8~1,则表现为基质效应影响不大。本实验对47 种化合物的基质效应进行评估(图4),发现47 种化合物的基质效应均低于1,其中85%的化合物受到基质抑制,因此本方法检测采用基质匹配曲线,以此满足农药残留的检测要求。
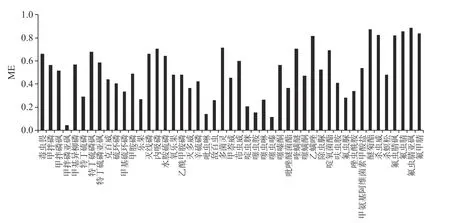
图4 47 种化合物在茶叶中的基质效应Fig.4 Matrix effects of 47 compounds in tea
2.6 线性范围、检出限、定量限
在优化的实验条件下,按“1.2.2”配制6 个浓度水平的基质工作溶液,上机测定,以目标物的质量浓度为横坐标,对应的定量离子峰面积为纵坐标绘制标准曲线。如表2,47 种目标化合物在2~100 ng/mL范围内线性良好,相关系数为0.9971~0.9996,检出限(LOD)为0.001~0.006 mg/kg,定量限(LOQ)为0.002~0.020 mg/kg,满足农药残留的检测要求。
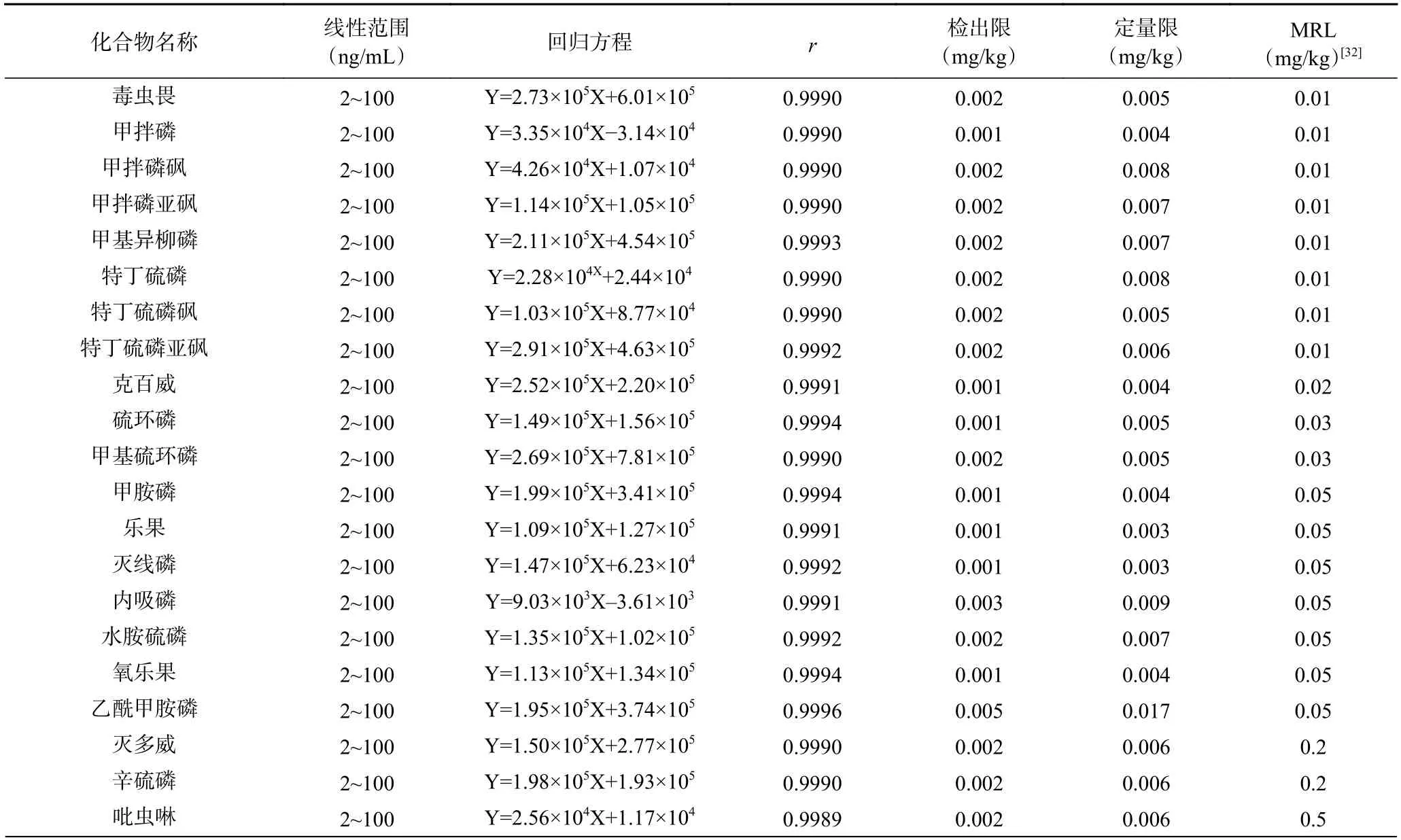
表2 47 种化合物的线性范围、回归方程、相关系数、检出限、定量限和食品中农药最大残留限量(MRL)Table 2 Linear ranges,regression equations,correlation coefficients,LOD,LOQ and maximum residue limits (MRL) for pesticides in food of 47 compounds
2.7 回收率
根据GB/T 27404-2008[33]对食品理化检测的质量控制要求,分别向空白茶叶样品添加低、中、高3 水平加标回收实验,平行测试6 次,结果见表3。47 种化合物的平均回收率为73.4%~114.3%,相对标准偏差(RSD%)为0.3%~19.9%(n=6),方法具有良好的回收率与精密度。
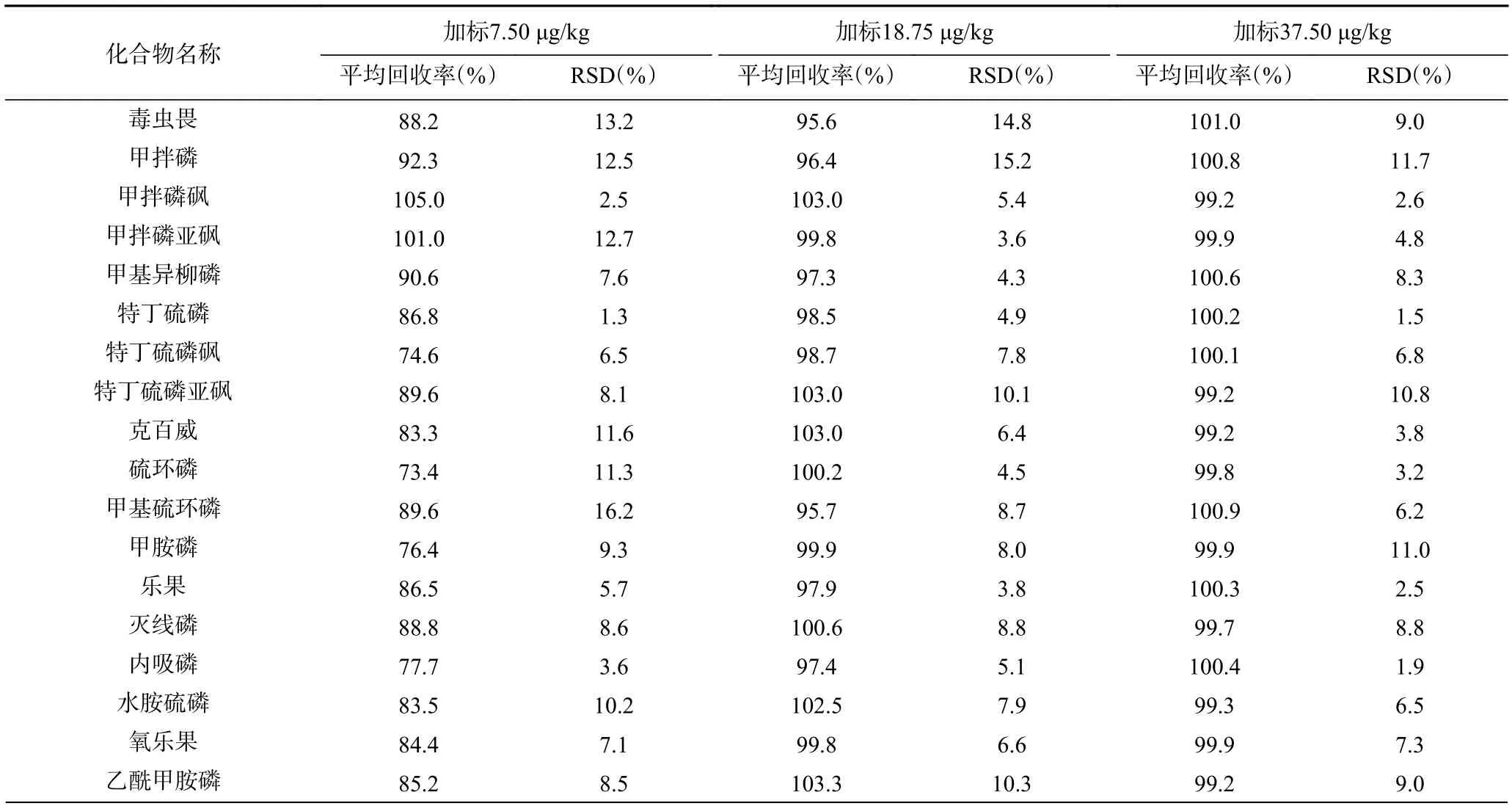
表3 47 种化合物的加标回收率及相对标准偏差(n=6)Table 3 Recovery rates and relative standard deviations of 47 compounds (n=6)
2.8 实际样品检测
利用本次实验建立的方法和国家标准方法GB 23200.121-2021[34]分别对广西省内销售的100 份茶叶进行农药残留分析,包含绿茶20 份、红茶20 份、白茶10 份、黑茶25 份、花茶25 份。部分农药超出国家标准限值,结果见表4,其余农药均为未检出。
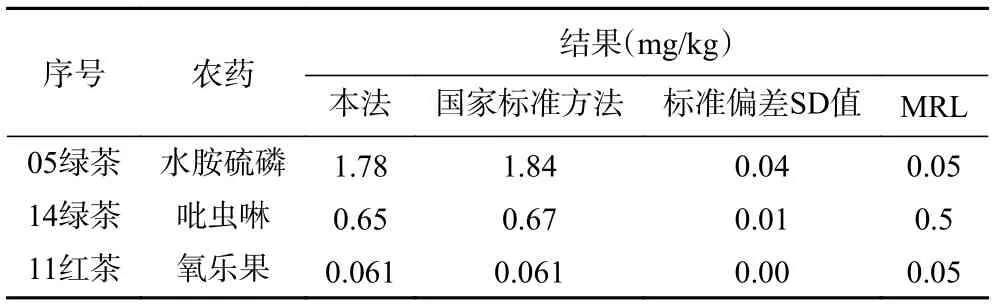
表4 QuEChERS 方法和国家标准方法结果对比Table 4 Comparison results of QuEChERS method and national standard method
3 结论
本文采用优化QuEChERS 方法进行前处理,超高效液相色谱-串联质谱作为检测仪器,在最优的实验条件下,47 种农药平均回收率为73.4%~114.3%,相对标准偏差为0.3%~19.9%(n=6),检出限为0.001~0.006 mg/kg,定量限为0.002~0.020 mg/kg,并对广西省内销售的100 份茶叶进行农药残留分析,包含绿茶20 份、红茶20 份、白茶10 份、黑茶25 份、花茶25 份,其中检出绿茶中水胺硫磷1.78 mg/kg、吡虫啉0.65 mg/kg,红茶中氧乐果0.061 mg/kg,其余农药均为未检出。与国家标准方法相比,标准偏差SD 值满足农药残留的检测要求。该方法灵敏、准确、稳定,可满足茶叶中47 种农药残留的检测要求。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

