基于转录组学探讨林蛙油对卵泡发育障碍大鼠的影响
何星瑶,王 玉,王君淑,王晓汇,邸 琳,刘新宇,赵宏宇,*,张凤清
(1.长春工业大学,吉林长春 130012;2.吉林省中医药科学院 药效毒理评价中心,吉林长春 130012;3.敦化市市场监督管理局,吉林敦化 133700)
林蛙油(Oviductus Ranae,OR),中药名哈蟆油,为中国林蛙(Rana temporaria chensinesisDavid)雌蛙输卵管干制品,是珍贵的保健品。现代药理研究表明,林蛙油中富含多种生物活性物质,在抗疲劳、抗氧化、增强免疫力方面有一定的功效[1-2],在改善女性更年期综合征方面效果良好[3-4]。动物研究中发现林蛙油对大鼠体内雌激素水平具有显著提高的作用,并且其作用机理与卵巢卵泡发育有着密不可分的关系[5-7]。
课题组为研究林蛙油的雌激素样作用已开展了几个阶段的研究:在第一阶段研究中发现[8]林蛙油对去卵巢大鼠不体现出雌激素样作用,由此发现林蛙油的雌激素样作用功能依赖于卵巢,很可能是调节卵巢而产生的作用,且林蛙油的雌激素样作用与外源雌激素作用不同,是通过影响卵巢内生长期卵泡发育程度导致血清雌激素水平提升的结果。为进一步探讨林蛙油的雌激素样机制,第二阶段进行了林蛙油对卵泡发育障碍大鼠和正常大鼠卵泡发育的研究,在卵泡发育障碍模型中发现[9],林蛙油能够促进大鼠卵巢PI3K蛋白表达及Akt 蛋白磷酸化水平,能够下调卵泡发育障碍的大鼠卵巢内PTEN mRNA 表达,上调PI3K蛋白表达,促进Akt 蛋白磷酸化水平升高。在林蛙油对卵泡发育的影响中发现[10],大鼠连续灌胃林蛙油8 周后,血清激素、卵巢组织学变化和怀胎情况,均出现了卵巢过度刺激进而呈现早衰的现象,PI3K/Akt 信号通路在mRNA 水平上有上调作用;经过前期一系列研究发现林蛙油的雌激素样作用可能是刺激大鼠卵巢并与卵泡的生长发育相关。
转录组测序(RNA sequencing,RNA-Seq)技术是一种新型高通量测序技术,可以对细胞或组织的转录组进行全面研究,可以同时测量数千个基因的表达水平并提供特定的功能途径与生物过程[11]。近年来对卵巢的转录组测序研究中发现了幼鼠与成年鼠卵巢的转录组差异,结果发现一些调节卵泡发育的关键基因与重要的功能通路如细胞调亡等[12];以及应用转录组学技术探索了环磷酰胺代谢产物损伤卵巢颗粒细胞的差异表达基因与信号通路的影响等[13]。
本次研究中,选用环磷酰胺(Cyclophosphamide,CTX)造模建立大鼠卵泡发育障碍模型,依据前期实验经验选择林蛙油生物活性较好的灌胃周期,进一步通过转录组学角度分析林蛙油的雌激素样作用对卵泡发育的影响并探索除PI3K/Akt 信号通路以外的可能涉及到的信号通路,为林蛙油的雌激素样作用机制研究提供充足的理论及实验依据。
1 材料与方法
1.1 材料与仪器
Wistar 大鼠 SPF 级、雌性、体质量190±20 g、60 只,购自辽宁长生生物技术股份有限公司,动物合格证号SCXK(辽)2020-0001;林蛙油 通化德正堂野生资源开发有限公司,经吉林省中医药科学院邸琳主任药师鉴定为中国林蛙(Rana chensinesis)雌蛙输卵管干制品;环磷酰胺 大连美仑生物技术有限公司;戊酸雌二醇 DELPHARM Lille SAS;克罗米芬片 塞浦路斯Medochemie Ltd 公司;醋酸甲地孕酮分散片 青岛国海生物制药有限公司;革兰氏染色液(快速法) 珠海贝索生物技术有限公司;雌二醇(Estradiol,E2)、孕酮(Progesterone,P)、促黄体生成素(Luteinizing hormone,LH)、促卵泡生成素(Follicle stimulating hormone,FSH)、睾酮(Testosterone,T)放射免疫法试剂盒 北京北方生物技术研究所有限公司;戊巴比妥钠 天津市光复精细化工研究所;甲醛 分析纯,辽宁泉瑞试剂有限公司。
XH 6080 型放免仪 西安核仪器厂;HC-3618R 高速冷冻离心机 安徽中科中佳科学仪器有限公司;JA 2003 B 型千分之一电子天平 上海越平科学仪器有限公司;Y-2000 型电子天平 常熟双杰测试仪器厂;L18-Y928 型搅拌机 九阳股份有限公司;CX 23 型光学显微镜 日本Olympus 公司。
1.2 实验方法
1.2.1 动物分组与给药 SPF 级雌性Wistar 大鼠60 只,体质量190±20 g,饲养条件:动物室温度20~26 ℃,相对湿度55%~70%,12 h 明/暗循环,自由进食及饮水,实验动物饲养于吉林省中医药科学院实验动物SPF 级屏障系统IVC 笼具内,本实验由吉林省中医药科学院实验动物伦理委员会审核通过(批准号 JLSZKYDWLL2021-012),符合实验动物伦理委员会规定。所有大鼠适应性饲养一周后行阴道涂片,选择发情周期明确且周期在 4~5 d 的大鼠随机分为对照组(C)、模型组(M)、阳性药组(P)、林蛙油低(ORL)、高(ORH)剂量组,每组12 只大鼠。对照组腹腔注射等体积生理盐水,除对照组外,其余大鼠均腹腔注射环磷酰胺14 d(首日100 mg/kg,后续10 mg/kg)建立卵巢损伤大鼠模型;造模次日,林蛙油低、高剂量组以200、400 mg/kg 灌胃剂量灌胃林蛙油溶液,阳性药组选用人工周期加促排卵治疗方式,每5 d 为一个治疗循环,前3 d 灌胃戊酸雌二醇溶液0.1 mg/kg、第4 d 灌胃戊酸雌二醇溶液0.1 mg/kg 和醋酸甲地孕酮溶液0.8 mg/kg、第5 d 不给药。末次给药前2 d 灌胃枸橼酸氯米芬溶液10 mg/kg 直至处理;对照组灌胃等体积蒸馏水,各组大鼠每次灌胃体积均为20 mL/kg,连续灌胃14~16 d(依据处理时期,灌胃时长之调整),每间隔3 d 称量体质量。
1.2.2 动物处理及取材 自造模10 日起各组大鼠每日制作阴道涂片判断大鼠所在发情时期[14],从而计算发情周期。选择灌胃达到14 d 以上且同时处于发情前期的大鼠处理。末次灌胃2 h 后,大鼠3%戊巴比妥钠(30 mg/kg)麻醉后腹主动脉采血,3000 r/min 离心10 min,取血清-20 ℃保存备用。摘取子宫、卵巢,称量重量计算器官指数(器官指数=器官重量/体质量×1000),一侧卵巢及子宫4%多聚甲醛固定保存备用,另一侧卵巢液氮保存备用。
1.2.3 血清性激素检测 取大鼠血清,依照放免法试剂盒说明书中步骤操作,测定其中E2、P、T、FSH、LH 含量。
1.2.4 卵巢及子宫组织病理学观察 取于4%多聚甲醛固定48 h 后的卵巢及子宫,常规脱水,石蜡包埋,连续切片,苏木素-伊红(HE)染色后,中性树胶封片。全切片扫描观察卵巢及子宫组织的形态学变化,计算卵巢的窦前卵泡、窦状卵泡、成熟卵泡及黄体数目并测定各组子宫内膜厚度。
1.2.5 转录组测序及数据分析 提取各组大鼠卵巢组织(每组随机选取3 只)总RNA,经检测合格后用于RNA-seq。构建cDNA 文库,利用Illumina Nova-Seq 6000 型测序平台进行高通量测序,FastQC 评估原始测序数据质量,过滤得到Clean reads。使用TopHat2 的升级版HISAT2(http://ccb.jhu.edu/software/hisat2/index.shtml)软件将过滤后的 Reads 比对到参考基因组上。随后进行参考基因比对、冗杂序列分析、均一性分布及基因覆盖率等分析。样本处理、上机测序及数据可视化分析均由上海派森诺生物科技股份有限公司协助完成。
1.2.6 差异表达基因(Differentially expressed genes,DEGs)筛选 采用DESeq 基于负二项分布对基因表达进行差异分析,筛选差异表达基因条件为:表达差异倍数 |log2FoldChange|>1,显著性P<0.05。筛选后分别得到模型组与对照组DEGs、阳性药组与模型组DEGs,林蛙油低、高剂量与模型组DEGs。利用派森诺基因云绘制火山图,韦恩图及热图。
1.2.7 GO 功能和KEGG 富集分析 基于基因本体数据库(Gene Ontology,GO)与京都基因与基因组百科全书数据库(KEGG),进行GO 及KEGG 富集分析,找出与整个基因组背景相比,差异基因显著富集的GO term 与KEGG pathway;并综合分析结果,以确定差异基因行使的主要生物学功能。
1.3 数据处理
使用SPSS 20.0 进行统计学分析,数据用以均数±标准差()表示,多样本均数间比较采用Oneway ANOVA,两组间比较采用t检验,以P<0.05表示差异有统计学意义。
2 结果与分析
2.1 大鼠一般情况观察
如表1 所示,对照组大鼠精神状态良好,活动敏捷,皮毛光滑,反应灵敏;模型组大鼠随造模时间延长,活动减少,多数时间呈蜷缩状,精神萎靡,皮毛黯淡,与对照组相比,体质量极显著减轻(P<0.01);阳性药组大鼠给药一段时间后,反应较敏捷,皮毛稍有光泽,暴躁易怒,体质量与模型组相比无显著性差异;林蛙油低、高剂量组大鼠给药一段时间后,精神状态良好,皮毛光滑,活动量相对增多,体质量相比模型组有上升趋势但无显著性差异。
表1 各组大鼠体质量(,n=12)Table 1 Body weight of rats in each group (,n=12)
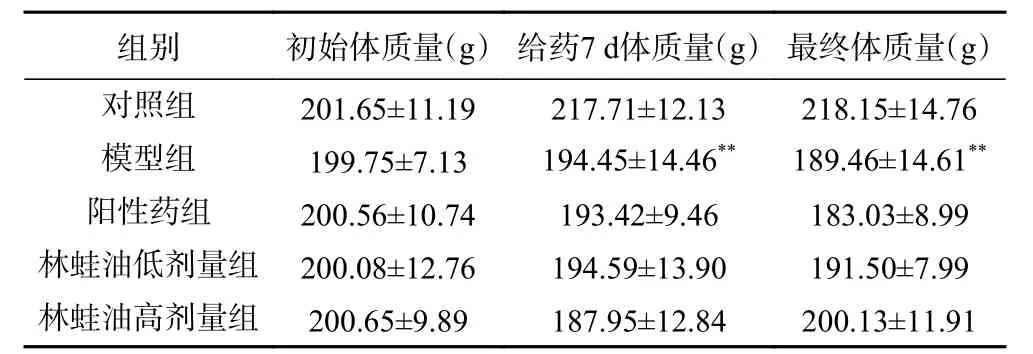
表1 各组大鼠体质量(,n=12)Table 1 Body weight of rats in each group (,n=12)
注:与对照组大鼠比较,*P<0.05,**P<0.01;与模型组大鼠比较,#P<0.05,##P<0.01;表2~表4同。
2.2 林蛙油对大鼠卵巢、子宫湿重及器官指数的影响
如表2 所示,与对照组相比,模型组大鼠卵巢、子宫质量以及卵巢指数均降低,具有极显著差异(P<0.01),子宫指数显著降低(P<0.05);与模型组相比,阳性药组大鼠子宫质量以及子宫指数均升高,具有极显著差异(P<0.01);林蛙油低剂量组大鼠子宫质量以及子宫指数均显著升高(P<0.05),林蛙油高剂量组大鼠子宫质量以及子宫指数均升高,具有极显著差异(P<0.01)。
表2 各组大鼠卵巢、子宫湿重及器官指数(,n=12)Table 2 Ovarian,uterine wet weight and organ index of rats in each group (,n=12)
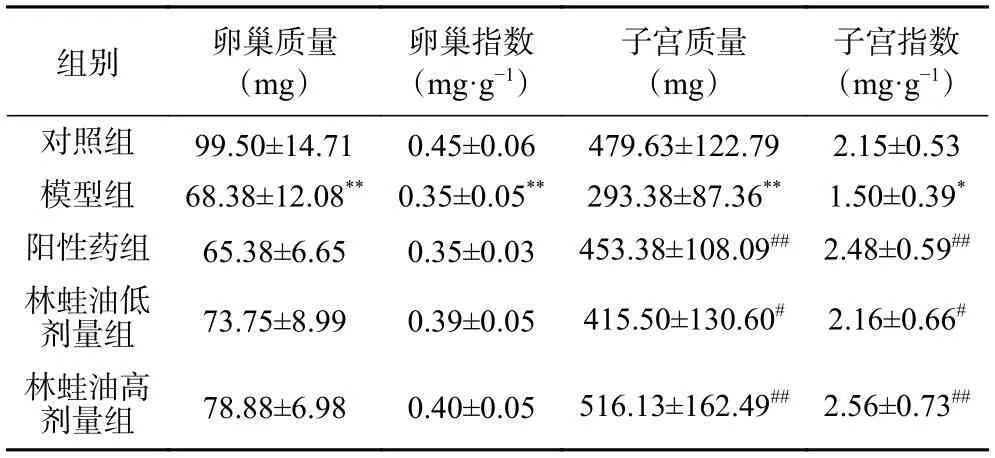
表2 各组大鼠卵巢、子宫湿重及器官指数(,n=12)Table 2 Ovarian,uterine wet weight and organ index of rats in each group (,n=12)
2.3 林蛙油对大鼠血清性激素含量的影响
如表3 所示,与对照组相比,模型组大鼠血清中FSH、LH 含量显著上升,P、T、E2含量显著降低(P<0.05)。与模型组相比,阳性药组大鼠血清中FSH、LH 含量显著降低(P<0.05),P、T 含量显著上升(P<0.05),E2含量上升,差异有极显著性(P<0.01);林蛙油低剂量组大鼠血清中FSH、LH 含量显著降低(P<0.05),P、T、E2含量显著上升(P<0.05);林蛙油高剂量组大鼠血清中FSH 含量显著降低(P<0.05),P 含量显著上升(P<0.05),E2含量上升,差异有极显著性(P<0.01)。
表3 各组大鼠血清性激素含量(,n=8)Table 3 Serum sex hormone levels of rats in each group(,n=8)
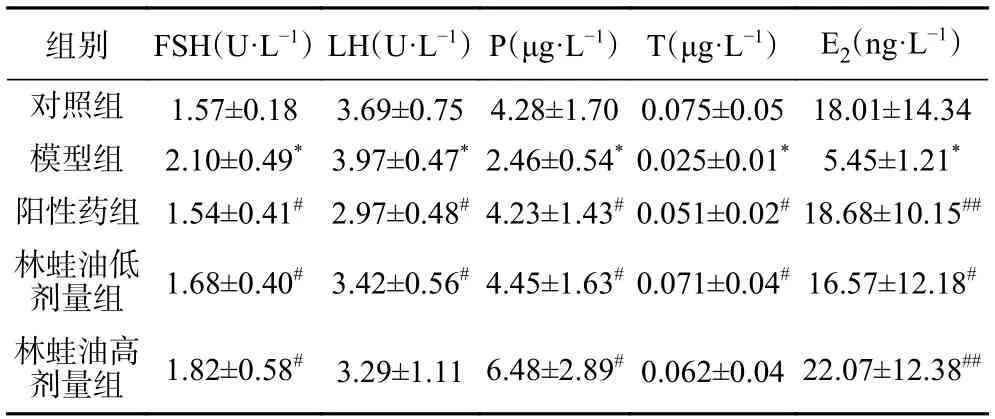
表3 各组大鼠血清性激素含量(,n=8)Table 3 Serum sex hormone levels of rats in each group(,n=8)
综合表2、表3 数据可知,环磷酰胺可导致大鼠的FSH、LH 水平上升,P、E2水平降低,可能因其直接的靶器官毒性导致卵巢萎缩以及子宫无法响应周期而增厚,表明腹腔注射环磷酰胺致卵巢损伤模型造模成功;阳性药组通过外源激素补充的方式提高了大鼠血清中孕激素和雌激素含量,从而对子宫起到了保护作用但对于卵巢没有明显改善,而林蛙油组表现出与阳性药类似的子宫保护作用,同时对卵巢也有一定的保护作用。
2.4 林蛙油对大鼠卵巢、子宫组织病理形态的影响
如表4、图1、图2 所示,对照组大鼠卵巢可见皮质髓质结构清晰,皮质内可见不同发育阶段的各级卵泡和新鲜黄体,颗粒细胞饱满丰富,髓质层内可见丰富血管;子宫切片镜下可见子宫内膜较厚,子宫腔大,腺体及结缔组织丰富。

图1 林蛙油对大鼠卵巢病理的影响(HE,40×)Fig.1 Effect of Oviductus Ranae on ovarian histopathology in rats (HE,40×)
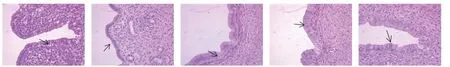
图2 林蛙油对大鼠子宫病理的影响(HE,400×)Fig.2 Effect of Oviductus Ranae on uterine histopathology in rats (HE,400×)
表4 各组大鼠各级卵泡数量及子宫内膜厚度(,n=6)Table 4 Number of follicles at each level and endometrial thickness in each group of rats (,n=6)
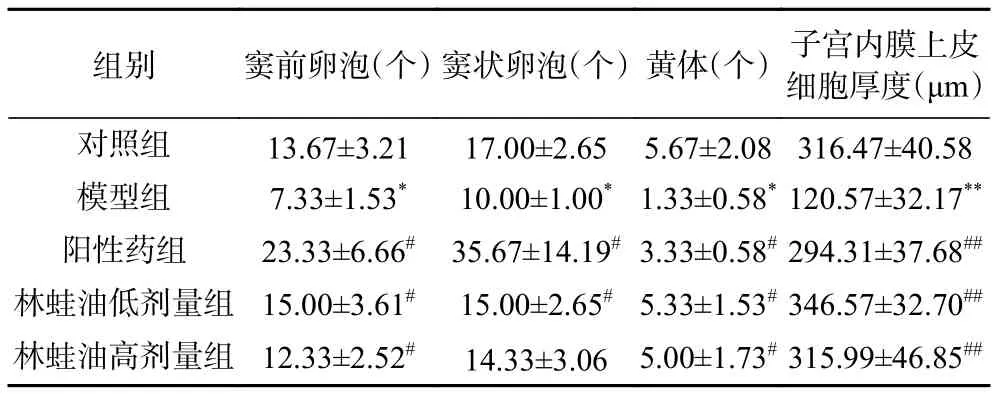
表4 各组大鼠各级卵泡数量及子宫内膜厚度(,n=6)Table 4 Number of follicles at each level and endometrial thickness in each group of rats (,n=6)
与对照组相比,模型组大鼠卵巢切片镜下可见卵巢体积明显萎缩,卵泡发育不良,无成熟卵泡,颗粒细胞排列稀疏,窦前、窦状卵泡、黄体数量显著减少(P<0.05);子宫切片镜下可见腺体数量减少,子宫内膜呈单层立方上皮,子宫内膜上皮细胞厚度变薄,差异有极显著性(P<0.01),基质中血管少,基质细胞数量少、子宫间质萎缩,结缔组织不丰富。表明环磷酰胺对卵泡数量及子宫均有负面影响,本实验卵巢损伤模型成立。
与模型组相比,大鼠卵巢切片镜下可见阳性药组和林蛙油低剂量组窦前、窦状卵泡、黄体数量显著增多(P<0.05),林蛙油高剂量组窦前卵泡、黄体数量显著增多(P<0.05);大鼠子宫切片镜下可见阳性药组、林蛙油低、高剂量组子宫内膜上皮细胞厚度均增加,差异有极显著性(P<0.01);表明阳性药及林蛙油均能改善环磷酰胺所致的卵泡与子宫的发育障碍,促进窦前、窦状卵泡的生长发育,改善子宫组织结构。阳性药组大鼠的窦前、窦状卵泡数量的显著提升提示可能与实验末期给予的枸橼酸氯米芬刺激卵泡发育有关。
2.5 转录组测序数据分析
结果显示各实验组样本可比对到参考基因组上的序列占总序列的比例均大于96%,Q30(测序质量分数大于30 的碱基占所有碱基的百分数)均大于93%,表明测序质量良好,测序数据准确可靠。见表5。
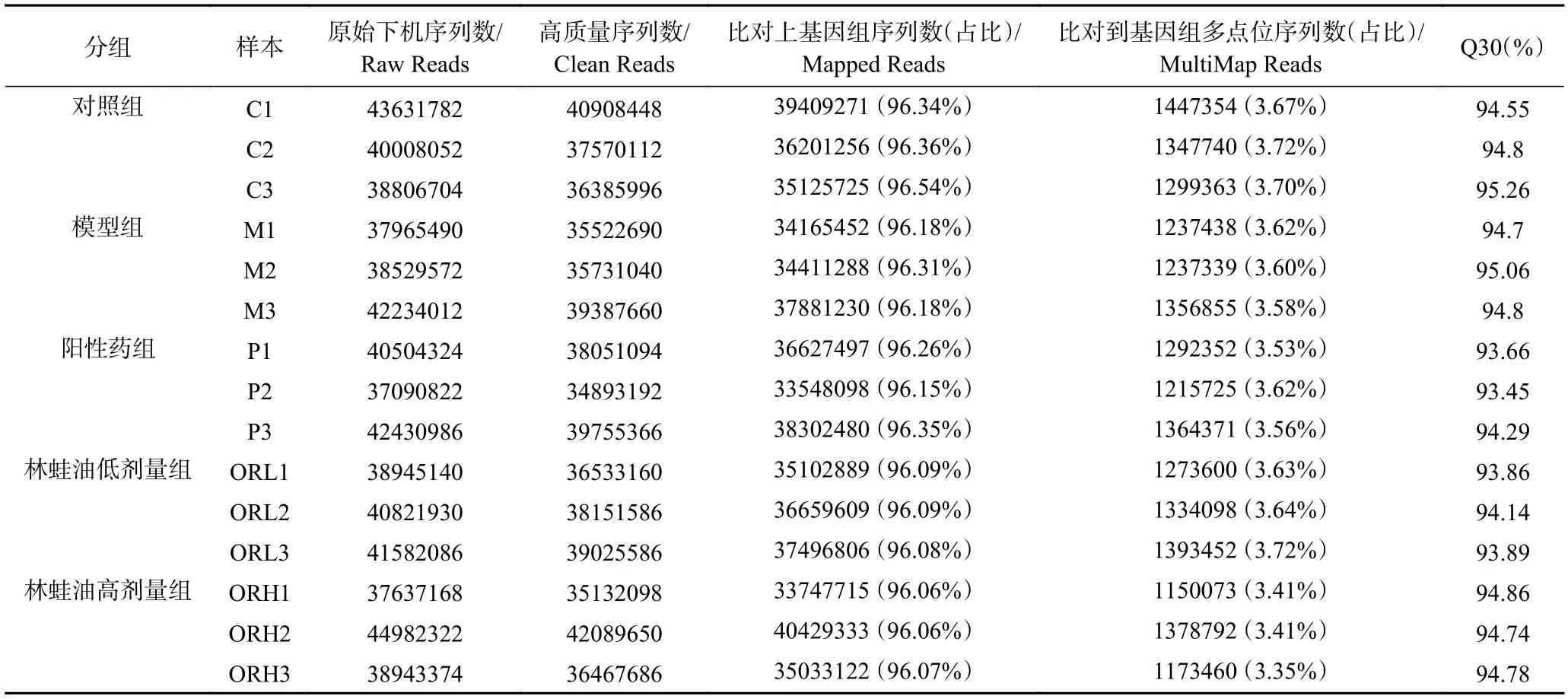
表5 Clean reads 的质量与比对结果Table 5 Quality of Clean reads and comparison results
2.6 分析差异表达基因
如图3A 所示,与对照组相比,模型组DEGs共1024 个,其中458 个基因表达上调,566 个基因表达下调。如图3B 所示,与模型组相比,阳性药组DEGs 共353 个,其中190 个基因表达上调,163 个基因表达下调。如图3C 所示,与模型组相比,林蛙油低剂量组DEGs 共738 个,其中233 个基因表达上调,505 个基因表达下调。如图3D 所示,林蛙油高剂量组DEGs 共572 个,其中276 个基因表达上调,296 个基因表达下调。结果提示其可能为林蛙油对卵巢损伤大鼠卵泡发育的作用靶点。
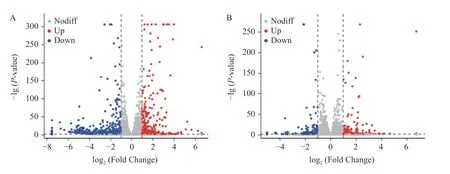
图3 林蛙油对卵巢损伤大鼠差异表达基因(DEGs)的影响Fig.3 Effect of Oviductus Ranae on differentially expressed genes (DEGs) in ovarian-injured rats
如图3E、3F 所示,对各组差异基因进行韦恩图分析发现,四对差异比较中的共同交集基因共有71 个,对照/模型组与林蛙油低剂量/模型组和林蛙油高剂量/模型组之间成对的差异基因的共同交集基因分别有173、108 个,而对照/模型组与阳性药/模型组之间成对的差异基因的共同交集基因分别有28 个,这说明林蛙油不同剂量之间以及阳性药对卵巢损伤大鼠卵泡保护作用中,所调控的基因表达存在差异,而这种差异可能是作用的机制所在。
2.7 差异表达基因的GO 生物学功能分析
基因本体(Gene Oncology,GO)生物数据库用于对基因及其蛋白功能进行注释,主要分为生物学过程(biological process,BP)、细胞组件(cellular component,CC)和分子功能(moelcular function,MF)三个类别[15]。将各实验组DEGs 进行富集分析,结果如下。
如图4A 所示,对照组与模型组DEGs 共富集到1767 个GO 条目,其中在BP 中共富集到1357条,主要富集在免疫反应、免疫系统过程、对其他生物的反应、防御反应、对外部生物刺激的反应等途径;在CC 中共富集到159 条,主要富集在细胞外区、活动纤毛、细胞表面等途径;在MF 中共富集到251 条,主要富集在2'-5'-寡腺苷酸合成酶活性、蛋白质结合、钙离子结合等途径。
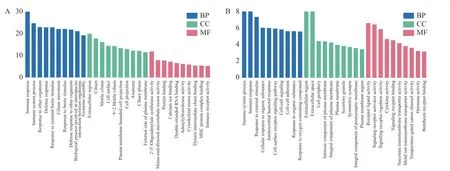
图4 差异表达基因GO 富集分析Fig.4 GO enrichment analysis of differentially expressed genes
如图4B 所示,阳性药组与模型组DEGs 共富集到1268 个GO 条目,其中在BP 中共富集到1023条,主要富集在免疫系统过程、免疫反应、对外部生物刺激的反应、细胞对有机物的反应等途径;在CC 中共富集到85 条,主要富集在细胞外区、细胞外间隙、质膜等途径;在MF 中共富集到160 条,主要富集在受体配体活性、信号受体激活剂活性、信号受体调节活性等途径。
如图4C、4D 所示,林蛙油低、高剂量组与模型组DEGs 分别共富集到1790、1616 个GO 条目,在BP 中分别富集到1416、1291 条,主要富集在免疫反应、防御反应、免疫系统过程、对外部生物刺激的反应、细胞黏附等途径;在CC 中分别富集到153、128 条,主要富集在细胞外区、细胞外围、细胞外间隙等途径;在MF 中分别富集到221、197 条,主要富集在细胞因子受体活性、免疫受体活性、2'-5'-寡腺苷酸合成酶活性、钙离子结合等途径。
2.8 差异表达基因的KEGG 代谢与信号通路分析
对照组与模型组DEGs 的KEGG 富集分析结果如图5A 所示,涉及到43 个信号通路,富集的重要信号通路主要包括丙型肝炎、细胞黏附分子、病毒蛋白与细胞因子和细胞因子受体的相互作用、甲型流感等。阳性药组与模型组DEGs 的KEGG 富集分析结果如图5B 所示,涉及到32 个信号通路,富集的重要信号通路主要包括JAK/STAT 信号通路、细胞因子-细胞因子受体相互作用、癌症中的转录调控异常、IL-17 信号通路等。林蛙油低、高剂量组与模型组DEGs 的KEGG 富集分析结果如图5C、5D 所示,分别涉及到47、35 个信号通路,富集的重要信号通路主要包括PI3K/Akt 信号通路、破骨细胞分化、病毒性心肌炎、B 细胞受体信号通路、IgA 产生的肠道免疫网络、抗原处理和呈递、炎症性肠病、吞噬体等。
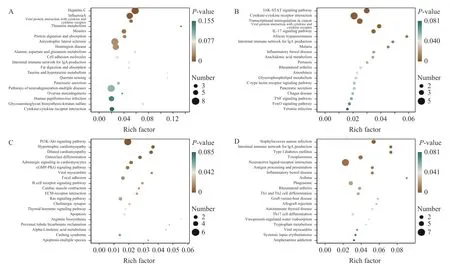
图5 差异表达基因KEGG 富集分析Fig.5 KEGG enrichment analysis of differentially expressed genes
综合GO 及KEGG 富集分析结果发现,林蛙油能够通过参与机体的代谢调节进而保护受损卵巢的功能及卵泡的发育,通过免疫反应、防御反应激活细胞外区、细胞表面上受体靶标等保护卵巢,进而通过细胞因子、黏附因子、分泌因子等介导卵巢内细胞间、细胞与细胞外基质的相互作用进而影响卵泡的发育,各组间比较得出的富集重要信号通路(如PI3K/Akt、B 细胞受体信号通路等)提示其可能为林蛙油对卵巢损伤大鼠卵泡发育作用的关键调控通路。
3 讨论
近年来化疗所致的女性性腺损害在临床上已达成共识[16]。在化疗药物类别中,环磷酰胺在临床中对卵巢的毒性很具代表性,并具有剂量依赖性效应[17-18],使用环磷酰胺造模为好的选择,因此本实验选用环磷酰胺为造模用药[19],并且在预实验中对环磷酰胺的剂量进行了筛选,确定了100 mg+10 mg 为最佳给药剂量,该造模剂量下,大鼠体重及器官指数下降明显,且无死亡率,可保证一定的进食饮水等生活状态。
目前关于林蛙油提升血清雌激素水平功能的研究,主要集中在林蛙油中的雌激素样物质上,多数研究认为服用后雌激素水平升高是通过外源性摄入林蛙油中的雌激素样物质所起的作用,关于外源激素制备大鼠高雌激素血症模型的研究中[20]发现从外源激素机制考虑,林蛙油中的雌二醇不足以将服用者血清雌二醇含量显著提升。前期实验室研究[8]已证实正常大鼠服用林蛙油后血清雌二醇显著上升,但各器官指数却没有显著的变化,并不符合使用外源雌激素的结果。提示林蛙油确实有作用于性腺轴中“垂体-卵巢”部分的内源途径来提升机体雌激素。
本研究结果显示,林蛙油及阳性药均能改善造模对大鼠子宫指标的影响,对卵巢指标也有改善的趋势;病理方面提示林蛙油及阳性药的干预能缓解卵泡因发育不完整而导致闭锁无法正常排卵,导致雌激素减少这一进程,从而保护卵巢与子宫功能,且林蛙油的干预效果更趋近于正常对照组;激素水平方面提示林蛙油和阳性药干预后大鼠血清中 FSH、LH 含量下降,P、E2含量上升,进一步证明了林蛙油对卵巢功能及卵泡发育的促进作用,以上指标均证明环磷酰胺对卵巢功能的影响,提示卵巢损伤模型复刻成功,同时验证了林蛙油对卵巢损伤大鼠卵泡发育的促进作用,与前期研究阶段结果一致。
转录组学方面GO 及KEGG 富集结果可证实林蛙油及阳性药对卵巢保护作用的途径存在不同,与对照组相比,模型组富集结果说明环磷酰胺对大鼠细胞产生了烷化作用,可能导致细胞的RNA 发生改变[21],使胞外功能出现障碍,抗病毒的能力下降从而导致免疫能力下降,从而导致各个器官的发育障碍;与模型组相比,林蛙油低、高剂量组富集结果提示林蛙油可能通过免疫系统反应和防御反应等生物学过程,调节细胞外区、免疫受体活性、细胞因子活性等功能对卵巢损伤大鼠卵泡发育有促进作用,且PI3K/Akt、B 细胞受体、抗原处理和呈递等通路可能为其作用的主要调控机制。阳性药组富集结果提示阳性药通过参与大鼠体内的免疫系统过程,进而影响细胞外区功能及改善受体配体活性来改善卵巢损伤情况,JAK/STAT、IL-17 等信号通路可能为其作用的主要调控机制。
体内各种细胞因子、内分泌因子的调控作用是必不可少的,它们共同作用决定卵母细胞及不同发育阶段卵泡的存活或凋亡[22];机体中有两条经典的细胞凋亡途径,分别是细胞外途径和细胞内途径[23-24]。卵巢+局部多因子调节系统和网络以旁分泌、自分泌形式参与卵巢周期性优势卵泡选择、排卵、性激素合成等[25]。黏附因子通过介导卵巢内细胞间、细胞与细胞外基质的相互作用进而影响卵泡的发育[26]。PI3K作为细胞内非常重要的信号转导分子,PI3K 蛋白在卵巢内的表达含量能够反映卵巢的发育状态[27-28]。Akt 能够激活细胞凋亡级联反应中调控蛋白,增强抗凋亡基因的表达,通过磷酸化多种转录因子,抑制凋亡基因的表达,促进细胞生长[29-30]。本研究中林蛙油组在PI3K/Akt 信号通路有显著富集,由此认为PI3K/Akt、B 细胞受体等信号通路可能为林蛙油雌激素样作用的主要调控机制,林蛙油的雌激素样作用可能通过免疫系统反应和防御反应等生物学过程,调节细胞外区、免疫受体活性、细胞因子活性等功能对卵巢损伤大鼠卵泡发育起到保护作用,且该结论与前阶段实验相一致。
4 结论
综上所述,林蛙油能有效改善环磷酰胺所致的卵巢损伤大鼠的血清性激素水平、卵巢卵泡发育情况、子宫内膜萎缩等情况,其分子机制可能与PI3K/Akt、B 细胞受体等通路及基因有关。本研究从整体水平揭示了林蛙油对卵巢损伤大鼠卵泡发育改善情况的转录组学特征,为林蛙油的雌激素样作用机制提供了理论与实验依据,为后续实验提供了研究基础。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

