马齿苋中吲哚类生物碱的生物活性研究
兰秀娟 郭胜男 王金焕 王呈玉 英锡相

【摘 要】 目的:研究马齿苋中分离所得吲哚类生物碱的抗胆碱酯酶活性及抗氧化活性。方法:采用改良的Ellman法测定各化合物的抗胆碱酯酶活性,通过测量吸光度值计算化合物的胆碱酯酶抑制率,并计算IC50值;采用DPPH自由基清除法测定各化合物的抗氧化活性,通过测量吸光度值计算化合物的DPPH清除率,并计算IC50值。结果:马齿苋中oleraindole A-oleraindole G均有抗胆碱酯酶活性,其中,oleraindole B 抗胆碱酯酶作用的IC50值为40.22 μM,与阳性药毒扁豆碱(IC50=37.92 μM)的活性相当;oleraindole A、B、C、D和G均具有抗氧化活性,其中,oleraindole C和oleraindole A抗氧化作用的IC50值分别为7.49 μM和9.68 μM,远远优于阳性药BHA的活性(IC50=37.81 μM)。结论:oleraindole B抗胆碱酯酶活性较强,oleraindole C和oleraindole A抗氧化活性较优,可为马齿苋生物碱的深入研究提供科学依据。
【关键词】 马齿苋;吲哚类生物碱;生物活性
【中图分类号】R285.5 【文献标志码】 A【文章编号】1007-8517(2024)05-0020-05
DOI:10.3969/j.issn.1007-8517.2024.05.zgmzmjyyzz202405005
Study on the Biological Activities of Indole Alkaloids in Portulaca Oleracea L.
LAN Xiujuan GUO Shengnan WANG Jinhuan WANG Chengyu YING Xixiang*
Abstract:Objective To investigate the anticholinesterase activity and antioxidant activity of the indole alkaloids isolated from Portulaca oleracea L.. Methods The anticholinesterase activity of the compounds was determined by the modified Ellmans method, and the IC50 values were calculated by measuring the absorbance values. The antioxidant activity of the compounds was determined by the DPPH radical scavenging method, and the IC50 values were calculated by measuring the absorbance values. Results The results showed that oleraindole A-oleraindole G all had anticholinesterase activity, among which, the IC50 value of the anticholinesterase effect of oleraindole B was 40.22 μM, which was comparable to the activity of the positive drug eserine (IC50=37.92 μM); oleraindole A, B, C, D and G all had antioxidant activity, among which, the IC50 values of oleraindole C and oleraindole A were 7.49 μM and 9.68 μM, respectively, which were much better than the activity of the positive drug BHA (IC50=37.81 μM).Conclusion The stronger anticholinesterase activity of oleraindole B and the superior antioxidant activity of oleraindole C and oleraindole A could provide a scientific basis for the in-depth study of Portulaca oleracea L..
Keywords:Portulaca oleracea L.; Indole Alkaloids; Biological Activities
馬齿苋(Portulaca oleracea L.)为马齿苋科马齿苋属一年生草本植物,又名长命菜、五行草等,为药食两用植物[1]。马齿苋生命力顽强,分布范围广泛,多见于田野路边,被世界卫生组织(WHO)列为世界上应用最广泛的药用植物之一[2-3]。马齿苋作为传统中药已经有上千年的历史,其味酸、性寒,归肝、大肠经,具有清热解毒、凉血止血、止痢的功效。马齿苋中含有多种化学成分,如生物碱[4-6]、黄酮[7, 8]、有机酸[9]、萜类[10]等,具有抗氧化[11]、抗乙酰胆碱酯酶[12]、抗炎[13]等多种药理活性。课题组长期从事马齿苋研究工作,其中生物碱类成分为马齿苋活性成分之一,本文对课题组分离得到的吲哚类生物碱进行生物活性研究。
阿尔茨海默病(alzheimers disease,AD)是一种神经系统退行性疾病,主要表现为记忆障碍、认知障碍和行为异常等症状,给患者身体带来伤害,严重影响生活质量[14]。研究[15]表明,抑制胆碱酯酶可以使乙酰胆碱堆积,兴奋胆碱受体,改善AD患者学习和记忆能力。因此,本文对实验室分离的马齿苋吲哚类生物碱进行了抗胆碱酯酶活性研究,为AD药物的进一步研究提供实验基础。此外,自由基氧化损伤被认为是中枢神经系统疾病(如帕金森、AD等)的重要因素[16],抗氧化作用可以作为中枢神经系统疾病的潜在治疗方法,故本文还对马齿苋中吲哚类生物碱进行了抗氧化活性研究,期望为马齿苋中生物碱成分的深入研究提供科学基础。
1 材料
1.1 实验材料及试剂 Oleraindole A、Oleraindole B、Oleraindole C、Oleraindole D、Oleraindole E、Oleraindole F及Oleraindole G(均由本实验室分离所得,纯度>97%),毒扁豆碱(上海瀚翔生物科技有限公司),碘代硫化乙酰胆碱(ATCI)和乙酰胆碱酯酶(AChE)(大连美伦生物科技有限公司),二硫代二硝基甲酸(DTNB)(上海金水生物科技有限公司),磷酸氢二钠和磷酸二氢钠(上海国药控股试剂有限公司),1,1-二苯基-2-苦基肼自由基(DPPH)(美国sigma公司),丁基羟基茴香醚(BHA)(上海祥瑞生物有限公司),甲醇(色谱纯,天津市凯信化学工业有限公司)
1.2 实验仪器与设备 HBS-1096A96孔酶标仪(南京德铁实验设备有限公司),Hitachi UV-3010型紫外可见分光光度计(日本日立公司),十万分之一天平(瑞士METTLER),HH-4型数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司)。
2 方法
2.1 抗胆碱酯酶试验 本实验根据改良的Ellman法测定各个化合物的抗胆碱酯酶活性。精密称取oleraindole系列化合物及毒扁豆碱,用甲醇配制成五个系列浓度31.25 μM、62.5 μM、125 μM、250 μM和500 μM的样品溶液。具体操作如下:于96孔酶标板中加入140 μL的磷酸缓冲盐溶液(0.1 M,pH=8.0,包含0.1 moL/L磷酸氢二钠和磷酸二氢钠),20 μL的样品溶液,15 μL的AChE(0.2 U/mL),于37 ℃下孵育10 min后,加入10 μL的ATCI(15 mmoL/L)和10 μL的DTNB(15 mmoL/L),于37 ℃下孵育20 min后,将96孔板置于酶标仪中,在405 nm波长下测量各组样品的吸光度值。其中,以甲醇代替样品溶液作为空白组,以毒扁豆碱代替样品溶液作为阳性对照组。各化合物胆碱酯酶抑制率按下列公式计算(A代表吸光度):
抑制率(%)=(A空白-A样品)/A空白×100%
2.2 抗氧化试验 本实验使用DPPH自由基清除法测定各个化合物的抗氧化活性。精密称取oleraindole系列化合物及BHA,用甲醇配制成10 μM、20 μM、30 μM、50 μM和100 μM五个系列浓度的样品溶液。此外,DPPH溶液现用现配,精密称取适量DPPH,用甲醇配制成浓度为80 μM的溶液,全程避光操作。具体操作如下:将1 mL的样品溶液与1 mL的DPPH溶液充分混合,于室温、避光环境下放置10 min,将紫外分光光度计检测波长设置为517 nm后,测量样品的吸光度值。其中,以甲醇代替样品溶液作为空白组,以BHA代替样品溶液作为阳性对照组,以1 mL甲醇与1 mL样品溶液的混合溶液作为对照组。各化合物DPPH清除率按下列公式计算(A代表吸光度):
DPPH清除率(%)=[1-(A样品-A对照)/A空白]× 100%
3 结果
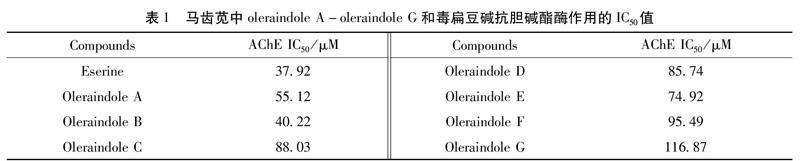
3.1 各化合物抗胆碱酯酶活性 马齿苋中oleraindole A-oleraindole G的化学结构如图1所示,其抗胆碱酯酶活性结果如图2所示,从活性结果中可以看出,oleraindole A至oleraindole G均表现出一定的抗胆碱酯酶活性,且各化合物对胆碱酯酶的抑制作用随着化合物浓度的增大而增强,呈剂量依赖性的趋势。
表1所示结果为各化合物抗胆碱酯酶作用的IC50值,由此结果可知,oleraindole B 的抗胆碱酯酶活性最强,其IC50值为40.22 μM,与阳性药毒扁豆碱(IC50=37.92 μM)的活性相当。在苷元结构中,Oleraindole A 的活性次之,而在苯环上有两个羟基取代的oleraindole C活性最弱。与苷元oleraindole B和oleraindole A 的活性相比,其苷类结构即oleraindole E 、oleraindole D、oleraindole F和oleraindole G的活性均下降。
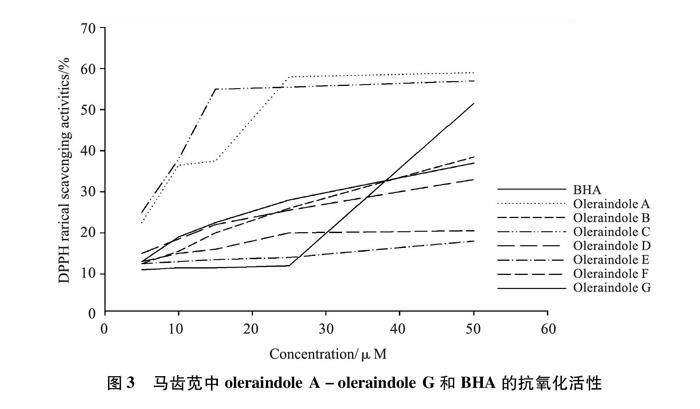
3.2 各化合物抗氧化活性 马齿苋中oleraindole A-oleraindole G的抗氧化活性结果如图3所示,从活性结果中可以看出,oleraindole A、oleraindole B、oleraindole C、oleraindole D、oleraindole G均表现出了较强的抗氧化活性,且各化合物的抗氧化作用随着化合物浓度的增大而增强,呈剂量依赖性的趋势。
表2所示结果为各化合物抗氧化作用的IC50值,由此结果可知,oleraindole C的抗氧化活性最强(IC50=7.49 μM),oleraindole A的活性次之(IC50=9.68 μM),且二者的抗氧化活性均优于阳性药BHA(IC50=37.81 μM)。在苷元结构中,oleraindole B的活性最弱(IC50=42.10 μM)。与苷元oleraindole A和oleraindole B的活性相比,其苷类结构中,oleraindole G(IC50=41.87 μM)和oleraindole D(IC50=62.30 μM)表现出较强的抗氧化活性,而oleraindole F和oleraindole E的活性明显降低。
4 讨论
马齿苋作为传统中药已经有上千年历史,其具有化学成分多样性和药理活性多样性的特点,受到了学者们的关注。课题组长期从事马齿苋相关研究工作,从马齿苋当中分离出了多种化学成分,生物碱类化学成分作为马齿苋活性成分之一,有必要對其生物活性进行研究。
AD又称老年痴呆,是一种进行性发展的神经退行性疾病,临床上表现为记忆障碍、执行功能障碍、行为改变、人格改变等特征,病因迄今未明。胆碱能系统改变与AD的认知功能损害程度密切相关,通过抑制胆碱酯酶来增强胆碱能神经传递是治疗AD的有效方法之一[17]。研究[18]表明,生物碱类常表现出乙酰胆碱酯酶抑制作用,具有治疗AD的潜力,故本实验对马齿苋中吲哚类生物碱进行抗胆碱酯酶活性研究。实验结果显示oleraindole B的抗胆碱酯酶活性最优,oleraindole A的活性次之,oleraindole C的活性明显下降,通过比较各化合物化学结构的特点,可以推断化学结构中-3″位置的取代基对活性影响较大,其中,当-3″位置为疏水基团甲氧基取代时,oleraindole B的活性最优;当-3″位置无取代基团时,oleraindole A的活性次之;而当-3″位置为亲水基团羟基取代时,oleraindole C的活性则明显下降。与苷元结构相比,oleraindole D至oleraindole G的抗胆碱酯酶活性均下降,说明oleraindole系列的糖苷形式不利于化合物抗胆碱酯酶活性的发挥。
細胞受到氧化损伤是中枢神经系统疾病(如精神分裂、帕金森氏症、脑瘫阿尔茨海默病)发生的重要因素,抗氧化作用可作为中枢神经系统疾病治疗的潜在手段,且研究[19]表明含有酚羟基基团的生物碱类化学成分常具有较强的抗氧化活性。因此,本实验对马齿苋中吲哚类生物碱进行抗氧化活性研究。实验结果显示oleraindole C的抗氧化活性最优,其化学结构中-3″和-4″位置含有两个酚羟基;oleraindole A的-3″位置无酚羟基取代,其活性次之;而oleraindole B的-3″位置为供电子集团甲氧基,使其抗氧化活性下降。与苷元结构相比,oleraindole D-oleraindole G的抗氧化活性均下降,其中,oleraindole G的-6位有两个葡萄糖取代,其抗氧化活性与oleraindole B的活性相当。上述活性结果提示生物碱抗氧化活性与其结构中酚羟基的个数相关,酚羟基个数越多,抗氧化活性越强。
本实验对马齿苋中吲哚类生物碱oleraindole A-oleraindole G进行了抗胆碱酯酶活性及抗氧化活性研究,发现oleraindole A既表现出较强的抗胆碱酯酶活性,又表现出较优的抗氧化活性,具有进一步研究的价值。此外,oleraindole B抗胆碱酯酶活性最佳,oleraindole C抗氧化活性最佳,该实验结果可为吲哚类生物碱的深入研究提供科学依据。
参考文献
[1]TIAN J L, LIANG X. Chemical contituents of Portulaca oleracea[J]. Chem Nat Compd, 2015, 51(4):760-761.
[2]ZHOU Y X, XIN H L, RAHMAN K, et al. Portulaca oleracea L.:A review of phytochemistry and pharmacological effects[J]. Biomed Res Int, 2015(2015):925631.
[3]XU X Q, YU L S, CHEN G N. Determination of flavonoids in Portulaca oleracea L. by capillary electrophoresis with electrochemical detection[J]. J Pharm Biomed Anal, 2006, 41(2):493-499.
[4]ZHAO C C, ZHAG C G, HE F, et al. Two new alkaloids from Portulaca oleracea L. and their bioactivities[J]. Fitoterapia, 2019( 136):104166.
[5]XU W, LIU F Y, WANG H B, et al. A new indole alkaloid from Portulaca oleracea L. and its antiacetylcholinesterase activity[J]. Lat Am J Pharm, 2020, 39(3):591-595.
[6]SONG M Y, YING Z M, YING X X, et al. Three novel alkaloids from Portulaca oleracea L. and their anti-inflammatory bioactivities[J]. Fitoterapia, 2022(156):105087.
[7]YAN J, SUN L R, ZHOU Z Y, et al. Homoisofavonoids from the medicinal plant Portulaca oleracea[J]. Phytochem, 2012(80):37-41.
[8]DUAN Y, YING Z M, ZHANG M B, et al. Two new homoisoflavones from Portulaca oleracea and their activities[J]. Nat Prod Res, 2022, 36(7):1765-1773.
[9]UDDIN M K, JURAIMI A S, HOSSAIN M S, et al. Purslane weed (Portulaca oleracea):a prospective plant source of nutrition, omega-3 fatty acid, and antioxidant attributes[J]. Scientific World Journal, 2014(2014):951019.
[10]XIN H L, XU Y F, HOU Y H, et al. Two novel triterpenoids from Portulaca oleracea L.[J]. Helv Chim Acta, 2008, 91(11):2075-2080.
[11]YANG X, ZHANG W J, YING X X, et al. New flavonoids from Portulaca oleracea L.and their activities[J]. Fitoterapia, 2018(127):257-262.
[12]XU W, YING Z M, TAO X J, et al. Two new amide alkaloids from Portulaca oleracea L. and their anticholinesterase activities[J]. Nat Prod Res, 2021, 35(21):3794-3800.
[13]DUAN Y, YING Z M, HE F, et al. A new skeleton flavonoid and a new lignan from Portulaca oleracea L. and their activities[J]. Fitoterapia, 2021(153):104993.
[14]賈建平,陈生弟. 神经病学[M]. 8 版. 北京:人民卫生出版社,2018:265-270.
[15]ZKAI A G, EI-SHATOURY E H, AHEMED A S, et al. Production and enhancement of the acetylcholinesterase inhibitor, huperzine A, from an endophytic alternaria brassicae AGF041[J]. Appl microbiol biotechnol, 2019, 103(14):5867-5878.
[16]BAINS M, HALL E D. Antioxidant therapies in traumatic brain and spinal cord injury [J]. Biochim Biophys Acta, 2012, 1822(5):675-684.
[17]TALESA V N. Acetylcholinesterase in Alzheimers disease[J]. Mech Ageing Dev, 2001, 122(16):1961-1969.
[18]PEREIRA D M, FERRERES F, OLIVEIRA J M A, et al. Pharmacological effects of Catharanthus roseus root alkaloids in acetylcholinesterase inhibition and cholinergic neurotransmission[J]. Phytomedicine, 2010, 17(8-9):646-652.
[19]YANG Z J, LIU C J, XIANG L, et al. Phenolic alkaloids as a new class of antioxidants in Portulaca oleracea[J]. Phytother Res, 2009, 23(7):1032-1035.
(收稿日期:2023-06-12 编辑:刘 斌)
基金项目:辽宁省科技厅博士科研启动基金计划项目(2022-BS-198);辽宁中医药大学2021年高层次引进人才科研启动项目(2100221002)。
作者简介:兰秀娟(1991—),女,汉族,博士,讲师,研究方向为中药药效物质。E-mail:xiujuanlan@139.com
通信作者:英锡相(1964—),男,满族,博士,教授,研究方向为中药药效物质与药代动力学。E-mail:yingxixiang@163.com

