应用微量蛋白质定量分析评估临床样本炎性反应状态
叶雨昕,李慧娴,阎 涛,张 赟,孙玉琳*
国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院 北京协和医学院 肿瘤医院 1.分子肿瘤学国家重点实验室;2.麻醉科,北京 100021
不可控的炎性反应与肿瘤的发生、发展及治疗反应密切相关,是肿瘤的十四大特征之一[1]。此外,各种感染性和损伤性应激也会刺激机体产生炎性反应[2],参与各种疾病。在此过程中,外周血单核细胞的数量和活性是了解机体全身性炎性反应状态的重要窗口。大量研究表明,人类和小鼠肿瘤中外周血单核细胞数量明显升高并与不良预后相关,而其可进一步被活化,激活细胞内的炎性小体等相关信号通路,产生大量的细胞和趋化因子,影响肿瘤和疾病的转归和进程[3]。
炎性小体是机体天然免疫的重要组成部分,是由模式识别受体NLRP3、接头蛋白ASC即凋亡相关斑点样蛋白(apoptosis-associated speck-like protein)和效应蛋白pro-caspase-1组成的多聚蛋白复合物[4],其激活后产生活性caspase-1,可将下游的细胞因子前体pro-IL-1β和pro-IL-18分别转化为成熟型IL-1β和IL-18并引发一系列炎性反应[5]。通常检测全身性炎性水平的方法需要先从大量外周血中提取单核细胞,再经实时荧光定量PCR(real-time quantitative polymerase chain reaction, qPCR)或蛋白质免疫印迹(Western blot)等方法,评价炎性小体和下游相关分子的表达水平[6-10]。QPCR灵敏,所需样本量较少,但只能检测mRNA水平的变化;而传统的Western blot检测操作繁琐,对样本量要求较高,需要从比较大量的外周血中分离单核细胞并提取蛋白质,不便于临床使用。微量蛋白质定量分析系统(quantita-tive analysis of trace-level proteins)是一种用于高效、自动和准确测量生物样品中蛋白质含量的设备[11]。基于传统的Western blot,该系统将所需步骤的SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)、电转移、抗体杂交和酶联免疫显影等步骤集中,从而实现全自动化。本研究基于10例乳腺癌患者的术前、术后外周血样本,探索了微量蛋白质定量分析在炎性小体相关通路分子检测中的应用价值,并与qPCR做了对比分析,为临床样本的微量、快速、精准检测提供了标准方法和参考。
1 对象与方法
1.1 研究对象
本研究对象来自于2022年05月03日至2023年12月01日中国医学科学院肿瘤医院乳腺外科行乳腺癌单侧乳房切除术(包括前哨淋巴结活检或腋窝淋巴结清扫)或保乳术(包括前哨淋巴结活检或腋窝淋巴结清扫)的患者,共10例,年龄为18~70岁,ASA Ⅰ-Ⅲ级;手术均由同一组乳腺外科医生承担。排除了合并炎性疾病和近30 d内接收过手术治疗的患者。本研究方案经中国医学科学院肿瘤医院伦理委员会批准(批号:20/332-2528)。所有患者均知情同意。
1.2 方法
1.2.1 外周血单个核细胞的获取:使用含柠檬酸钠抗凝的BD Vacutainer® CPTTM单个核细胞制备管(BectonDickinson公司,货号362761)采集所有入组患者的手术前和术后2 h血液样本,单次采血量约6 mL。收集后的采血管在22 ℃,1 700 ×g离心30 min,吸取中间白色细胞层(图1)进行实验,加入3~4倍体积的1×PBS,吹打混匀;300×g离心10 min,离心后弃上清,得到外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)沉淀(操作用时约1 h)。
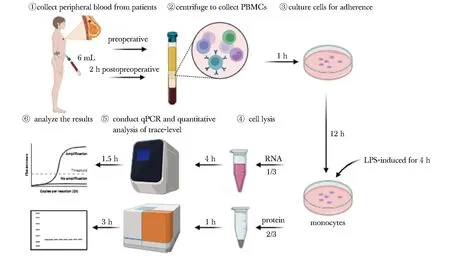
PBMCs.peripheral blood mononuclear cells, created with BioRender.com.
1.2.2 单核细胞的分离培养和活化处理:使用含10%胎牛血清的RPMI 1640培养液(大连美仑生物技术有限公司)重悬上述分离后的单个核细胞,吹吸混匀移入T25培养瓶中(操作用时约5 min),并在含5% CO2的孵箱中37 ℃培养过夜。在此过程中,未贴壁的淋巴细胞被换液去除,从而获得了纯化的具有贴壁特性的单核细胞样本。随后使用100 ng/mL脂多糖(lipopolysaccharide, LPS, Sigma-Aldrich公司)对贴壁的单核细胞进行活化处理4 h(操作用时约5 min)。将获取的细胞分成两部分,三分之二的细胞使用适量含有1×蛋白质酶抑制剂(Roche公司)、1×磷酸酶抑制剂(Bimake公司)的RIPA强裂解液(北京康为世纪生物科技有限公司)进行蛋白质裂解,三分之一的细胞用TRIzol® Reagent(Invitrogen公司)裂解提取RNA,分别于-80 ℃冰箱中保存。
1.2.3 实时定量PCR:使用RNAprep Pure微量样品总RNA提取试剂盒[天根生化科技(北京)有限公司]提取纯化总RNA,将提取的总RNA使用HiFiScript cDNA合成试剂盒(北京康为世纪生物科技有限公司)进行反转录。将反转录得到的cDNA以1∶2比例稀释后使用AceQ Universal SYBR qPCR Master Mix试剂盒(南京诺唯赞医疗科技有限公司)进行qPCR检测(操作用时约5.5 h)。内参基因使用β-actin,相对基因表达水平采用了2-ΔΔCt法,引物序列(表1)。

表1 基因引物序列和抗体信息Table 1 Gene primer sequences and antibody information
1.2.4 微量蛋白质定量分析:采用JESS全自动蛋白质定量分析系统(protein simple, USA)进行。首先使用BCA法定量蛋白质样品,其次按12~230 ku 中分子量蛋白分析试剂(货号SM-W004)操作要求取相应体积5×master mix(即 loading buffer)和0.1×sample buffer,混合制成样品检测液,95 ℃变性5 min,加入到检测板的样品孔道中。然后将一抗稀释液、一抗(表1)、二抗、发光液、洗涤液分别加入到检测板的相应孔道中,室温2 500 r/min离心检测板5 min。将检测板和预制毛细管板放入仪器,运行Compass for SW软件程序,开展微量蛋白质定量分析(操作用时约4 h),采用细胞裂解液作为质控,运行结束后采集图像检测目的蛋白及内参蛋白的灰度值并计算比值,内参基因使用β-actin。
1.3 统计学分析

2 结果
2.1 外周血单核细胞的分离
全部10例患者术前、术后外周血中贴壁单核细胞计数结果(表2),可见不同个体相同体积外周血中单核细胞数量差异较大,可达两个数量级,而绝大部分患者经过手术应激后外周血单核细胞数量明显增加。

表2 10例患者手术前后外周血贴壁单核细胞数量
2.2 利用qPCR检测caspase-1和IL-1β的mRNA在乳腺癌患者手术前后单核细胞中的表达变化
首先选择炎性小体的效应分子caspase-1和下游分子IL-1β,利用qPCR技术对10例乳腺癌患者手术前后外周血单核细胞中2个分子mRNA的表达水平进行了检测。结果显示,与术前相比,caspase-1的表达水平在5例患者中术后显著升高,在4例患者中显著降低,而在1例患者中则未呈现出显著差异(图2A)。另外,针对IL-1β的检测结果显示,4例患者的表达水平术后显著升高,5例患者的表达水平显著降低,而有1例患者的表达水平未呈现明显差异(图2B)。综合,6例患者在caspase-1和IL-1β的表达水平上呈现出一致的趋势,其中3例患者的术后表达水平均上升(BC1、BC7、BC8),另外3例患者的表达水平则呈现下降的趋势(BC3、BC6、BC10),而剩余4例患者的2个基因呈现不一致的结果。

A.qPCR detected the expression levels of caspase-1 mRNA in peripheral blood monocytes samples from breast cancer patients before and after surgery; B.qPCR detected the expression levels of IL-1β mRNA in peripheral blood monocytes samples from breast cancer patients before and after surgery;pre.preoperative monocytes; post.postoperative monocytes; The ratio of gene expression level in postoperative monocytes to that in preoperative monocytes was represented on the Y-axis, while different patients are represented on the X-axis;*P<0.05, **P<0.01, ***P<0.001 compared to the control group.
2.3 乳腺癌患者单核细胞中caspase-1和IL-1β蛋白的微量快速检测
利用微量蛋白质定量分析系统检测了10例乳腺癌患者手术前后配对单核细胞样本中caspase-1和IL-1β的蛋白水平,结果显示,有6例患者的术后caspase-1表达水平显著升高3例患者的显著降低,而有1例患者的表达水平未呈现出显著差异(图3A,B)。另外,6例患者的术后IL-1β表达水平显著升高,2例患者的显著降低,而有2例患者的表达水平未呈现出明显差异(图3A,C)。综合,有8例患者在caspase-1和IL-1β的术后表达水平上呈现出一致的趋势,其中5例患者的术后表达水平上升(BC1、BC2、BC3、BC4、BC7),2例患者的则呈现下降趋势(BC6、BC9),而有1例患者的表达水平未呈现明显差异(BC10)。

A.quantitative analysis of trace-level proteins detecting the expression levels of caspase-1 and IL-1β proteins in breast cancer patients before and after surgery, pre.preoperative monocytes; post.postoperative monocytes; The ratio of protein expression level in postoperative monocytes to that in preoperative monocytes was represented on the Y-axis, while different patients were represented on the X-axis; B.quantitative analysis of caspase-1 protein levels in breast cancer patients before and after surgery; C.quantitative analysis of IL-1β protein levels in breast cancer patients before and after surgery; D.quantitative analysis of cleaved caspase-1 protein levels in breast cancer patients before and after surgery; E.quantitative analysis of cleaved IL-1β protein levels in breast cancer patients before and after surgery; *P<0.05, **P<0.01, ***P<0.001 compared with the control group.
值得注意的是,caspase-1和IL-1β在体内均以无活性的酶原形式存在,在炎性反应状态下,两者先后被蛋白质水解激活,而蛋白质水平的检测能显示前体蛋白质的酶切活化。8例患者表现出明显的caspase-1和IL-1β活性切割条带(BC1、BC2、BC3、BC4、BC6、BC7、BC9、BC10),其中4例术前、术后均有活性切割条带(BC1、BC2、BC9、BC10),4例术后出现活性切割条带(BC3、BC4、BC7、BC8)且均出现明显增加的趋势,1例术前出现活性切割条带(BC6)(图3D,E)。这些结果提示微量蛋白质定量分析系统具有直观地检测caspase-1和IL-1β蛋白水解活化的能力,进一步深入理解患者体内的炎性反应状态。
2.4 信使RNA(mRNA)和蛋白质检测结果的比较
对比mRNA和蛋白质水平的检测结果发现,有4例患者的术后caspase-1 mRNA和蛋白质表达水平均显著升高(BC1、BC4、BC7、BC8),3例患者均显著降低(BC6、BC9、BC10),而有3例患者(BC2、BC3、BC5)的mRNA和蛋白质表达水平呈现不一致改变(图4A)。此外,有4例患者的术后IL-1β mRNA和蛋白质表达水平显著升高(BC1、BC2、BC7、BC8),2例患者均显著降低(BC6、BC10),而有4例患者(BC3、BC4、BC5、BC9)的mRNA和蛋白质表达水平呈现不一致(图4B)。综上所述,共3例患者mRNA和蛋白质水平caspase-1和IL-1β表达水平均显著升高(BC1、BC7、BC8),2例患者的表达水平均显著降低(BC6、BC10)。由此可见,仅仅依赖于mRNA水平的检测不能完全反映机体内蛋白质的真实表达情况,结合蛋白质的表达和活化情况能够更全面地评估患者的炎性反应状况。

A.comparison of caspase-1 expression levels in breast cancer patients before and after surgery using quantitative analysis of trace-level proteins and qPCR; B.comparison of IL-1β expression levels in breast cancer patients before and after surgery using quantitative analysis of trace-level proteins and qPCR; The ratio of gene or protein expression level in postoperative monocytes to that in preoperative monocytes was represented on the Y-axis, while different patients were represented on the X-axis.
2.5 比较单核细胞炎性反应水平检测方法之间的优缺点
对传统检测单核细胞内炎性反应水平的qPCR和Western blot,以及本研究中使用的微量蛋白质定量分析进行了方法学上的比较和总结(表3)。QPCR检测虽然比较灵敏,所需样本量也比较少,但mRNA水平不能真实地反映体内蛋白质的表达变化和功能活性状态。通过对比研究发现,近一半患者的术后caspase-1和IL-1β改变呈现出mRNA水平和蛋白质水平相反的变化,因此并不推荐将qPCR检测用于单核细胞炎性小体活化状态和全身性炎性反应状态的评估。传统的Western blot检测虽能在蛋白质水平上反映炎性相关因子的变化,但所需外周血用量过大,操作时间长,对患者和操作者负担过重,并不适于临床样本检测。而本研究使用的微量蛋白质定量分析具有样本量需求较少、流程标准化、高可重复性、高灵敏度等优势,能够在短时间内快速反映出患者体内的真实蛋白质水平改变和活性状态,为临床样本的快速、微量检测提供了更加适用的方法。总的来说, 微量蛋白质定量分析对于评估临床样本中的炎性因子表达水平和炎性反应状态具有重要意义,其可靠性和高效性使其成为未来临床样本检测的有力工具。

表3 单核细胞炎性反应水平检测方法之间的比较Table 3 Comparison of inflammatory levels in monocytes detection methods
3 讨论
单核细胞是体内各种炎性相关细胞因子的主要来源,也是评估全身性炎性反应状态的主要对象。本研究以乳腺癌患者手术前后分别经LPS处理4 h的外周血单核细胞为样本,对比分析了qPCR和微量蛋白质定量分析方法对caspase-1和IL-1β表达量的检测结果,为评估各种应激因素和肿瘤状态对于体内炎性微环境影响的临床研究,以及肿瘤患者的临床管理提供了方法学参考。
文献报道[6],单核细胞对LPS的响应非常迅速,炎性小体相关分子的mRNA和蛋白水平迅速增加,到3 h IL-1β的mRNA已进入平缓增长期,而到6 h部分样本的mRNA表达量已明显下降。因此本文选择了LPS处理4 h进行检测。研究结果表明大部分个体的炎性相关因子在术后2 h即明显升高,但剩余个体反而表现出降低或没有明显变化。这种差异可能对于患者的全身性炎性反应状态具有重要影响,但需要更为系统的随访观察。重要的是,近半患者手术前后caspase-1和IL-1β的mRNA水平的变化与蛋白质表达水平变化不一致。这提示研究疾病发展中关键蛋白的表达情况,仅依赖基因水平的检测可能存在局限性,而蛋白质水平的检测能反映体内更多层面的表达调控,比如翻译、翻译后修饰等,相比于蛋白质总量,酶切活性对于炎性反应状态的评估更加重要。
近年来,微量蛋白质定量分析系统已经广泛应用于基础研究和产品研发中。在磷酸化和蛋白异构体分析、疫苗研发和治疗性蛋白质等不同领域中,其均展现出多方面的优势[12-15]。本研究也证明其在测量蛋白质水平上具有样本需求量小、流程标准化、可重复性高、灵敏度高等特点,更适用于临床样本的检测。本研究也存在一些局限性,比如样本量相对较小,仅检测了少数因子的表达等,限制了结果的全面性和泛化性。
综上,本研究通过对比分析发现,传统的qPCR检测不适于炎性反应状态的评估,而微量蛋白质分析具有样本用量少、灵敏度高、重复性好、操作相对简单等优点,特别适合基于临床样本的分析,可为深入了解肿瘤炎性反应微环境的分子机制、临床诊断和治疗等提供依据。

