替雷利珠单抗联合放化疗治疗局部晚期食管鳞癌的疗效和不良反应分析*
胡俊霞,刘益民,朱林,董婷婷,胡筱,刘德林,张慧敏
223800 江苏 宿迁,宿迁市第一人民医院 肿瘤科(胡俊霞、刘益民、朱林、董婷婷、胡筱、张慧敏);210009 南京,江苏省肿瘤医院 内科(刘德林)
食管癌是全球第八大常见的癌症,也是导致癌症相关死亡的第六大原因[1],食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是亚洲食管癌的主要病理类型,占我国所有食管癌患者的90%[2]。虽然根治性手术治疗可以使早期ESCC患者获得长期生存,但绝大多数ESCC患者因高龄、基础疾病较多、或因进食梗阻导致的体能状况差等原因导致身体机能较差,就诊时已属于中晚期,单纯手术已无法治愈,且术后反流性食管炎、食管纵膈瘘等并发症的发生率较高,各方面因素导致中晚期ESCC患者的手术治疗的比例持续较低。作为局部治疗的替代,根治性放化疗是局部晚期ESCC除手术以外的最重要的治疗方式,也是临床局部晚期ESCC应用最广泛的治疗方法,尽管通过同步或者序贯放化疗,仍有约三分之一的ESCC残留病变患者在治疗1年内复发[3]。近年来,免疫检查点抑制剂显示出较强的抗肿瘤活性,随着大型3期试验结果公布,程序性死亡受体-1(programmed cell death receptor-1,PD-1) 单抗与化疗联合表现出较高的疾病缓解率,不良反应可控,PD-1单抗联合化疗成为晚期或者转移性ESCC的一线治疗,ESCC的治疗进入了免疫治疗时代[4-10]。理论上,PD-1单抗联合放化疗可以为局部晚期ESCC患者提供协同抗肿瘤作用,但局部晚期ESCC放化疗联合PD-1单抗治疗的三期研究数据尚未公布。为此,本研究通过回顾性分析,评估替雷利珠单抗联合放化疗治疗局晚期ESCC患者的有效性和安全性,为临床诊疗提供参考。
1 材料与方法
1.1 一般资料
收集宿迁市第一人民医院2019年2月至2021年12月初诊局部晚期食管鳞癌患者的临床资料,所有患者均经胃镜、B超、CT、钡餐造影、病理等检查确诊为局部晚期鳞状细胞癌,不具备手术适应证或拒绝手术,排除远处转移,按照第七版国际抗癌联盟(Union for International Cancer Control,UICC)分期法进行临床分期。根据放化疗过程中是否联合替雷利珠单抗,分为联合治疗组和单纯放化疗组。本研究符合《赫尔辛基宣言》的相关要求,患者均知情同意,通过医院伦理委员会批准(批号:2023-SL-0112)。
1.2 研究方法
通过收集经我院收治并随访的局部晚期食管癌患者的临床资料、病理分型、影像学资料,化疗和放疗方式,分析其治疗疗效,进而找到与该类患者预后相关的治疗因素。
1.3 诊疗方案
所有患者均接受白蛋白结合型紫杉醇(200 mg/m2,d1)联合顺铂(25 mg/m2,d1~3)或者卡铂(AUC=4)化疗,3周为1个疗程。根据病灶缓解程度及机体状况4~6周期后行局部放射治疗,放疗期间替吉奥口服同步化疗,具体为替吉奥 40 mg/m2/d,分为早晚两次口服,每周一至周五,与放疗同步。其中联合治疗组除接受白蛋白结合型紫杉醇联合顺铂或者卡铂化疗外,另接受联合替雷利珠单抗免疫治疗,每3周200 mg;而单纯放化疗组患者仅接受白蛋白结合型紫杉醇及铂类(顺铂或者卡铂)化疗。所有患者待放疗结束后2月评估近期疗效,联合治疗组无进展患者每3周行替雷利珠单抗免疫治疗,每3月行影像学复查,直至病情进展或者替雷利珠单抗维持治疗满2年,对照组仅接受每3月一次的影像学复查直至病情进展。所有患者每次入院时采集外周血检测T淋巴细胞,直至该患者随访结束。本研究随访截止时间为2023年10月。
1.4 放疗方案
食管癌放疗均采用调强技术,6MV X线,靶区勾画大体肿瘤靶体积(gross target volume,GTV):包括GTVp及GTVn。GTVp为可见的食管病灶,应综合多种影像学和内镜结果确定,如食管造影、增强CT、MRI和(或)PET-CT、电子上消化道内镜和(或)腔内超声检查。GTVn为可见的转移淋巴结,指CT、超声和(或)MRI显示的短径≥10 mm(食管旁、气管食管沟≥5 mm)的淋巴结,或PET-CT显示标准摄取值高(炎性淋巴结除外),或者虽低于上述标准,但淋巴结有明显坏死、环形强化、强化程度与原发灶相仿、偏心钙化者,也作为GTVn。在GTV基础上前后左右外扩0.3~0.5 cm、上下两端外扩3 cm设为临床靶体积(clinical target volume,CTV)。而计划靶区(planning target volume,PTV)一般是在CTV的基础上再次前后上下外扩0.5 cm。以95%PTV设总剂量60 Gy/1.8~2.0 Gy,采用常规分割方式,即每周一至周五每日照射1次。危及器官勾画主要包括双肺、心脏、肝脏、气管及主支气管、胃、脊髓。
1.5 治疗疗效及副反应评价标准
患者治疗近期疗效评估在放疗完成后2月进行。肿瘤近期疗效按照实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版进行评价,完全缓解(complete response,CR):所有靶病灶消失,所有病理淋巴结的短径减小至<10 mm;部分缓解(partial response,PR):靶病灶直径之和比基线水平减少至少30%;进展(progressive disease,PD):所有靶病灶直径的总和增加至少20%,或出现新病灶;稳定(stable disease,SD):介于PR与PD之间。以CR+PR计算客观缓解率(objective response rate,ORR),以CR+PR+SD计算疾病控制率(disease control rates,DCR)。患者远期疗效评估为随访截止点即疾病无进展生存期(progression-free survival, PFS),PFS是指患者从治疗开始,到原发肿瘤进展、新发远处转移、因其他原因患者去世或失访的时间。以无进展生存率作为远期疗效指标。药物毒副反应采用药物毒性反应标准NCI CTCAE 5.0版评价,急性放疗毒副反应采用急性反射反应评分标准(RTOG/EORTC)评价。
1.6 统计学方法
采用SPSS 27.0软件对数据进行统计学分析。Kaplan-Meier法及Log-rank检验进行生存分析,单因素Logistic回归计算95%CI。计数资料用Pearsonχ2检验(T<5采用Fisher确切概率法)。以P<0.05作为差异有统计学意义。
2 结 果
2.1 患者资料
共筛选出符合要求的患者31例,联合治疗组18例,单纯放化疗组13例,其中男性21例、女性10例;年龄在55~79岁,中位年龄67岁。两组患者一般临床资料(表1)比较,差异均无统计学意义(P>0.05),具有可比性。

表1 两组患者的临床资料比较
2.2 近期疗效评估
表2显示,联合治疗组CR 4例、PR 11例、SD 3例;单纯放化疗组CR 1例、PR 4例、SD 7例、PD 1例;联合治疗组ORR为83.33%,单纯放化疗组为38.46%,两组差异有统计学意义(P=0.020);联合治疗组DCR为100%,单纯放化疗组为92.31%,差异无统计学意义(P=0.419)。
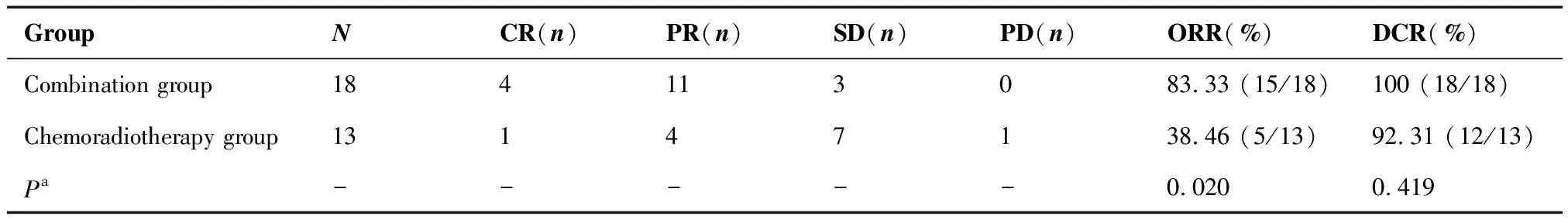
表2 两组患者近期疗效比较
2.3 远期疗效评估
截止到2023年10月,患者最短随访时间为20.3个月,31例患者均顺利完成治疗,联合治疗组和单纯放化疗组的中位PFS分别为36.5个月(95%CI:25.75~47.25)和24.0个月(95%CI:21.05~26.95),差异具有统计学意义(P=0.021)。联合治疗组1年无进展生存率为100%,单纯放化疗组为92.3%,差异无统计学意义(OR=1.08,95%CI:0.93~1.27,P=0.419);联合治疗组2年无进展生存率为77.0%,单纯放化疗组为39.2%,差异有统计学意义(OR=5.85,95%CI:1.22~27.99,P=0.033;图1)。
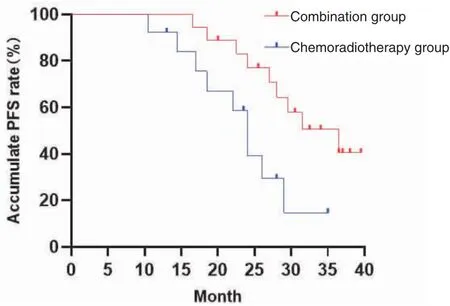
图1 两组患者的生存曲线图
2.4 外周血T淋巴细胞
联合治疗组和单纯放化疗组患者外周血T淋巴细胞比较,治疗前,各T细胞亚群及比值的差异无统计学意义(均P>0.05);治疗后,联合治疗组CD4+T细胞、CD4+/CD8+T高于单纯放化疗组,差异有统计学意义(P=0.036,P=0.002),CD3+T细胞高于单纯放化疗组,但差异无统计学意义(P=0.368),联合治疗组CD8+T低于单纯放化疗组,差异有统计学意义(P=0.048;表3)。
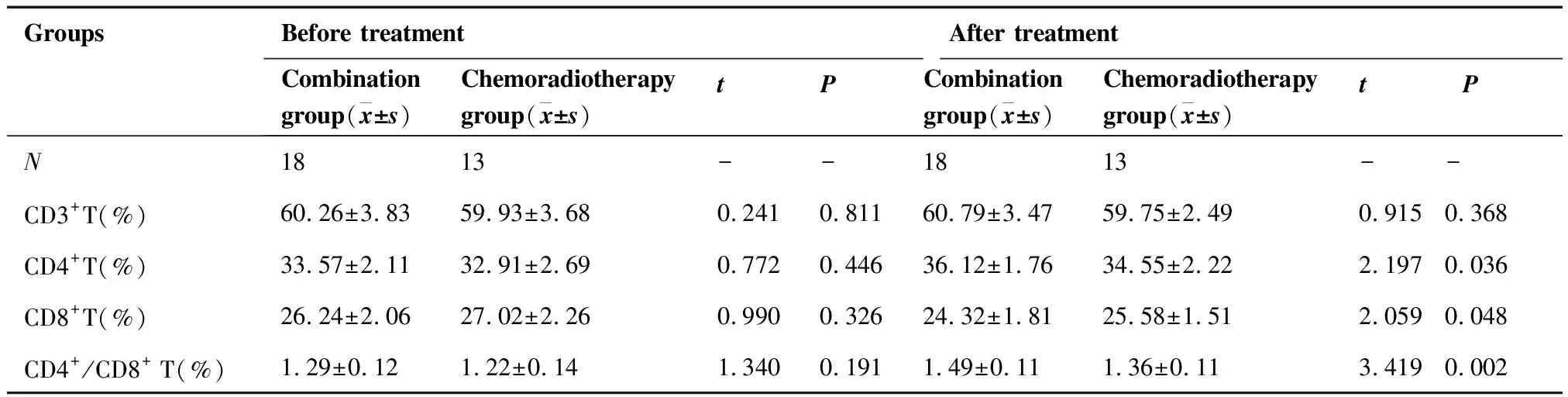
表3 两组患者治疗前后T淋巴细胞比较
2.5 不良反应
患者的不良反应主要表现为放射性食管炎、骨髓抑制、甲状腺功能减退、食欲减退、放射性肺炎。联合治疗组与单纯放化疗组在放射性食管炎、骨髓抑制、食欲减退、放射性肺炎方面差异均无统计学意义;联合治疗组甲状腺功能减退发生率为55.56%,单纯放化疗组发生率15.38%,两组均为1~2级,但差异有统计学意义(P=0.032;表4)。

表4 两组患者不良反应比较
3 讨 论
食管癌是我国高发癌瘤之一,诊断时常病期较晚,发病人数和死亡病例均约占全球的一半以上[11]。外科手术依然是早期食管癌的主要治疗方法,对于不可手术切除或拒绝手术的局部晚期食管癌患者,越来越多的临床证据表明,放疗联合化疗的恰当组合可使患者生存获益,尤其是对我国更为常见的局部晚期ESCC患者,对于不能手术的Ⅲ期ESCC患者,目前的标准治疗是同步放化疗[3, 12]。具有里程碑意义的RTOG 85-01试验确立了根治性放化疗作为不可切除局部晚期食管癌患者治疗的基础[13]。然而在RTOG 85-01试验中,根治性同步放化疗组中与治疗相关死亡患者达到61例,3级以上的不良反应发生率达到44%,传统治疗似乎走到了瓶颈,需要对最佳的放化疗联合治疗方案进行深入的研究。
近年来,随着国产新型高效化疗药物白蛋白结合型紫杉醇研发成功,并因集采降价使得药物的可获取性得以极大的提高,较多的临床研究证实白蛋白结合型紫杉醇联合铂类在鳞状细胞癌中有较高的疾病控制率[14],而且由于其生物结构的特性,不易发生过敏,不需要用药前预处理,与普通紫杉醇相比,具有较多的用药优势[15]。另外,抗肿瘤药物免疫检查点抑制剂(immune checkpoint inhibitor,ICI)为代表的新型免疫治疗药物,尤其是PD-1单抗,为ESCC患者的诊疗带来新的策略。基于大型随机对照临床试验的公布, 已有多种PD-1单抗获批一线治疗晚期或者转移性ESCC患者。另有小样本二期研究提示PD-1单抗联合术前新辅助放化疗不仅不良反应可控,不会延迟手术的时机,而且增加手术患者的病理完全缓解率[16]。但由于临床研究的复杂性和临床数据的适用性,这些PD-1单抗均未联合根治性放疗,使得局部晚期ESCC放化疗联合PD-1单抗的真实世界研究数据更为珍贵,并且有利于观察药物在更广泛人群中的使用情况和证据积累。替雷利珠单抗是我国自主研发的抗PD-1单克隆抗体,已在国内外上市近4年, 积累了较多ESCC的临床证据,如RATIONALE-306研究[6]替雷利珠单抗为不能手术的晚期ESCC患者的一线治疗提供了高级别循证依据,RATIONALE-302研究[17]替雷利珠单抗为ESCC患者的二线治疗提供了生存获益,但替雷利珠单抗联合放化疗治疗局部晚期ESCC患者的RATIONALE-311临床实验正在开展[18],已披露数据较为有限,其研究结果值得期待。随着PD-1单抗在临床中的广泛使用,发现免疫治疗后需要激活免疫应答发挥抗肿瘤作用常常需要几周甚至3~4个月的时间。基于该理论基础,在本研究设计时,课题组考虑临床常见的初诊ESCC患者的特点如下:①诊断时年龄较大;②因常合并进食梗阻症状而导致营养不良;③初诊时因肿瘤体积较大,直接行放疗靶区周围脏器放射线累积量较高,导致放疗耐受性较差、不良反应发生率高。综合以上特点,课题组选择先行4~6周期替雷利珠单抗联合化疗或者单纯化疗,待病灶缩小,进食和营养状况改善后再行同步放疗,减少放射性不良反应的发生,保障放疗的顺利进行。
放疗作为包括ESCC在内的恶性实体肿瘤治疗的重要局部治疗手段,近年来显示出与ICI免疫治疗发挥协同效应,改善抗肿瘤治疗的疗效[19-20]。免疫功能状态本身也是食管癌发生发展的一个重要因素,机体在抗肿瘤的细胞免疫中,T细胞介导的特异性免疫应答反应起着重要作用。正常情况下,CD4+T细胞和CD8+T细胞之间始终保持动态平衡,CD4+/CD8+T细胞比值在一定程度上反映肿瘤患者细胞免疫功能紊乱状态和肿瘤免疫活性状态,CD4+T细胞的减少可使肿瘤发生免疫逃逸[21]。PD-1抗体通过肿瘤特异性T细胞的产生刺激或部分逆转耐受诱导,进而增强抗肿瘤T细胞全身免疫活性,活化的T细胞通过淋巴管进入血液循环,然后进入组织发挥作用[22]。所以在通过PD-1抗体和放化疗治疗局部晚期ESCC时,监测外周微环境中CD4+T细胞和CD8+T细胞的数量和功能,不仅利于探索放疗是否增加免疫治疗抗肿瘤活性,更利于识别获益人群。本研究结果显示,联合治疗组中CD4+T细胞和CD4+/CD8+T细胞比值明显高于单纯放化疗组,提示替雷利珠单抗联合放化疗可能改善ESCC患者的免疫状态,恢复免疫系统抑制肿瘤的能力,外周血T细胞监测可能成为ESCC疗效评估和分层管理的预测模型之一。
本研究还发现,联合治疗组ORR为83.33%,单纯放化疗组为38.46%,两组差异有统计学意义(P=0.020),提示替雷利珠单抗联合白蛋白结合型紫杉醇及铂类一线用于局部晚期食管鳞癌有效缩小了病灶及淋巴引流区的瘤体体积,可能会改善患者的远期疗效。经过最短随访时间为20.3个月的监测,联合治疗组中位PFS为36.5个月(95%CI:25.75~47.25),远高于单纯放化疗组24.0个月(95%CI:21.05~26.95),差异有统计学意义(P=0.021)。联合治疗组1年无进展生存率为100%,单纯放化疗组为92.3%,差异无统计学意义(OR=1.08,95%CI:0.93~1.27,P=0.419);联合治疗组2年无进展生存率为77.0%,单纯放化疗组为39.2%,差异有统计学意义(OR=5.85,95%CI:1.22~27.99,P=0.0325)。这些结果表明在兼顾患者进食、营养、肿瘤负荷、放疗耐受性等条件下,替雷利珠单抗可有效改善局部晚期ESCC患者的PFS,这可能带来总生存期的延长,给放化疗的ESCC患者带来生存获益。
在不良反应方面,主要有放射性食管炎、骨髓抑制、甲状腺功能减退、食欲减退、放射性肺炎。放射性食管炎为食管癌放疗期间主要的不良反应,大部分经对症处理后很快好转,两组均无4级放射性食管炎发生;骨髓抑制也是放化疗患者常见的不良反应之一,所有患者中骨髓抑制的发生率为74.19%,但3~4级骨髓抑制发生率两组未见明显差异;甲状腺功能减退为免疫抑制剂常见不良反应之一,联合治疗组55.56%较单纯放化疗组15.38%明显升高,但均为1~2级,不影响患者用药。放射性肺炎的发生联合治疗组较单纯放化疗组增多,但两组差异无统计学意义。以上可见,替雷利珠单抗联合放化疗用于局部晚期食管癌的治疗有良好的安全性。
本研究也存在一定的局限性。首先,这是一个小样本量的回顾性研究;第二,本研究主要纳入初诊局部晚期ESCC年龄较大的患者,为保证临床治疗的安全性和放疗的有效完成,化疗强度整体偏小,联合治疗的PFS延长是否转换为OS的获益仍有待阐明;第三,PD-1抗体治疗的个体差异性等。
总之,替雷利珠单抗联合白蛋白结合型紫杉醇及铂类一线用于局部晚期食管鳞癌放化疗中的疗效较好,不良反应可耐受,安全性可控。因回顾性试验存在局限性,这种维持性治疗的疗效仍需要在前瞻性随机试验中进一步验证。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

