累及大血管的腹膜后肿瘤处理策略探讨
屈国伦 曲兴龙 张洪强 王洪波 王康伟 彭帅 综述 陈勇 审校
腹膜后肿瘤(retroperitoneal tumor,RPT)是指原发于腹膜后腔隙内的肿瘤,可来源于疏松结缔组织、肌肉、血管、神经等腹膜后软组织,但不包括腹膜后脏器如胰腺、肾脏等脏器结构的肿瘤及转移瘤[1]。RPT难以早期发现,确诊时肿瘤体积往往较大[2],常累及腹膜后血管、神经及腹腔脏器;其中约20% 累及动脉,64%累及静脉,16%同时累及动静脉[3]。手术是治疗RPT 最主要的方式,若首次en-bloc 切除达到切缘阴性,则成为此类患者达到潜在根治性治疗的最佳时机[4]。RPT 手术难度大且易复发,特别是直径>10 cm的巨大RPT,多需要联合脏器切除甚至血管重建,对外科医师是一项重大挑战,完善的手术策略和精细的手术技巧对累及大血管RPT 的成功处理十分关键,本文对累及大血管的RPT 处理策略和研究进展进行综述。
1 RPT 术前评估与准备
RPT 病理类型较复杂,对其要有足够的认识与准备:1)对于复杂的RPT,特别是对于累及大血管的RPT,首次对肿瘤进行彻底切除对患者至关重要,需要由有经验的手术团队和多学科团队协作完成[5]。2)术中冰冻对病理科医师要求极高,对诊断难以有较大帮助或者不能改变手术前预设好的切除范围,手术需以影像学诊断为基础并结合术中情况确定切除范围[6]。影像学检查是RPT 术前评估的最常用手段,包括B 超、CT、MRI、PET-CT 等[7-8]。超声可以准确评估肿瘤与邻近组织、器官、血管间关系,手术当天血管内超声(intravascular ultrasound,IVUS)可用于术前拟定血管壁、血管切除和修补、置换等计划,还能检查肿瘤血栓周围的血管壁,扇形边缘无清晰的内膜高回声是血管受侵犯的典型征象,IVUS 对门静脉和肠系膜上静脉受侵犯的检测灵敏度达95% 以上,特异度也超过90%[9-10]。CT 是最常用的检查手段,腹部CT 三维血管成像不仅可判断肿瘤位置,还能了解肿瘤与腹主动脉及内脏动脉的关系和对血管侵犯程度。腹膜后肿瘤定位CT 诊断符合率约85%[11]。肿瘤对腹腔血管部分包绕时,静脉多表现为管壁不规则、管腔狭窄,而动脉多规则、无明显狭窄;当肿瘤完全被包绕血管时,受累静脉多见管壁破坏、管腔狭窄,甚至癌栓,影像显示出静脉内充盈缺损或回流静脉不显影,动脉则可见管壁不规则及管腔狭窄征向,肿瘤如果较小也可仅表现为对血管的压迫和推移[12]。MRI 能准确显示RPT 大小、范围、肿瘤与邻近脏器之间的关系,对判断肿瘤是否累及神经更有优势。CT 和MRI 对RPT 的诊断率高达90%;而穿刺活检可用于术前确诊肿瘤性质,影像学检查和穿刺活检为手术风险评估及手术方案设计、临床决策制定提供重要依据[13]。
有研究报道RPT 的完整切除率为67%~94%,RPT 伴有重要血管受累以及多脏器受到侵犯是影响RPT 切除率的主要因素,对腹膜后肿瘤患者CT 数据进行三维可视化系统处理和三维重建,可多维度了解肿瘤解剖学位置、血管走向以及与腹腔脏器和周围组织的关系,这种三维可视化成像对术前精准评估、手术方案规划具有重要指导作用[14-15]。数字减影血管造影可有效显示肿瘤的血供,为手术或血管栓塞提供依据,对于复杂、巨大的RPT 可在术前进行介入栓塞,降低手术难度、减少术中出血及术后并发症,尤其是对于>10 cm 的肿瘤效果更明显[16-17]。对于无法栓塞或者不适合栓塞的RPT 患者,术前预判出血量较大,可在术前采取低位腹主动脉球囊置入,术中酌情行球囊阻断术,以减少术中出血。
混合现实技术(mixed reality,MR)可对RPT 侵犯血管及周围脏器进行术前分析和手术导航,目前MR已用于RPT 侵犯邻近血管的评价,其敏感度约87.5%,特异度约84.6%;也用于RPT 侵犯邻近器官的评价,其敏感度约为63.6%,特异度约70.0%[18]。
RPT 患者术前,还需要对心肺、肝肾等脏器功能评估,另外约46%的RPT 患者就诊时伴有营养不良,术后并发症风险明显增高,还需注意术前、术后营养支持,对于中重度贫血者可适量输血,对于肿瘤巨大有出血风险者,需要进行术前备血[1,19]。
2 RPT 累及下腔静脉、肾静脉的处理
RPT 常累及下腔静脉(inferior vena cava,IVC)与肾静脉(renal vein,RV),由于手术视野深、范围广,成为手术的难点,当出现以下情况时:1)当肿瘤源于IVC 或RV;2)IVC 或RV 被瘤栓致完全闭塞;3)肿瘤侵犯IVC 或RV 不完整切除,可因肿瘤蔓延生长致IVC 完全阻塞;4)IVC 或RV 受肿瘤黏连致密或包裹难以分离,可行肿瘤完整切除+血管切除+人工血管置换术[20]。
临床实践中,可根据下腔静脉与周围脏器关系选择处理腹腔静脉,可将IVC 分为4 段(图1):Ⅰ段为髂总静脉分叉处至肾静脉入口以下2 cm,Ⅱ段为肾静脉以下2 cm 至肾静脉以上2 cm,Ⅲ段为肾静脉以上2 cm 至膈肌,Ⅳ段为膈上段。由于IVC 壁薄,被肿瘤侵犯时若损伤范围小可以采取横向缝合或者补片修补防止血管狭窄,并且修补后的血管管腔不小于正常直径的1/2;对于损伤范围较大,且游离长度有限而直接吻合存在困难的,则需要整段切除,当缺损IVC 长度大于2 cm 时,需行血管置换。Ⅰ段是最常受肿瘤侵犯的部位,该段侧支循环丰富且易建立,来自盆腔脏器及下肢静脉的血液回流主要流经该段,若需切除此段IVC,应尽量避免在术中损伤侧支循环而导致回流障碍。切除Ⅱ段IVC 易影响双侧肾静脉的回流,左肾静脉可依靠左肾被膜静脉和左肾上腺静脉,以及左膈下静脉、生殖静脉汇入而产生代偿可能。若该段IVC 受肿瘤侵犯并影响左侧肾静脉时,可在靠近IVC 处结扎左肾静脉,通过应用呋塞米、监测肾静脉压力值变化等评估左侧肾静脉的血液回流情况,而决定是否需行左侧肾静脉重建。右侧肾静脉短,侧枝循环也少,如果手术中切除Ⅱ段IVC,右肾因血液回流障碍而引起淤血及毒素产生,此时常需行右肾切除或右肾静脉重建。而切除Ⅲ段IVC,仅切除了肾静脉汇入点上方的IVC,若患者此处侧支循环已形成,则无需血管重建,此时肾静脉血液可通过肾脏下段IVC 经侧支循环汇入至奇静脉,再回流到心脏,否则需要重建。原发肿瘤很少累及Ⅳ段IVC,是否在体外循环下手术是这段最需要考虑的问题,对于RPT 累及IVC,特别是肾静脉平面以上段下腔静脉不可轻易结扎和切除,会使回心血量急剧减少、双肾淤血而引起功能障碍,切除受肿瘤侵犯不同部位IVC 所面临的风险不同。当肿瘤侵犯IVC时,对于部分患者需对IVC 进行整段切除,国内外学者对IVC、肾静脉切除后是否需要重建仍存在较大争议,根据肿瘤侵犯部位、血管堵塞程度、侧枝循环建立情况综合评估后制定个体化治疗方案已成为主要方向[21-26]。
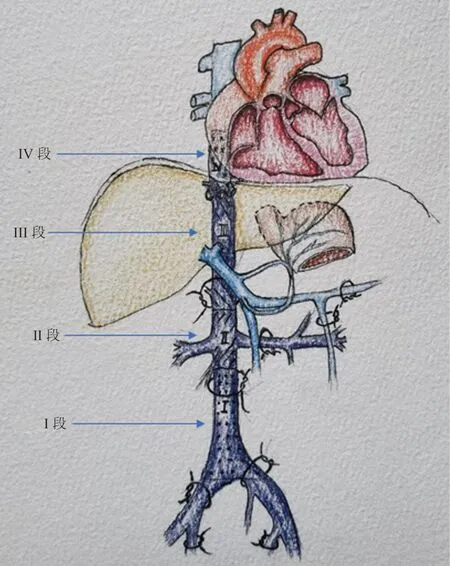
图1 下腔静脉分段及PRT 累及腹腔静脉的处理
目前国内学者多认为出现以下情况时需行血管重建,防止术后下肢出现肿胀[27]:1)下腔静脉和髂静脉通畅;2)术前患者已经存在下肢肿胀等静脉回流障碍的征象;3)手术范围较广泛,破坏了大量有效侧枝循环;但静脉重建长期通畅率较低,有效的侧枝循环建立,使临床症状并不明显;而肿瘤压迫及侵犯下腔静脉也是一个较为漫长过程,在此过程中可形成充分的侧枝循环,此时断离IVC 可不必重建。
3 RPT 累及门静脉、肠系膜上静脉、髂静脉的处理
由于静脉壁比较薄,RPT 易侵犯到腹腔静脉并形成癌栓。门静脉位置深,手术暴露困难,若RPT 累及门静脉,如需要切除,则必须对门静脉予以修复[28]。在进行门静脉修复时,若静脉切除范围<5 cm,则可行静脉端端吻合,否则应行端侧吻合或者血管移植,对于血管重建者静脉阻断时间应<60 min,否则可能引起肝及肝外器官的损伤[29]。另外在进行血管阻断前需进行局部或全身肝素化。脾静脉、肠系膜上和肠系膜下静脉血液汇聚至门静脉,若受肿瘤累及,可以结扎脾静脉和肠系膜下静脉,肠系膜下静脉可通过左半结肠的血管弓,可通过结肠中静脉及直肠下静脉交通,其结扎不会引起消化系统血液淤滞;而肠系膜上静脉引流区域广,在其汇入门静脉起始部发生缺损或离断时须予以修复和重建,避免造成严重后果,当切除范围在5 cm 以内时可直接予以吻合,当切除范围过大时,则需考虑血管重建或吻合,切除近端肠系膜上静脉时,可考虑人工血管移植,对于病情允许者,可行脾脏切除,向右翻转脾静脉,与肠系膜上静脉吻合重建;而髂内静脉通常是可结扎的,髂总静脉、髂外静脉一般情况下也是可结扎的,条件允许者建议重建,以降低下肢静脉血栓及下肢肿胀[30-31]。
4 RPT 累及腹腔干、肝总动脉、肠系膜上动脉、肾动脉的处理
腹腔干损伤后较难修复,可在肝总动脉与主动脉间行人工血管或自体大隐静脉重建,切除部分肾动脉后可采用自体大隐静脉重建,通常吻合在肾动脉下方的主动脉或髂动脉上,在肾动脉开口处附近的主动脉上进行吻合则操作比较困难[30]。当RPT 累及腹腔干和(或)肝总动脉时,情况紧急时,可切除和结扎腹腔干起始部及分支,此时肝、胃、脾等脏器由于具有丰富的侧枝血液循环,切除并不影响血供,可不必重建,特殊情况下需要进行肝总动脉重建者,可采取端端吻合、自体大隐静脉移植、人工血管重建处理,胃左动脉、脾动脉受肿瘤累及时,可直接结扎,但胆囊侧枝循环少,其血供源于肝固有动脉终末支,切除腹腔干、肝固有动脉时需一并切除胆囊,避免缺血坏死。对于肠系膜上动脉术前已发生闭塞者,若临床无肠缺血症状,切除肠系膜上动脉时,可不必重建,肠系膜上动脉供血此时主要由肠系膜下动脉经过结肠中动脉左支形成的Riolan弓来代偿,若术前肠系膜上动脉通畅,或切除范围包括结肠中动脉者,切除后必须进行血管重建(图2)[27,32-33]。可采用铁氟龙以及涤纶人工血管或自体大隐静脉进行重建[34]。应用大隐静脉重建时需要注意静脉瓣膜方向。
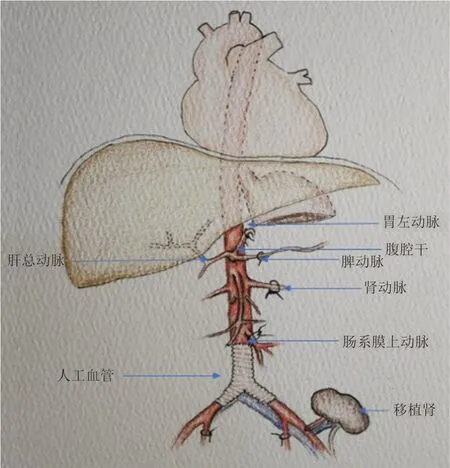
图2 RPT 累及腹腔大动脉的处理
5 RPT 累及腹主动脉、髂动脉的处理
RPT 常侵犯腹主动脉、髂动脉,当肿瘤完全包裹或者严重侵犯血管时,术中分离时容易出血,手术时间长,并且还存在肿瘤残留,可选择连同动脉在内的肿瘤肿块切除方式,再进行人工血管置换;由于动脉壁较厚,存在鞘膜的保护,有些RPT 与动脉黏连,可在仔细分离下,成功剥离肿瘤[35]。在重建血管时,至少要保留肠系膜下动脉和双侧髂内动脉中的任一支,避免引起盆腔脏器或者臀部肌肉缺血,当肿瘤侵犯肾脏以上腹主动脉时,可能同时累及肾动脉、腹腔干、肠系膜动脉,联合腹主动脉切除后需重建内脏血管,此时手术分离往往比较困难,容易损伤动脉引起大出血,造成创伤巨大而导致根治机会较小[5,31]。
6 结语
累及大血管RPT 手术涉及大量血管外科开放性手术技术,从手术方案设计、血管解剖、血液流入流出道的控制,到血管的重建,对术者技术极具挑战[36]。对于大部分累及大血管的原发性RPT 而言,均获得R0或R1 切除,其中下腔静脉是最常见受累的大血管,其他常见受累的血管为髂静脉、髂动脉和腹主动脉,RPT 联合腹主动脉或内脏动脉的en-bloc 切除更具难度,尤其是多处内脏动脉受累,常视为手术禁区,对此类手术需要谨慎评估,对血管重建后获益较大的原发性RPT 患者才予考虑。近年来有关累及大血管RPT手术的报道均未出现围手术期死亡,从远期疗效来看,局部/远处复发率为8%~90%,五年生存率为25%~80%[37]。
累及大血管RPT 可视为腹膜后肿瘤生物侵袭性的标志之一,需要加强多学科协作并进行综合评判[38]。血管重建要基于肿瘤分期、肿瘤转移、肿瘤与血管的关系,联合切除邻近大血管时需要全面评估所累及的血管能否有效解离,分离过程中需注意血管壁是否存在薄弱点,以及强行分离带来的大出血风险。对于局部复发的RPT 患者,联合血管切除更需慎重,血管重建应限于肿瘤等级低、预后好及可切除性大的患者。
累及大血管RPT 作为肿瘤外科领域的重要病种,其手术涉及到血管外科、普外科等多学科内容,术前评估、手术策略、术后管理对肿瘤外科医生在累及大血管RPT 患者治疗过程中起着至关重要的作用,加强多学科协作和围手术期管理是保证手术顺利进行的关键,只要准备充足,术中处理得当,大部分患者均可获得R0 或R1 切除,并可获得良好预后。
本文无影响其科学性与可信度的经济利益冲突。

