持续静脉泵注重组人血管内皮抑制素联合化疗一线治疗晚期非小细胞肺癌的随机、对照临床试验
刘涛,唐磊,李青聪,黄东,李自康
雅安市人民医院肿瘤科,四川雅安 625000
肺癌是一种医疗界常见的恶性疾病,其中非小细胞肺癌(Non-small Cell Lung cancer, NSCLC)的患者数量最多。据统计,大概80%的肺癌患者被确诊为NSCLC,而许多人在接受治疗的过程中,癌症已经进入了晚期,这使得其生存率大幅度下滑[1-2]。近年来,免疫疗法在肿瘤治疗方面取得革命性的突破,但到目前为止,免疫疗法药物的昂贵成本超出了绝大多数患者的承受能力[3]。根据相关的研究,第三代化疗药和铂类双药的结合能够显著改善晚期癌症的治愈情况[4],然而,这种结合的有效性只占30%,使得晚期癌症的治疗效果达到了稳定状态。所以,尽管大部分晚期癌症的治疗依赖于一线的化疗,但是,由于它们都是化疗药物,可能会导致骨髓抑制、恶心和呕吐等不良反应,这些都是难以预防的[5-7]。对此,本研究选取2019年3月—2022年9月期间雅安市人民医院接受治疗的150名晚期NSCLC患者为研究对象,现报道如下。
1 资料与方法
1.1 一般资料
按照随机数表法对本院收治的150例晚期NSCLC患者进行了分组,分为化疗组(n=75)和联合组(n=75)。化疗组男41例,女34例;年龄51~71岁,平均(59.26±5.43)岁;病理类型:腺癌35例,鳞癌40例;肿瘤分期:ⅢB期37例,Ⅳ期38例;吸烟状态:是31例,否44例;皮层脑电图(Electrocorticography, ECoG)评分:0分29例,1分31例,2分15例;体质量45~62 kg,平均(51.54±3.78)kg。联合组男43例,女32例;年龄52~72岁,平均(59.34±5.48)岁;病理类型:腺癌39例,鳞癌36例;肿瘤分期:ⅢB期34例,Ⅳ期41例;吸烟状态:是30例,否45例;ECoG评分:0分23例,1分34例,2分18例;体质量46~61 kg,平均(51.48±3.45)kg。两组患者一般资料对比,差异无统计学意义(P>0.05),具有可比性。患者及家属均知情同意。本研究经医院医学伦理委员会审核(HYYH2024-0013)。
1.2 纳入与排除标准
纳入标准:符合晚期非小细胞肺癌的诊断标准[8];首次确诊;TNM分期为ⅢB~Ⅳ期;卡氏评分>70分;ECoG评分为0~2分;预计生存期在3个月及以上。排除标准:合并其他恶性肿瘤者;严重呼吸道疾病者;对本研究所用药物过敏者;肺部先天发育不良者;主要脏器功能异常,无法耐受化疗者。
1.3 方法
化疗组给予常规一线化疗方案治疗。根据患者不同病理类型进行用药,具体方法为:①腺癌:AP方案:化疗第1天静滴500 mg/m2培美曲塞二钠[国药准字H20080624;规格:500 mg(以培美曲塞计)],化疗第1天静滴75 mg/m2顺铂(国药准字H22022966;规格:6 mL:30 mg)+500 mL氯化钠注射液;②鳞癌:GP方案:化疗第1天和第8 d静滴1 000 mg/m2吉西他滨(国药准字H20133195;规格0.2 g/瓶);化疗第1天静滴75mg/m2顺铂+500 mL氯化钠注射液。
联合组加以重组人血管内皮抑制素(国药准字S20050088;规格:15 mg/2.4×105 U/3 mL/支)治疗,将其加入500 mL生理盐水中,在化疗开始前4 d,采用便携式输液泵持续24 h静脉泵入,1次/d,30 mg/(m2·次)(1.2×105 U/m2),治疗中出现的不良反应按指南要求进行处理。
两组均以21 d为1个疗程,即每次治疗后休息1周行下1次治疗,持续治疗3个疗程。
1.4 观察指标
临床疗效[9]:在治疗完成后,完全缓解(Complete Response, CR):所有的病灶都会消失,并且至少能持续4周;部分缓解(Partial Response, PR):病灶总径缩小范围在>30%,维持时间>4周;病变稳定(Stable Disease, SD):介于PR和PD间,即病变总径在没有达到PR时减少,在没有达到PD的情况下增加;病变进展(Progressive Disease, PD):病灶总径增加>20%,或有新的病变出现。总疗效=(CR例数+PR例数+SD例数)/总例数×100%。
肿瘤标志物:治疗前、治疗结束后,取患者空腹静脉采血3~5 mL,静置2 h后,离心半径15 cm,3 000 r/min离心10 min后的血清,采用ELISA检测血清细胞角蛋白19片段(Cytokeratin 19 Fragment,CYFRA 21-1)、糖类抗原125(Carbohydrate Antigen 125, CA125)、癌胚抗原(Carcinoembryonic Antigen,CEA)。
血管内皮功能:治疗前、治疗结束后,采集患者空腹肘静脉血5 mL,以离心半径13 cm、3 000 r/min离心10 min,取上清,采用贝克曼AU2800型全自动生化分析仪以免疫比浊法检测缺氧诱导因子-1α(Hypoxia Inducible Factors-1α, HIF-1α)、血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)及血管生成素2(Angiopoietin-2, Ang-2)水平。
免疫功能:治疗前、治疗结束后,取患者静脉血3~5 mL,制备单细胞悬液,以流式细胞仪(德国Partec 型号FC 500 MPL)检测全血CD3+、CD4+、CD8+水平,并计算CD4+/CD8+比值。
不良反应发生情况:记录从用药开始至治疗结束后1个月内发生的与治疗相关的不良反应,包含恶心呕吐、皮肤瘙痒、肝功能异常、血小板降低、发热。
1.5 统计方法
使用SPSS 22.0统计学软件分析数据,临床疗效、不良反应情况属于计数资料,用例数(n)和率(%)表示,采用χ²检验;肿瘤标志物水平、血管内皮功能、免疫功能属于计量资料,符合正态分布,用()表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效对比
与化疗组对比,联合组的总有效率高,差异有统计学意义(P<0.05),见表1。
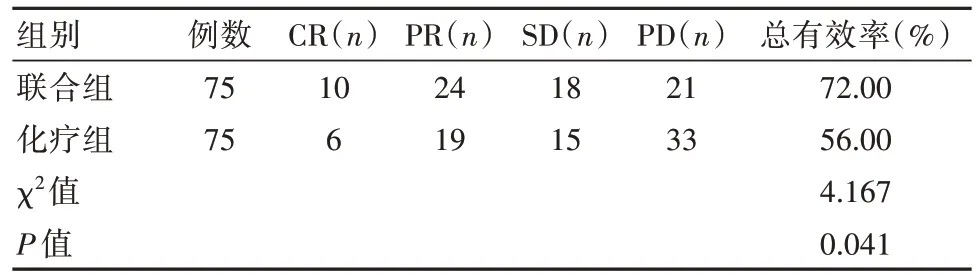
表1 两组患者临床疗效对比
2.2 两组患者肿瘤标志物水平对比
治疗结束后,联合组CYFRA21-1、CA125、CEA均低于化疗组,差异有统计学意义(P均<0.05),见表2。
表2 两组患者肿瘤标志物水平对比()
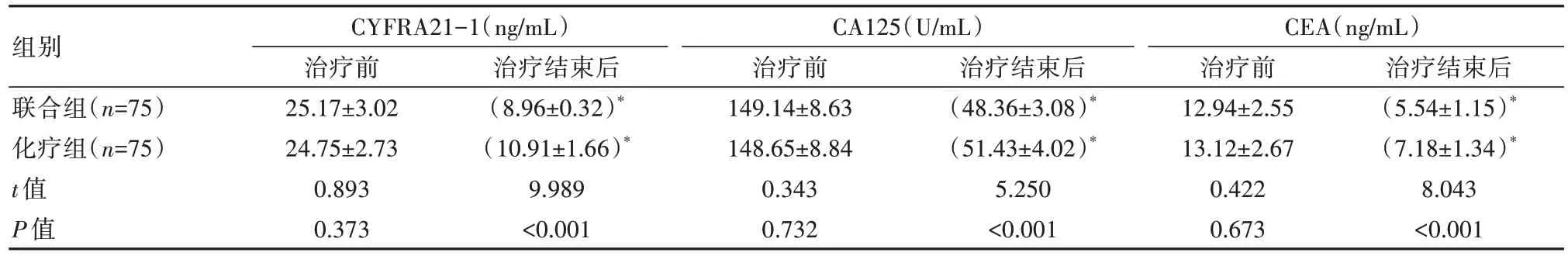
表2 两组患者肿瘤标志物水平对比()
注:CYFRA21-1:血清细胞角蛋白19片段,CA125:糖类抗原125,CEA:癌胚抗原;与治疗前组内比较,*P<0.05。
组别联合组(n=75)化疗组(n=75)t值P值治疗结束后(5.54±1.15)*(7.18±1.34)*8.043<0.001 CYFRA21-1(ng/mL)治疗前25.17±3.02 24.75±2.73 0.893 0.373治疗结束后(8.96±0.32)*(10.91±1.66)*9.989<0.001 CA125(U/mL)治疗前149.14±8.63 148.65±8.84 0.343 0.732治疗结束后(48.36±3.08)*(51.43±4.02)*5.250<0.001 CEA(ng/mL)治疗前12.94±2.55 13.12±2.67 0.422 0.673
2.3 两组患者血管内皮功能对比
治疗结束后,联合组HIF-1α、VEGF、Ang-2均低于化疗组,差异有统计学意义(P均<0.05),见表3。
表3 两组患者血管内皮功能对比()
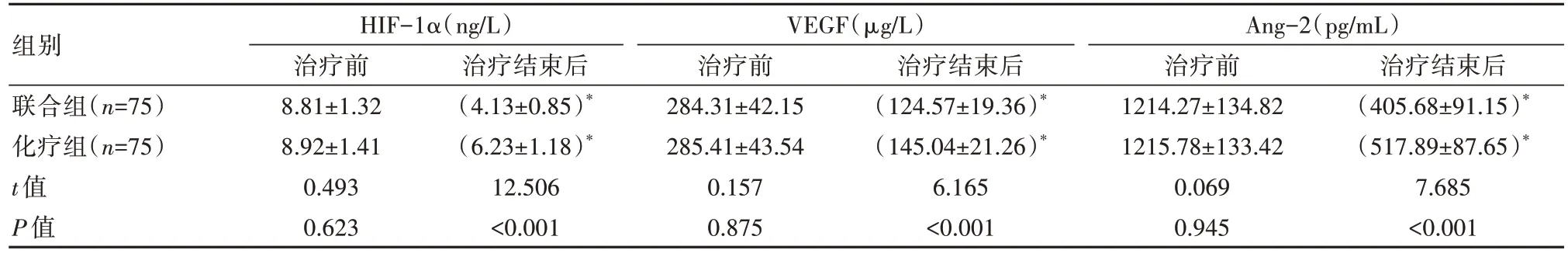
表3 两组患者血管内皮功能对比()
注:HIF-1α:缺氧诱导因子-1α,VEGF:血管内皮生长因子,Ang-2:血管生成素2;与治疗前组内比较,*P<0.05。
组别联合组(n=75)化疗组(n=75)t值P值治疗结束后(405.68±91.15)*(517.89±87.65)*7.685<0.001 HIF-1α(ng/L)治疗前8.81±1.32 8.92±1.41 0.493 0.623治疗结束后(4.13±0.85)*(6.23±1.18)*12.506<0.001 VEGF(μg/L)治疗前284.31±42.15 285.41±43.54 0.157 0.875治疗结束后(124.57±19.36)*(145.04±21.26)*6.165<0.001 Ang-2(pg/mL)治疗前1214.27±134.82 1215.78±133.42 0.069 0.945
2.4 两组患者免疫功能对比
联合组治疗结束后,CD3+、CD4+、CD4+/CD8+高于化疗组,CD8+低于化疗组,差异有统计学意义(P均<0.05),见表4。
表4 两组患者免疫功能对比()

表4 两组患者免疫功能对比()
注:与治疗前组内比较,*P<0.05。
组别联合组(n=75)化疗组(n=75)t值χ2值治疗结束后(2.08±0.66)*(1.16±0.34)*10.732<0.001 CD3+(%)治疗前62.14±5.52 62.47±4.75 0.392 0.695治疗结束后(67.51±5.43)*(64.07±3.21)*4.723<0.001 CD4+(%)治疗前33.75±1.27 33.68±1.54 0.304 0.762治疗结束后(38.42±3.15)*(30.92±2.07)*17.232<0.001 CD8+(%)治疗前24.51±4.57 24.02±4.51 0.661 0.510治疗结束后(19.51±4.78)*(23.74±6.13)*4.7126<0.001 CD4+/CD8+治疗前1.38±0.28 1.40±0.34 0.393 0.695
2.5 两组患者不良反应情况对比
两组不良反应发生率(恶心呕吐、皮肤瘙痒、肝功能异常、血小板降低、发热)对比,差异无统计学意义(P均>0.05),见表5。
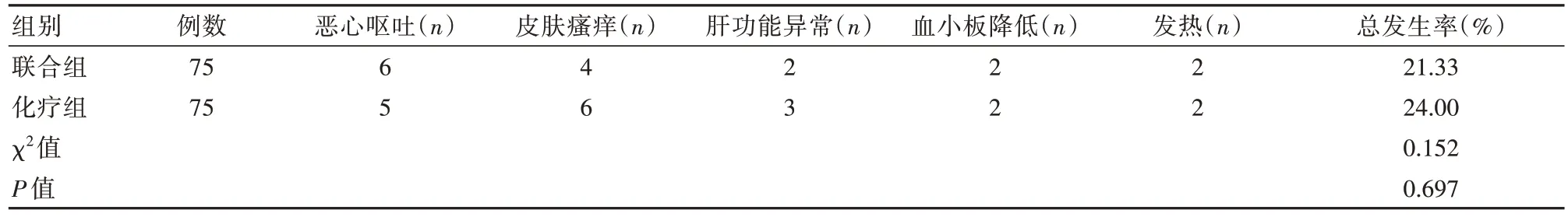
表5 两组患者不良反应情况对比
3 讨论
临床上,肺癌是一种常见的肿瘤,而且由于空气质量的恶化以及居民的生活方式的转变,中国的肺癌患者数量正在持续上升。NSCLC是肺癌中最为常见的病例类型,但由于该病早期症状缺乏特异性,大多数患者在确诊时便已错过最佳手术治疗时间,需采取其他综合治疗方法。其中化疗尤其是以铂为主的联合化疗方案是癌症常见治疗手段,在临床所确诊的NSCLC患者中,约有90%的患者需借助化疗进行治疗,且对该肿瘤疾病的各个阶段都显示出良好的治疗效果[5-7]。
临床报道,在恶性肿瘤的发生和发展过程中,患者的肿瘤标志物指标也会发生相应的变化,这些指标的上升和下降通常反映了肿瘤的严重程度,且血管生成因子在肿瘤血管生成中的作用也不可忽视,其水平与肿瘤的治疗效果具有直接关联[8-11]。在本研究中,治疗后联合组Cyfra21-1为(8.96±0.32)ng/mL、CA125为(48.36±3.08)U/mL、CEA为(5.54±1.15)ng/mL、HIF-1α、VEGF、Ang-2均低于化疗组(P均<0.05),表明二者联合能够有效降低患者肿瘤标志物水平,改善血管内皮功能,马怡等[12]研究显示,治疗后联合治疗组CYFRA21-1、(8.91±1.66)ng/L、CA125(48.43±4.0)μg/L、CEA(5.18±1.34)pg/mL均更低(P均<0.05)一致。分析原因:在于在化疗方案中,培美曲塞作为一种抗叶酸药物,其主要成分吡咯嘧啶可以干扰肿瘤细胞对叶酸的依赖性的新陈代谢,这一点可以从其结构上看出,这样就能够对细胞的复制产生抑制作用,从而阻止肿瘤的扩展。吉西他滨作为嘧啶核苷酸类似物,具有广泛的抗癌谱和独特的作用机制,可直接作用细胞G1/S期,减少血管内皮生长因子,阻断细胞增殖;顺铂为铂类抗癌药,其分子中的铂原子可直接干扰癌细胞DNA复制,减少细胞增殖。而恩度是一种常见的内皮抑制素,可直接作用于VEGF,阻断其信号传导,降低蛋白水解酶的活性,加速内皮细胞凋亡;有学者证实恩度具有时间依赖性,其会随着治疗时间的延长而增强抗肿瘤作用。
NSCLC在中老年人群中的发病率较高,期间患者在长期化疗的影响下,骨髓造血干细胞功能破坏,导致免疫白细胞和血小板急剧减少,对免疫系统产生重大影响,加上患者在自身疾病的消耗下,免疫功能会在一定程度上降低。这也是本研究化疗组单独使用化疗药物后CD3+、CD4+、CD4+/CD8+下降,而CD8+升高的原因。因此,为进一步提高晚期NSCLC患者总体生存率,有学者提出以生物标志物为指导的抗血管靶向药物治疗。本研究将恩度辅助用于化疗治疗,治疗后患者CD3+、CD4+、CD4+/CD8+明显增高,CD8+明显降低(P均<0.05),证明恩度辅助治疗有助于改善化疗患者的细胞免疫功能。分析原因:恩度是治疗晚期癌症特异性血管内皮抑制剂,属于内源性糖蛋白,其与个体化化疗方案结合使用具有良好的生物活性和稳定性,可有效降低蛋白水解酶活性的水平,阻止新生血管向肿瘤细胞内生长,从而限制细胞组织内营养和氧气,以上调免疫细胞应答,增强机体抗肿瘤免疫反应,显著改善患者的免疫系统功能。且本研究结果显示,与化疗组相比,观察组的各种不良反应发生率均未见明显上升趋势,表明恩度联合化疗具有较高安全性,不会导致药物相互作用。
综上所述,持续的静脉注射恩度并配合进行化疗,在晚期NSCLC的治疗中表现出了显著的成效,这种方法有助于大幅度降低患者的血清肿瘤标志物以及血管内皮因子的水平,从而提升了患者的免疫系统功能,以增强对体内肿瘤细胞活性的控制,进而提高临床疗效,且不增加不良反应。

