UPLC-Q-TOF-MS/MS 法分析鉴定鸡血藤中药复方提取物的化学成分
谢灿辉,贾德政,胥爱丽,邬旻珊,肖观林,毕晓黎,张素中,曹颖男*
(1.广州中医药大学 第五临床医学院,广东 广州 510405;2.广东省中医药工程技术研究院 广东省中医药研究开发重点实验室,广东 广州 510095;3.广州新华学院 药学院,广东 广州 510520)
近年来癌症的发病率逐年上升,肿瘤的发生发展与机体的免疫功能低下密切相关。一方面机体免疫系统可通过多种免疫效应机制杀伤和清除肿瘤细胞;另一方面,肿瘤细胞也能通过多种机制抵抗免疫系统对其的杀伤与清除[1-2]。中药在治疗肿瘤方面具有副作用小、多靶点的特点,在提高机体免疫力方面有很大优势,因此,以中医药调护机体、增强免疫力来治疗癌症的方法越来越受关注。
鸡血藤中药复方选取临床的抗肿瘤中药验方,在结合肿瘤病因确立的治则治法上优化筛选出以鸡血藤、重楼、莪术、柴胡组成的中药复方(发明专利授权号CN106237265B),该中药复方的抗肿瘤作用机制与免疫调节有高度相关性。尽管上述四味中药均进行过系统的化学成分分析,但中药复方发挥治疗作用具有多成分、多靶点、多途径整体调节的特点,各药味组成中药复方后,其化学成分可能会发生变化,多味药之间可能会产生相互作用从而生成新的化学成分[3]。因此,对中药复方的化学成分进行快速鉴定分析,获取尽可能多的化学成分信息,对于研究化学成分与药效之间的关系有十分重要的作用。
超高效液相色谱-四极杆-飞行时间串联质谱(UPLC-Q-TOF-MS/MS)技术广泛用于中药复方的多成分分析,具有灵敏度高、分辨率高、分离效率高和扫描速度快的特点,可为中药药效物质基础研究提供重要参考[4-5]。本实验采用UPLC-Q-TOF-MS/MS 技术,通过离子碎片推测化学成分可能的裂解途径,实现对鸡血藤中药复方提取物中化学成分的快速分离鉴定,为进一步研究鸡血藤中药复方药效物质基础提供了依据。
1 实验部分
1.1 材料、试剂与仪器
阿魏酸(批号110773-201313,纯度99.6%)、儿茶素(批号110877-201203,纯度96.6%)、表儿茶素(批号110878-200102,纯度99.7%)、原儿茶酸(批号110809-201906,纯度97.7%)、原儿茶醛(批号813-9201)、咖啡酸(批号110885-200102)、柴胡皂苷a(批号110777-201510,纯度93.2%)、柴胡皂苷d(批号110778-201208,纯度94.6%)、大豆苷(批号111738-201302,纯度91.3%)、大豆苷元(批号1502-200101)、绿原酸(批号110753-202119,纯度96.2%)、重楼皂苷I(批号111590-202105,纯度94.5%)、重楼皂苷Ⅱ(批号111591-201604,纯度91.4%)、重楼皂苷Ⅵ(批号111592-201203,纯度95.1%)、重楼皂苷Ⅶ(批号111593-202105,纯度98.4%)、芒柄花素(批号111703-200603)、染料木苷(批号111709-201702,纯度99.9%)、吉马酮(批号111655-201204)、莪术醇(批号100185-200405)对照品均购自中国食品药品检定研究院;异绿原酸B(批号RDD-Y06911812012,纯度98%)、隐绿原酸(批号AF9080321,纯度98%)、新绿原酸(批号RDD-X01402112013,纯度98%)对照品均购自成都瑞芬思生物科技有限公司;异绿原酸A(批号RDD-Y06911812012,纯度98%)对照品购自成都瑞芬思德丹生物科技有限公司;柴胡皂苷b2(批号MUST-19032104,纯度99%)对照品购自成都曼思特生物科技有限公司。以上未标明纯度的对照品的纯度均大于98%。
实验用水为屈臣氏蒸馏水,甲醇、乙腈、甲酸均为质谱纯(美国Fisher Chemical 公司),其余试剂均为分析纯。鸡血藤(批号210501,产地广东)、北柴胡(批号220502,产地陕西)、莪术(批号220601,产地广西)、重楼(批号220501,产地云南)购自广州至信中药饮片有限公司,以上药材均经广东省第二中医院(广东省中医药工程技术研究院)刘法锦研究员鉴定。
Sorvall Legend Micro 17R 型微量离心机(美国Thermo Scientific 公司);XS205 型电子分析天平(十万分之一,瑞士Metter-Toledo 公司);ExionLC AC 型液相色谱仪(日本岛津公司);X500R 质谱仪(美国AB Sciex公司)。
1.2 复方样品制备
取莪术45 g,置于圆底烧瓶中,加入14倍量水,水蒸气蒸馏法提取挥发油5 h,冷却后移取挥发油并冷藏。药渣与60 g 鸡血藤、45 g 柴胡、45 g 重楼置于圆底烧瓶中,加入6 倍量水,加热回流2 h,提取3 次,合并水煎液,70 ℃减压干燥至干。刮取干膏,将其研磨成细粉,喷入挥发油,即得鸡血藤中药复方样品。
1.3 溶液配制
1.3.1 供试品溶液精密称取鸡血藤中药复方样品粉末0.25 g 置于锥形瓶中,加入70%甲醇10 mL,超声处理30 min。将提取液以12 000 r/min 离心10 min,取上清液用0.22 µm 微孔滤膜过滤,即得鸡血藤中药复方供试品溶液。
1.3.2 对照品溶液精密称取各对照品适量,置于10 mL 棕色瓶中,甲醇超声溶解,室温放置澄清,以12 000 r/min离心10 min,取上清液用0.22 µm微孔滤膜过滤,即得混合对照品溶液。
1.4 实验方法及数据处理
1.4.1 色谱条件色谱柱:Waters ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 µm);流动相:0.1%甲酸水溶液(A)-乙腈(B);流速:0.3 mL/min;柱温:30 ℃;进样量:1 µL。梯度洗脱:0~3 min,95%~85% A;3~7 min,85%~75% A;7~13 min,75%~67% A;13~24 min,67%~55% A;24~34 min,55%~35% A;34~36 min,35%~20% A;36~40 min,20%~2% A;40~44 min,2% A;44~45 min,2%~95% A;45~50 min,95% A。
1.4.2 质谱条件电喷雾离子源(ESI);正、负离子模式喷雾气压:5.5、-4.5 kV,裂解电压:100、-80 V,毛细管电压:5.5、-4.5 kV,碰撞能量:35、-35 eV,质量扫描范围:m/z100~1 000,离子源温度:500 ℃,气帘气压力:35 psi(1 psi≈6.895 kPa),雾化气与辅助气压力:55 psi。
1.4.3 数据处理通过查阅CNKI、SciFinder、ChemicalBook、PubChem、TCM systematic Pharmacology Database and Analysis Platform 等平台或数据库,对鸡血藤中药复方中化学成分的相关数据进行收集整理,构建鸡血藤中药复方本地化学成分数据库。采用SCIEX OS 3.1.0软件进行峰提取、峰匹配分析处理,在满足质量偏差≤5,同位素丰度比≤5,数据库匹配得分≥90 的基础上,与数据库中化合物的准分子离子峰、碎片裂解规律进行对比分析,最终鉴定化合物的结构。
2 结果与讨论
鸡血藤中药复方提取物的UPLC-Q-TOF-MS/MS 总离子流图见图1。共鉴别出82种成分,包括黄酮类22种,苯丙素类24种,萜类25种,酚酸类4种,甾体类6种,氨基酸类1种。上述成分中,24种归属于鸡血藤,16 种归属于莪术,27 种归属于柴胡,11 种归属于重楼,来源于多种药味的成分有6 种。从鸡血藤中药复方中新发现的在处方药材中未见报道的成分有10种(见表1)。

表1 鸡血藤中药复方提取物化学成分的UPLC-Q-TOF-MS/MS 鉴定与分析Table 1 UPLC-Q-TOF-MS/MS identification and analysis of chemical components in Jixueteng formula extract
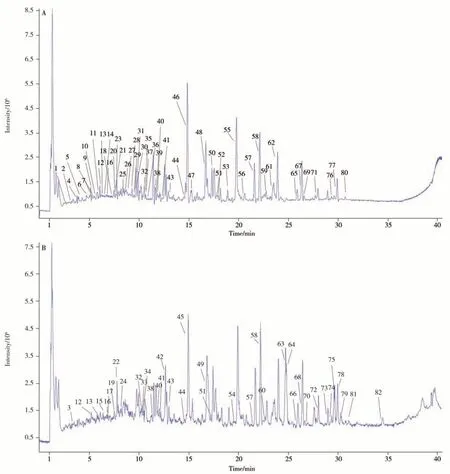
图1 鸡血藤中药复方提取物在负(A)、正(B)离子模式下的基峰色谱图Fig.1 Base peak chromatograms of Jixueteng formula extract in negative(A) and positive(B) ion modes
2.1 主要化合物的鉴定和归属
2.1.1 黄酮类黄酮类化合物是一种次生代谢产物,存在于各种植物中。其是以3个碳原子和2个苯环连接而成的化合物,并以C6-C3-C6结构为基本母核。在鸡血藤中药复方中,黄酮类化合物的主要来源是鸡血藤药材。该类化合物是鸡血藤抗肿瘤和抗贫血的主要活性成分。在电喷雾质谱中,黄酮类化合物易脱去糖基,并丢失中性碎片离子-O、-CO、-H2O、-CO2。此外,也容易发生逆狄尔斯-阿尔德反应(RDA)裂解[6]。化合物9 和13 在负离子模式下的分子离子峰均为m/z289.071 1[M-H]-,推断其分子式均为C15H14O6,在裂解过程中脱落一分子CO2和一分子C6H6O2,形成m/z245.0818[M-H-CO2]-、m/z179.035 0[M-H-C6H6O2]-,两个化合物互为同分异构体。经文献[6]与对照品对比,确认化合物9为儿茶素,化合物13为表儿茶素,儿茶素可能的质谱裂解途径见图2A。化合物4在负离子模式下的分子离子峰为m/z153.019 3[M-H]-,推断分子式为C7H6O4,在二级质谱中产生m/z109.028 9[M-H-CO2]-碎片离子,与文献[7]及对照品比对,鉴定为原儿茶酸,可能的质谱裂解途径见图2B。异黄酮为黄酮类的异构体,其母核为3-苯基色原酮,当其结构存在甲氧基取代时,在负离子模式下易产生CH3碎片。化合物32 在负离子模式下的分子离子峰为m/z475.1234[M-H]-,在二级质谱图中产生m/z267.065 9[M-HC6H10O5]-和m/z252.043 2[M-H-C6H10O5-CH3]-碎片离子,通过质谱信息与文献[5]对比,推断该化合物为芒柄花苷,可能的质谱裂解途径见图2C。
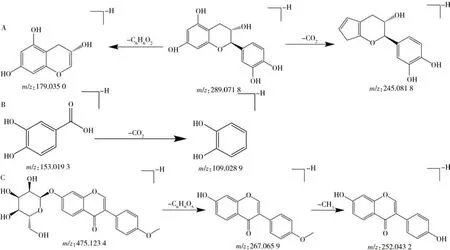
图2 儿茶素(A)、原儿茶酸(B)、芒柄花苷(C)的质谱裂解途径Fig.2 Fragment pathways of catechin(A),protocatechuic acid(B) and ononin(C)

(续表1)
2.1.2 萜 类萜类化合物是自然界中重要的有机化合物之一,半萜类、单萜类、二萜类和三萜类等天然萜类化合物被发现具有强大的抗肿瘤、抗炎和抑菌活性。萜类化合物有多种母核类型,均由同一生源途径衍生而来。大多数萜类化合物具有双键、共轭双键和活泼氢,许多萜类化合物还含有内酯结构。在鸡血藤中药复方中,萜类化合物的主要来源是莪术药材,部分来源于重楼和柴胡。化合物82在正离子模式下产生的分子离子峰为m/z219.1743[M+H]+,脱去1分子H2O生成碎片离子m/z201.1647[M+H-H2O]+,再脱去1 分子C6H8,生成碎片离子m/z105.0700[M+H-H2O-C6H8]+。经与文献[7]和对照品比对,确认化合物82 为吉马酮,可能的质谱裂解途径见图3A。化合物79 在正离子模式下的分子离子峰为m/z231.1369[M+H]+,二级质谱中检测到碎片离子m/z213.1273[M+H-H2O]+和m/z203.1439[M+H-C2H4]+,结合文献[8],推测为莪术酮,可能的质谱裂解途径见图3B。柴胡皂苷在负离子模式下常与羧酸形成加合离子,化合物57在一级质谱中检测到加合离子m/z825.4642[M+HCOO]-,在二级质谱中出现未加合的分子离子峰m/z779.4558[M-H]-,脱去1 分子糖后,生成碎片离子m/z617.4051[M-H-Glu]-。经与文献[9]和对照品比对,确认化合物57为柴胡皂苷a,可能的质谱裂解途径见图3C。
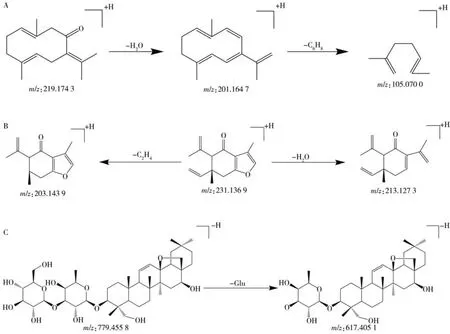
图3 吉马酮(A)、莪术酮(B)、柴胡皂苷a(C)的质谱裂解途径Fig.3 Fragment pathways of germacrone(A),curzerenone(B) and saikosaponin a(C)
2.1.3 苯丙素类苯丙素类化合物是一类由苯环和3个碳链连接而成的天然化合物,在植物中广泛分布。在鸡血藤中药复方中,苯丙素类化合物主要来自柴胡药材。大多数苯丙素类化合物是苯丙酸类化合物,在ESI 电离条件下与奎宁酸脱水成酯,并且易发生脱氧奎宁酸的中性丢失,从而生成相应的苯丙酸碎片离子。以化合物8为例,在负离子模式下分子离子峰为m/z353.0878[M-H]-,通过酯键裂解,中性丢失咖啡酰基,产生奎宁酸分子离子m/z191.0563[M-H-C9H6O3]-,通过与文献[10]和对照品比对,确认为绿原酸,可能的质谱裂解途径见图4A。化合物23在负离子模式下的分子离子峰为m/z193.0506[M-H]-,其二级质谱碎片离子为m/z178.0274[M-H-CH3]-、m/z134.0369[M-H-CH3-CO2]-。结合裂解规律,并与文献[11]和对照品比对,确认化合物23 为阿魏酸,可能的质谱裂解途径见图4B。化合物27 在负离子模式下的分子离子峰为m/z515.1195[M-H]-,失去1 分子C9H6O3得到m/z353.0882[M-HC9H6O3]-碎片离子,继而发生脱氧奎宁酸的中性丢失,再失去1 分子C7H10O5,得到离子碎片m/z179.3040[M-H-C9H6O3-C7H10O5]-。通过与文献[12]及对照品比对,确认化合物27为异绿原酸A,可能的质谱裂解途径见图5。
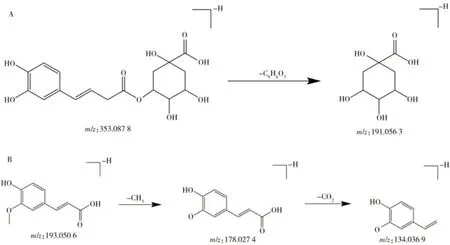
图4 绿原酸(A)和阿魏酸(B)的质谱裂解途径Fig.4 Fragment pathways of chlorogenic acid(A) and ferulic acid(B)

图5 异绿原酸A的质谱裂解途径Fig.5 Fragment pathways of isochlorogenic acid A
2.1.4 甾体类甾体类化合物具有环戊烷并氢化菲的环系结构,常与糖结合以皂苷的形式存在。鸡血藤中药复方中的甾体类化合物较少,主要来源于重楼药材,其中重楼皂苷为主要的活性成分。重楼皂苷在质谱条件下易发生脱糖基、H2O、CO2以及苷元等基团,但较少出现分子离子加合峰及苷元的碎片峰信号。化合物73 在正离子模式下产生分子离子峰m/z723.4314[M+H]+,在二级质谱中得到m/z579.3153[M+H-Rha]+、m/z433.2575[M+H-Rha-Glu]+的碎片离子,经与文献[13]对比,推测该化合物为重楼皂苷V,可能的质谱裂解途径见图6A。化合物41 在正离子模式下检测到的分子离子峰为m/z885.4842[M+H]+,在二级质谱中可检测到失去一分子葡萄糖的碎片离子m/z723.4321[M+H-Glu]+,该碎片离子失去一分子鼠李糖基得到碎片离子m/z579.3148[M+H-Glu-Rha]+,继续丢失1个葡萄糖基得到碎片离子m/z415.3217[M+H-Glu-Rha-Glu]+。对比文献[14]中的裂解规律,推测化合物41 为纤细薯蓣皂苷,可能的质谱裂解途径见图6B。

图6 重楼皂苷V(A)和纤细薯蓣皂苷(B)的质谱裂解途径Fig.6 Fragment pathways of paris saponin V(A) and gracillin(B)
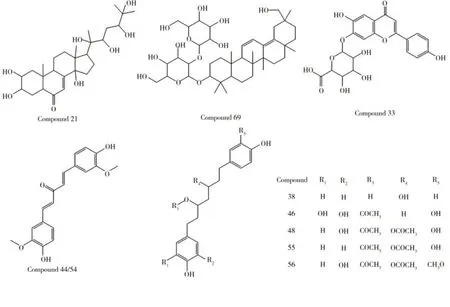
图7 鸡血藤中药复方的10种新成分Fig.7 10 New components of Jixueteng formula extract
2.2 讨 论
鸡血藤中药复方的化学成分复杂,以黄酮类、苯丙素类、萜类化合物为主,且大多数与肿瘤发病机制有关。黄酮类化合物有着广泛的抗肿瘤机制,可通过抑制细胞增殖、对化疗增效减毒、诱导细胞自噬等多个机制起到抗肿瘤作用[15]。文献表明,鸡血藤中的芒柄花素、甘草素、表儿茶素等黄酮类成分可显著抑制裸鼠移植模型中乳腺癌细胞(MCF-7)的生长,同时还可抑制癌细胞转移[16]。苯丙素类化合物也具有广泛的抗肿瘤作用。该类化合物主要来源于莪术和柴胡,以莪术醇为例,莪术醇具有非常好的抗肿瘤作用,可通过调控相关肿瘤的基因表达、抑制肿瘤组织血管的生成、影响细胞分化、抑制肿瘤细胞增殖并阻止肿瘤发生侵袭和转移等多种作用途径来发挥抗肿瘤功效[17]。萜类化合物来源于柴胡与重楼,主要以皂苷类化合物为主,其中柴胡皂苷a、d 可通过诱导细胞凋亡、抑制细胞增殖和生长、提高机体免疫功能等方式发挥抗肿瘤作用,且在宫颈癌、肝癌、肺癌等研究中均表现出显著的治疗效果[18];重楼皂苷可通过抑制肿瘤细胞增殖、诱导肿瘤细胞程序性死亡、增加肿瘤细胞对化疗药物的敏感性、抑制肿瘤细胞迁移与侵袭、与其他药物协同作用来发挥抗肿瘤作用[19]。
此外,在鸡血藤中药复方中还发现了药材中未见报道的10种新成分,推测为中药复方制备过程中多味药的成分相互作用产生。化合物21 和69,根据其结构式推断为四环三萜类和五环三萜类化合物,这两类化合物在抗肿瘤、调节血脂、保肝和免疫调节方面显现出较高的药理活性[20]。芹菜素-7-O-β-D-葡萄糖醛酸苷是由芹菜素的7位羟基结合1分子的β-D-葡萄糖醛酸而成,具有很强的抗癌、抗氧化等药物活性[21]。木脂素类化合物为苯丙素类的一种,具有广泛的生物活性,可诱导癌细胞凋亡、逆转肿瘤细胞耐药性、抑制细胞增殖、抗血管生成等抗肿瘤作用[22-23]。化合物38、44、46、48、54、55、56 从结构式可推断为木脂素类化合物,由此推测可能与上述抗肿瘤药效相关,其中,化合物44和54互为同分异构体。鸡血藤中药复方中的抗肿瘤成分众多,不同类型、不同来源的活性成分可通过协同或互补作用,实现多成分、多通路、多靶点综合治疗的效果。在本实验中未能检测到某些已知成分,可能与ESI的离子化效率有关。此外,部分难以区分的同分异构体结构只依靠四极杆-飞行时间串联质谱进行确认存在一定的局限性。因此,需要进一步结合其他波谱分析技术确认这些成分的存在。
3 结 论
本实验采用UPLC-Q-TOF-MS/MS 技术分析鸡血藤中药复方提取物中的化学成分,通过本地数据库与色谱峰信息对比分析,共鉴别出82种化合物,以黄酮类、苯丙素类、萜类化合物为主。并发现该复方药材中未见报道的新成分10种,其药理作用可能与鸡血藤中药复方的抗肿瘤功效相关。研究结果丰富和完善了鸡血藤中药复方的化学成分库,为鸡血藤中药复方药效物质基础研究及质量控制方法建立提供了重要依据。

