胸壁窦道病人应用富血小板血浆凝胶联合负压封闭引流的临床疗效观察
郭忠梁 刘元媛 刘应平 王静 徐敏 王国昌
胸壁窦道通常需给予手术治疗,若存在慢性窦道,则需在全身抗感染及抗结核治疗后,完全切除窦道及胸壁结核病灶,但伤口较难愈合,通常在清创术后需给予负压封闭引流(vacuum sealing drainage,VSD)治疗,VSD、清创、皮瓣移植、换药、植皮等是促进伤口愈合的方式,临床需根据不同伤口给予不同治疗手段[1-2]。伤口愈合延期后会形成窦道,若处理不当会导致窦道坏死,加重感染[3]。水凝胶、水胶体、泡沫、藻酸盐及银离子敷料是治疗窦道的敷料,但传统换药对创面改善有限,无法行皮瓣移植修复术,预后不佳[4]。富血小板血浆凝胶(autologous platelet-rich gel,APG)是促进创面愈合的新型方式[5]。有研究证实,APG+VSD在难愈性创面中具有一定效果[6-7]。本研究探讨APG+VSD在胸壁窦道中应用效果。
对象与方法
一、对象
2019年10月~2021年3月收治的胸壁窦道病人89例,采用随机数表法分为观察组(45例)及对照组(44例)。观察组采用APG+VSD治疗,对照组采用VSD治疗。纳入标准:(1)均诊断为胸壁窦道;(2)窦道经标准治疗1个月后无好转;(3)均为单纯窦道;(4)均知情并自愿参与本项研究。排除标准:合并严重凝血功能障碍及血小板减少症;合并重要脏器功能障碍;合并除肺癌、食管癌以外的恶性肿瘤;免疫功能异常;糖尿病。均签署我院伦理委员会出具的知情同意书。
二、方法
两组均给予常规处理:全麻后行清创术,将窦道腔中内分泌物排尽,并送细菌培养,在创面新鲜后再次清创至有少量渗血;同时对结核窦道给予抗结核治疗。
1.对照组:采用VSD进行治疗:根据创面面积采用负压泡沫材料覆盖创面区域,放置冲洗管及抽吸管,并用无菌贴膜将创面封闭,采用甲硝唑+庆大霉素+生理盐水对创面进行冲洗,启动5分钟后暂停2分钟(间歇模式),负压值-10.6至-8.0 kPa。每10天更换一次敷料,常规给予抗生素治疗1周。
2.观察组:采用APG+VSD治疗,VSD治疗10天,抽取病人外周静脉血,离心后去除下层红细胞后,留置血小板层及血浆层,离心5分钟,获取自体富血小板血浆(platelet-rich plasma,PRP)10 ml。制备APG(在符合感控要求的专用治疗室或层流手术室进行,严格遵照相关制备系统的操作流程):将PRP及凝血酶-钙按照10∶1比例混合后,凝固则形成APG。采用长针注射部分PRP至窦道壁中,随后将APG缓慢填充进窦道,采用水胶体敷料及藻酸盐敷料将其覆盖,并给予无菌敷料包扎,每2天更换一次敷料,1周后更换窦道中APG。
3.观察指标:(1)依据文献评估疗效[8]:治愈:窦道完全封闭,且窦道口上皮化;有效:窦道口未完全封闭,但明显缩小,窦道腔消失;无效:窦道体积无明显变化;有效率:治愈、有效例数之和占总例数比率。(2)记录并比较两组窦道恢复情况,包括窦道封闭时间、创面愈合时间、住院时间、二次修复手术率、窦道复发率。(3)抽取病人治疗前和治疗后2周清晨空腹血,离心后取上清液保存待检,并采用ELISA法检测病人炎症因子水平,包括C反应蛋白(CRP)、白细胞计数(WBC)、肿瘤坏死因子(TNF)-α。采用疼痛视觉模拟评分(VAS)评估病人治疗前和治疗后2周疼痛情况。(4)细菌培养 :在治疗前及治疗后2周应用生理盐水,对创面进行冲洗,清除坏死组织后用一次性培养管蘸取渗液,进行细菌培养,阳性率为阳性例数占总例数比率。(5)瘢痕状态评估:在创面预合后1个月、2个月采用温哥华瘢痕量表(VSS)对两组瘢痕增生情况进行评估,共16个等级,从瘢痕血管分布、柔软度、色泽及厚度对瘢痕进行评估。(6)记录两组不良反应发生率,包括皮肤过敏、局部刺痛、创面红肿、局部感染。
三、统计学方法
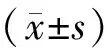
结果
1.两组一般资料比较见表1。两组一般资料比较,差异无统计学意义(P>0.05)。
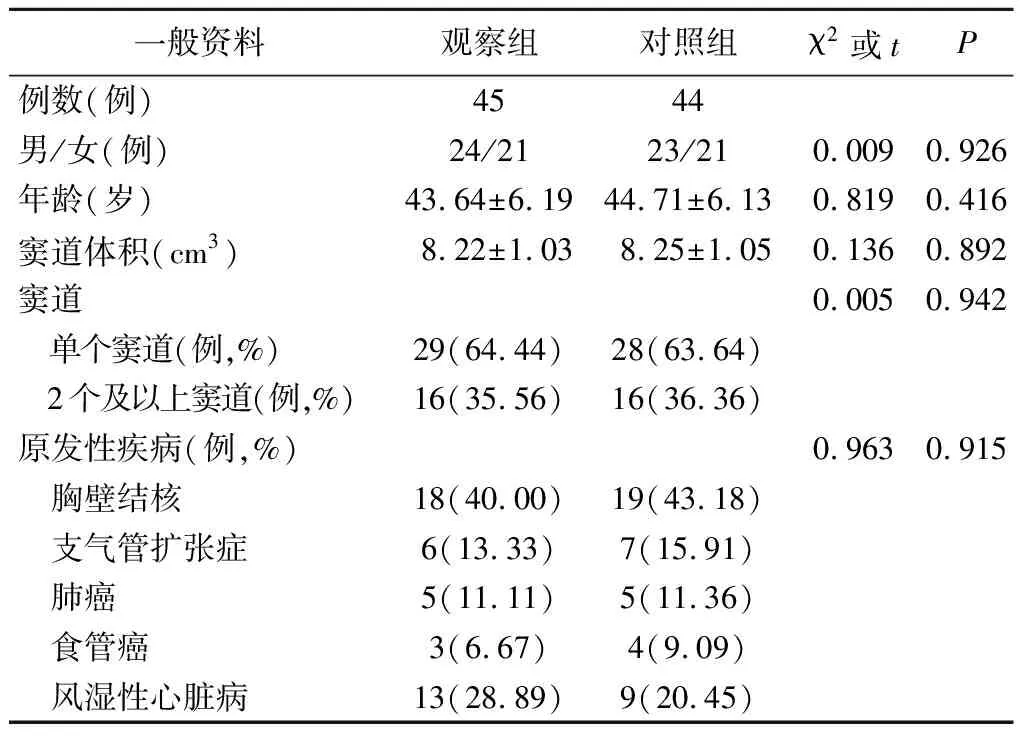
表1 两组一般资料对比
2. 两组疗效对比见表2。结果表明,两组临床总有效比较,差异有统计学意义(P<0.05)。

表2 两组疗效比较(例,%)
3.两组窦道愈合情况比较,见表3。观察组窦道封闭时间、创面愈合时间、住院时间均短于对照组,二次修复手术率、窦道复发率低于对照组,差异有统计学意义(P<0.05)。

表3 两组窦道愈合情况比较
4.两组治疗前后炎症因子水平及VAS评分比较,见表4。 治疗前两组CRP、WBC、TNF-α、VAS评分比较,差异无统计学意义(P>0.05)。观察组治疗后CRP、WBC、TNF-α、VAS评分均低于对照组,差异有统计学意义(P<0.05)。

表4 两组治疗前和治疗后2周炎症因子水平及VAS评分比较
5.两组治疗前后创面细菌培养阳性率比较 :治疗前两组创面细菌培养阳性率比较,差异无统计学意义(P>0.05),治疗后1周、2周,观察组创面细菌培养阳性率低于对照组,差异有统计学意义(P<0.05),见表5。

表5 两组治疗前后创面细菌培养阳性率比较(例,%)
6.两组创面愈合后VSS评分比较见表6。结果表明,观察组创面愈合后1个月、2个月VSS评分低于对照组,差异有统计学意义(P<0.05)。

表6 两组创面愈合后VSS评分比较
7.两组不良反应比较见表7。观察组不良反应发生率低于对照组,差异有统计学意义(P<0.05)。

表7 两组不良反应比较(例,%)
8.见图1A、B、C、D 。 A:入院时照片,胸骨手术术后窦道形成3+月,在院外门诊换药窦道未见明显闭合,窦道长大约15 cm,多个皮肤窦道形成,创腔内宽深度均1 cm,开胸术后窦道无胸骨骨髓炎; B:APG凝胶; C:床旁清创,填塞的APG凝胶,联合负压治疗; D:术后半年随访照片。

A:入院时照片,胸骨手术术后窦道形成3+月,在院外门诊换药窦道未见明显闭合,窦道长大约15 cm,多个皮肤窦道形成,创腔内宽深度均1 cm,开胸术后窦道无胸骨骨髓炎; B:APG凝胶; C:床旁清创,填塞的APG凝胶,联合负压治疗; D:术后半年随访照片
讨论
经胸骨手术创伤较大,术后病人免疫功能低下,体质减弱,极易并发多种内科慢性疾病,愈合能力欠佳,且一旦形成局部感染,可能会引起分泌物在胸骨固定钢丝上附着后侵袭周边组织,形成感染性窦道,增加临床治疗难度[9]。传统的清创、换药方式治疗时间长,引流效果难以保证,导致无法有效控感染,甚至出现感染加重,累及深部纵隔形成脓疮[10]。本研究结果表明,APG联合VSD治疗胸壁窦道效果显著优单独应用VSD治疗,可能是因为VSD技术可在对创面进行临时闭合处理后充分引流,有效促进肉芽组织生长,控制感染,减少内液渗出。PRP是一类血浆衍生物,其血小板浓度至少高于基线浓度的2倍,且含有大量生物因子和细胞因子,覆盖于瘘口,对瘘口起到有效的“封堵修补”的作用。PRP制备的APG在激活后可释放多种生长因子,一方面通过生物效应促进主要修复细胞的增殖分化,还可加快基质干细胞的分化,进一步加快细胞外基质(ECM)及纤维蛋白合成,促进窦道愈合[11-12]。本研究还发现,观察组窦道封闭时间、创面愈合时间、住院时间均显著短于对照组,二次修复手术率、窦道复发率低于对照组,提示APG联合VSD治疗可有效促进胸壁窦道恢复,并降低复发率及二次修复率。APG是在病人自身血液中提取的血小板浓缩液,血小板含量相对较高,且来源于病人自身,制备简便,且APG通过内分泌、自分泌方式促进周围组织分泌生长因子时间长达6周以上,可长时间促进机体中生长因子分泌降低复发率。PRP为自身血浆,其中含有大量营养物质,可为创面生长提供有利条件,促进恢复。
本研究发现,治疗后两组CRP、WBC、TNF-α、VAS评分均显著降低,且观察组以上指标均明显低于对照组,提示APG联合VSD治疗胸壁窦道,可有效降低机体炎症反应及疼痛程度,究其原因:APG是按病人血液中成分存在不同升降系数,采取离心方式提取血液中的血小板,故APG富含血小板,亦具有高浓度的纤维蛋白和白细胞,而白细胞可在机体感染及炎症反应中增强机体抗感染能力,降低机体炎症反应。本研究发现,APG联合VSD治疗胸壁窦道可有效抑制细菌生长,可能是因为APG中具有一定数量的白细胞,可在一定程度上抑制创面细菌生长。本研究中,观察组创面愈合后1个月、2个月VSS评分均显著低于对照组,提示APG联合VSD治疗胸壁窦道后,可减轻创面瘢痕状态。APG为自身血液提取,更能有效促进机体分泌高浓度生长因子,其比例较适合病人自身,避免单一生长因子浓度过高而导致纤维细胞或靶细胞过度增殖,创面组织可按需生长,因此产生的瘢痕相对较小。本研究还发现,观察组不良反应发生率低于对照组,提示APG联合VSD治疗胸壁窦道可降低机体不良反应发生率。
综上,APG联合VSD治疗胸壁窦道可降低机体炎症反应、疼痛程度,抑菌效果较佳,促进术后恢复。本研究虽研究时间跨度较大,但研究病例数较少,可能会导致研究结果存在一定偏差,且对于该治疗方案的成本-效益未进行探讨,相关结论及临床应用价值有待探究。APG联合VSD应用于常规细菌感染引起的窦道有较好的治疗作用,但是对于结核形成的窦道,需要慎重,相关报道较少,实用性如何仍有待考究。

