肝硬化病人血清lncRNA TUG1表达水平与肝功能、肝纤维化程度的相关性研究
李轶 尚立
肝硬化是肝脏慢性纤维化的终末期[1],肝纤维化是肝硬化进展的主要过程和必经阶段[2]。早期识别和治疗肝纤维化,有利于改善肝硬化疾病预后。有研究表明,长链非编码RNA牛磺酸上调基因1(long non-coding ribonucleic acid taurine up-regulated gene 1,lncRNA TUG1)可通过促纤维化相关基因的表达,加速肝纤维化的进展[3]。lncRNA TUG1在脂多糖诱导的肝细胞炎症中表达上调[4]。lncRNA TUG1可加速肝纤维化进展,而肝纤维化是肝硬化进展的必经阶段。因此推测,lncRNA TUG1可能通过促进肝纤维化参与肝硬化疾病进展。本研究探讨肝硬化病人血清lncRNA TUG1表达水平与肝纤维化和肝硬化的关系,以期为逆转或消退肝纤维化、治疗肝硬化提供相关线索。
对象与方法
一、对象
2020年2月~2022年6月本院收治的Child-Pugh分级C级的肝硬化病人92例,为肝硬化组,均为乙型肝炎肝硬化,男38例,女54例,年龄中位数为50岁。根据国内S2000标准对病人进行肝纤维化分级:S0~S4级,其中S0、S1、S2级归为轻中度纤维化(轻中度组,61例),S3、S4级归为重度纤维化(重度组,31例)。同期88例本院健康体检者为对照组,男33例,女55例,年龄中位数为50岁。纳入标准:(1)均经临床症状、血液学、腹部超声检查确诊,诊断符合中华医学会肝病学分会制订的诊治指南[5];(2)一般资料完整;(3)自愿参与本研究且签署同意书;(4)非酒精、药物等不良生活习惯引起的肝炎、肝硬化。排除标准:近6个月内接受过激素、干扰素等治疗;有肝外胆道梗阻性疾病;全身性炎症疾病、其他肝病或病毒感染;有精神疾患。
二、方法
1.血清lncRNA TUG1测定:采集对照组体检当天及肝硬化病人入组第二天(治疗前)清晨空腹静脉血,每分钟3 000转离心15分钟,分离血清,置于-80 ℃条件保存待测。依照RNA提取试剂盒说明提取血清总RNA,紫外分光光度计测定浓度和纯度,260 nm、280 nm波长处吸光度值处于1.8~2.1之间鉴定为合格,依照反转录试剂盒将提取的RNA反转录为cDNA。采用荧光定量PCR(qRT-PCR)法对lncRNA TUG1及其内参GAPDH进行扩增,序列见表1。qRT-PCR反应体系:cDNA模板(50 ng/μl)1 μl,上下游引物(10 μmol/L)各0.5 μl,SYBR Green qPCR Mix(2×)(美国EZBioscience公司)5 μl,ddH2O加之10 μl。反应条件:95 ℃预变性1分钟;95 ℃变性30秒,58 ℃退火30秒,72 ℃延伸30秒,45个循环后终止。为减小误差,每个样品重复3次,反应终止后采用2-ΔΔCT法计算lncRNA TUG1相对表达量。
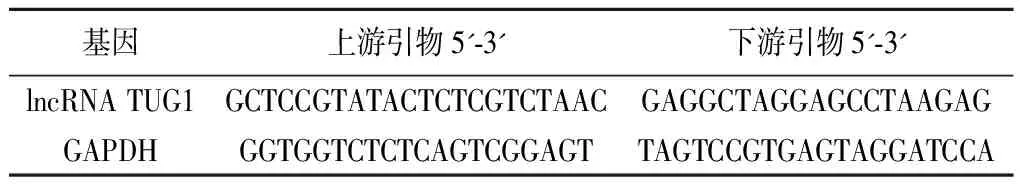
表1 qRT-PCR引物序列
2.肝功能指标、肝纤维化指标检测:采用全自动生化分析仪测定血清丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)水平,采用酶联免疫吸附(ELISA)法测定肝纤维化指标层黏连蛋白(LN)、Ⅲ型前胶原肽(PⅢP)、Ⅳ型胶原(CⅣ)水平,采用全自动荧光定量PCR仪检测血清乙型肝炎病毒DNA(HBV DNA)水平。
3.治疗方法:肝硬化病人入组后均口服恩替卡韦分散片,每次0.5 mg,每天1次。
三、统计学方法
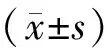
结果
1.对照组、肝硬化组血清lncRNA TUG1、肝功能指标、肝纤维化指标水平比较:肝硬化组血清lncRNA TUG1、ALT、AST、TBIL、LN、PⅢP、CⅣ水平均高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组血清lncRNA TUG1、肝功能指标、肝纤维化指标水平比较
2.肝硬化病人不同肝纤维化程度组一般资料及lncRNA TUG1、肝功能指标、肝纤维化指标比较:重度组肝硬化病程、HBV DNA、lncRNA TUG1、ALT、AST、TBIL、LN、PⅢP、CⅣ均显著高于轻中度组,差异有统计学意义(P<0.05)。两组性别、BMI、乙肝家族史比较,差异均无统计学意义(P>0.05)。见表3。
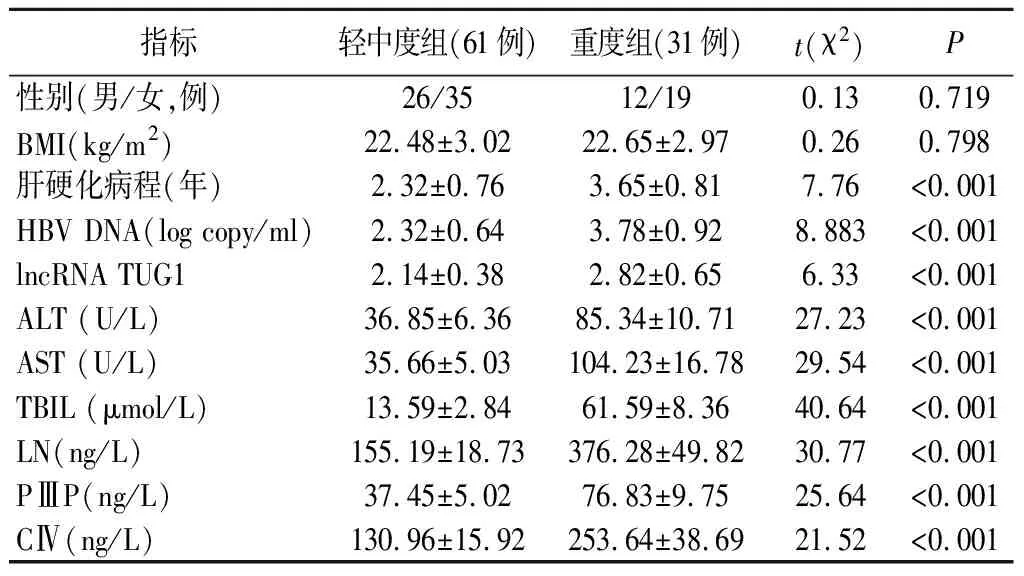
表3 肝硬化病人不同肝纤维化程度组一般资料及lncRNA TUG1、肝功能指标、肝纤维化指标比较
3.肝硬化病人血清lncRNA TUG1与肝功能指标、肝纤维化指标的相关性:Pearson相关分析结果显示,肝硬化病人血清lncRNA TUG1与HBV DNA、ALT、AST、TBIL、LN、PⅢP、CⅣ均呈正相关(P<0.05)。见表4。
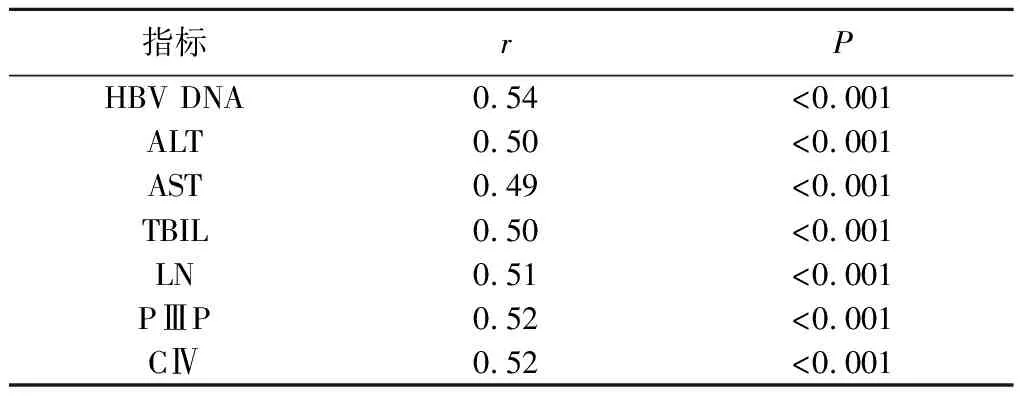
表4 肝硬化病人血清lncRNA TUG1与肝功能指标、肝纤维化指标的相关性
4.血清lncRNA TUG1水平对肝硬化病人肝纤维化程度的评估效能:以血清lncRNA TUG1水平为检验变量,以肝硬化病人肝纤维化程度是否发展为重度为状态变量绘制ROC曲线,结果显示,lncRNA TUG1评估肝硬化病人肝纤维化程度发展为重度的曲线下面积(area under curve,AUC)为0.91(95%CI:0.84~0.99),截断点为2.61,特异性为90.2%,敏感度为83.9%,见图1。

图1 血清lncRNA TUG1水平预测肝硬化患者肝纤维化程度加重风险的ROC曲线
5.影响肝硬化病人肝纤维化程度的多因素Logistic回归分析:将肝硬化病人肝纤维化程度是否发展为重度作为因变量,以lncRNA TUG1、肝硬化病程、ALT、AST、TBIL、LN、PⅢP、CⅣ为自变量进行多因素Logistic回归分析,结果显示,lncRNA TUG1、LN为肝硬化病人肝纤维化程度发展为重度独立影响因素(P=0.001、0.004)。见表5。其中,自变量lncRNA TUG1、肝硬化病程、ALT、AST、TBIL、LN、PIIIP、CIV均为连续变量,采用实际值;肝纤维化程度为分类变量,赋值情况:重度=1,轻中度=0。
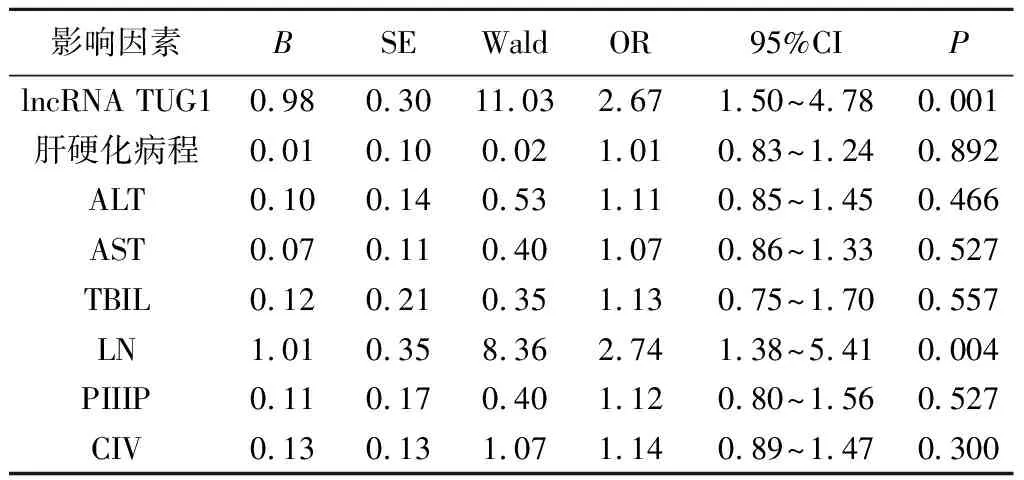
表5 影响肝硬化病人肝纤维化程度的多因素Logistic回归分析
讨论
肝硬化可由肥胖、非酒精性脂肪肝、高饮酒量、乙型或丙型肝炎感染、自身免疫性疾病等引起,是肝脏疾病病人死亡率增加的主要原因[6-8]。肝硬化是在长期炎症后发展起来的,炎症导致健康肝实质被纤维化组织和再生结节替代,从而导致门静脉高压,该疾病从无症状期(代偿性肝硬化)演变为症状期(失代偿性肝硬化),其并发症往往导致病人生活质量受损和高死亡率[9-10]。
研究显示,肝脏中纤维化逆转至正常结构的程度高于其他组织,其解决纤维化的基础包括:中断或清除导致慢性肝损伤的有害物质,炎症反应的失活和抗炎/恢复性途径的诱导,细胞外基质降解[11-13]。本研究结果显示,lncRNA TUG1在肝硬化病人血清中表达水平相对升高,且表达随肝纤维化程度增加而升高,与Han等[3]研究结果一致。lncRNA TUG1是一种与肝脏病理性损伤密切相关的lncRNA,其表达下调可显著抑制转化生长因子-β1/smad信号通路激活,进而逆转肝星状细胞活化,发挥抗肝纤维化作用[14]。据此推测,本研究中lncRNA TUG1表达升高可能有利于激活肝星状细胞,推动肝纤维化病理进程。Li等[15]研究显示,TUG1的沉默显著抑制增生性瘢痕纤维化中的细胞外基质生物合成,推测lncRNA TUG1也可能与肝纤维化过程中的细胞外基质合成有关,其表达上调可能有利于细胞外基质生物合成,进而促进肝纤维化进展。
研究表明,肝功能指标及肝纤维化指标均与肝硬化病人病情进展有密切联系,肝硬化存在以及病人病情加重可造成上述指标异常增高[5,16]。Pearson相关分析发现,血清lncRNA TUG1与肝功能指标、肝纤维化指标及HBV DNA均呈显著正相关,证实血清lncRNA TUG1水平可一定程度反映肝硬化病人肝功能损伤和肝纤维化程度。ROC曲线分析结果提示,lncRNA TUG1水平可评估肝硬化病人肝纤维化程度,当其检测水平高于截断值2.61时,病人肝纤维化可能进展为重度。
综上所述,肝硬化病人血清lncRNA TUG1、肝功能指标及肝纤维化指标水平均明显升高,lncRNA TUG1与病人肝功能、肝纤维化程度密切相关,其水平随肝纤维化程度增加而升高。临床中寻找有效拮抗lncRNA TUG1途径的相关物质,可能有助于逆转或消退肝硬化病人肝纤维化。本研究未纳入丙肝肝硬化病人进行对比分析,且未能对治疗后病人血清lncRNA TUG1表达水平变化进行动态检测,今后将增加样本量进行对比分析。

