NPS-2143对胶质瘤增殖与迁移能力的影响及机制*
聂佳丽, 殷海棠, 文志鹏, 郑志昌, 李明, 李琴, 樊兴华, 赵青青, 张彦燕*, 杨继红,***
(1.贵州医科大学 药学院, 贵州 贵阳 550004; 2.贵州医科大学附属医院 药学部, 贵州 贵阳 550004)
胶质瘤是中枢神经系统最常见的恶性肿瘤之一[1],低级别胶质瘤患者的中位生存时间在3~10年,而高级别胶质瘤患者仅为15个月[2]。手术、放疗和化疗是目前临床上治疗胶质瘤最重要的手段[3],其中替莫唑胺(Temozolomide,TMZ)是治疗胶质瘤的一线化疗药物。由于TMZ的天然耐药或获得性耐药等原因,大约50%的中枢神经系统胶质瘤患者经TMZ治疗后效果不理想[4-5]。因此,探究新的胶质瘤治疗药物及其分子机制对于改善患者生存预后具有重要意义[6]。自噬是细胞中一种高度进化的、保守的、动态的、依赖溶酶体的蛋白与受损细胞器的代谢过程[7-9],在肿瘤发生发展及放化疗抵抗中有复杂的调控功能;抑制自噬会增加正常细胞发生恶性转化的可能,干扰自噬也可以抑制包括胶质瘤在内多种肿瘤的生长与增殖,并增加其放化疗敏感性[10-11]。调节细胞自噬水平的细胞信号通路众多,其中AKT-mTOR信号通路在调节肿瘤细胞自噬水平中扮演重要角色,激活AKT-mTOR信号通路可以降低肿瘤细胞自噬水平[12-13]。NPS-2143是一种钙敏感受体(calcium sensing receptor,CaSR)拮抗剂,研究表明NPS-2143能够抑制乳腺癌细胞、胃癌细胞、黑素瘤癌细胞及肾癌细胞等多种肿瘤细胞的发生发展过程[14-16],但其在胶质瘤细胞中的作用及机制不明。相关研究发现,CaSR可以调控细胞自噬水平[9],利用拮抗剂抑制CaSR可以降低多种细胞的自噬水平[17],提示NPS-2143可能可以通过抑制自噬进而阻碍胶质瘤的生长、增殖及迁移能力。U87、U251和Hs683是胶质瘤研究中常用细胞系,具有相对稳定的遗传特征,还能反映临床胶质瘤细胞增殖、侵袭性等特征。本研究以胶质瘤U87、U251和Hs683细胞为研究对象,观察NPS-2143对胶质瘤细胞增殖与迁移能力的影响及其可能机制。
1 材料与方法
1.1 实验材料
1.1.1细胞株 人脑胶质瘤细胞系U87、U251和Hs683购自中国科学院细胞库(上海生物化学与细胞生物学研究所,中国科学研究院),由文志鹏课题组保存。
1.1.2主要试剂 NPS-2143(美国 Selleck公司),培养基(dulbecco's modified eagle medium,DMEM)、0.25%胰蛋白酶及胎牛血清(美国 Gibco 公司);6孔板、96孔板、Transwell 小室(美国 Corning 公司), 细胞增殖毒性试剂盒(cell counting kit-8,CCK-8)试剂(日本Dojindo研究所),RIPA裂解液(P0013c)、BCA蛋白浓度测定试剂盒 (P0010S)、ECL化学发光液(P0018S)试剂(上海碧云天生物公司);细胞周期试剂盒(KGA512)和细胞凋亡试剂盒(KGA108)试剂(江苏凯基生物公司),Annevin V-FITC/碘化丙啶(propidium,PI)试剂盒(上海碧云天生物公司),P21、Cyclin D1、Bax、Caspase 3、N-cadherin、MMP2、MMP9、p-AKT(Ser473)、p-mTOR(Ser448)抗体(武汉 Proteintech公司),LC3和P62抗体(美国 CST公司)。
1.1.3主要仪器 BCD-271TMCM冰箱(青岛 海尔),FORWA371高温灭菌型CO2培养箱、ST16R离心机(美国 Thermo);DMIL倒置显微镜、DMIL LED倒置荧光显微镜(德国 Leica),Navios流式细胞分析仪、Allegra 64R高速台式冷冻离心机(美国 Beckman),Chemi Scope5300化学发光成像系统(上海 Clinx勤翔),DPN9272恒温培养箱(上海精宏),TP-114电子天平(美国 丹佛),A02-6SB-0N生物安全柜(新加坡 Esco),TS 3D脱色摇床(海门 其林贝尔)。
1.2 研究方法
1.2.1细胞培养及分组 人脑胶质瘤细胞系U87、U251和Hs683培养于含10%胎牛血清的DMEM培养基中,在37 ℃、5%CO2的培养箱中进行培养,当细胞融合率达到90%时,使用0.25%胰酶消化3 min,加入3 mL完全培养基终止消化,用巴氏吸管进行反复轻柔的吹打细胞,将其转移到15 mL离心管中,进行1 000 r/min离心5 min,倒弃上清液,再加入完全培养基轻柔吹打细胞并重悬备用;胶质瘤U87、U251细胞按照1∶3的细胞密度进行传代,胶质瘤Hs683细胞按照1∶6的细胞密度进行传代;将胶质瘤细胞各分为3组,不加药物的对照组(Control组)、6 μmol/L和8 μmol/L NPS-2143处理组(指定浓度)。
1.2.2CCK-8实验检测细胞增殖能力 取备用胶质瘤U87、U251细胞以1 000个/孔的密度接种于96孔板,培养12 h;根据文献调研及前期实验摸索,用浓度分别为0.0 μmol/L、2.5 μmol/L、5.0 μmol/L、7.5 μmol/L、10.0 μmol/L NPS-2143处理细胞,检测NPS-2143处理浓度与胶质瘤细胞增殖之间的关系;再用浓度分别为0.0 μmol/L、2.5 μmol/L、5.0 μmol/L的NPS-2143处理胶质瘤细胞,培养24 h、48 h和72 h,检测NPS-2143处理时间与胶质瘤细胞增殖之间的关系。用含10 μL CCK-8的100 μL DMEM替换培基,在37 ℃下避光孵育1 h;使用酶标仪在450 nm处测定光密度(optical density, OD)值。
1.2.3平板克隆形成试验检测细胞克隆数 取备用胶质瘤U87和U251细胞以1 000个细胞/孔的密度接种在6孔板,用指定浓度的NPS-2143处理细胞,每间隔7 d更换1次含NPS-2143的培基,连续培养21 d后于显微镜下观察细胞克隆形成情况;弃去培养板中的培基,1 mL/孔PBS洗涤培养皿2次,4%多聚甲醛固定细胞15 min,小心吸弃多聚甲醛,用1 mL PBS清洗2次,然后用0.1%结晶紫染色10 min,用1 mL/孔PBS洗涤3次后,放置37 ℃的烘箱烘干后,拍摄细胞板,用Image J软件计菌落形成数。
1.2.4流式细胞术检测细胞周期 将适量备用胶质瘤U87和U251细胞接种于6孔板,过夜培养后用指定浓度的NPS-2143处理细胞72 h,用0.25%胰酶消化胶质瘤细胞,加入1 mL/孔完全培基终止消化;将细胞悬液转移到15 mL离心管中,1 000 r/min离心5 min,弃上清,加入70%预冷的乙醇,轻柔的涡旋混匀后在-20 ℃的冷冻室中固定过夜;取出固定后细胞,1 000 r/min、4 ℃、离心5 min,弃上清,用含2 μL RNase A(10 g/L)的100 μL PBS重悬细胞,37 ℃孵育30 min;1 500 r/min、4 ℃、离心5 min,弃上清;用含有20 μL PI(1 g/L)的400 μL PBS重悬细胞,37 ℃避光孵育30 min,流式细胞仪分析,Modifit软件计算细胞周期分布。
1.2.5Annevin V-FITC/PI试剂盒检测细胞凋亡 将适量备用胶质瘤U87和U251细胞接种于6孔板,过夜培养后用指定浓度的NPS-2143处理细胞72 h,用不含EDTA的胰蛋白酶消化胶质瘤细胞,1 mL完全培养基终止消化;1 500 r/min离心5 min,弃上清液,加入1 mL PBS溶液,轻柔的吹打重悬细胞,1 500 r/min离心5 min,用含5 μL Annexin V-FITC和10 μL PI的200 μL染色缓冲液重悬细胞,37 ℃避光孵育30 min;流式细胞仪进行检测,Version 10.0 FlowJo软件分析细胞凋亡情况。
1.2.6划痕实验测细胞迁移能力 将备用胶质瘤U87和Hs683细胞以2.5×105个/孔的密度接种于6孔板中,并在37 ℃、5%CO2的培养箱中过夜,当细胞融合度达到90%时,弃去原培养液,用1 mL PBS洗涤2次后,吸去PBS,于板底合适位置用直尺画直线用于固定拍照视野,加入6 μmol/L NPS-2143后用100 μL移液管尖端划伤痕形成伤口,于之后24 h、48 h时间点用显微镜观察并拍摄愈合图像,计算并分析创面闭合的相对距离。
1.2.7Transwell实验测细胞迁移能力 将适量备用胶质瘤U87和Hs683细胞接种于6孔板中,并在37 ℃、5%CO2的培养箱中过夜,24 h后用指定浓度的NPS-2143处理,当细胞处理48 h时,准备Matrigel胶,溶胶并4 ℃过夜,试管和枪头于-20 ℃预冷备用;当细胞处理72 h后,用无血清的培养基DMEM稀释Matrigel胶,取100 μL稀释胶加到24孔Transwell上室中,37 ℃孵育4~5 h备用;弃去细胞原培养液,1 mL PBS洗涤2次后0.25%胰酶消化细胞、1 mL无血清DMEM重悬、1 500 r/min离心5 min,弃上清液,1 mL无血清DMEM轻柔的吹打重悬细胞,接种到铺有Matrigel胶的Transwell上室,将500 μL含10%胎牛血清的DMEM添加到Transwell下室,培养48 h;然后取出小室,吸去上室液体,PBS轻柔洗涤2次,4%多聚甲醛固定细胞15 min,小心吸弃多聚甲醛,PBS轻柔清洗2次,0.1%结晶紫染色10 min,用PBS清洗2次,晾干于倒置显微镜下观察并拍摄。
1.2.8Western blot检测蛋白表达 将适量备用胶质瘤U87、U251及Hs683细胞接种于6孔板,过夜培养后用指定浓度的NPS-2143处理细胞72 h,PBS 清洗2次并消化细胞,1 500 r/min离心5 min,弃上清,加适量RIPA裂解液于冰上裂解15 min,4 ℃、12 377 r/min离心15 min,取上清液用BCA法测定蛋白浓度,按规定比例将上样缓存液加入上清液中,99 ℃水浴10 min,将制备好的蛋白样品进行SDS-PAGE电泳、转膜、5%脱脂牛奶室温封闭1 h、一抗4 ℃孵育过夜,TBST洗膜3次、室温孵育二抗1 h、TBST洗膜3次(10 min/次),加ECL发光试剂显影,采用Image Lab4.1进行图像分析。
1.3 统计学分析

2 结果
2.1 细胞增殖
CCK-8实验结果表明NPS-2143可以抑制胶质瘤细胞的增殖,且具有浓度依赖性和时间依赖性(P<0.05);平板克隆形成实验结果发现,NPS-2143处理组的细胞集落形成数量少于Control组(P<0.05);上述结果提示NPS-2143可以抑制胶质瘤细胞增殖及克隆形成能力。见图1。

注:A、B为CCK-8实验结果;C为细胞平板克隆实验结果及定量结果;与同类细胞Control组相比,(1)P<0.05,(2)P<0.01。
2.2 细胞周期及P21、Cyclin D1的蛋白表达
流式细胞实验结果显示,NPS-2143组中G1期细胞的比例高于Control组(P<0.05)。 Western blot结果显示,NPS-2143显著增加胶质瘤U87和U251细胞中P21、降低Cyclin D1的蛋白表达水平(P<0.01)。见图2。

注:A为细胞周期实验分析胶质瘤细胞的结果及定量结果,B为Western blot 实验结果及定量结果;与同类细胞Control组相比,(1)P<0.05,(2)P<0.01,(3)P<0.001。
2.3 细胞凋亡及促凋亡蛋白Bax和Caspase 3表达
流式细胞实验结果显示,与Control组相比,NPS-2143处理组中胶质瘤U87和U251细胞的凋亡细胞增加(P<0.05);Western blot结果显示,NPS-2143组中促凋亡蛋白Bax和Caspase 3表达水平高于Control组(P<0.05);上述结果提示,NPS-2143可诱导胶质瘤细胞凋亡。见图3。

注:A为流式细胞术分析胶质瘤细胞凋亡结果;B为凋亡蛋白Bax和Caspase 3蛋白条带图及定量结果;与同类细胞Control组相比,(1)P<0.05,(2)P<0.001。
2.4 细胞迁移和侵袭能力
划痕实验和Transwell实验结果显示,NPS-2143降低胶质瘤U87、Hs683细胞的迁移能力(P<0.05);Western blot结果显示,NPS-2143降低胶质瘤U87、Hs683细胞中MMP2、MMP9、N-cadherin蛋白表达水平(P<0.05);上述结果表明,NPS-2143可能通过调节上皮间质转化(epithelial-mesenchymal transition, EMT),干扰胶质瘤U87、Hs683细胞的迁移能力。见图4。

注:A为划痕实验胶质瘤细胞的迁移侵袭能力和定量结果;B为Transwell实验胶质瘤U87、Hs683细胞的迁移能力的形态学和定量结果;C为 Western blot 实验结果及EMT蛋白定量结果;与同类细胞Control组相比,(1)P<0.05,(2)P<0.01。
2.5 NPS-2143通过激活AKT-mTOR通路抑制胶质瘤细胞自噬
实验结果表明:NPS-2143可以显著增加胶质瘤U87和U251细胞LC3Ⅱ、LC3Ⅱ/Ⅰ和P62的蛋白表达水平(P<0.05),提示NPS-2143可能抑制胶质瘤细胞晚期自噬。透射电镜观察胶质瘤细胞自噬囊泡结果表明:与Control组相比,NPS-2143处理组胶质瘤细胞自噬囊泡数量增加,提示NPS-2143可以阻碍胶质瘤细胞晚期自噬。Western blot检测结果显示,NPS-2143提高胶质瘤U87和U251细胞p-AKT和p-mTOR蛋白表达水平(P<0.05),提示NPS-2143可以激活AKT-mTOR通路。上述结果表明,NPS-2143可能通过激活AKT-mTOR信号通路抑制胶质瘤细胞自噬。见图5。
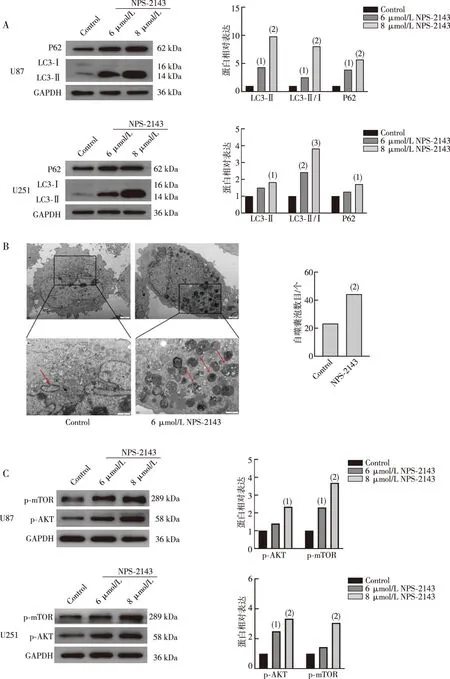
注:A为Western blot 实验结果及自噬蛋白定量结果;B为透射电镜观察胶质瘤细胞中自噬囊泡形态变化和结果(上8 000×,下20 000×,红色箭头指示为自噬囊泡);C为Western blot 实验结果及AKT-mTOR通路蛋白的定量结果;与同类细胞Control组相比,(1)P<0.05,(2)P<0.01,(3)P<0.001。
3 讨论
胶质瘤是成人最常见的中枢神经系统恶性肿瘤之一,即使积极接受标准治疗,患者预后也十分不理想。因此,临床迫切需要发现和开发治疗胶质瘤的新化合物。NPS-2143是一种选择性CaSR拮抗剂,在体外表现出抑制多种肿瘤生长与增殖的抗肿瘤能力[20-21],但NPS-2143在胶质瘤中的作用尚不清楚。
自噬是一种进化上保守的蛋白和细胞器降解过程,它对细胞的生存、分化、发育及稳态至关重要[22]。作为一个动态循环系统,自噬可以通过降解蛋白和细胞器为细胞提供必要能量和蛋白合成原料。自噬不仅对正常生理环境中细胞生命活动有重要调控作用,并且在癌症、肌病及神经退行性变等多种疾病的病理过程中也扮演重要角色。癌前病变过程中,自噬可以阻止正常细胞发生恶性转化,抑制癌症发生。但当肿瘤形成后,自噬可以帮助肿瘤细胞克服缺氧、营养缺乏及免疫监视等不利的肿瘤微环境,促进肿瘤生长、增殖与放化疗抵抗。为探讨NPS-2143是否通过抑制自噬来抑制胶质瘤发展,我们采用Western blot方法分析LC3Ⅱ、LC3Ⅱ/Ⅰ和P62的蛋白表达水平,结果显示,与Control组相比,NPS-2143处理组的胶质瘤细胞中LC3Ⅱ、LC3Ⅱ/Ⅰ和P62的表达显著增加,提示NPS-2143可能抑制自噬的晚期。为了进一步证实这一结果,本研究采用透射电镜观察了胶质瘤细胞自噬囊泡,结果显示,NPS-2143处理后的胶质瘤细胞中自噬囊泡数量增加,进一步表明NPS-2143可以抑制胶质瘤细胞晚期自噬。
自噬在肿瘤发生中扮演重要角色,抑制自噬可以诱导肿瘤细胞发生凋亡、细胞周期阻滞,并抑制肿瘤细胞的侵袭与迁移。胶质瘤细胞的迁移和侵袭是导致术后患者复发的主要因素,抑制胶质瘤细胞侵袭与迁移对改善患者预后具有重要意义。过往研究提示,抑制膀胱癌细胞自噬可诱导细胞凋亡[23],并且抑制自噬可抑制基质金属蛋白酶MMP2和MMP9介导的膀胱癌细胞迁移和侵袭[24]。此外,相关研究表明抑制恶性黑色素瘤和胶质瘤细胞自噬可诱导凋亡和细胞周期阻滞,进而导致细胞死亡,还能抑制胶质瘤细胞的迁移和侵袭[25-28]。Xing等[18]的研究发现,通过破坏自噬小体和溶酶体之间的融合来特异性地抑制自噬,从而诱导胰腺癌、胃癌和乳腺癌细胞等多种癌细胞系的凋亡来触发细胞死亡。与上述研究类似,本研究结果提示,NPS-2143通过抑制胶质瘤细胞自噬诱导G1期细胞周期阻滞和凋亡,并抑制胶质瘤细胞的增殖和迁移能力。
AKT-mTOR信号通路是细胞信号传导的经典信号通路之一,与众多人类疾病相关。过往研究报道表明mTOR是自噬的负调控因子[29]。AKT是将生长因子信号连接到下游通路的中心节点,同时也是mTOR的上游信号调控通路,激活AKT-mTOR通路可以抑制细胞自噬水平[30]。同样,我们的研究结果显示:NPS-2143可以导致p-AKT和p-mTOR的蛋白表达水平上升,提示NPS-2143可能通过激活AKT-mTOR信号通路进而抑制胶质瘤细胞自噬。
综上所述,本研究发现NPS-2143可能通过激活AKT-mTOR信号轴抑制晚期自噬,从而抑制胶质瘤的进展。本研究将为胶质瘤的治疗药物筛选提供新的思路与可能。同时,本研究未能进一步在动物水平探究NPS-2143的抗胶质瘤能力、血脑屏障通透性和安全性,这些有待于我们在未来的研究中进一步探索和验证。

