草莓茎基腐病病原菌鉴定、致病力分析及防治药剂筛选
叶梓 谢雨璐 张国芳 李晓媛 陈卫良 毛碧增,*
(1浙江大学生物技术研究所/农业农村部作物病虫分子生物学重点实验室/浙江省作物病虫生物学重点实验室,浙江 杭州 310058;2浙江省建德市草莓科技小院,浙江 建德 311600;3浙江省宁波市农业科学研究院生物技术研究所,浙江 宁波 315100;4杭州市农业科学研究院生物技术研究所,浙江 杭州 310024)
草莓(FragariaananassaDuchesne.)是蔷薇科(Rosaceae)草莓属(Fragaria)多年生浆果类草本植物[1]。草莓营养丰富,其中维生素B1、C,矿质元素钾、磷、钙、铁,抗氧化物质鞣花酸、类黄酮等含量颇丰,在人体防病抗衰老方面有良好功效,有“水果皇后”之美誉[2]。浙江省为我国草莓主产区之一,草莓也已成为浙江省特色高效优势产业代表之一。在建德、奉化、诸暨和临海等重点草莓种植区域,草莓已经成为当地农民的主要经济来源[3]。浙江草莓种植主要以设施栽培为主,由于种植环境密闭、高温高湿,加上连作的种植方式,草莓土传病害频发,严重影响草莓品质和产量[4]。已报道的草莓根茎部病原菌有20多种,其中大多为真菌病原菌[5]。近年来,根茎部细菌性病害也被陆续报道,2021年Song等[6]和Li等[7]分别报道了由草莓黄单胞菌(Xanthomonasfragariae)引起的草莓冠腐病,该病害导致茎部出现空洞,发病植株往往苗期就死亡,发病率高达40%。而谢昀烨等[8]在浙江台州发现了草莓细菌性茎基部坏死病,经鉴定病原菌为路氏肠杆菌(Enterobacterludwigii)。本课题组于2021年在浙江宁波草莓种植地新发现了一种由菠萝泛菌(Pantoeaananatis)引起的草莓细菌性基腐病[9],病害前期叶背面出现水渍状病斑,之后蔓延扩大形成褐色不规则斑点和病斑,后期植株枯萎死亡,剖开茎基部发现空腔结构。该病严重危害草莓生长发育,可使草莓减产50%。但目前对草莓茎基腐病的研究较少,且局限于病害发生的初步报道[9-10]。因此,本研究在浙江省建德草莓种植基地采集具有相同症状的发病植株,进行病原菌分离纯化,通过形态学和分子生物学对其进行鉴定,同时对该病原菌的致病性、生物学特性和寄主范围进行测定,并挑选20种具有不同作用机理的药剂开展对该病原菌的抑菌试验,筛选有效防治药剂,以期为草莓茎基腐病的防控提供科学有效的指导。
1 材料与方法
1.1 试验材料
病株来源:在浙江省建德市草莓种植基地采集具有草莓茎基腐病典型症状的植株。
供试菌株:水稻细菌性叶斑病病原菌P.ananatisZJU11由浙江大学李斌教授惠赠;大肠杆菌DH5α来源于本课题组。
供试植物:草莓品种为粉玉。寄主范围测定试验所用作物:番茄(SolanumlycopersicumL.)、辣椒(Capsicum annuumL.)、西瓜(CitrulluslanatusThunb.)、白菜(BrassicaparachinensisL.H.Bailey)、西兰花(Brassica oleraceaL.)、豆角(VignaunguiculataL.Walp.)和水稻(OryzasativaL.)。
供试杀菌剂:根据农药的不同作用机理,参考文献[11-12],挑选供试药剂20种,详细信息见表1。
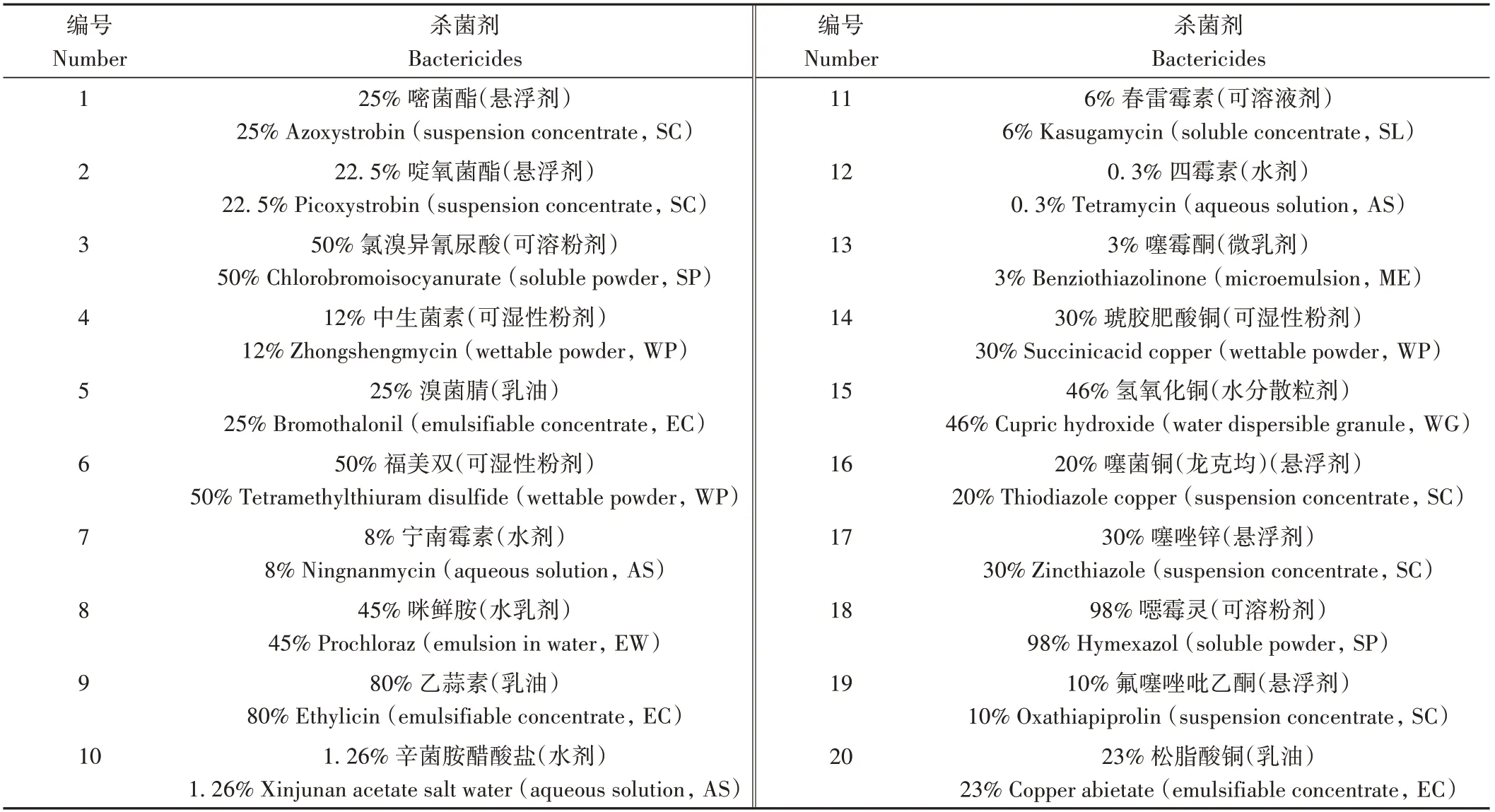
表1 供试药剂Table 1 Bactericides for sensitivity assays
1.2 病原菌分离纯化
无菌水冲洗干净草莓病株根茎部表面,置于超净工作台中,用灭菌刀片在病健交界部位切取1 cm×1 cm样品,75%酒精中浸泡30 s,无菌水冲洗1~2次后置于0.1%升汞中3 min,无菌水漂洗3次,晾干后放入研钵中加入无菌水充分研磨,研磨液经梯度稀释后涂布于溶菌肉汤(Luria-Bertani,LB)平板,以最后一次漂洗的无菌水作为空白对照,30 ℃培养24~48 h,挑取单菌落进行下一步试验,并与20%甘油1∶1混合后置于-80 ℃冰箱中保存。
1.3 致病性验证
依据科赫氏法则进行分离物回接。将过夜培养的菌液配制为1×108CFU·mL-1浓度的菌悬液,采用灌根接种法将15 mL的菌悬液浇至2月龄的草莓苗根部,无菌水作为对照,每处理组10株草莓苗,重复2次。置于人工气候箱(28~30 ℃,相对湿度75%,光周期16 h光∶8 h暗)内进行培养,观察发病情况,当植株发病后再次分离病原菌并鉴定。
1.4 病原菌鉴定
1.4.1 形态学鉴定 将病原菌转接于LB和氯化三苯四氮唑(triphenyltetrazolium chloride,TTC)平板上,30 ℃恒温培养24 h,观察细菌在平板上的生长及菌落形态。普通光学显微镜观察菌体着色和运动情况,电子显微镜观察菌体的形态、大小。
1.4.2 分子生物学鉴定 将纯化后菌株接种至LB培养液中,28 ℃培养18 h后,用细菌基因组DNA抽提试剂盒(诺唯赞生物,南京)对病原菌DNA进行提取,提取的DNA在-20 ℃保存。为了对病原菌进行分类鉴定,分别使用16S核糖体RNA(16S ribosomal RNA,16S rRNA)、DNA促旋酶B亚基(DNA gyrase subunit B,gyrB)、延伸因子G(elongation factor G,fusA)、亮氨酰tRNA合成酶(leucyl-tRNA synthetase,leuS)、胞嘧啶核苷三磷酸合成酶(cytidine triphosphate synthetase,pyrG)、核糖体蛋白L2(ribosomal protein L2,rplB)、ATP合成酶β亚基(ATP synthase beta subunit,atpD)和翻译起始因子2(translation initiation factor 2,infB)基因引物进行扩增[13-14],所用引物序列见表2。PCR扩增产物经1.2%凝胶电泳检测后切胶回收,测序后通过BLAST进行同源性比较,并下载高相似度序列。利用MEGA Ⅹ(V10.0.5)进行多基因串联,采用最大似然(maximum likelihood,ML)法构建多基因系统发育树。

表2 目标片段扩增引物序列Table 2 Target fragment amplification primer sequences
1.5 生物学特性研究
1.5.1 生理生化检测 参照《伯杰细菌鉴定手册(第八版)》[15],用细菌生化鉴定试剂盒(滨和微生物,杭州)对病原菌进行运动性、淀粉水解、吲哚、硝酸盐、硫化氢、麦芽糖、七叶灵苷、氧化酶、苯丙氨酸脱氨酶和Voges-Proskauer试验(V-P)共10项生理生化指标测定,以无菌水作阴性对照。
1.5.2 生长曲线绘制 将过夜培养的菌液OD600调为1.0,作为种子液进行后续试验。加1 mL种子液至50 mL LB液体培养基,28 ℃、180 r·min-1条件下振荡培养。每隔2 h测1次OD600值,至OD600值数据无明显变化。重复3次,整理所得数据绘制病原菌生长曲线。
1.5.3 不同盐浓度、pH值、温度的影响 分别加1 mL种子液于盐浓度为0.1%、1%、3%、5%、7%和9%的50 mL LB液体培养基中,28 ℃培养18 h,重复3次,测定不同盐浓度下的菌液OD600值。分别加1 mL种子液于pH值为3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0的50 mL LB液体培养基中,28 ℃培养18 h,重复3次,测定不同pH值条件下菌液OD600值。分别加1 mL种子液于13、18、23、28、33、38、43、48和53 ℃下的50 mL LB 液体培养基中培养18 h,重复3次,测定不同温度处理下菌液OD600值。
1.6 菌株寄主范围研究
挑选蔷薇科作物草莓,茄科作物辣椒、番茄,葫芦科作物西瓜,十字花科作物白菜、西兰花,豆科作物豆角,禾本科作物水稻等6个科的8种作物幼苗,采用灌根法接种进行寄主范围的测定,方法如下:
纯化后的菌株培养过夜,用LB培养液配制成浓度为1×108和1×104CFU·mL-1的菌悬液。P.ananatisZJU11配制同样浓度的菌悬液。1×108CFU·mL-1的大肠杆菌DH5α的菌悬液和LB培养液作为对照组。每处理组20株幼苗,重复3次。接种后置于25~35 ℃下培养,每天观察发病情况,从发病部位再次分离病原菌并鉴定。此外,为了便于与ZJU11的致病性比较,除灌根法接种外,对水稻植株还采用了离体接种法和剪叶法进行接种。
根据症状发生情况制定病情分级标准(表3),统计植株接种后的病情指数,按照病情指数范围0~20、20~50和50以上,将病原菌对作物的毒性划分为低毒性、中毒性和高毒性,确定病原菌对不同作物的毒性。
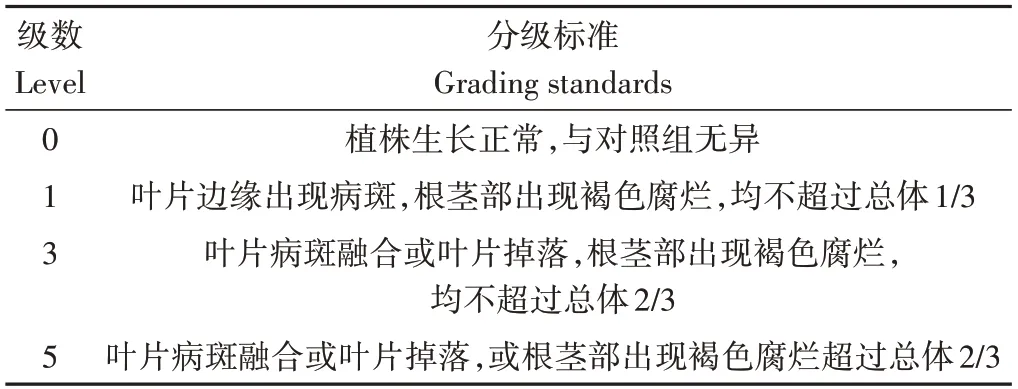
表3 病情分级标准Table 3 Disease grading standard
1.7 药剂筛选
本试验采用抑菌圈法,配制含菌量1×108CFU·mL-1的LB平板进行有效药剂筛选。药剂初筛:根据20种药剂推荐的使用剂量[11-12],设置4个浓度梯度。每个含菌平板放置无菌滤纸片(直径6 mm)5个,吸加不同浓度梯度药剂于滤纸片上,中间滤纸片滴加灭菌水为对照。将培养皿置于30 ℃恒温培养箱中培养24 h后,观察滤纸片周围有无抑菌圈,试验重复3次。药剂复筛:根据初筛确定有抑菌作用的药剂,并设置8个浓度梯度,试验重复4次。采用十字交叉法测量抑菌圈的直径,对照组抑菌圈直径记为6 mm。抑菌率计算参照文献[16],用Origin2023软件计算毒力回归方程、抑制中浓度(EC50)和相关系数,分析比较不同药剂的抑菌效果。抑菌率具体计算公式如下:
2 结果与分析
2.1 田间症状
田间调查发现,草莓茎基腐病危害苗期草莓,该病害发生前期症状为叶片背面叶脉周围出现水渍状病斑,随后出现不规则褐色斑点并融合扩大。后期随着病情加重,病株的根茎部坏死,整株草莓苗萎蔫死亡,剖开茎基部,观察到空腔结构出现(图1)。

图1 田间感病草莓根部症状Fig.1 Symptoms of strawberry stem rot in field
2.2 病原菌分离和形态学特征
从病健交界部位分离得到较为均一的菌落,从中选择代表性菌落JD1进行致病性验证。JD1接种8 d后,在一些叶片上出现了水渍状病斑(图2-A)。接种5周后,接种草莓苗坏死,与田间症状相似(图2-B)。对照草莓无明显症状(图2-C、D)。经再分离纯化后得到的菌株,与初病原分离物形态特征相同,16S rRNA测序序列一致,初步判断菌株JD1为引起草莓茎基腐病的病原菌。

图2 菌株JD1致病性验证Fig.2 Pathogenicity test of strain JD1 on strawberry
观察到JD1在LB板上呈黄色、圆形、粘稠状,透明锃亮,散发刺激性气味(图3-A),在TTC培养基上呈红色,表面粘稠,周缘光滑,散发刺激性气味(图3-B)。对菌株进行革兰氏染色,染色结果呈红色阴性反应,为革兰氏阴性菌(图3-C);扫描电镜下菌体大小约(0.2~0.6) μm×(0.9~1.8) μm,两端钝圆,呈短杆状(图3-D)。该分离物形态与Zhang等[9]、Song等[10]、王继承[17]、王琦[18]和张烨等[19]报道的菠萝泛菌形态特征较为一致。
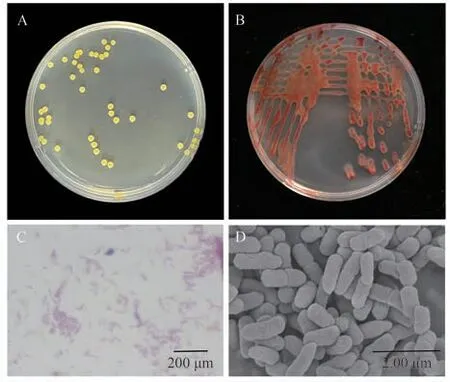
图3 菌株JD1的形态Fig.3 Morphology of strain JD1
2.3 分子生物学鉴定
对菌株JD1的16S rRNA、fusA、gyrB、leuS、pyrG、rplB、atpD、infB基因进行扩增,分别得到了长度1 146、783、1 397、750、424、464、881及1 132 bp的扩增片段,符合预期。随后从NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)下载亲缘关系较近的成团泛菌(Pantoea agglomerans)、分散泛菌(Pantoeadispersa)和斯氏泛菌(Pantoeastewartii)等其他泛菌属菌株对应基因序列作为参比序列,构建JD1的系统发育树,结果显示JD1菌株与菠萝泛菌聚为一支(图4)。结合形态学特征、致病性验证和分子生物学结果,将该病原分离物鉴定为菠萝泛菌(Pantoeaananatis)。

图4 基于16S rRNA、gyrB、fusA、leuS、pyrG、rplB、atpD、infB构建的系统发育树Fig.4 Phylogentic tree constructed based on 16S rRNA、gyrB、fusA、leuS、pyrG、rplB、atpD、infB gene sequences
2.4 生物学特性研究
2.4.1 生理生化特性 生理生化特性检测是微生物鉴定常用方法。应用细菌生理生化试剂盒进行检测,结果见表4,鉴定分离纯化后的培养物为菠萝泛菌。该菌株具有运动性,能够分解利用麦芽糖,淀粉水解、七叶灵苷水解、吲哚、V-P试验结果阳性,能够产生硫化氢,氧化酶、硝酸盐还原和苯丙氨酸脱氨酶试验结果阴性。与《伯杰细菌鉴定手册(第八版)》[15]中对菠萝泛菌的描述一致。
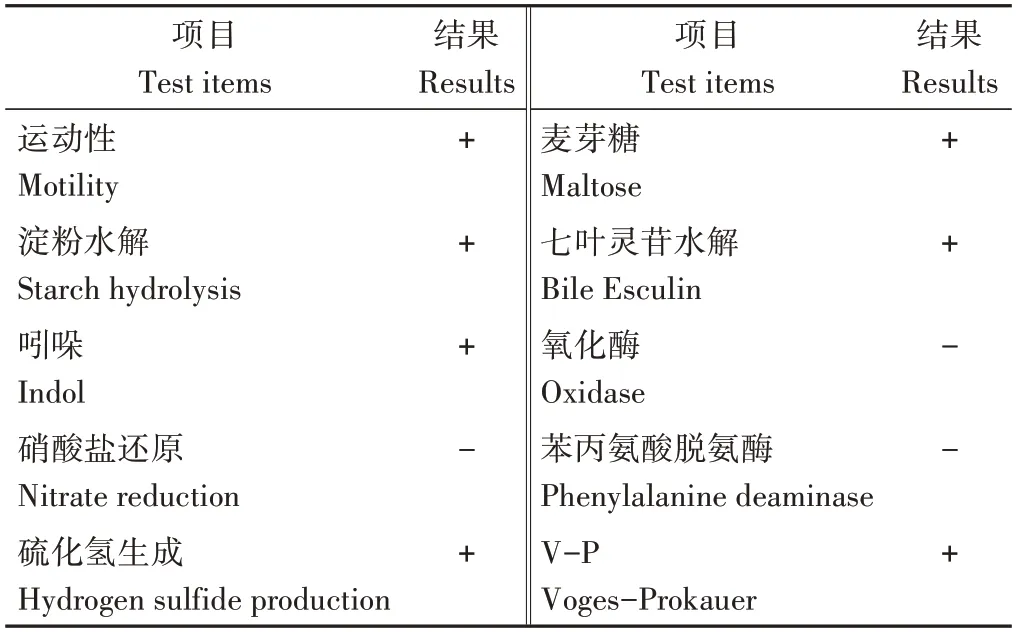
表4 菌株生理生化特征Table 4 Physiological and biochemical characters of the strain
2.4.2 生长曲线 以OD600值为纵坐标,培养时间为横坐标,绘制菌株JD1的生长曲线如图5-A所示。该病原菌生长较快,在2~26 h菌体呈对数生长,26 h后菌体生长趋势平缓,处于稳定生长期。
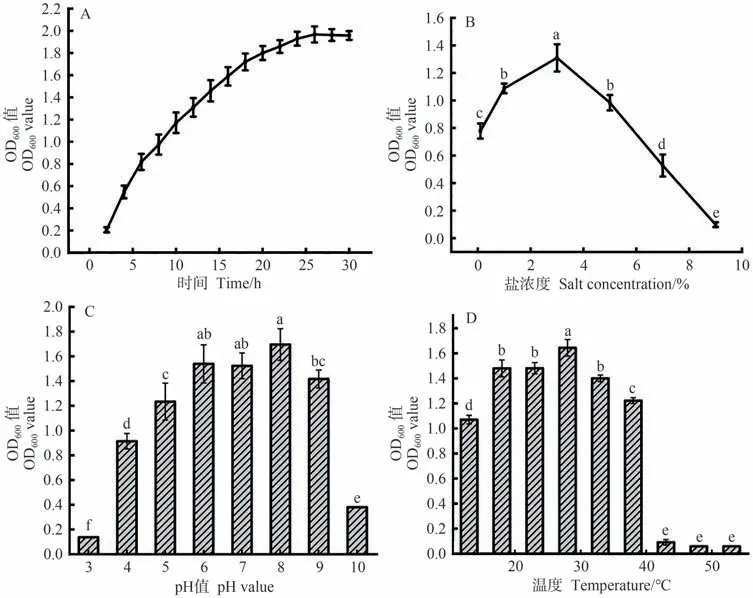
图5 菌株JD1的生长特性Fig.5 The Growth characteristics of strain JD1
2.4.3 不同盐浓度、温度、pH值下JD1的生长情况以OD600值为纵坐标,不同盐浓度为横坐标绘图,观测18 h后JD1的生长情况(图5-B),可知JD1最适生长盐浓度为1%~5%,盐浓度高于5%时菌株生长受到抑制,生长缓慢,超过7%以后基本不生长。观测不同pH值的LB液体培养基培养18 h后JD1的生长情况(图5-C),发现在pH值4~9范围内JD1都可以生长,生长速度随pH值升高先加快后下降,最适生长pH值为8。由此可知,该菌适合在中性及偏碱性环境生长。在不同温度LB液体培养基中培养18 h后,观测JD1的生长情况(图5-D)。发现菌株JD1最适生长温度为28 ℃,超过该温度后菌株生长速率明显下降,43 ℃以上基本无法生长。
2.5 菠萝泛菌菌株寄主范围研究
对草莓、番茄、辣椒、西瓜、白菜、西兰花、豆角和水稻等8种作物,采用灌根法进行接种,同时采用离体法和剪叶法接种水稻。统计结果(表5、图6)显示DH5α菌悬液和LB液体培养液处理组都无明显症状。JD1菌株以1×108和1×104CFU·mL-1浓度接种均能够引起草莓、番茄、辣椒、西瓜和水稻发病,而对白菜、西兰花和豆角没有致病性。在1×108CFU·mL-1浓度下JD1菌株对番茄、辣椒和草莓表现为高毒性,对西瓜和水稻表现为中毒性;1×104CFU·mL-1浓度下JD1菌株对番茄和辣椒表现为高毒性,对西瓜表现为中毒性,对草莓和水稻表现为低毒性。以上说明JD1菌株对辣椒、番茄和草莓有较强致病性,对西瓜和水稻具有一定致病性。总体来看,JD1菌株对不同作物危害程度为:番茄>辣椒>草莓>西瓜>水稻>白菜、西兰花、豆角。
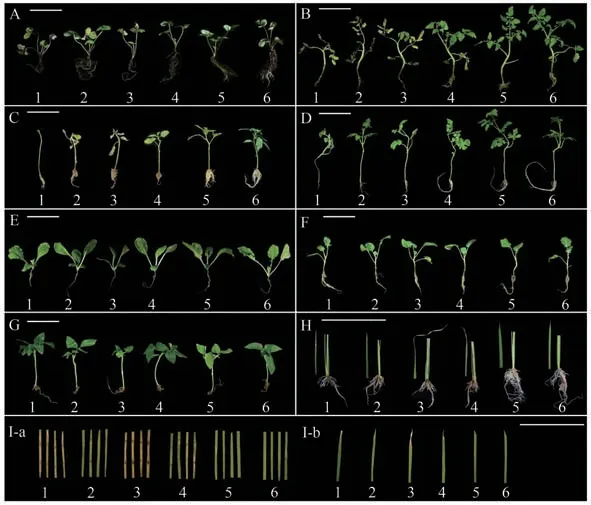
图6 不同作物接种JD1后的发病情况Fig.6 Disease incidence in different crops after inoculation with P.ananatis JD1
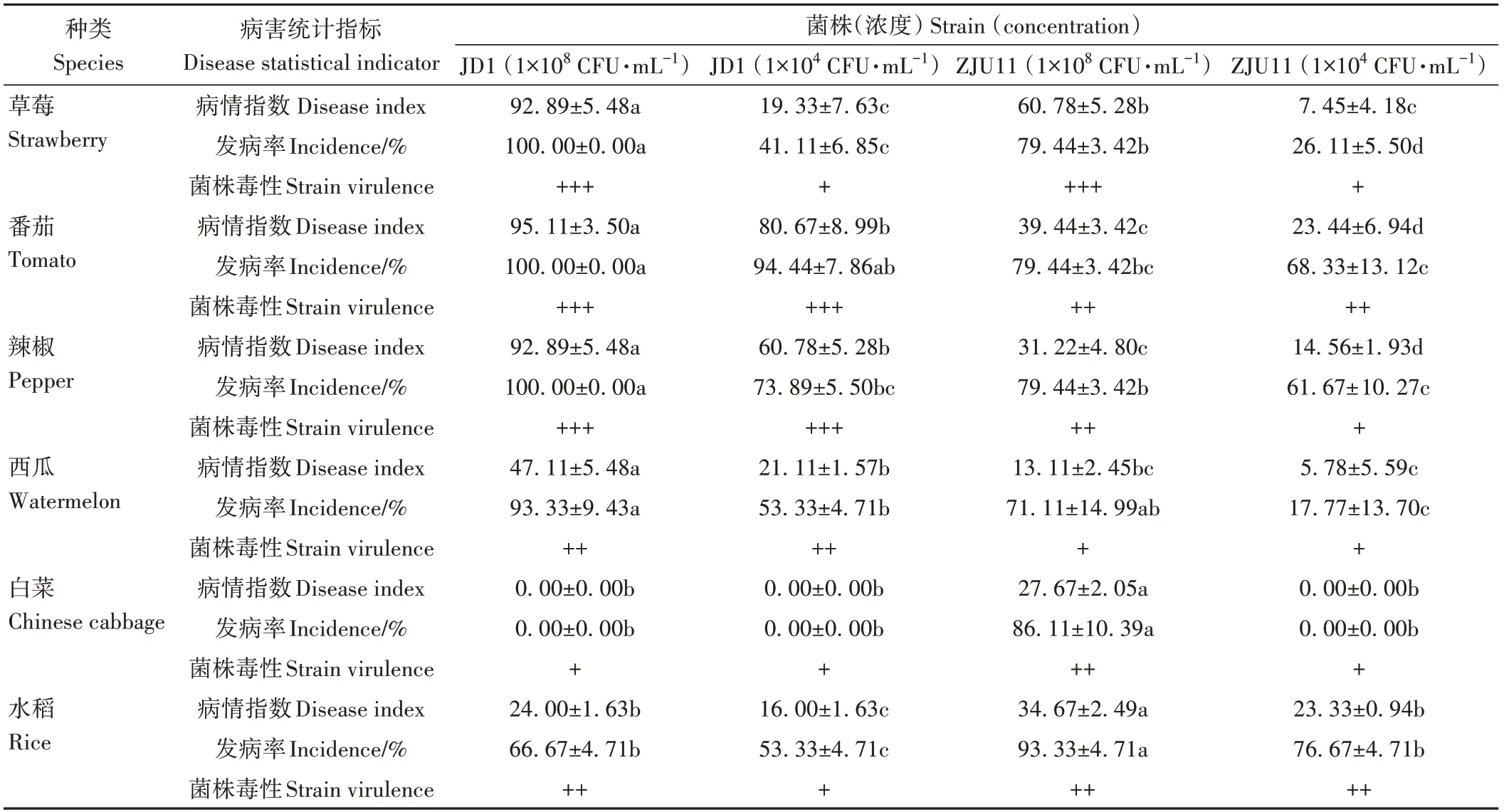
表5 不同作物接种不同浓度JD1或ZJU11后的发病情况Table 5 Disease incidence of different crops inoculated with different concentrations of P.ananatis JD1 or ZJU11
ZJU11菌株接种各作物,统计结果(表5、图6)显示1×108和1×104CFU·mL-1浓度下均能够引起草莓、番茄、辣椒、西瓜、白菜和水稻发病,对西兰花和豆角没有致病性。在1×108CFU·mL-1浓度下ZJU11菌株对草莓表现为高毒性,对番茄、辣椒、白菜和水稻表现为中毒性,对西瓜表现为低毒性;1×104CFU·mL-1浓度下ZJU11菌株对番茄和水稻表现为中毒性,对草莓、辣椒、西瓜和白菜表现为低毒性。以上说明ZJU11菌株对草莓、番茄、水稻、辣椒、白菜和西瓜有一定致病性。依此来看ZJU11菌株对不同作物危害程度为:草莓>番茄>水稻>辣椒>白菜>西瓜>西兰花、豆角。以上结果表明JD1和ZJU11对测试的8种作物的致病性强弱有所不同,且1×108CFU·mL-1浓度下ZJU11菌株对草莓、番茄、辣椒和西瓜在致病性上表现为显著弱于JD1菌株。
2.6 室内药剂筛选
利用平板抑菌圈法测定了20种药剂对P.ananatis的抑菌效果,发现12%中生菌素可湿性粉剂、50%福美双可湿性粉剂、80%乙蒜素乳油和0.3%四霉素水剂4种有效药剂(图7中4、6、9、12)。计算4种药剂对P.ananatis的毒力回归方程、相关系数和EC50值(表6),结果显示50%福美双可湿性粉剂抑菌效果最好,EC50值为20.805 7 mg·L-1,其次为0.3%四霉素水剂,EC50值为42.540 1 mg·L-1,12%中生菌素可湿性粉剂EC50值为329.443 5 mg·L-1,而80%乙蒜素乳油的抑菌效果不理想,对应EC50值为2 953.344 3 mg·L-1。

图7 20种杀菌剂对JD1的抑制效果Fig.7 Inhibitory effect of twenty bactericides on JD1
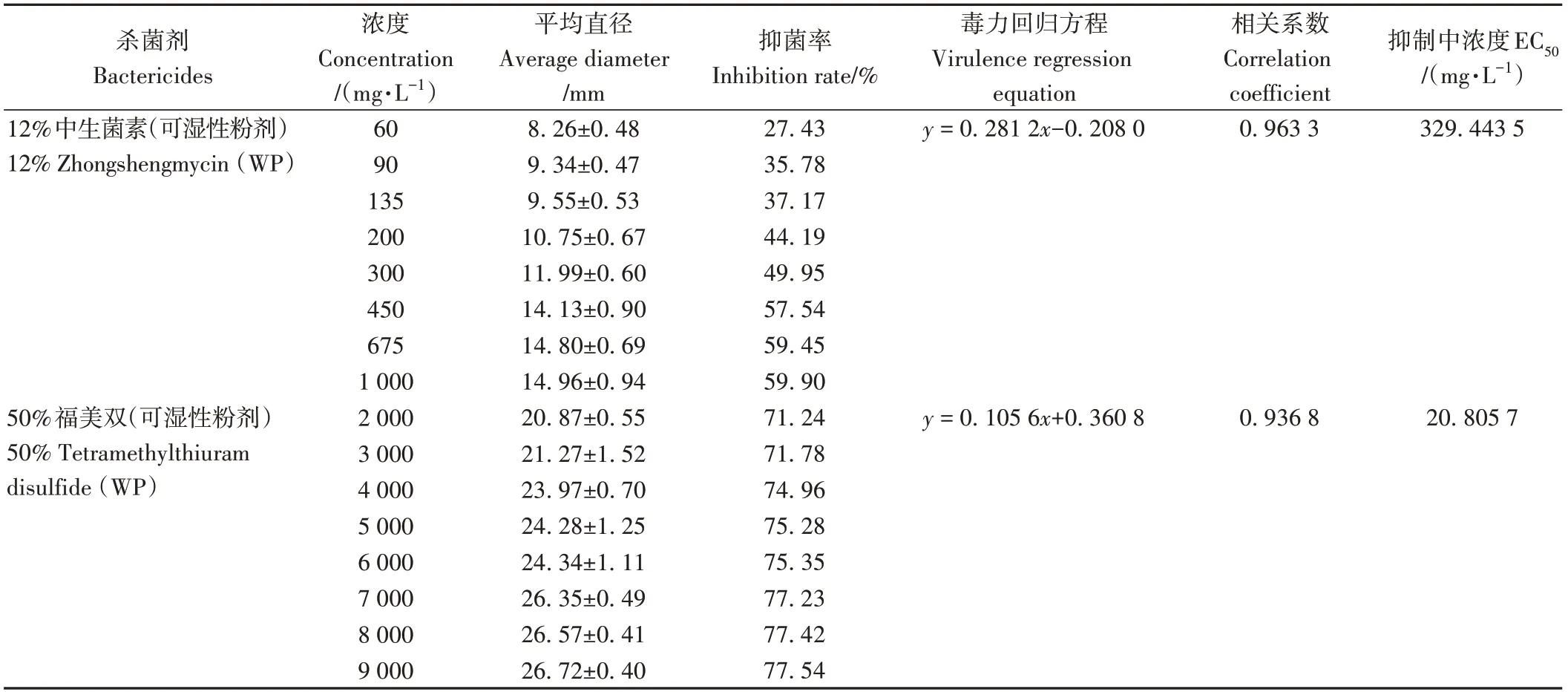
表6 4种杀菌剂对JD1的抑菌效果Table 6 Inhibition effects of four bactericides against JD1
3 讨论
随着草莓细菌性病害近年渐多,关于草莓茎基腐病病原已有报道。Zhang等[9]通过形态学及16S rRNA、gyrB、fusA多基因联合建树确定了引起浙江宁波草莓根冠腐病的病原菌为P.ananatis。Song等[10]基于形态学及gyrB、fusA、leuS、核糖核酸聚合酶β亚基(RNA polymerase beta subunit,rpoB)基因串联建树确定了引起江苏东海草莓茎腐病的病原菌为P.ananatis。但相关研究仅限于病害发生的初步报道,关于病原物的研究较为空白,因此明确病原菌的分类地位、生物学特性、寄主范围和有效药剂等,可为后续病害防控提供理论支持。本研究从浙江省建德市草莓基地发现了一种草莓病害,依据泛菌属保守基因16S rRNA、gyrB、fusA、leuS、pyrG、rplB、atpD和infB[14]构建系统发育进化树,结合形态学特征和生理生化特性,确定了引起建德草莓茎基腐病的病原菌为菠萝泛菌P.ananatis。这与Zhang等[9]在浙江宁波草莓基地和Song等[10]在江苏东海草莓种植地的发病草莓植株上分离到的病原菌一致。由此可见,P.ananatis引起的草莓病害已在多地传播,应引起密切关注和重视。
P.ananatis最初被划分在欧文氏菌属Erwinia,于1989年被分类至泛菌属Pantoea,在全世界都有分布,存在于水、土壤、植物体表面、植物种子内以及人和动物的伤口、体液当中,具有非常广阔的生态位[20]。早期报道中,P.ananatis常作为内生菌或腐生菌提及[18],随着研究的不断深入,发现其可以侵染多种植物引发病害,单子叶植物病害如禾本科的水稻细菌性叶斑病[21]、玉米细菌性褐腐病[22]和小麦细菌性叶斑病[23],百合科的洋葱叶枯病[24];双子叶植物病害如葫芦科的甜瓜果实腐烂病[25]、黄瓜细菌性叶斑病[26],以及高大乔木植物病害如桉树叶疫病[27]。在2019年和2022年加拿大[28]和埃及[29]分别报道了由P.ananatis引起的草莓细菌性叶枯病。本研究发现分离自草莓茎基腐病株的P.ananatis菌株JD1能够引起茄科作物番茄、辣椒,葫芦科作物西瓜,禾本科作物水稻发病,且对番茄和辣椒表现出较强致病性;对十字花科作物白菜、西兰花,以及豆科作物豆角没有致病性。轮作或间套作种植模式是防治土传病害的有效措施,通过填闲期种植不同作物,可调节土壤微生物群落结构和多样性,从而减轻作物病害发生[30]。但从本研究结果来看,轮作或间套作作物种类的选择尤为关键,若选择的作物仍为P.ananatis的寄主,将会引起病原菌的连续积累与传播,作物发病程度不减反增。因此,建议在草莓茎基腐病发生的种植区,考虑白菜、西兰花和豆角作为草莓生长期间或收获后的间套作或轮作作物,避免与茄科的番茄、辣椒,葫芦科的西瓜和禾本科的水稻等作物轮作,导致田间病原菌积累,加重病害发生,造成不必要的经济损失。
现有研究表明,分离自不同寄主的P.ananatis菌株表现出了致病性上的差异。如Lao等[26]报道了P.ananatis引起的黄瓜细菌性叶斑病,而Kido等[25]发现从甜瓜果腐病中分离的P.ananatis可以引起多种葫芦科植物果实腐烂,但对黄瓜和哈密瓜例外;研究发现P.ananatis引起大白菜细菌性干烧病[19],但分离自水稻的P.ananatis却对土豆和大白菜没有致病性[18]。本研究发现分离自水稻病株的P.ananatisZJU11表现出与草莓致病菌P.ananatisJD1不一样的致病力,ZJU11在1×108和1×104CFU·mL-1浓度下接种水稻,病情指数和发病率明显高于JD1接种,而在同浓度接种草莓时,ZJU11接种后的草莓病情指数和发病率都显著低于JD1接种结果(表5),推断这与病原菌的分离来源密切相关。ZJU11还能够引起茄科作物番茄、辣椒和葫芦科作物西瓜发病,但同浓度下致病力都显著弱于JD1(表5),即这两株分离自不同寄主的P.ananatis菌株出现了较为明显的致病力分化。此外白菜也可被ZJU11侵染,与王琦[18]报道的水稻致病菌P.ananatis对大白菜不致病结果不同,推测由于作物品种和生长环境不同,同样的寄主分离得到的病原菌小种也存在差异。
P.ananatis既感染单子叶植物,也感染双子叶植物,但国内针对P.ananatis引起的病害的防控相关研究较为空缺,王继承[17]通过体外药剂筛选和田间实验,确定了氯溴异氰尿酸对引起桑枯萎病的P.ananatis有较好的防治效果。在本研究用来测定对P.ananatis抑菌效果的20种杀菌剂中也包含了氯溴异氰尿酸,同样的浓度下氯溴异氰尿酸对JD1却没有抑菌效果,分析可能是由于寄主及分离地区不同,菌株互为不同小种,在耐药性上也有所差异。陈小林等[12]发现四霉素对从芒果细菌性坏死病中分离得到的泛菌属病原菌具有较好的抑制效果,而氯溴异氰尿酸、中生菌素、乙蒜素等药剂敏感性较差,与本研究结果较为一致。通过室内药剂初筛和复筛,发现50%福美双和0.3%四霉素这两种药剂的抑菌效果较好,它们的EC50值分别为20.805 7和42.540 1 mg·L-1,但其田间的实际防治效果有待进一步研究。
4 结论
经形态学与分子生物学鉴定,确定引起浙江省建德市草莓茎基腐病病原菌为菠萝泛菌P.ananatis。该病原菌JD1生长最适pH值为8,最适温度为28 ℃,最适盐浓度为1%~5%。JD1还可引起番茄、辣椒、西瓜和水稻发病,但对白菜、西兰花和豆角没有致病性,且与分离自水稻叶斑病的P.ananatisZJU11有明显的致病力差异。室内毒力测定结果显示50%福美双可湿性粉剂和0.3%四霉素水剂有较好的抑菌效果,可用于草莓茎基腐病的化学防治。

