心房颤动射频消融术后心脏损伤后综合征一例
王昊 孟庆坤 杨桂棠 孙胜楠 刘海涛
患者男性,63 岁。高血压病史20 余年,发现阵发性心房颤动(简称房颤)1.5个月,应用普罗帕酮等抗心律失常药物治疗效果欠佳,遂来本院拟行射频消融术。入院后完善术前检查,在局麻和静脉复合麻醉下行射频消融术,应用盐水灌注消融导管(强生STSF)实施环肺静脉电隔离术(43℃,40~45 W),术后透视心影未见异常。术后第2天患者诉呼吸时胸痛,无胸闷、气短等症状。查体示:体温36.8℃,血压97/71 mm Hg,心率75次/分,心律齐,心音低顿。白细胞计数(WBC)及中性粒细胞百分比(N%)升高(WBC 14.8×109/L,N%87.7%),心肌损伤标记物升高[CK-MB 7.24 ng/mL,正常参考范围0~3.38 ng/mL;心肌肌钙蛋白Ⅰ(c TnⅠ)1 140 pg/mL,正常参考范围0~34 pg/mL],心脏超声提示大量心包积液,立即行心包穿刺术,抽出暗红色血性心包积液450 ml,放置引流管。术后第3天患者出现发热(体温38.2℃),复查心电图可见ST 段弓背向下抬高(图1),白细胞计数持续升高(WBC 19.1×109/L),C 反应蛋白(CRP)、降钙素原(PCT)升高(CRP 80.74 mg/L,正常参考范围0~10 mg/L;PCT 0.320 ng/mL,正常参考范围0~0.05 ng/mL),考虑炎症反应,给予抗生素治疗(阿莫西林钠克拉维酸钾)。持续引流48 h 后,复查心脏超声无心包积液,拔除引流管。术后第4天患者体温恢复正常,心电图ST段回落恢复至术前。术后第5天白细胞计数恢复正常,复查肺部CT 提示双肺下叶渗出改变,左肺下叶部分实变(较术前新增),双侧胸腔积液(较术前新增)(图2)。术后1 周患者PCT 恢复至正常,复查心脏超声无心包积液,患者出院。
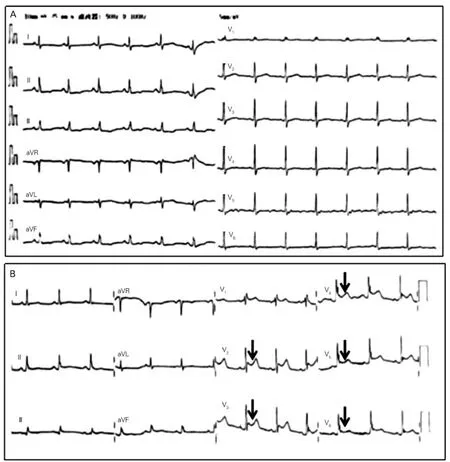
图1 术前及术后发热时心电图

图2 术前及术后发热时肺部CT
术后第14天(出院1周后),患者突发胸闷、气短,心脏超声提示大量心包积液,再次入院。查体:体温36.6℃,血压109/82 mm Hg,心率103 次/分,呼吸20 次/分,心律齐,心音低钝。实验室检查示:白细胞计数及中性粒细胞百分比再次升高、血红蛋白(Hb)下降(WBC 12.6×109/L,N%82.9%,Hb 100 g/L),心肌损伤标记物正常,行心包穿刺术,抽出暗红色血性心包积液300 ml,放置引流管。此次心包积液考虑为心脏损伤后综合征(postcar diac injur y syndro me,PCIS),给予口服洛索洛芬及秋水仙碱抗炎治疗。患者心包积液引流量约每天300 ml,血红蛋白进行性下降,最低降至77 g/L,不能完全除外心脏穿孔,静脉滴注凝血酶原、血浆等止血、扩容治疗,同时输注红细胞悬液提升Hb。上述治疗3天后患者症状逐渐好转,心包积液量逐渐减少至完全消失。药物治疗1周患者各项指标恢复正常后出院。
出院后6个月随访,患者恢复良好,复查肺部CT 及心脏彩超,未再出现心包积液和胸腔积液。
讨论 PCIS是指心脏受到各种损伤后出现的以心包、胸膜和肺实质炎症为主要临床表现的一组综合征,包括心肌梗死后、心脏外科手术后、介入相关手术后(包括经皮冠状动脉介入术、心律失常导管消融术、起搏器置入术)、钝性或者贯通伤后发生的急性心包炎。有关PCIS的发病机制至今不明,较多观点认为是心肌损伤后心肌释放心肌抗原,与心肌抗体发生作用从而引发一系列的免疫反应。还有一些假说认为,心脏损伤、心脏穿孔后血液渗入心包间隙,射频消融时释放的能量刺激心包反应等对该综合征的发生起到了关键作用[1]。
PCIS尚无统一的诊断标准,目前诊断采用基于临床过程和体检结果、实验室数据和影像学研究的综合方法,并排除其他可能的病因[2]。2015 年欧洲心脏学会(ESC)指南中[3]指出,对PCIS的诊断需要心包和/或心肌的损伤,以及除外至少两种其他原因引起的发热,即心包或胸膜痛、心包或胸膜摩擦音、心包积液或胸腔积液。PCIS最常发生在从激发事件开始7~20 d的潜伏期之后,也有极少数发生在受伤后数小时内。PCIS的实验室检查可发现白细胞升高、红细胞沉降率升高、CRP升高。PCIS相关的胸腔积液往往是左侧,如果是双侧,通常是左侧胸腔积液更多;PCIS相关的胸腔积液为渗出液,四分之三的病例以淋巴细胞为主,近三分之二是血性的[4]。本例患者在射频消融术后第二天出现的症状以胸痛为主,心脏超声提示大量心包积液,而后逐渐出现发热、胸闷、气短等症状,白细胞和CRP增高,心电图提示心包炎,肺部CT 提示肺部炎症和胸腔积液;应考虑为PCIS。但由于术后第二天出现大量血性心包积液,更多考虑心脏穿孔引起心包压塞,给予心包穿刺引流、停抗凝药物,同时给予抗炎等对症处理,症状很快缓解出院。术后第14天患者再次出现大量心包积液,白细胞和CRP也再次增高,考虑PCIS,由于心包积液量较大,Hb下降较快,也不能完全除外心脏穿孔,因此一方面给予类固醇激素、非甾体抗炎药和秋水仙碱等抗炎治疗,另一方面给予凝血酶原、凝血因子等止血治疗。该患者出现PCIS的原因考虑为:第一、射频消融术心肌损伤后释放心肌抗原,与心肌抗体发生作用从而引发一系列的免疫反应。第二、首次心脏穿孔后血液渗入心包间隙,刺激心包反应引起PCIS。该患者两次心包积液均为血性,给诊断造成一定的困难,始终不能除外心脏穿孔,但心脏穿孔和PCIS治疗不矛盾,因此治疗上给予止血的同时积极抗炎治疗。另外,该患者两次出现心包积液的同时伴随胸腔积液、甚至肺部实变;心电图可见普遍ST 段弓背向下抬高,随着病情好转,心电图恢复最初状态;实验室检查白细胞、PCT、CRP等炎性因子增高,这些均符合PCIS临床表现及实验室检查特征。但为了最大限度地减少患者风险,未对患者心肌或心包标本进行确认性组织病理学分析。
对于房颤导管消融术后出现PCIS,Yuku mi等[5]推测心房的射频消融可能影响周围的心包或其他结构并触发PCIS;Liu等[6]报道了1 728例射频消融术中,21例(1.2%)术后出现心脏穿孔,其中6 例(6/21,28.6%)诊断为继发于心脏穿孔的PCIS;这6名PCIS患者中,胸腔积液出现在消融手术后3 h至4天。因此,射频消融术后出现心包积液伴胸腔积液、发热、炎症反应的患者,除了考虑心脏穿孔外,还要考虑PICS。
PCIS的治疗基本上是基于经验性的抗炎治疗和辅助性的秋水仙碱治疗。推荐使用非甾体抗炎药和类固醇药物作为一线抗炎治疗手段,其中类固醇的疗效最好。在持续、恶化或复发的PCIS病例中,患者应接受低剂量类固醇治疗(每天泼尼松0.2~0.5 mg/kg),对于存在血流动力学障碍的患者应选择心包穿刺。而秋水仙碱已被证明对于预防心包炎是安全有效的,建议在标准抗炎治疗的基础上使用秋水仙碱,采用体重调整剂量(即如果体重≤70 kg,每天一次,每次0.5 mg;如果体重≥70 kg,每天两次,每次0.5 mg)[3]。本例患者在使用洛索洛芬、秋水仙碱及对症治疗后病情好转。

