隐丹参酮对铜绿假单胞菌的生长及生物膜形成的抑制作用
马书恒 缪林坪 陈荻秋 韩丽 张富凯 贺气志

收稿日期:2023-09-11;修回日期:2023-09-27。
基金項目:国家自然科学基金青年项目(82100040);湖南省教育厅科学研究项目(湘教通〔2022〕323号-22B0899);湖南省大学生创新创业训练项目(湘教通〔2021〕197号-3905);湖南省大学生创新创业训练计划重点支持领域项目(湘教通〔2023〕237号-38);长沙医学院大学生创新创业训练项目(长医教〔2023〕51号-108)。
作者简介:#表示为共同第一作者。
* 通信作者:贺气志,副教授,主要从事中医药抗感染的相关研究及生物传感器设计。E-mail: 314190831@qq.com。
摘 要:为研究隐丹参酮(cryptotanshinone)对铜绿假单胞菌(Pseudomonas aeruginosa)的生长和生物膜形成的影响及其机制,采用微量稀释法测定隐丹参酮对铜绿假单胞菌的最小抑菌质量浓度(MIC),利用结晶紫染色法、倒置显微镜和激光扫描共聚焦显微镜观察隐丹参酮对铜绿假单胞菌生物膜形成的影响,再采用实时荧光定量聚合酶链反应(RT-qPCR)检测隐丹参酮对铜绿假单胞菌生物膜形成相关基因LasI、LasR、RhlI和RhlR的表达的影响。隐丹参酮对铜绿假单胞菌的MIC为800.0 μg/mL;结晶紫染色后,隐丹参酮的质量浓度为800.0 μg/mL时抑制菌膜效果最佳,且呈剂量依赖性(P<0.01);利用激光共聚焦显微镜观察隐丹参酮对生物膜的形成和分布,200.0 μg/mL时抑菌效果显著提升。在200.0~800.0 μg/mL的质量浓度范围内,800.0 μg/mL的隐丹参酮对LasI、LasR、RhlI和RhlR基因的表达具有抑制作用(P<0.01)。隐丹参酮抑制铜绿假单胞菌生物膜形成机制可能是通过下调LasI等基因的表达。本研究表明,隐丹参酮可以作为群体感应抑制剂干预铜绿假单胞菌的耐药,为临床多重耐药铜绿假单胞菌(MDR-PA)的治疗提供参考。
关键词:铜绿假单胞菌;生物膜;隐丹参酮;群感系统;耐药性
中图分类号:R378.99+1 文献标志码:ADOI:10.3969/j.issn.1007-7146.2024.01.011
Inhibitory Effect of Cryptotanshinone on Biofilm Formation of Pseudomonas aeruginosa
MA Shuheng1a#, MIAO Linping1b#, CHEN Diqiu1a, HAN Li1b, 2, ZHANG Fukai1b, HE Qizhi1b, 2*
(1. Changsha Medical University a. The First Clinical College, b. School of Basic Medical Science, Changsha 410219, China;
2. Hunan Provincial Key Laboratory of the Research and Development of Novel Pharmaceutical Preparations, Changsha 410219, China)
Abstract: To investigate the effects of cryptotanshinone on the growth and biofilm formation of Pseudomonas aeruginosa and its mechanism, the minimum inhibitory concentration (MIC) of cryptotanshinone on P. aeruginosa was determined by microdilution, and the effect of cryptotanshinone on P. aeruginosa biofilm formation was observed by crystal violet staining, inverted microscope and laser scanning confocal microscope, and the effect of cryptotanshinone on P. aeruginosa biofilm formation was measured by real-time fluorescence quantitative polymerase chain reaction (RT-qPCR). The effect of cryptotanshinone on the expression of genes related to P. aeruginosa biofilm formation was detected by RT-qPCR. The MIC of cryptotanshinone on P. aeruginosa was 800.0 μg/mL; after crystal violet staining, the best inhibition of biofilm was observed at the mass concentration of cryptotanshinone of 800.0 μg/mL in a dose-dependent manner (P<0.01). The formation and distribution of biofilm by cryptotanshinone were observed by confocal laser microscopy, and the inhibition effect was significantly enhanced at 200.0 μg/mL. In the range of 200.0~800.0 μg/mL mass concentration, cryptotanshinone at 800.0 μg/mL mass concentration inhibited the expression of LasI, LasR, RhlI and RhlR genes (P<0.01). The mechanism of cryptotanshinone inhibition of P. aeruginosa biofilm formation may be through the down-regulation of LasI and other genes expression. The present study suggests that cryptotanshinone can be used as a group-sensing inhibitor to intervene in the drug resistance of P. aeruginosa, which can provide a reference for the treatment of multi-drug-resistant P. aeruginosa (MDR-PA) in the clinic.
Key words: Pseudomonas aeruginosa; biofilm; cryptotanshinone; quorum sensing; drug resistance
(Acta Laser Biology Sinica, 2024, 33(1): 090-096)
铜绿假单胞菌(Pseudomonas aeruginosa,PA)是常见的条件致病菌,是导致医院内感染和呼吸及相关性肺炎的主要原因,在囊性纤维化病人和免疫缺陷个体中引起的发病率和死亡率较高。PA对多种抗生素具有耐药性,包括氨基糖苷类(aminoglycosides)、喹诺酮类(quinolones)和β-内酰胺类(β-lactams)。PA产生多重耐药性的原因主要是其具有多种内生性、获得性和适应性抗生素耐药机制。其中,生物膜介导的适应性耐药可以产生多重耐药持久细胞,阻止抗生素治疗靶点的合成,从而形成多重耐药性[1-3]。
群体感应(quorum sensing,QS)系统是细菌之间通过自诱导信号分子进行交流的信號通路,其通过监测细菌密度和调控细菌行为调节细菌生物膜形成。PA的群感系统分别有Las、Rhl、PQS和IQS 4个系统,Las和Rhl系统是PA主要的2个QS系统。Las和Rhl系统都受到N-酰基高丝氨酸内酯(N-acyl-homoserine lactone,AHL)自诱导信号分子调节,LasR和RhlR基因决定生成转录调节因子,LasI和RhlI基因决定生成合成酶,产生AHL同系物3OC12-HSL和C4-HSL自诱导信号分子。随着细菌密度的不断增大,自诱导信号分子达到一定阈值,LasR和RhlR分别与3OC12-HSL和C4-HSL结合,Las和Rhl系统被激活,调节细菌生物膜的形成[4-5]。有研究发现,该系统可造成细胞凋亡从而破坏肠上皮屏障[6]。
隐丹参酮(cryptotanshinone)是一种二萜醌类化合物(图 1),提取自植物丹参(Salvia miltiorrhiza Bunge),具有抗氧化、抗炎和抗肿瘤等作用,同时还具有对人体毒副作用小的特点[7-8]。此外,隐丹参酮还可以抑制铜绿假单胞菌、金黄色葡萄球菌(Staphylococcus aureus)等浮游细菌 [9-10] 的生长。然而,对于隐丹参酮对生物膜抑制作用机制的研究还很缺乏。因此,我们假设隐丹参酮可能通过抑制Las和Rhl系统的表达抑制PA生物膜的形成。本研究采用体外观察的方法检测隐丹参酮对PA生物膜形成的抑制作用,为PA感染的治疗和耐药性的研究提供依据。
图1 隐丹参酮的化学结构
Fig. 1 The chemical structure of cryptotanshinone
1 材料与方法
1.1 材料
隐丹参酮、1%结晶紫溶液购于北京索莱宝科技有限公司;甲醇购于北京兰博康斯科技有限公司;PA为临床分离菌,由长沙医学院第一附属医院提供;12孔板、96孔板、溶菌肉汤(Luria-Bertani,LB)培养基、UNlQ-10柱式总RNA分离试剂盒等购于生工生物工程(上海)股份有限公司;实时荧光定量聚合酶链反应(real-time fluorescence quantitative PCR,RT-qPCR)试剂盒购于北京百奥莱博科技有限公司。
1.2 方法
1.2.1 隐丹参酮对PA最小抑菌浓度的测定
活化的PA接种至液体LB培养基,37℃摇床过夜培养8 h,取对数生长期的菌液,使用液体LB培养基稀释至1.5×108 CFU/mL菌悬液备用。使用液体LB培养基将隐丹参酮稀释至质量浓度为0~800.0 μg/mL。在96孔板中,每个孔加入100 μL的菌悬液和100 μL稀释后含隐丹参酮的培养液,混合后于37℃培养24 h,使用酶标仪测定OD600 nm值(细菌培养液在600 nm波长处的吸光值)。液体LB培养基作空白对照,每组设3个复孔。
1.2.2 结晶紫染色法观察隐丹参酮对PA生物膜
形成的影响
将100 μL 1.5×108 CFU/mL的 PA菌液接种到96孔板中,分别加入隐丹参酮(0~800.0 μg/mL)溶液,于 37℃恒温培养箱中静置培养48 h。吸出浮游菌,使用PBS缓冲液冲洗孔板3次,向每个孔中加入100 μL甲醇固定15 min,弃去甲醇溶液,使用磷酸盐缓冲溶液(phosphate buffered saline,PBS)冲洗3次。向每个孔中加入100 μL 1%结晶紫溶液,并在室温下染色5 min。随后吸出1%结晶紫溶液,用蒸馏水洗去多余的染液,自然风干后,向各孔中加入100 μL 体积分数为33%的冰醋酸溶液溶解5 min,用酶标仪在570 nm处测量培养孔中溶液的OD570 nm值(细菌培养液在570 nm波长处的吸光值),根据获得的OD570 nm值测定生物膜形成的能力[11],每组设3个复孔。
1.2.3 显微镜观察隐丹参酮对PA生物膜形成的影响
取12孔细胞培养板,孔中放入无菌玻片,每孔分别加入1 mL菌液和1 mL各质量浓度的隐丹参酮溶液(0~800.0 μg/mL),37℃静止培养24 h后,吸出多余液体,使用PBS缓冲液洗涤3次,甲醇固定15 min后,生理盐水洗涤3次,自然风干。每孔加入500 μL配制好的结晶紫染色剂或SYTO9染色剂,避光染色15 min后,吸出染色液,使用生理盐水洗涤3次。取出玻片,制片后放于倒置显微镜和激光共聚焦显微镜下观察PA生物膜形成情况。
1.2.4 隐丹参酮对PA生物膜形成相关基因表达的影响
将PA接种于96孔板,每孔加入200 μL LB培养基。每个孔中加入不同质量浓度的隐丹参酮溶液(0~800.0 μg/mL),37℃静置培养48 h。收集浮游细菌,离心,收集沉淀物,使用UNlQ-10柱式总RNA分离试剂盒提取沉淀物细胞的总RNA。按照生产厂家提供的程序对生物膜形成的相关基因LasI、LasR、RhlI和RhlR进行RT-qPCR,并从中获得RT-qPCR数据。RT-qPCR分析所用引物见表1。重复试验3次。
表1 引物信息
Tab. 1 Primer information
Gene Primer sequence
LasI
F: GAAATCGATGGTTATGACGC
R: CGGCACGGATCATCATCTTC
LasR
F: ATGGCCTTGGTTGACGGT
R: TCAGAGAGTAATAAGACCCAAATTAACG
RhlI
F: TCAGGTCTTCATCGAGAAGC
R: CGTTGCGAACGAAATAGCG
RhlR
F: TGGATCCGGCGATCCTCAAC
R: GCTCTAGAGCTTCTGGGTCAGCAACT
注:引物序列来自文献[12-13] 。
Note: Primer sequences from the literature[12-13].
1.2.5 數据分析
采用SPSS 25.0软件对试验数据进行统计分析。数据以平均值±标准差(x±s)表示,药物干预组与空白对照组的差异采用单因素方差分析,P<0.05,差异有统计学意义。
2结果与分析
2.1 隐丹参酮对PA最小抑菌质量浓度的测定
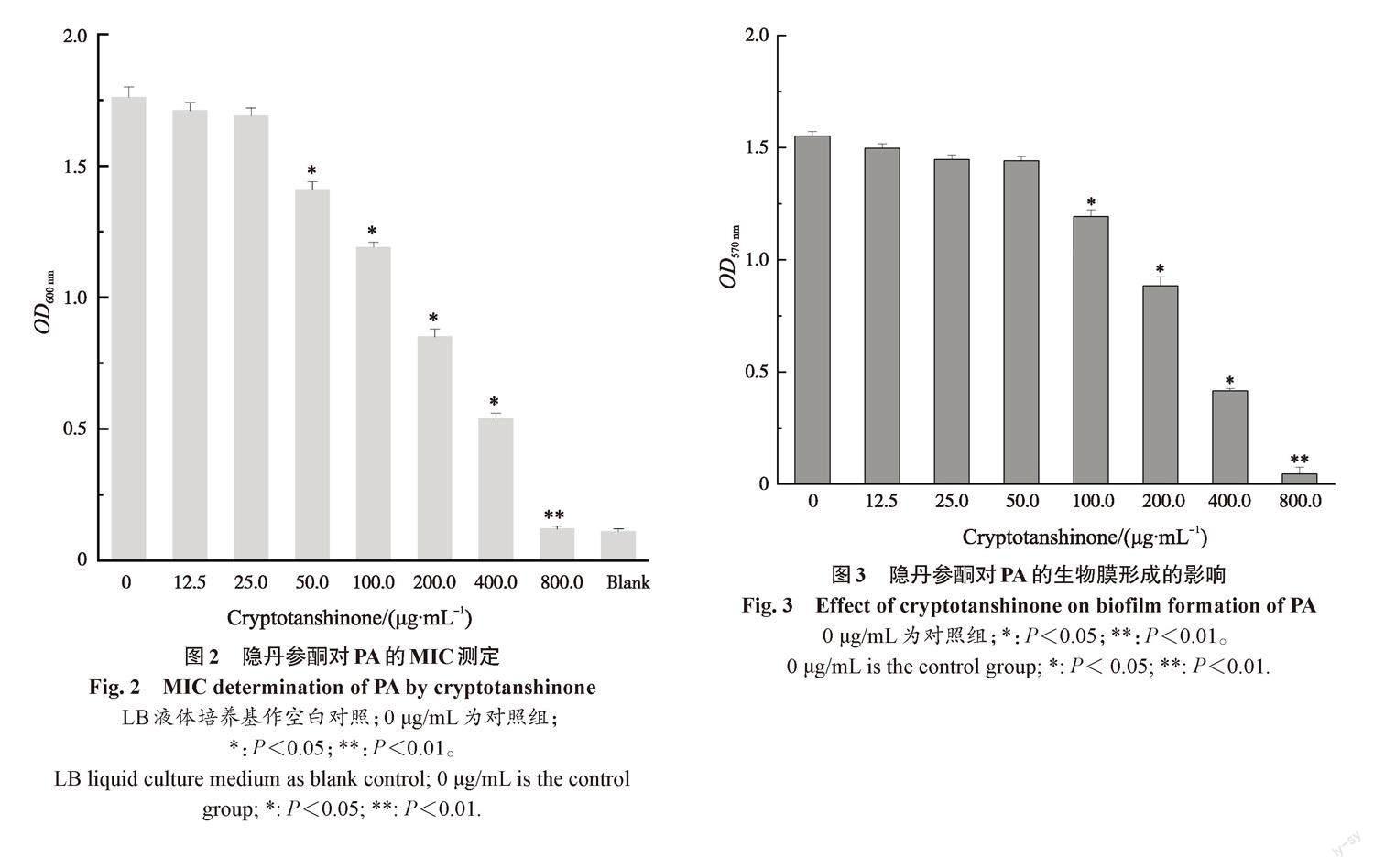
随着隐丹参酮质量浓度的增加,PA的生长显著受到抑制(图 2)。25.0 μg/mL的隐丹参酮对PA生长的抑制并不显著;50.0 μg/mL的隐丹参酮对PA生长有显著抑制(P<0.05);800.0 μg/mL的隐丹参酮对PA的生长完全抑制(P<0.01);隐丹参酮对于PA生长的MIC为800.0 μg/mL。这说明隐丹参酮对于PA有抑菌活性。
2.2 结晶紫染色法观察隐丹参酮对PA生物膜
形成的影响
利用结晶紫染色法测定不同质量浓度隐丹参酮对PA生物膜形成的影响(图3)。由阴性对照孔3次OD570 nm值计算出平均值及标准差的3倍作为临界值(optical delnsity critical,ODC),其大小为0.04,PA的OD570 nm为1.55,有很强的生物膜形成能力。加入100.0 μg/mL的隐丹参酮,PA的生物膜形成开始明显减少(P<0.05),随着隐丹参酮质量浓度的增加,生物膜形成逐渐减少,当加入质量浓度为800.0 μg/mL的隐丹参酮时,生物膜形成被完全抑制(P<0.01)。结果证明,隐丹参酮能有效抑制PA生物膜的形成。
2.3 结晶紫染色观察隐丹参酮对PA生物膜形成的影响
结晶紫染色后于倒置显微镜下观察生物膜的形成情况(图4)。空白对照组形成的生物膜密集、均匀。随着隐丹参酮质量浓度增大,生物膜形成量呈现依赖性减少。隐丹参酮质量浓度达到100.0 μg/mL时,生物膜显著减少;质量浓度达到800.0 μg/mL时,几乎无生物膜生长。
2.4 激光共聚焦显微镜观察隐丹参酮对PA生物膜形成的影响
使用激光扫描共聚焦显微镜观察隐丹参酮对PA生物膜形成的影响(图5)。空白对照组的PA形成片状的生物膜,均匀覆盖在玻片上,浮游细菌较少。质量浓度小于100.0 μg/mL的隐丹参酮作用于PA,生物膜形成时未有显著的抑制效果,PA仍以生物膜形式集中黏附于玻片表面;隐丹参酮质量浓度为100.0 μg/mL时,PA形成的生物膜开始减少,分布较分散,生物膜周围有少量的浮游细菌;随着质量浓度的增加,PA的数量及生物膜形成逐渐减少,隐丹参酮质量浓度为800.0 μg/mL时,PA几乎不形成生物膜,细菌比较分散。激光扫描共聚焦显微镜观察的结果与倒置显微镜观察的结果相同。
2.5 隐丹参酮对PA生物膜形成相关基因表达的影响
为探究隐丹参酮抑制PA生物膜形成的机制,在不同质量浓度隐丹参酮作用下测定生物膜形成相关基因的表达。LasI、LasR和RhelI、RhlR基因分别组成Las系统和Rhl系统,可以调节PA的毒力因子和生物膜的形成。试验结果表明(图6):隐丹参酮可以抑制Las和Rhl系统中LasI、LasR、RhlI和RhlR基因的表达(P<0.05);隐丹参酮质量浓度为100.0 μg/mL时,LasI基因表达量相较于对照组未有明显差异,LasR、RhlI和RhlR基因的表达被显著抑制(P<0.05);隐丹参酮质量浓度为200 μg/mL时,4个基因表达量均显著下降(P<0.05);隐丹参酮质量浓度为800.0 μg/mL时,4个基因的表达量下降50%以上(P<0.05)。由上述结果可以得出,隐丹参酮能够通过抑制PA的Las和Rhl系统抑制生物膜的形成。
3 讨论
PA是导致医院内感染的常见细菌之一,常见于烧伤及免疫低下相关患者的继发感染中。在临床应用的抗感染治疗过程中,由于PA本身存在较强的固有耐药性,并且随着抗生素的滥用,其产生了多重耐药性。PA的感染治疗成为了临床工作的重点和难点。国内外对PA的耐药机制展开了大量的研究,研究结果表明,生物膜的形成是PA耐药机制的主要原因之一[14-15]。因此,抑制PA的生物膜形成对解决其耐药问题起着重要作用。
研究发现,中草药含有多种抑菌活性成分,且作用效果显著。 Wang等[16]的研究证明,鱼腥草酸钠可以有效控制PA的生物膜分散能力,并可以通过药物剂量依赖性的方法控制关键生物膜调控剂bdlA基因的表达及其有关蛋白质的形成,也可以控制QS体系中的Las的表达;Guo等[17]证明,穿心莲内酯可以通过干扰QS系统降低鸡致病性大肠杆菌的致病性。此外,中药还具有价格低廉、副作用小、不易产生耐药性等优点。丹参是天然的草本植物,有活血化瘀、镇静安神等药效。研究发现,其有治疗心血管疾病和恶性肿瘤的功效[18-19],而对细菌感染的治疗报道较少。隐丹参酮是提取自丹参的脂溶性物质,具有抗菌抗炎,抗肿瘤、抗氧化等活性。薛明等[20]的研究显示,隐丹参酮对于金黄色葡萄球菌具有明显的抑制生长作用。本研究通过试验测定隐丹参酮的MIC为800 μg/mL,表明其对PA的生长具有抑制作用,具有抗菌活性。
PA的多重耐药性与生物膜的形成密切相关。一些研究表明,隐丹参酮對金黄色葡萄球菌具有抗生物膜活性[21]。在本研究中,我们进一步研究了隐丹参酮对PA的抗生物膜活性。在结晶紫染色法中,随着隐丹参酮质量浓度的增加,OD570 nm值呈剂量依赖性减少。当使用800 μg/mL的隐丹参酮时,PA的生物膜形成完全被抑制。激光共聚焦扫描显微镜和倒置显微镜结果显示,隐丹参酮能显著降低生物膜的分布和形成。这些结果表明,隐丹参酮可以通过破坏生物膜干预PA多重耐药性的产生。
PA生物膜的形成受多种因素的调节。QS系统依靠细胞密度进行调节,是调控生物膜形成的关键因素之一。PA主要依赖于Las和Rhl两个LuxI/R群体感应系统。LasI产生自诱导信号分子3OC12-HSL,LasR与信号分子结合成为LasR:3OC12-HSL复合体,激活包括RhlR在内的许多基因的转录。RhlR被激活后,RhlR结合RhlI产生的自诱导因子C4-HSL形成RhlR:C4-HSL复合物,调节生物膜的形成[22]。在过去的十几年中,人们针对研制PA的群感效应研发了不同的抑制剂,通过干扰Las和Rhl系统或拮抗LasR和RhlR的方式使生物膜的结构被破坏或形成受阻。Ishida等[23]的研究利用一种合成的群体感应抑制剂,N-酰基环戊酰胺(C15H29NO),抑制3OC12-HSL和C4-HSL与其同源受体的结合,干扰Las和Rhl系统,导致PA生物膜的形成受损。G?kalsin等[24]的研究证明,在植物、藻类和地衣中常见的类胡萝卜素玉米黄质,通过结合群体感应信号受体LasR和RhlR来阻断毒力基因LasB和RhlA的表达,减少了PA生物膜的形成。杨磊等[25]研究了大叶桉挥发油对PA生物膜抑制效果以及相关基因的表达,发现植物相关提取物可以对PA生物膜形成的相关基因产生作用。为了研究隐丹参酮抑制PA生物膜形成的机制,我们选择Las和Rhl系统相关基因作为药物干预研究的候选基因。随着隐丹参酮质量浓度的增加,这4个关键基因的表达量逐渐降低。当隐丹参酮质量浓度达到800 μg/mL时,相对表达量下降到50%以下,说明隐丹参酮可以通过抑制Las和Rhl系统抑制PA生物膜的形成。AHL是Las和Rhl系统的自诱导信号分子,由LasI和RhlI产生。因此可以推测,AHL的产生可能受到隐丹参酮的抑制,从而导致生物被膜形成的减少。
综上所述,本研究表明,隐丹参酮对PA生物膜的形成具有抑制作用,为治疗PA的感染和干预其多重耐药性的产生奠定了基础。隐丹参酮抑制PA生物膜的形成机制可能是隐丹参酮抑制Las和Rhl系统的相关基因,进而影响PA的群体感应系统以及生物膜的形成。因此,隐丹参酮作为PA生物膜形成的群体感应抑制剂具有良好的研发潜力。
参考文献(References):
[1] PANG Z, RAUDONIS R, GLICK B R. Antibiotic resistance in Pseudomonas aeruginosa: mechanisms and alternative therapeutic strategies[J]. Biotechnology Advances, 2019, 37(1): 177-192.
[2] TUON F F, DANTAS L R, SUSS P H, et al. Pathogenesis of the Pseudomonas aeruginosa biofilm: a review[J]. Pathogens, 2022, 11(3): 300.
[3] 朱雄林, 冯显红, 杨梅, 等. 医院铜绿假单胞菌感染分布及耐药机制研究[J]. 中国病原生物学杂志, 2022, 17(4): 446-450.
ZHU Xionglin, FENG Xianhong, YANG Mei, et al. Study on infection distribution and drug resistance mechanism of Pseudomonas aeruginosa in hospital[J]. Journal of Parasitic Biology, 2022, 17(4): 446-450.
[4] RUTHERFORD S T, BASSLER B L. Bacterial quorum sensing: its role in virulence and possibilities for its control[J]. Cold Spring Harbor Perspectives in Medicine, 2012, 2(11): a012427.
[5] 欧兴坤, 李文桂. 铜绿假单胞菌群体感应系统Las/Rhl蛋白的研制现状[J]. 中国病原生物学杂志, 2021, 16(8): 988-992.
OU Xingkun, LI Wengui. Advance in studies on Las/Rhl of Pseudomonas aeruginosa[J]. Journal of Parasitic Biology, 2021, 16(8): 988-992.
[6] TAO S, XIONG Y, HAN D, et al. N-(3-oxododecanoyl)-L-homoserine lactone disrupts intestinal epithelial barrier through triggering apoptosis and collapsing extracellular matrix and tight junction[J]. Journal of Cellular Physiology, 2021, 236(8): 5771-5784.
[7] 汪丽佩, 金超英, 王一奇, 等. 隐丹参酮抑制STAT3磷酸化改变弥漫大B细胞淋巴瘤移植瘤肿瘤微环境作用的研究[J]. 中国药学杂志, 2023, 58(8): 683-688.
WANG Lipei, JIN Chaoying, WANG Yiqi, et al. Effect of cryptotanshinone on tumor microenvironment of diffuse large B cell lymphoma xenograft model mice by inhibiting STAT3 phosphorylation[J]. Chinese Pharmaceutical Journal, 2023, 58(8): 5771-5784.
[8] 刘航, 夏丽洁, 李金耀, 等. 隐丹参酮对乳腺癌他莫昔芬耐药细胞的生长抑制作用与机制研究[J]. 药学学报, 2022, 57(9): 2751-2758.
LIU Hang, XIA Lijie, LI Jinyao, et al. Inhibitory effects and mechanisms of cryptotanshinone on the growth of tamoxifen resistant breast cancer cells[J]. Acta Pharmaceutical Sinica, 2022, 57(9): 2751-2758.
[9] FENG C, HUANG Y, HE W, et al. Tanshinones: first-in-class inhibitors of the biogenesis of the type 3 secretion system needle of Pseudomonas aeruginosa for antibiotic therapy[J]. ACS Central Science, 2019, 5(7): 1278-1288.
[10] 易辉, 祖瑞铃, 易玉玲, 等. 隐丹参酮对表皮葡萄球菌生物膜的抑制作用[J]. 中国感染控制杂志, 2017, 16(9): 798-803.
YI Hui, ZU Ruiling, YI Yuling, et al. Inhibitory effect of cryptotanshinone on biofilm of Staphylococcus epidermidis[J]. Chinese Journal of Infection Control, 2017, 16(9): 798-803.
[11] 易彩虹, 劉德梦. 大肠埃希菌生物被膜形成能力测定及其耐药性分析[J]. 山东医药, 2016, 56(2): 62-63.
YI Caihong, LIU Demeng. Determination of biofilm formation ability and drug resistance analysis of Escherichia coli[J]. Shandong Medical Journal, 2016, 56(2): 62-63.
[12] STEINDLER L, BERTANI I, DE SORDI L, et al. LasI/R and RhlI/R quorum sensing in a strain of Pseudomonas aeruginosa beneficial to plants[J]. Applied and Environmental Microbiology, 2009, 75(15): 5131-5140.
[13] 张峰领, 安琳, 李进, 等. 铜绿假单胞菌LasR基因反义肽核酸序列筛选及其抑制生物被膜形成的研究[J]. 第三军医大学学报, 2017, 39(6): 529-535.
ZHANG Fengling, AN Lin, LI Jin, et al. Screening of antisense peptide nucleic acid sequence targeting LasR gene of Pseudomonas aeruginosa and its inhibition on biofilm formation[J]. Bulletin of the Third Military Medical College, 2017, 39(6): 529-535.
[14] 陈兴英, 张能华, 袁春妹, 等. 黄芩苷联合妥布霉素对耐碳青霉烯铜绿假单胞菌的生物膜抑制作用分析[J]. 中国卫生检验杂志, 2023, 33(9): 1071-1074.
CHEN Xingying, ZHANG Nenghua, YUAN Chunmei, et al. Inhibitory effect of baicalin combined with tobramycin on biofilm of carbapenem-resistant Pseudomonas aeruginosa[J]. Chinese Journal of Health Laboratory Technology, 2023, 33(9): 1071-1074.
[15] ?IEMYT? M, CARDA-DIEGUEZ M, RODR?GUEZ-DIAZ J C, et al. Real-time monitoring of Pseudomonas aeruginosa biofilm growth dynamics and persister cells eradication[J]. Emerging Microbes & Infections, 2021, 10(1): 2062-2075.
[16] WANG T, HUANG W, DUAN Q, et al. Sodium houttuyfonate in vitro inhibits biofilm dispersion and expression of bdlA in Pseudomonas aeruginosa[J]. Molecular Biology Reports, 2019, 46(1): 471-477.
[17] GUO X, ZHANG L Y, WU S C, et al. Andrographolide interferes quorum sensing to reduce cell damage caused by avian pathogenic Escherichia coli[J]. Veterinary Microbiology, 2014, 174(3/4): 496-503.
[18] WANG X, MORRIS-NATSCHKE S L, LEE K H, et al. New developments in the chemistry and biology of the bioactive constituents of tanshen[J]. Medicinal Research Reviews, 2007, 27(1): 133-148.
[19] 郝红, 李方, 王志, 等. 隐丹参酮对脑缺血再灌注损伤神经元细胞凋亡的作用[J]. 中国临床药理学杂志, 2021, 37(3): 250-254.
HAO Hong, LI Fang, WANG Zhi, et al. Effects of cryptotanshinone on the apoptosis of neurons after cerebral ischemia reperfusion injury[J]. The Chinese Journal of Clinical Pharmacology, 2021, 37(3): 250-254.
[20] 薛明, 崔颖, 汪汉卿, 等. 隐丹参酮及其代谢物在猪体内的药代动力学研究[J]. 药学学报, 1999(2): 2-5.
XUE Ming, CUI Ying, WANG Hanqing, et al. Pharmacokinetic study of cryptotanshinone and its metabolites in pig[J]. Acta Pharmaceutical Sinica, 1999(2): 2-5.
[21] 李昌勤, 赵琳, 薛志平, 等. 隐丹参酮抑菌作用机制研究[J]. 中国药学杂志, 2012, 47(21): 1706-1710.
LI Changqin, ZHAO Lin, XUE Zhiping, et al. Antibacterial mechanism of cryptotanshinone[J]. Chinese Pharmaceutical Journal, 2012, 47(21): 1706-1710.
[22] OLOUGHLIN C T, MILLER L C, SIRYAPORN A, et al. A quorum-sensing inhibitor blocks Pseudomonas aeruginosa virulence and biofilm formation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(44): 17981-17986.
[23] ISHIDA T, IKEDA T, TAKIGUCHI N, et al. Inhibition of quorum sensing in Pseudomonas aeruginosa by N-acyl cyclopentylamides[J]. Applied and Environmental Microbiology, 2017, 73(10): 3183-3188.
[24] G?KALSIN B, AKSOYDAN B, ERMAN B, et al. Reducing virulence and biofilm of Pseudomonas aeruginosa by potential quorum sensing inhibitor carotenoid: zeaxanthin[J]. Microbial Ecology, 2017, 74(2): 466-473.
[25] 楊磊, 黄庆, 高兴新, 等. 大叶桉挥发油对铜绿假单胞菌的体外抑菌效果及生物膜抑制作用[J]. 广西医学, 2023, 45(1): 56-59, 66.
YANG Lei, HUANG Qing, GAO Xingxin, et al. Effects of bacteriostasis in vitro and biofilm inhibition of Eucalyptus robusta-derived volatile oil on Pseudomonas aeruginosa[J]. Guangxi Medical Journal, 2023, 45(1): 56-59, 66.

