肾脏3.0 T 多频磁共振弹性成像:解剖区域、生理因素与正常肾脏硬度的关系
梁秋梅,戚瑞瑞,罗培茵,孟凡琦,盘中贤,陈秋怡,李峻枫,潘劲统,陈玥瑶
0 引言
慢性肾脏疾病(chronic kidney disease, CKD)已成为一个全球性的重大公共卫生问题[1-5],当疾病发展到终末期,患者只能通过透析或者换肾来维持生命[6],是死亡的主要原因之一。病理活检是评估肾脏情况的金标准,然而存在取样误差、有创性及术后并发症等局限性。基于血清肌酐计算的估计肾小球滤过率(estimated glomerular filter rate, eGFR)是临床最常用于评估CKD 患者肾功能的方式,并以此作为CKD 分期的依据[7],但该指标因受到身体质量指数(body mass index, BMI)、种族等影响[8-12],敏感性和特异性都较低。
在肾功能恶化过程中,肾脏发生的一些病理改变,如肾小球硬化、肾小管间质纤维化等都会使肾脏变硬[13-15],因此,组织硬度可以作为无创评估肾脏功能及结构变化的影像生物标志物。磁共振弹性成像(magnetic resonance elastography, MRE)是唯一可以评估组织硬度的MR技术,在评估肝纤维化方面已取得了显著的成果,目前也逐渐有研究报道了MRE 在糖尿病肾病、IgA 肾病、肾小球肾炎、狼疮性肾炎等CKD 诊断中的可行性,并且具有良好的诊断价值[16-22]。最近新引入的3.0 T 多频MRE(multifrequency MRE, mMRE)[23-28]相对传统单频MRE,具有更高的图像分辨率,因此可以更全面地评估肾功能及肾结构的改变。
相对于肝脏,肾脏是一个高度血管化、异质性和各向异性的器官[29-30],肾脏不同解剖区域(左肾和右肾,全肾、外皮质、内皮质和髓质)的硬度可能存在差异,生理因素的改变(年龄、性别、BMI、饮水情况)可能对肾脏硬度产生影响,而既往相关研究较少且结果不一[31-33],这将影响将来应用mMRE 评估肾脏疾病严重程度的准确性。所以我们的研究目标是提供正常肾脏不同解剖区域mMRE 参数值的参考范围,分析生理因素与肾脏mMRE 参数值的关系,为将来应用mMRE 评估肾脏疾病的研究提供数据分析的参考及患者准备。
1 材料与方法
1.1 研究对象
这项前瞻性研究遵守《赫尔辛基宣言》,得到了深圳市中医院(广州中医药大学第四临床医学院)伦理委员会的批准(批准文号:K2023-047-02),并获得每位志愿者的书面知情同意书。2023 年3 月至2023 年12 月在我院门诊部招募97 名健康志愿者。纳入标准:(1)无任何肾病史,肾功能正常;(2)无影响肾功能的其他疾病如糖尿病、高血压、高尿酸等;(3)无MRI检查禁忌证。排除标准:图像存在明显伪影,影响观察。记录每位志愿者年龄、性别、身高、体质量,计算BMI。
1.2 MR检查
所有志愿者在禁饮禁食4 h后接受mMRE 检查,其中10名受试者完成第一次检查后被带出扫描仪室休息30 min,然后再次返回扫描仪进行第二次检查,以评估mMRE 技术短期复查的稳定性及再现性;另外18 名受试者(男、女各9 名)进行饮水试验,参考CHEN 等[31]的试验方法,志愿者完成第一次检查后被带出扫描仪室,并被要求在10 min 内喝完1 L 水,休息10 min 后重新返回扫描仪中进行第二次扫描,以评估饮水对肾脏硬度的影响。
所有序列采用3.0 T 超导型MR 仪(MAGNETOM,Prisma, Siemens Healthcare, Erlangen, Germany),16 通道体部相控阵线圈。取舒适仰卧位,双手放于头部减少伪影,然后双肾正后方分别放置一个震动单元。扫描序列包括冠状位常规T1WI、T2WI 及mMRE。常规T1WI 序列扫描参数:冠状位扫描方式,体素1.2 mm×1.2 mm×2.5 mm,层厚2.5 mm,视野380 mm×380 mm,重复时间5.38 ms,回波时间3.69/2.46 ms,翻转角9°。常规T2WI 序列扫描参数:冠状位扫描方式,体素1.1 mm×1.1 mm×4.0 mm,层厚4 mm,视野360 mm×360 mm,重复时间1 200 ms,回波时间92 ms,翻转角150°。mMRE 序列扫描参数:冠状位扫描方式,体素2.5 mm×2.5 mm×2.5 mm,层数23,层间距0 mm,层厚2.5 mm,视野250 mm×250 mm,相位编码方向R>L,平均次数1,重复时间1 670 ms,回波时间56 ms,回波间隔1 ms,振幅45 mT/m,梯度扭矩模式1 st,四种频率激发40、50、60、70 Hz。
1.3 图像后处理及分析
mMRE 通过一次扫描可以得到提供解剖信息的幅值图和提供剪切波运动信息的相位差图,然后使用k-MDEV(基于波数的多频双粘弹性)的反演重建方法进行后处理[34-35],反演前将4 个频率(40、50、60、70 Hz)的振幅加权波数相加,以生成一个复合剪切波速度图(弹性图),其中包含了所有机械频率的波信息,用于测量剪切波速度(单位:m/s),反映组织硬度,后文也可被称为弹性值;另外还生成T2WI 幅值图,用于显示解剖结构。本研究后处理流程在德国洪堡大学提供的弹性成像后处理官方网站www.bioqic-apps.charite上进行。
选择肾门处连续2个层面冠状位(不包括边缘切片)的mMRE T2WI 幅值图及弹性图,由2 名MRE 经验丰富的放射科医生(分别具有5 年和3 年MRE 诊断经验的副主任医师和高级住院医师)在不知道受试者临床资料的情况下手动勾画感兴趣区(region of interest, ROI)。选择以下ROI[19,33]:全肾、外皮质、内皮质和髓质(图1),其中每一层面全肾和肾外皮质的ROI应包括图像上尽量多的目标组织,肾内皮质及肾髓质的ROI在肾脏上部、中部及下部分别选取1个面积约为0.6 cm2的圆形ROI。选取ROI 时应避开肾边缘、皮髓质分界及肾窦肾血管的位置。饮水后的ROI与饮水前保持一致,以减少测量误差。计算2名医生勾画的2个层面相应区域ROI的平均值作为全肾、外皮质、内皮质和髓质的平均剪切波速度。所有ROI勾画使用Image J软件完成。
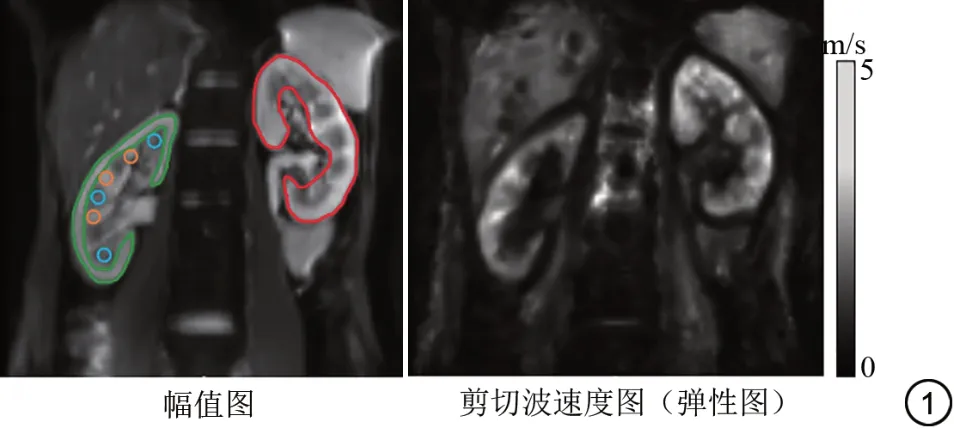
图1 感兴趣区(ROI)选取的示意图。磁共振弹性成像(MRE)的原始数据经后处理后可获得幅值图和弹性图,以幅值图为解剖参考,勾画肾脏相应区域的ROI:全肾(红色),外皮质(绿色),内皮质(橙色),髓质(蓝色)。Fig.1 Diagram of Regions of interest (ROI) selection.After post-processing, the raw data of magnetic resonance elastography (MRE)can be obtained with magnitude map and elasticity map, and the magnitude map is used for anatomical reference to outline the ROI of the corresponding regions of the kidney: whole kidney (red), outer cortex(green), inner cortex (orange), and the medulla (blue).
1.4 统计分析
采用SPSS 25.0 统计学软件(IBM SPSS Statistics)进行统计分析。使用Kolmogorov-Smirnov 检验评估计量资料是否符合正态分布。符合正态分布的计量资料以均数±标准差表示,非正态分布的计量资料以中位数(四分位数间距)表示。计算组内相关系数(intra-class correlation coefficient, ICC)评估观察者间及mMRE 技术短期复查的一致性和稳定性。ICC 判定标准为:ICC<0.40,一致性差;0.40≤ICC<0.75,一致性较好;ICC≥0.75,一致性好。使用配对t检验或配对Wilcoxon 符号秩和检验分析左右侧及饮水前后全肾、外皮质、内皮质和髓质的剪切波速度差异。使用t检验或Wilcoxon 符号秩和检验分析男性和女性之间肾脏内部不同解剖区域剪切波速度的差异。采用单因素方差分析或Kruskal-WallisH检验分析剪切波速度在全肾、外皮质、内皮质、髓质之间的差异,以及肾脏不同解剖区域剪切波速度在3个年龄组之间的差异。采用Spearman 或Pearson 相关分析剪切波速度与年龄、BMI的相关性。所有检验均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 研究对象的基本特征
根据纳入标准及排除标准,排除5 名健康志愿者,其中4 名图像严重伪影,1 名肾结石并肾积水,本研究最终纳入健康志愿者92 名,其中女50 名、男42 名,92 名受试者中位年龄为44(27)岁,身高为(162.7±8.3)cm,体 质 量 为(61.0±8.9)kg,BMI 为(23.0±2.7)kg/m2。将92名受试者按年龄段分成3组:20~35岁32名,36~50岁31名,51~65岁29名。
2.2 观察者间及mMRE技术短期复查的稳定性
在92 名受试者的mMRE 检查中,2 名观察者测量的全肾、外皮质、内皮质及髓质弹性值之间的ICC值分别为0.977、0.964、0.951、0.953(P均<0.05)。在10 名受试者的mMRE 短期复查中,2 次检查测量的全肾、外皮质、内皮质及髓质弹性值之间的ICC 值分别为0.877、0.871、0.833、0.827(P均<0.05)。
2.3 肾脏硬度的解剖区域差异
左右侧全肾、外皮质、内皮质和髓质的剪切波速度差异均无统计学意义,P值分别为0.153、0.896、0.548、0.237(表1),因此取两侧全肾、外皮质、内皮质和髓质的剪切波速度平均值作为肾脏内部不同解剖区域的弹性值进行比较。肾脏不同解剖区域中测量的剪切波速度差异存在统计学意义(F=323.97,P<0.001),其中最高剪切波速度在肾内皮质[(3.01±0.22)m/s]中测得,然后是外皮质[(2.69±0.20)m/s]和全肾[(2.55±0.17)m/s],最后是髓质[(2.16±0.15)m/s],且不同解剖区域两两比较差异均具有统计学意义(P<0.05)(图2)。
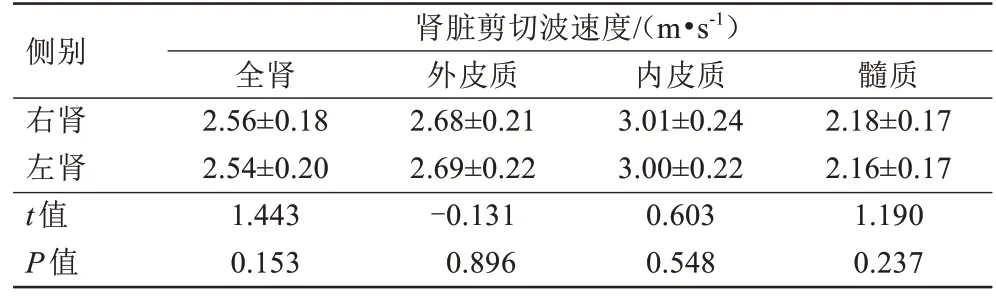
表1 左肾和右肾的全肾、外皮质、内皮质及髓质剪切波速度的比较Tab.1 The comparison of shear wave speed in the whole kidney, outer cortex, inner cortex and medulla between left and right kidney

图2 健康志愿者肾脏不同解剖区域(全肾、外皮质、内皮质、髓质)的剪切波速度分布箱式图。Fig.2 Box plots of shear wave speed in different anatomical regions of the kidney (whole kidney, outer cortex, inner cortex, medulla) in healthy volunteers.
2.4 年龄、性别、BMI与肾脏硬度的关系
全肾(r=-0.301,P=0.004)及内皮质(r=-0.330,P=0.001)的剪切波速度随着年龄增长略有下降,而在外皮质和髓质中未发现剪切波速度与年龄的关系(表2)。全肾(F=5.327,P=0.007)及内皮质(F=6.198,P=0.003)的剪切波速度在三个年龄组中差异具有统计学意义,两两比较发现,在20~35 岁与36~50 岁之间及20~35 岁与51~65 岁之间差异具有统计学意义(P<0.05),详见表3。男性全肾、外皮质、内皮质和髓质的剪切波速度均稍高于女性,P值分别为0.005、0.031、0.047、0.048(表4,图3)。肾脏所有解剖区域剪切波速度与BMI均不存在相关关系(P>0.05)。
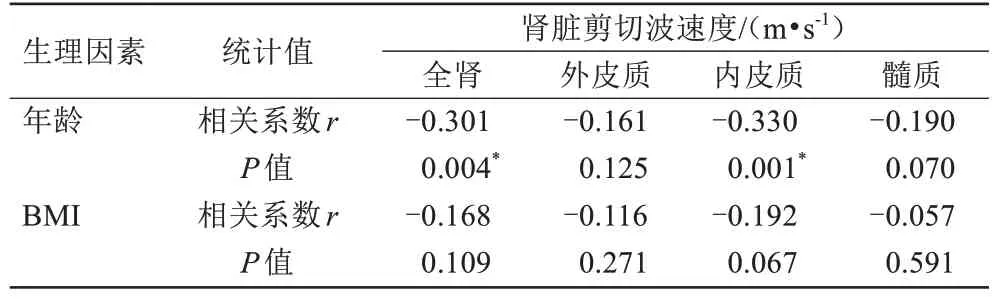
表2 年龄和BMI与全肾、外皮质、内皮质及髓质剪切波速度之间的相关性Tab.2 The correlation between age, BMI and shear wave speed in the whole kidney, outer cortex, inner cortex and medulla
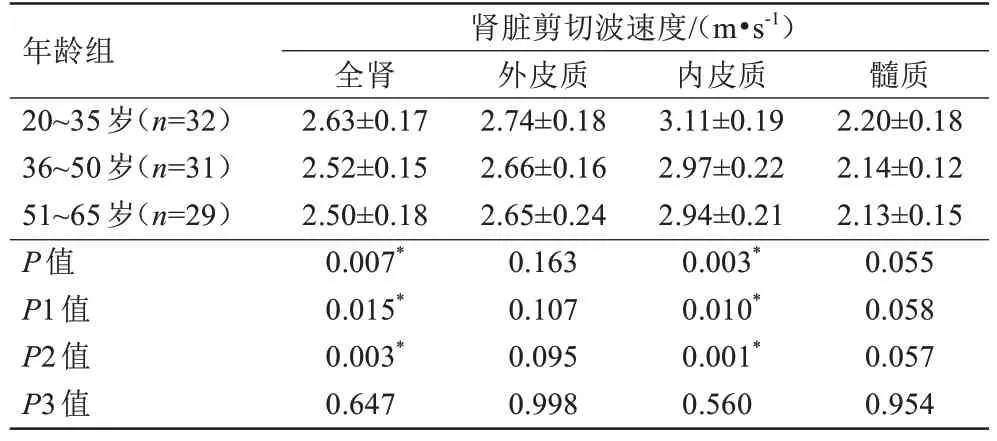
表3 三个年龄组之间全肾、外皮质、内皮质及髓质剪切波速度的比较Tab.3 The comparison of shear wave speed in the whole kidney, outer cortex, inner cortex and medulla among three age groups
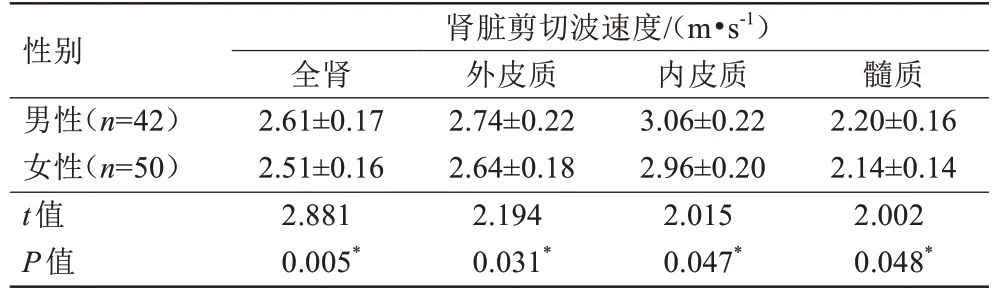
表4 男性和女性的全肾、外皮质、内皮质及髓质剪切波速度的比较Tab.4 The comparison of shear wave speed in the whole kidney, outer cortex, inner cortex and medulla between males and females
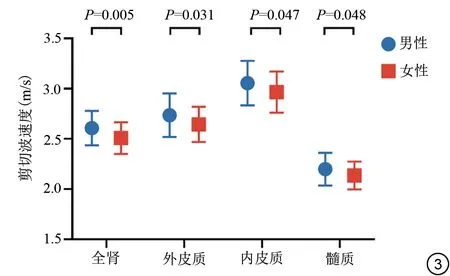
图3 男性和女性的全肾、外皮质、内皮质和髓质剪切波速度的组间比较。Fig.3 Between-group comparison of the whole kidney, outer cortex,inner cortex and medulla shear wave speed in males and females.
2.5 饮水情况与肾脏硬度的关系
18 名受试者肾脏所有解剖区域在饮水后,相应区域剪切波速度均有所增加(P<0.05)。9 名男性志愿者外皮质增加最明显(12.7%,P<0.001),其次是内皮 质(12.6%,P<0.001),最 后 是 全 肾(11.4%,P<0.001)和髓质(10.1%,P=0.001)。9 名女性志愿者外皮质增加最明显(11.5%,P=0.001),其次是内皮质(11.0%,P<0.001),最后是全肾(10.5%,P=0.001)和髓质(8.9%,P<0.001)(图4,表5)。
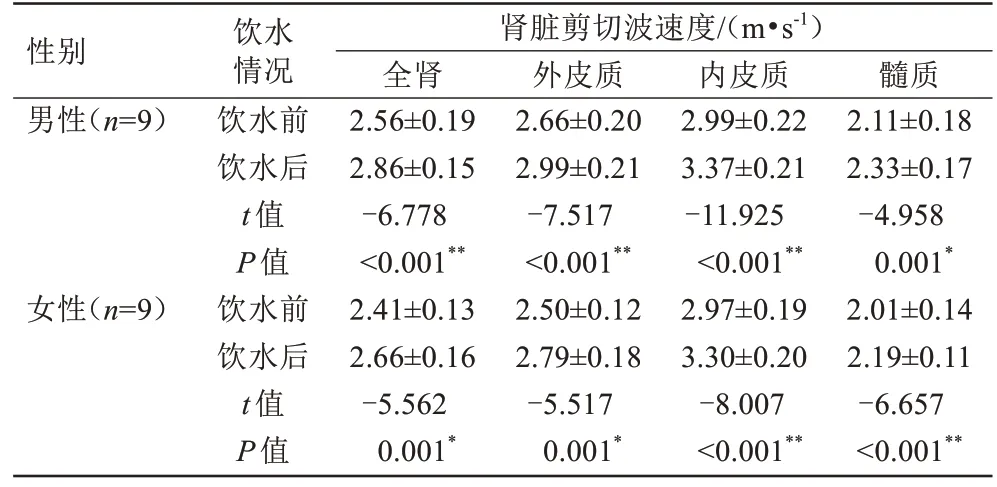
表5 男性和女性饮水前后全肾、外皮质、内皮质及髓质剪切波速度的比较Tab.5 The comparison of shear wave speed in the whole kidney, outer cortex, inner cortex and medulla before and after drinking water in males and females
3 讨论
本研究应用mMRE 探讨了正常肾脏不同解剖区域(左肾和右肾,全肾、外皮质、内皮质和髓质)的硬度差异,以及生理因素(年龄、性别、BMI、饮水情况)与肾脏硬度的关系。研究结果显示正常肾脏不同解剖区域的硬度差异存在统计学意义,其中内皮质和外皮质拥有较高的硬度。另外肾脏硬度在不同年龄、性别及饮水情况下差异也存在统计学意义。这些结果不仅为将来应用mMRE 研究肾脏疾病提供了正常肾脏不同解剖区域硬度的参考值,同时也得出了可能与肾脏硬度相关的因素。
3.1 肾脏mMRE技术的稳定性
传统的单频MRE 容易受到低振幅横波不足、噪声和波反转相关伪影的影响,具有解剖分辨率低、扫描时间长、扫描层数少等缺点[24],本研究采用的mMRE 可获取多个频率的波场并使用抗噪声恢复剪切波速度值相位梯度法,不同的频率为复合弹性图提供了互补的信息[25],另外我们使用更高的场强(3.0 T)与mMRE 技术结合,可以获得具有更高细节分辨率、噪声稳健性和组织内均匀性的MRE 图,非常适合于小型和异质的器官,如肾脏。本研究结果显示mMRE 不仅在观察者间具有良好的一致性,而且在短期内复查中也表现了出色的再现性,另外有研究[36-38]也证实了MRE 在短期及长期复查中的可重复性,这表明肾脏mMRE是一个可靠且稳定的技术。
3.2 肾脏硬度的解剖差异性
本研究发现左右侧全肾、外皮质、内皮质和髓质的硬度差异无统计学意义,反映了左右肾的一致性,而肾脏内部不同解剖区域的硬度差异具有统计学意义,MARTICORENA 等[33]的试验也得出了与本研究类似的结果,该研究还显示了肾内皮质硬度最大[(2.91±0.17)m/s],其次是外皮质[(2.52±0.11)m/s]和全肾[(2.15±0.08)m/s],最后是髓质[(2.46±0.12)m/s],且两组间都存在显著性差异,反映了肾脏是个高度异质性的器官,并且能被MRE检出及量化其硬度,这为将来应用mMRE 研究肾脏疾病提供了正常肾脏的基础数据。肾脏内部不同解剖区域的硬度差异可以从肾脏解剖和生理的角度去解释[39],肾皮质富含肾小球,丰富的血液灌注使肾实质处于被压缩的状态,而髓质主要由肾小管构成[40],低灌注状态使肾实质张力较低,所以肾皮质的硬度高于髓质,另外虽然外皮质的肾小球数目比内皮质多,但是内皮质的肾小球体积比外皮质更大[41-43],这或许是内皮质比外皮质较硬的原因。然而另外有学者[31]却发现左肾的硬度高于右肾,且髓质硬度大于皮质。这可能与以下因素有关:首先,使用的MRE设备及参数不同,既往研究使用的大部分是单频MRE,噪声多,而本研究使用的是mMRE,拥有更加高清的图像分辨率;其次,边界效应,图像分析的时候肾皮质的ROI包含周围的脂肪,导致肾皮质硬度降低。
3.3 肾脏硬度与年龄、性别的关系
除此之外,本研究表明随着年龄的增长,肾脏全肾及内皮质的硬度出现轻微降低的趋势,这一发现与既往的研究结果[33]相符。衰老过程中肾小球逐渐出现肿大、缺血[41]及数目的减少[44]在一定程度上解释了这个现象。另外,本研究发现性别与肾脏硬度存在关系,男性肾脏不同解剖区域的硬度均稍高于女性,以往的肾脏MRE 相关研究未发现该结果,这种差异可能是因为男性相较于女性具有更高的eGFR和肾血浆流量[45-47]。因此,在未来应用mMRE 对肾脏疾病的评估和鉴别中,或许需综合考虑年龄和性别对肾脏硬度的影响。
3.4 肾脏硬度与饮水情况的关系
本研究发现志愿者饮水后,肾脏内部每个解剖区域的硬度都有所增加,与既往大部分MRE 研究结果类似[23,31-33],可能原因是饮水后,肾脏血液灌注量增大,肾实质张力增加所致。另外还发现外皮质和内皮质硬度变化比髓质更明显,这可能与肾皮质肾小球较丰富,所以血液灌注量改变更大有关。有研究[23,48]在肝脏也发现了同样的结果,众所周知,肝脏拥有肝动脉及门静脉两套供血血管,也是一个血液灌注很丰富的器官,在健康者饮水后,MRE和超声弹性成像测量的肝脏硬度都有所增加。由此可见,对于血供丰富的器官,其硬度均会受到饮水的影响。所以为了规范肾脏MRE,成像前应该严格禁水,以区分是饮水还是疾病导致的肾脏硬度改变。
3.5 局限性
本研究的局限性包括以下几方面:(1)仅对志愿者饮水10 min 后再次进行mMRE 扫描,没有对饮水后不同间隔时间长短对肾脏硬度的影响作进一步分析;另外由于饮水试验可能会引起年龄稍大志愿者不适,所以未按照不同年龄段进行分组分析。(2)已知肾脏是一个各向异性的器官[49],将来的研究可以结合DTI进一步探讨各向异性对肾脏硬度的影响。(3)由于MRE需要特殊的动力装置,费用昂贵,目前尚未在各大医院普及,所以本研究未能在多中心进行相关研究。将来随着MRE 技术的发展,可完善多中心研究以探索不同设备间的差异。
4 结论
总之,本研究利用3.0 T mMRE 技术深入探讨了肾脏解剖区域、生理因素与正常肾脏硬度之间的关系。这些发现有望为以后应用mMRE 无创评估肾脏疾病的研究提供可靠的科学依据,建立可行的量化标准,为临床医生及患者提供更丰富的诊疗手段。另外,将来mMRE可与其他功能性MRI技术(如弥散加权成像,动脉自旋标记,血氧水平依赖等)相结合,从多个微观角度无创评估肾脏的病理生理变化,有着广阔的临床研究前景。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:陈玥瑶设计本研究的方案,对稿件重要内容进行讨论和修改,获得了深圳市科技计划项目资金资助;梁秋梅负责试验设计,起草和撰写稿件,获取、分析及解释本研究数据;戚瑞瑞、罗培茵、孟凡琦、盘中贤、陈秋怡、李峻枫、潘劲统负责MRI 扫描,序列优化,图像处理,获取、分析及解释本研究数据,对稿件重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

