CMR特征追踪技术在帕金森病患者左心评估中的价值
岳汛,刘铃,彭鹏飞,蒲倩,杨慧义,明悦,岳书婷,黄小华,徐严明,孙家瑜*
作者单位 1.川北医药学院附属医院放射科,南充 637002;2.四川大学华西医院放射科,成都 610041;3.四川大学华西医院神经内科,成都 610041
0 引言
帕金森病(Parkinson's disease, PD)是一种常见的老年神经退行性疾病,其临床表现主要包括运动症状,如静止性震颤、运动迟缓、肌张力和姿势及步态异常,以及非运动症状,如神经精神症状、睡眠障碍和感觉异常等[1-3]。非运动症状多发生在疾病早期,且大多数与自主神经功能紊乱有关。其中,心血管自主神经功能障碍很常见,涉及交感和副交感神经系统且大多早于运动症状,并可进一步导致心血管功能障碍[4-5]。
PD 患者的心脏改变包括心脏自主神经功能障碍、心肌病、冠心病、心律失常或心源性猝死等[2,6-7]。老年人群中,PD 患者心力衰竭(heart failure, HF)患病率是非PD 患者的两倍(20% vs.9%)[8]。因此,早期诊断及干预PD 患者的心脏异常对减少心血管不良事件的发生尤为重要。123I-间碘苄胍显像(123I-metaiodobenzylguanidine scintigraphy,123I-MIBG)可检测PD 患者的心脏交感神经功能改变从而推断心肌受累状况,以123I-MIBG 积累量降低评估心肌损害,其量—效关系优于左室射血分数(left ventricular ejection fraction, LVEF),但123I-MIBG 费用较高,临床尚未普及[9]。超声心动图研究发现[7],PD 患者LVEF正常,但存在舒张功能障碍及左心室向心性肥厚的情况,且随着疾病的进展呈逐渐加重趋势。心肌应变相较于传统的心功能指标射血分数更加敏感,可在疾病的亚临床阶段为疾病提供早期影像学依据。斑点追踪超声心动图是评估心肌应变的常用检查方法。研究显示[10],PD 患者整体纵向应变(global longitudinal strain, GLS)降低,且与运动及认知功能障碍严重程度相关,提示PD 患者或存在亚临床收缩功能障碍。但超声心动图的成像质量和测量的准确性会受声窗条件和操作者经验等诸多因素的影响[11]。
早期发现PD 患者心脏受损可以为临床诊疗提供依据,对预防PD 患者心源性猝死和意外死亡至关重要。心脏磁共振(cardiac magnetic resonance, CMR)具有无创、无电离辐射、可重复性高、多参数及多序列成像等优点,是无创评估心脏结构及功能的“金标准”,对心脏疾病诊断及预后至关重要[12]。CMR 特征追踪(feature tracking, FT)技术基于常规平衡稳态自由进动电影序列,能够敏感地检测出射血分数正常情况下的亚临床心功能障碍,在早期发现PD 患者的心脏异常方面发挥着关键作用[13]。目前,我们尚未检索到国内外利用CMR 探究帕金森病患者左心结构及功能改变的文献。本研究旨在利用CMR-FT 技术评估PD 患者左心结构及功能,探讨影响其结构和功能的因素,这将有助于临床早期诊断PD 患者的心脏结构及功能的异常,并为指导临床研究和治疗决策提供影像学依据。
1 材料与方法
1.1 研究对象
前瞻性连续纳入于2022 年3 月至2023 年8 月四川大学华西医院神经内科收治的特发性PD患者(PD组)39 例,同期招募年龄及性别相匹配的健康对照者(对照组)34 例。PD 组纳入标准:(1)符合2016 年制定的中国帕金森病的诊断标准[14],并伴有运动迟缓等典型症状;(2)完成统一帕金森评定量表Ⅲ(Unified Parkinson's Disease Rating Scale Ⅲ, UPDRS Ⅲ)及自主神经症状自评量表(The Scales for Outcomes in Parkinson's Disease-Autonomic, SCOPA-AUT)及霍亚分级(Hoehn-Yahr stage, H&Y stage)等量表评分测试;(3)年龄在45~80 岁之间。排除标准:(1)各种原因引起的继发性帕金森综合征,如脑炎、脑血管病、脑积水、头部外伤、中毒史等;(2)帕金森叠加综合征,如进行性核上性麻痹、多系统萎缩、路易体痴呆、皮质基底节病变等;(3)严重的精神症状,无合作患者;(4)既往已知冠状动脉疾病、既往已知或行CMR检查时发现的瓣膜疾病、人工心脏瓣膜或心肌病;(5)合并高血压、糖尿病、呼吸睡眠综合征、高脂血症、高胰岛素血症及病态肥胖等疾病;(6)存在MRI检查禁忌。对照组纳入标准:(1)心电图及CMR检查未见异常;(2)年龄在45~80 岁之间。对照组排除标准:(1)患有糖尿病、高血压、病态肥胖等疾病;(2)存在心血管系统疾病家族史、严重心律失常及瓣膜心脏病等;(3)存在MRI检查禁忌。
收集患者年龄、性别、病程、UPDRS Ⅲ及SCOPA-AUT 等相关资料。采用UPDRS Ⅲ评估PD患者运动功能障碍严重程度。UPDRS Ⅲ为语言、表情、四肢活动、姿势及步态等27 项内容,每项1~4 分,总分108 分,评分越高,表明运动障碍越严重[15]。采用SCOPA-AUT 评估患者的自主神经功能障碍严重程度,量表包含泌尿、胃肠道、体温调节、性功能、心血管、瞳孔调节6 个系统共23 项,总分为0~69 分,分值越高表示患者自主神经功能障碍越严重[16]。
本研究遵循《赫尔辛基宣言》,通过四川大学华西医院伦理审查委员会批准(批准文号:2022795),所有受试者均签署知情同意书。
1.2 图像采集
图像采集使用联影(uMR 790,联影成像医疗,中国上海)3 T MRI设备,24通道心脏专用相控阵线圈。采用平衡稳态自由进动电影序列获取短轴(范围覆盖从心底到心尖)及二、三、四腔电影图像。扫描参数:层厚8 mm,层间距0 mm,重复时间(repetition time, TR)3.31 ms,回波时间(echo time, TE)1.57 ms,翻转角(flip angle, FA)50°,视野(field of view, FOV)280~340 mm2,矩阵大小336×336,时间分辨率35~45 ms。
1.3 图像分析
1.3.1 左心室功能及应变分析
心脏后处理采用CVI42(circle cardiovascular imaging, Calgary, Alberta, Canada, version 5.1.14)。将短轴电影图像导入FUNCTION 模块,逐层手动勾画舒张末期及收缩末期左心室心内膜及心外膜轮廓,获得LVEF、左心室收缩末期容积(left ventricular end-systolic volume, LVESV)、左心室舒张末期容积(left ventricular end-diastolic volume, LVEDV)及左心室心肌质量(left ventricular mass, LV mass)等常规心功能参数。经体表面积(body surface area, BSA)进行指数化校正后得到LVESV 指数(LVESV index,LVESVi)、LVEDV 指数(LVEDV index, LVEDVi)及LV mass指数(LV mass index, LV massi)。之后将短轴及二、三、四腔心电影图像导入STRAIN模块,获得相关应变参数包括整体纵向应变(global longitudinal strain, GLS)、整体径向应变(global radial strain,GRS)及整体周向应变(global circumferential strain,GCS)(图1)。
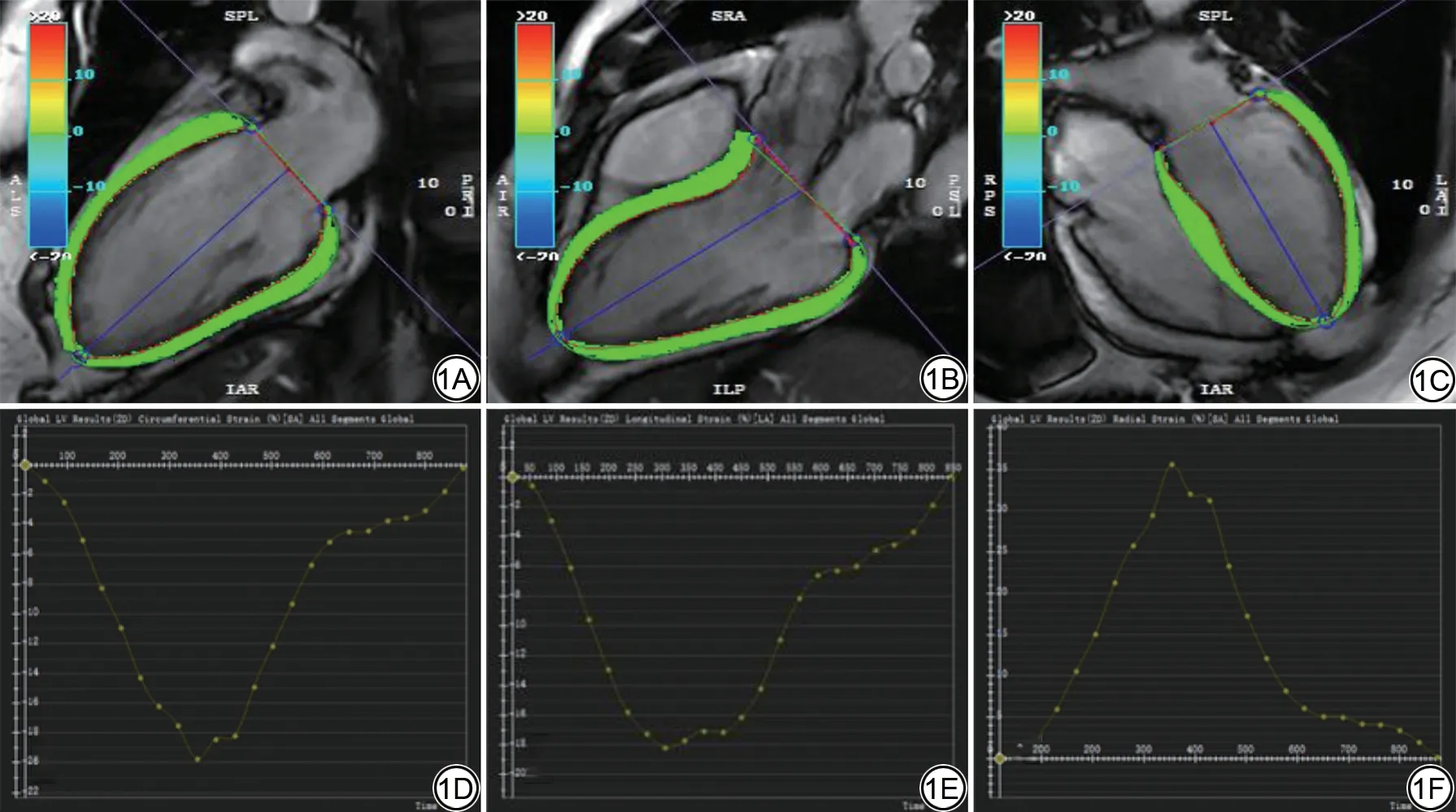
图1 左心室应变伪彩追踪示例图及应变参数曲线示例图。1A:二腔心;1B:三腔心;1C:四腔心;1D:左心室周向应变示例图;1E:左心室纵向应变示例图;1F:左心室径向应变示例图。Fig.1 Left ventricular strain pseudo-color tracking example and strain parameter curve example.1A: Two-cavity cine image; 1B: Three-cavity cine image; 1C:Four-cavity cine image; 1D: Left ventricular circumferential strain example; 1E: Left ventricular longitudinal strain example;1F: Left ventricular radial strain example.
1.3.2 左心房功能及应变分析
将二、四腔心电影图像导入Biplanar Function 模块,手动绘制左心房内膜轮廓,左心耳及肺静脉根部被排除在内膜边界之外,采用双平面算法自动获得左心房最小容积(left atrial minimum volume, LAV min),左心房最大容积(left atrial maximum volume, LAV max),运算得到左心房收缩前容积(left atrial presystolic volume, LAV pac)[公式(1)],经BSA 对左心房容积参数进行指数化校正后得到LAV min 指数(LAV min index, LAV mini)、LAV max 指数(LAV max index, LAV maxi)及LAV pac 指 数(LAV pac index, LAV paci)。根据左心房容积参数计算获得左心房功能参数:左心房总射血分数(left atrial total ejection fraction, LAEF total)[公式(2)]、左心房被动射血分数(left atrial passive ejection fraction, LAEF passive)[公式(3)]、左心房主动射血分数(left atrial active ejection fraction, LAEF active)[公式(4)]。
其中,A2c、A4c 分别代表左心房收缩前二、四腔心左心房面积,L 取左心房收缩前二、四腔心中较大的左心房长径。
将二、四腔心图像导入CVI42 STRAIN 模块,在二、四腔心图像上手动勾画左心室舒张末期左心房内膜及外膜轮廓,软件自动追踪运算生成左心房时间—应变曲线及时间—应变率曲线,得到左心房总应变Es(反映左心室收缩期左心房储备功能)、左心房被动应变(反映左心室舒张早期左心房导管功能)及左心房主动应变(反映左心室舒张晚期左心房增压泵功能)。对应的应变率参数包括:收缩期峰值正向应变率SRs、舒张早期峰值负向应变率SRe 及舒张晚期峰值负向应变率SRa(图2)。

图2 左心房应变伪彩追踪示例图及应变参数曲线示例图。2A:二腔心应变伪彩追踪示例图;2B:四腔心应变伪彩追踪示例图;2C:时间—应变曲线;2D:时间—应变率曲线。Es:总应变;Ee:被动应变,Ea:主动应变;SRs:收缩期峰值正向应变率;SRe:舒张早期峰值负向应变率;SRa:舒张晚期峰值负向应变率。Fig.2 Pseudo-color tracking images of left atrial myocardial strain and example of strain parameter curves.2A: Pseudo-color tracking images of two-cavity cine;2B: Pseudo-color tracking images of four-cavity cine; 2C: The time-strain curve; 2D: The time-strain rate curve.Es: total strain; Ee: passive strain; Ea: active strain;SRs: systolic peak positive strain rate; SRe: early diastolic peak negative strain rate; SRa: late diastolic peak negative strain rate.
1.4 一致性分析
由两名具有3年以上CMR 图像后处理经验的中级职称技师对20 例随机选择的受试者(10 例健康对照者和10 例PD 患者)进行组内及组间的一致性分析。组内一致性分析由同一观察者于1 月后重新分析相同的20例受试者确定。组间的一致性分析由第二个观察者进行评估,该观察者对第一个观察者的结果不知情。
1.5 统计学分析
所有数据均采用SPSS 26.0(IBM, Armork, New York, USA)进行统计分析。采用Kolmogorov-Smirnov检验评估数据的正态性。符合正态分布的连续变量表示为均数±标准差;不符合正态分布的连续变量表示为中位数(四分位数间距)。分类变量表示为频率或百分比。服从正态分布的两组间的比较采用独立样本t检验,不服从正态分布的采用Mann-WhitneyU检验,分类变量采用卡方检验。使用Pearson 或Spearman 相关系数模型评估心脏结构、功能及应变参数与UPDRS Ⅲ及SCOPA-AUT的相关性。组间及组内的一致性分析采用组内相关系数(intra-class correlation coefficient, ICC),ICC>0.75 则可认为数据可重复性好。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
PD 组39 例,年龄56.00(51.00,60.00)岁,病程4(2,6)年,H&Y stage 2(1,2.5)级,UPDRS Ⅲ(21.79±10.35)分,SCOPA-AUT 7(3,9.97)分;对照组34 例,年龄(56.47±7.30)岁。两组间性别、年龄差异均无统计学意义(P>0.05),见表1。

表1 PD组和对照组一般资料比较Tab.1 Comparison of general data between PD group and healthy control
2.2 左心室功能及应变参数比较
PD 组LVEF 低于对照组,差异具有统计学意义(P=0.041)。PD 组 的LVESV、LVESVi、LVEDVi 及LV massi 均高于对照组,差异具有统计学意义(P<0.05)。与对照组相比,PD 患者左心室GLS 降低,差异具有统计学意义(P=0.015)。两组间的左心室功能及应变参数的比较结果见表2。
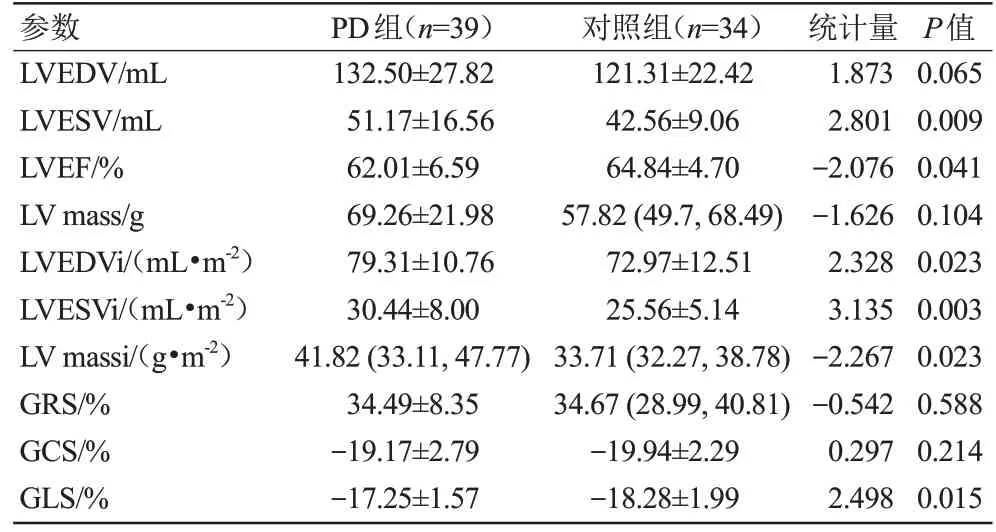
表2 两组左心室功能及应变参数比较Tab.2 The left ventricular function and strain parameters were compared between the two groups
2.3 左心房功能及应变参数比较
PD组的左心房容积参数,包括LAV paci、LAV mini和LAV maxi,与对照组相比差异无统计学意义(P均>0.05)。与对照组相比,PD 患者的左心房储备功能(LAEF total、Es、SRs)、导管功能(LAEF passive、Ee、SRe)及泵功能(LAEF active、Ea、SRa)均明显受损(P均<0.05)。两组间的左心房功能及应变参数的比较结果详见表3。

表3 两组左心房功能及应变参数比较Tab.3 Left atrial function and strain parameters were compared between the two groups
2.4 一致性分析
所有参数的组间ICC值为0.795~0.994,组内ICC值为0.834~0.996,均大于0.75,组间及组内一致性良好。
2.5 CMR 参数与UPDRS Ⅲ及SCOPA-AUT 的相关性分析
CMR 参数与UPDRS Ⅲ、SCOPA-AUT 的相关性分析结果详见表4。左心房储备功能(Es、SRs)与UPDRS Ⅲ均呈负相关性(r=-0.409、-0.355,P均<0.05)。左 心 房 导 管 功 能(LAEF passive、Ee)与UPDRS Ⅲ呈负相关(r=-0.326、-0.482,P均<0.05),SRe 与UPDRS Ⅲ呈正相关(r=0.417,P=0.008)。左心房储备功能(Es、SRs)与SCOPA-AUT呈负相关(r=-0.535、-0.319,P均<0.05);左心房导管功能Ee 与SCOPA-AUT 呈负相关(r=-0.319,P=0.048),SRe 与SCOPA-AUT呈正相关(r=0.359,P=0.025);左心房泵功能Ea与SCOPA-AUT呈负相关(r=-0.342,P=0.033)。

表4 PD组左室功能及参数与临床指标的相关性Tab.4 Correlation between left ventricular configuration and function parameters and clinical indicators in PD group
3 讨论
本研究结果显示,PD 组LVEF 低于对照组,LVEDVi、LVESV,LVESVi、LV massi 均高于对照组。PD 患者LVEF 仍在正常范围内,但GLS 降低。PD 组的左心房容积参数(LAV paci、LAV mini 和LAV maxi)与对照组相比均无明显变化。与对照组相比,PD 患者的左心房储备期、导管期及泵血期的射血分数、应变及应变率均明显减低。其中,左心房储备及导管功能与UPDRS Ⅲ及SCOPA-AUT 存在相关性,提示PD患者晚期或伴随更严重的左心房功能改变。
3.1 PD患者左心室结构功能改变
本研究发现,PD患者左室心肌质量增加,与以往超声心动图研究结果一致[7],其机制或为帕金森病相关的自主神经病变可造成节后交感和副交感神经系统功能障碍,进而导致心率和血压失调[17-18],其中,直立性低血压、夜间高血压及反杓型血压等与左室肥厚有关[19-21]。但EL MOKADEM 等[10]超声心动图研究中,PD患者LV massi较对照组无明显差异,推测其原因可能是其纳入的PD患者病程较短,不足以导致心肌质量的增加。本研究PD患者相较于对照组表现出更高的左室收缩及舒张末期容积,与以往研究结果一致[7,22-23],提示PD患者早期可能会出现代偿性心脏增大。
本研究发现,PD 组的LVEF 及GLS 低于对照组,提示PD患者存在心脏受损,左室收缩功能或已受到一定的影响,但PD 患者LVEF 仍在正常范围内,推测心功能仍处于代偿期。PD组GLS低于对照组,提示PD患者存在心肌力学改变,心肌应变可早于EF发现心肌功能受损,对评估PD患者亚临床收缩功能障碍具有潜在价值[13,24]。EL MOKADEM等[10]和STEFANO等[25]等应用超声斑点追踪技术同样发现,在LVEF 正常的情况下,PD患者心室收缩期心肌运动功能受损,表现为GLS的降低。
3.2 PD患者左心房结构及功能的改变
本研究结果显示,PD患者左房容积与对照组相比差异无统计学意义,但PD 患者的左心房储备功能(LAEF total、Es、SRs)、导管功能(LAEF passive、Ee、SRe)及泵功能(LAEF active、Ea、SRa)参数均减低。与本研究结果不同,PIQUERAS-FLORES 等[7]和ÇANGA等[26]的超声心动图研究中,PD 患者左房容积升高且与疾病严重程度相关,结论的差异可能主要是由于本研究纳入的PD 患者病程仍较短,不足以导致PD患者的左心房结构的改变。但左心房容积指数均属于晚期指标,反映左心室舒张压力的长期积累,并不能及时反映早期功能的改变。应变技术不仅可以定量评估心脏的容积,还可分别获得左心房储备期、导管期及泵血期的EF、应变及应变率,能够在左心房形态改变之前即早期发现左心房功能异常[27]。本研究中,基于CMR-FT测得的PD患者的左心房储备期、导管期及泵血期应变及应变率均减低,提示左心房应变可以先于左心房容积监测PD患者左心房功能异常。
PD 患者自主神经功能紊乱、炎症反应及氧化应激均与房颤的发生有关,房颤或是PD 患者早期非运动症状之一[28-31]。ÇANGA 等[26]发现,与对照组相比,PD 患者心房机电耦合时间、房内及房间的心房机电延迟时间(electro mechanical delay, EMD)及容积增加,且与PD 的疾病严重程度相关,提示PD 患者房颤易感性增加。心房重构是房颤病理生理机制的重要环节,包括宏观上的心房扩张、微观上的心肌纤维化[8-7,32]。因此,对左心房结构与功能进行全面、准确的定量评估可改善心血管结局。基于CMR-FT 获得的左心房应变及应变率可以反映左心房心肌的形变程度及形变速率,是评估PD 患者早期左心房改变的敏感指标[33-35],有助于增进对PD 患者心脏改变及预后分层的认识。
3.3 CMR参数与UPDRS Ⅲ及SCOPA-AUT的相关性
本研究显示,左心房应变(Es、Ee)及应变率(SRs、SRe)与UPDRS Ⅲ及SCOPA-AUT 存在相关性。ÇANGA 等[26]和PIQUERAS-FLORES 等[7]基于超声心动图描述了PD 患者左心房容积升高,并与UPDRS Ⅲ存在相关性,左心房容积是PD 的独立预测因子(OR:1.19,95% 置信区间:1.02~1.37;P=0.021)[7]。与左心房容积相比,左心房应变参数对负荷的依赖性更小,且能先于左心房容积监测PD 患者的左心房功能异常[36]。本研究结果提示,PD 患者心肌损害随UPDRS Ⅲ、SCOPA-AUT 的增加而逐渐加重,表现为左心房应变值逐渐减低。与EL MOKADEM 等[10]研究不同,本研究暂未发现左心室GLS 与运动功能障碍及自主神经功能障碍严重程度之间的相关性,其原因或为PD 患者在无明显瓣膜异常或心室功能减退的情况下,由于心房解剖、机械、电生理和/或血流动力学异常,引起了独立于心室功能改变的心房功能障碍。
3.4 局限性
本研究存在一定的局限性:(1)本研究为小样本、单中心研究,可能存在选择性偏倚;(2)PD患者病程仍较短,未分期比较PD 患者CMR 结果的差异;(3)本研究为横断面研究,没有随访心血管事件的发展;(4)未评估药物治疗对心脏结构及功能的影响。
4 结论
综上所述,PD患者左室收缩功能及左心房储备、导管、泵功能均受损;左心房储备及导管功能与运动功能及自主神经功能障碍的严重程度相关。CMR-FT 定量技术可早期发现PD 患者心功能改变,有利于早期临床干预,改善预后。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:孙家瑜设计了本研究的方案,对稿件重要内容进行了修改,并获得了四川省科技计划项目的资助;岳汛起草和撰写了稿件,获取分析并解释了本研究的数据;刘铃、彭鹏飞、蒲倩、杨慧义、明悦、岳书婷、黄小华、徐严明获取、分析及解释本研究的数据,并对稿件的重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

