COD/N对短程内源反硝化过程中NO和N2O积累的影响
王莎 李斌 孙江华
摘 要:利用序批式活性污泥反应器研究不同碳氮比(COD/N)(1,3,4,6)对短程内源反硝化污染物去除性能以及NO和N2O积累的影响。结果表明,化学需氧量和亚硝态氮在COD/N大于3时去除效果较好。NO的积累峰值随着COD/N的增加而先增加后降低,在COD/N为4时达到最大值0.45 mg/L。而N2O则呈现先降低后增加的趋势,当COD/N为3时积累峰值最小(3.7 mg/L)。NO的积累与COD/N、厌氧时间、NO和游离亚硝酸的抑制有关。N2O的积累是COD/N、NO、游离亚硝酸等共同作用的结果。
关键词:碳氮比;短程内源反硝化;一氧化氮;氧化亚氮;反硝化还原酶
中图分类号:X703 文献标志码:A 文章编号:1009-5128(2024)02-0086-09
收稿日期:2023-06-29
基金项目:陕西省科技厅项目:SNADPR工艺优化调控及微生物耦合机理研究(2023-JC-QN-0528);陜西省教育厅专项科研计划项目:亚硝酸盐反硝化过程一氧化氮歧化产氧机制研究(21JK0638);渭南师范学院人才项目:短程反硝化除磷过程NO歧化产氧机理研究(2021RC27)
作者简介:王莎,女,陕西咸阳人,渭南师范学院环境与生命科学学院讲师,工学博士,主要从事污水生物脱氮除磷研究。
随着城市化和工业化进程的推进,大量含氮物质被排放到地表水中,导致水体富营养化问题日趋严重,破坏了自然界的生态平衡[1]。为了缓解水体中氮对环境的影响,各种新型污水处理技术应运而生[2–6]。其中,短程内源反硝化工艺由于具有工艺简单、操作条件温和、反应速率快、节省碳源、污泥产量少等优点而受到广泛关注[7–10]。但是,相关研究发现,在短程内源反硝化过程中,其最终产物除N2外,还会产生一些其他中间物质,如一氧化氮(Nitric oxide,NO)和氧化亚氮(Nitrous oxide,N2O)等[11]。NO是一种有毒有害气体,释放到大气中后极易诱发各种环境问题,如酸雨、温室效应、臭氧层破坏和光化学污染等。N2O是一种强效的温室气体,其增温潜势是CO2的300倍左右,对全球温室效应的贡献约占5%~6%[12]。由此可见,对短程内源反硝化过程中NO和N2O产生机理的研究尤为重要。
碳氮比(COD/N)是影响反硝化反应的重要因素之一,也是控制短程内源反硝化过程中NO和N2O产生的一个重要参数。研究表明,在反硝化过程中,当COD/N较低时,虽然可节省碳源,但污染物的去除效果不理想;而且由于电子供体的缺乏,导致N2O不能顺利还原为N2[13]。而当COD/N过高时,N2O产生量有所降低,但是会造成碳源大量浪费,影响出水水质[14]。因此,研究COD/N对短程内源反硝化过程中污染物的去除性能、NO和N2O积累机理的影响,对于实现污染物的高效去除、中间产物的减量化排放以及推动生物脱氮工艺的广泛应用具有重要的理论意义。基于此,本研究采用式活性污泥反应器(Sequencing Batch Reactor,SBR)探究不同COD/N对短程内源反硝化污染物去除性能、NO和N2O积累特征的影响,分析NO和N2O的产生机理,以期为减少短程内源反硝化过程中NO和N2O的产生提供理论依据。
1 材料和方法
1.1 实验装置及运行
实验采用SBR反应器,该反应器由有机玻璃制成,体积为5 L。反应器的周期采用可编程逻辑控制器进行自动控制。每天运行3个周期,每个周期8 h,包括进水5 min,厌氧1 h,缺氧6.5 h,沉淀20 min,闲置5 min。每个周期结束后,排水量为2 L。反应器运行时的温度采用可调节的加热棒进行控制,其范围为30±1℃。在反应器的运行过程中,系统内混合液挥发性悬浮固体浓度和混合液悬浮固体分别控制在3 500±100 mg/L和5 000±200 mg/L。经过一段时间的驯化培养后,当反应器内化学需氧量(Chemical Oxygen Demand,COD)和亚硝态氮(NO[-2]-N)的去除率稳定地维持在90%以上时,说明该反应器启动成功。
1.2 接种污泥及进水水质
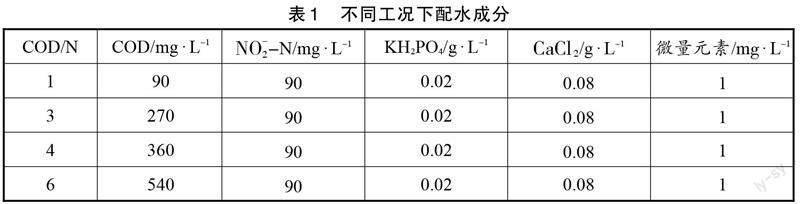
实验所用接种污泥取自陕西省某污水处理厂好氧反应池。实验进水为人工配置,其具体组成包括:360 mg/L的COD(碳源为C6H12O6·H2O),90 mg/L的NO[-2]-N(氮源为NaNO2),0.08 g/L的CaCl[2],0.02 g/L的KH2PO4和1 mg/L微量元素[15]。
1.3 实验设计
为了分析不同COD/N条件下短程内源反硝化过程中污染物的转化特征以及NO和N2O的产生机理,本研究分别在COD/N为1,3,4,6的条件下进行批式实验,其分别代表碳源充足、适量和不足。在实验中,固定进水中NO[-2]-N浓度为90 mg/L,通过改变进水中COD浓度来实现不同的COD/N,详细的配水水质见表1。
批式实验需在周期结束后进行。在周期结束后,手动控制停止进水,将反应器内的污泥清洗(向反应器中添加30℃左右的温水,经过搅拌、静沉后将水排出)3次,以去除反应器内残留的污染物质。然后向反应器中重新添加5 L 30℃左右的温水。将NO探头和N2O探头放置于反应器中,待其读数稳定后即可进行批式实验。在反应初始阶段,按照表1中污染物浓度配比向反应器中添加C6H12O6·H2O、KH2PO4、CaCl[2]以及微量元素等。在厌氧搅拌1 h后,加入NaNO2。实验中的各项操作均通过手动调控来实现,确保每组批式实验的初始条件一致,以减少各组实验之间的相对误差。在批式实验中,当反应器中NO[-2]-N的浓度低于检测限时,即可停止实验。若在周期时间(8 h)内NO[-2]-N没有消耗殆尽,则在反应8 h时停止实验。每个批式实验需重复3次。
1.4 指标分析及检测方法
本实验中COD、NO[-2]-N、NO[-3]-N分别采用重铬酸钾法、N-(1-萘基)-乙二胺分光光度法、酚二磺酸分光光度法測定。NO和N2O采用微电极(NO-500和N2O-500,Unisence,丹麦)进行实时监测。pH采用酸度计测定。系统内微生物群落结构采用16Sr RNA高通量测序法进行检测。
2 结果与分析
2.1 反应器启动
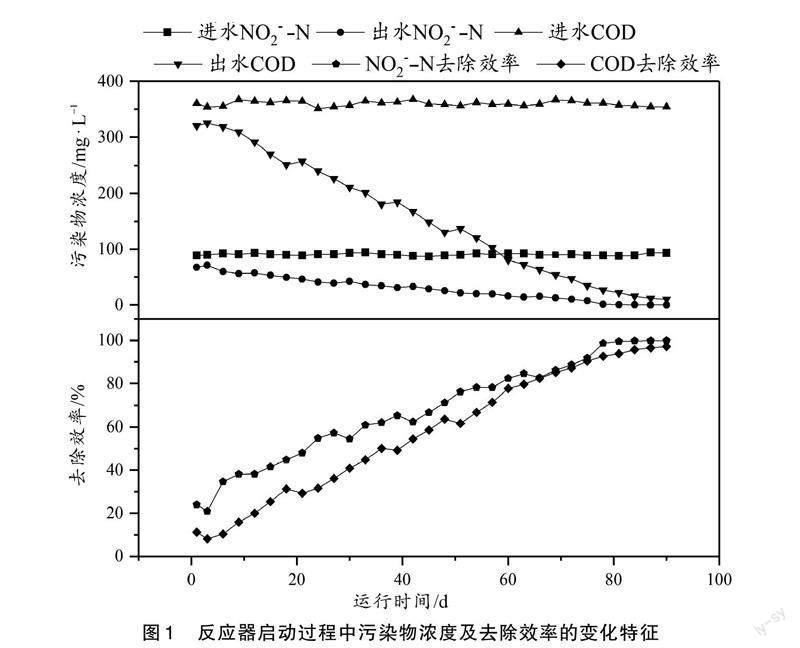
反应器在启动过程中,采用陕西省某污水处理厂好氧池中的污泥作为接种污泥,因此,要实现短程内源反硝化,需经过一段时间的驯化培养。其驯化培养过程中污染物浓度及去除效率的变化规律如图1所示。
由于接种污泥取自好氧池,其主要微生物为好氧细菌,因此在反应器运行初期,系统内进出水中COD和NO[-2]-N浓度没有明显差异。在接种第3天时,COD和NO[-2]-N的去除率仅为8.13%和20.89%,说明在此过程中只有少量的反硝化细菌,使得污染物不能被有效去除。经过一段时间的驯化培养后,出水中COD和NO[-2]-N浓度逐渐下降,COD和NO[-2]-N的去除效率增加。当反应器运行到第69天时,COD和NO[-2]-N的去除效率均达到85%以上,说明此时系统内已经富集大量的反硝化细菌,可以有效去除进水中的污染物。当运行到第80天时,出水中几乎检测不到COD和NO[-2]-N的存在,其去除率分别达到93.81%和99.51%,说明短程内源反硝化反应器启动成功。
2.2 微生物群落结构特征
为了进一步确定短程内源反硝化系统是否驯化成功,采用16Sr RNA高通量测序法对驯化前后的微生物群落结构进行鉴定。根据鉴定结果可知,反应器在驯化前,系统内主要门类有7个,分别是Proteobacteria(变形门),Ignavibacterae,Verrucomicrobia(疣微菌门),Bacteroidetes(拟杆菌门),Chloroflexi(绿弯菌门),Planctomycetes(浮霉菌门),Actinobacteria(放线菌门)。研究表明,Proteobacteria包含大量固氮菌和脱氮细菌,其占脱氮系统微生物的80%左右[16]。可见,污泥驯化前微生物系统中主要菌门与其他常见污水处理系统中微生物主要菌门分布相似。
驯化前的活性污泥中有20多个属,其中占比大于1%的包括Nitrosomonas(亚硝化单胞菌),Comamonas(丛毛单胞菌属),Reharvibaculum,Chiayiivirga,Ignavibacterium,Rhodopseudomonas(红假单胞菌属),Thermomonas(热单胞菌属),Aquamicrobium(水微菌属),Diaphorobacter,Spartobacteria_genera_incertae_sedis,Moheibacter,Limnobacter,Rehaibacterium等。由于接种污泥取自好氧反应池,因此该污泥中好氧微生物Nitrosomonas,Phycisphaera,Truepera,Comamonas,Aquamicrobium[17–19]占比较大。
在驯化成功的活性污泥反应器中,丰度较高的菌门包括Proteobacteria(变形门),Bacteroidetes(拟杆菌门),Ignavibacterae,Vernucomicrobia(疣微菌门),Actinobacteria(放线菌门),丰度分别为79.74%,14.60%,2.67%,1.53%,1.04%。在系统中,高丰度的Proteobacteria保证了氮素的良好循环。
在属水平上,占比较大的微生物包括Raoultella(拉乌尔菌属),Thauera(陶厄氏菌),Macellibacteroides,Paracoccus(副球菌属),Flavobacterium(黄杆菌属),Petrimonas,Ignavibacterium,Enterobacter(肠杆菌属)。研究表明,Raoultella可以以NO[-3]-N和NO[-2]-N作为电子受体进行反硝化。[20]Thauera是典型的反硝化细菌,该类细菌的存在有利于氮氧化物的还原[21]。Paracoccus和Flavobacterium属于反硝化除磷细菌,Paracoccus细菌的存在有助于NO的还原[22–23]。目前对于Macellibacteroides的功能还不明确,但是在污水生物脱氮系统中经常被检测到,说明该类细菌的存在有助于氮素的去除[24]。以上结果说明,经过一段时间的驯化培养后,SBR反应器内已经成功实现了反硝化细菌的富集,表明该反应器启动成功。
2.3 COD/N对污染物去除性能的影响
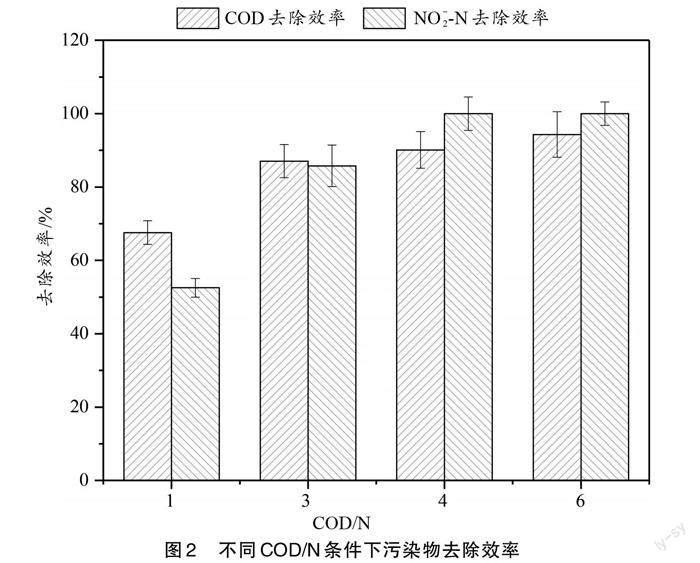
为了确定COD/N对短程内源反硝化过程中污染物去除性能的影响,本研究对不同条件下污染物的去除效率和转化过程进行了分析,其结果如图2和图3所示。
根据图2可知,COD的去除效率随着COD/N的增加而增加。一般情况下,当碳源不足时,COD基本会消耗完全,因此,COD的去除效率会随着COD/N的升高而降低,而在本实验中却出现相反的结论。根据数据分析和文献可知,这可能是由于难降解有机物所致[25]。彭永臻等[25]发现,在反应器中,有一部分难降解的有机物,这部分有机物可以通过仪器检测到,但是不能参与反应。该难降解有机物的存在会对COD的去除效率产生不同程度的影响。当COD/N为1时,反应器内进水COD浓度为86.53 mg/L左右,而出水中检测到的难降解有机物的量为28.06 mg/L。根据COD去除效率的计算公式可知,由于进水中COD的基数较小,此时反应器内剩余的难降解有机物对COD的去除效率影响显著。而当COD/N较大时,COD的去除效率较高可能是以下原因所致:在短程内源反硝化过程中,COD会在厌氧阶段贮存为胞内聚合物(PHA),若COD在厌氧阶段能完全贮存,则在厌氧后期,系统内就检测不到COD;若COD浓度过高,在厌氧阶段不能完全贮存时,在缺氧初期,系统内剩余的COD也会首先被作为电子供体参与外源反硝化(外源反硝化相比于内源反硝化更易进行),使得系统内COD消耗殆尽。由此可见,COD的去除效率只与进出水浓度有关。由于高COD/N时COD浓度较高,因此难降解有机物对COD的去除效率几乎没有影响,此时COD去除效率较高。
图2显示,NO[-2]-N也随着COD/N的增加而增加。当COD/N大于4时,NO[-2]-N基本可以完全被去除,其去除效率達到99.99%。这是因为在低COD/N(1和3)时,电子供体不足,NO[-2]-N不能被全部还原。而COD/N较高时,系统内电子供体充足,有利于NO[-2]-N的去除。据实验结果可知,当COD/N为4时,即可实现NO[-2]-N的完全还原。
为了进一步了解COD/N对短程内源反硝化过程中污染物去除性能的影响,本研究对污染物降解过程中的相关数据进行监测。不同COD/N条件下各污染物的转化过程如图3所示。在厌氧初期,当COD加入反应器后,其浓度快速降低,此时,外源COD以PHA的形式贮存在细胞体内。根据图3 pH的变化规律可知,COD贮存的过程中pH逐渐降低。当COD/N为1时,COD在15 min内即可全部贮存,而COD/N为3,4,6时,COD贮存所消耗的时间分别为30 min,45 min,60 min。这说明COD浓度越高,其贮存所消耗的时间越长。进入到缺氧阶段后,即开始进行内源反硝化,根据NO[-2]-N的变化规律可知,随着反应的进行,系统内pH逐渐升高。当NO[-2]-N浓度不再发生变化时,pH则停止升高,说明此时反硝化作用停止进行。
根据图3可知,不同COD/N条件下污染物去除所消耗的时间随着COD/N的增加而减少,COD/N为1和3时,实验在8 h内无法实现NO[-2]-N的完全去除。这是因为当碳源充足时,有利于反硝化的进行,使得NO[-2]-N可以在短时间内被还原。当COD/N较低时,由于缺乏电子供体,无法将系统内NO[-2]-N完全还原,即使延长时间,也不能实现NO[-2]-N的彻底去除。
2.4 COD/N对NO和N2O积累的影响
不同COD/N条件下NO和N2O的积累特征如图4所示。当COD/N为1时,NO在缺氧初期快速升高后又快速下降,其最大值为0.059 mg/L。当COD/N为3时,NO积累特征与COD/N为1时基本一致,但其最大值相对较高,为0.1 mg/L。当COD/N为4和6时,NO的积累量明显升高,且积累时间较长。NO的积累峰值为0.45和0.43 mg/L,积累持续时间分别为40 min和30 min。这说明,当COD/N从1增加到4时,NO积累峰值和积累时间随着COD/N的增加而增加,而当COD/N增加到6时,NO的积累峰值和积累时间有所降低。
根据图4可知,N2O的积累量和积累时间明显高于NO。当COD/N为1时,在缺氧初期,N2O浓度逐渐升高,在大约190 min时出现平台期,其浓度一直保持不变,之后又快速升高。当达到最大值12.4 mg/L时,N2O开始缓慢下降,直至反应结束。当反应结束时,系统内仍有3.89 mg/L的N2O未被还原。值得注意的是,在该实验中,N2O积累出现的平台期是由于N2O微电极出现突发性故障所致。由于N2O电极连接线接触不良,导致其检测的信号未被传送至电脑,因此出现该现象。
当COD/N为3时,N2O的积累峰值相比于COD/N为1时有所降低,仅为3.7 mg/L。当COD/N为4和6时,系统内N2O的积累特征与COD/N为1和3时明显不同。在缺氧初期,N2O积累量快速增加,该现象持续一段时间后,N2O的增加趋势变缓,之后又恢复快速增加趋势。当达到峰值后,N2O在很短的时间内快速被还原。虽然在COD/N为6时N2O的积累量高于COD/N为4时的积累量,但其还原所耗的时间明显较短(COD/N为6时耗时10 min,COD/N为4时耗时30 min)。
3 讨论
根据污染物的转化规律以及NO的积累特征可知,NO的积累与厌氧时间、COD/N、游离亚硝酸(Free nitrous acid,FNA)和NO的抑制有关,其具体原因是:在正常反硝化过程中,NO[-2]-N会在微生物的作用下经NO、N2O还原为N2。但是在本实验中,微生物经历1 h的厌氧阶段,在这个过程中,由于缺乏电子受体,各反硝化微生物体内的反硝化酶(亚硝酸盐还原酶、NO还原酶、N2O还原酶)的活性均有所降低,而酶的活性需要底物的刺激才能激活[26]。因此,在缺氧初期,当NO[-2]-N投加到反应器中时,亚硝酸盐还原酶活性被激活,使得NO[-2]-N迅速还原为NO。但是,在NO[-2]-N还原的过程中,NO还原酶活性还相对较低,使得产生的NO不能快速被还原,导致NO积累现象发生。当有NO积累时,NO还原酶活性逐渐恢复,NO在短时间内即可被还原为N2O。但是,根据实验结果可知,当COD/N为4和6时,NO的积累持续时间相对较长,这可能与电子供给量和FNA抑制有关。当COD/N较低时,由于电子供体较少,NO[-2]-N的还原速度较慢,产生的NO较少。而当电子供体较多时,大量的NO[-2]-N被还原为NO,使得NO在短时间内积累量增加。NO是一种有毒气体,积累量大时会对反硝化酶产生抑制,其对NO还原酶的抑制阈值为0.3 mg/L[27]。当COD/N为4和6时,NO的积累浓度峰值分别达到0.45 mg/L和0.43 mg/L,该浓度高于NO对NO还原酶的抑制浓度。因此,NO不能被还原为N2O,导致其积累现象发生。由于NO难溶于水,随着反应的进行,反应器内的NO一部分随着搅拌释放到大气中,另外一部分被微生物还原。在此阶段,NO的浓度逐渐降低。此外,FNA的抑制也会对NO的积累产生影响。如前文所述,COD的贮存会导致pH降低,因此,在COD/N为4和6时,厌氧结束后,由于COD的贮存,pH显著降低。根据FNA的计算方法可知,当NO[-2]-N浓度相同时,pH越低,FNA浓度越高。COD/N为4和6时,缺氧初期的FNA浓度超过其对NO还原酶的抑制阈值[28]。因此,FNA的抑制也在一定程度上导致了NO的积累。
N2O的积累量随着COD/N的增加呈现出先降低后升高的趋势,其积累峰值的最大值和最小值分别在COD/N为6和3时出现。造成该现象的原因是多因素作用导致的,主要包括COD/N、NO和FNA的抑制。
一般情况下,N2O的积累量会随着COD/N的降低而增加。这是因为N2O还原酶在所有反硝化还原酶中竞争电子能力最弱,当电子供体较少时,N2O还原酶由于竞争电子实力较弱,导致N2O不能被还原为N2[29]。在本实验中,在COD/N为1时,电子供体严重不足,反应结束时,系统内仍然有39.45 mg/L的NO[-2]-N剩余。在这种情况下,N2O不会被完全还原为N2。此时N2O的积累是由于低COD/N时电子供体的缺乏所致。在COD/N为3时,碳源较COD/N为1时多,此时,更多的N2O可以被还原。虽然在反应结束时仍然有少量剩余,但是该条件下N2O的积累量已经明显降低。在COD/N为1和3时符合N2O积累的正常规律。但是,当COD/N为4和6时,N2O的积累量却高于COD/N为1 mg/L时的情况,这可能是FNA和NO的抑制所致。FNA和NO对N2O还原酶的抑制浓度分别为0.04和0.075 mg/L[27–28]。而在COD/N为4和6的缺氧初期,FNA浓度为0.35和0.20 mg/L,NO浓度分别为0.45和0.43 mg/L,该浓度明显高于其对N2O还原酶的抑制阈值。因此,当COD/N为4和6时,在缺氧初期,由于NO的积累和FNA的双重抑制,导致N2O还原酶活性被抑制,N2O快速积累。在此过程中,由于双重抑制的作用,反硝化过程受到抑制。由图3可以看出,此时NO[-2]-N浓度变化幅度较小,进一步证明NO和FNA对反硝化的抑制。随着反应的进行,FNA和NO浓度逐渐降低,其对反硝化的抑制有所缓解,NO[-2]-N和NO浓度开始降低。但是,由于N2O还原酶比NO[-2]-N和NO还原酶对FNA更为敏感,虽然NO的浓度已经低于检测限,此时N2O仍然不能顺利还原为N2,所以,在此过程中出现了N2O的快速积累现象。而当FNA浓度低于其对N2O的抑制阈值时,由于电子供体充足,系统内积累的N2O在短时间内被全部还原为N2。而且COD/N越高,N2O还原速率越快。
4 结语
本文通过研究COD/N对短程内源反硝化過程中污染物去除性能以及NO和N2O积累特征的影响,分析了NO和N2O的产生机理,得到的主要结论如下:
(1)COD和NO[-2]-N的去除效率随着COD/N的增加而增加。当COD/N较低时,由于电子供体不足,无法将系统内NO[-2]-N完全还原。
(2)短程内源反硝化过程中,与低COD/N相比,高COD/N会引起NO的大量积累。NO的积累与厌氧时间、COD/N、NO和FNA的抑制有关。
(3)N2O的积累量随着COD/N的增加呈现出先降低后升高的现象。低COD/N(1和3)条件下N2O的积累是由于电子供体不足所致,而COD/N较高时N2O的积累主要是由NO和FNA的抑制造成,其中在N2O快速增长阶段主要是FNA的抑制,而在N2O缓慢增长阶段是FNA和NO的双重抑制。
参考文献:
[1] 王朝朝,马骏,殷春雨,等.反硝化颗粒污泥培养及工艺快速启动[J].中国给水排水,2021(23):1-8.
[2] 黄锐,宋云杰,田亮,等.厌氧氨氧化耦合反硝化工艺研究进展[J].环境科学与技术,2022(3):212-222.
[3] 陈思宇,张绍青,陈鹏,等.基于短程反硝化的生物脱氮技术研究进展[J].环境工程,2021(5):38-44.
[4] 叶啸天,戎振英,刘行平,等.同步短程硝化反硝化工艺启动性能研究[J].浙江海洋大学学报(自然科学版),2022(1):76-80.
[5] 敬双怡,宋子洋,刘超,等.MBBR工艺中SNEDPR的启动及性能研究[J].中国环境科学,2022(7):3121-3129.
[6] 王倩,胡嘉源,李天皓,等.铁强化厌氧氨氧化脱氮机理研究进展[J].中国环境科学,2022(11):5153-5162.
[7] 巩有奎,王淑莹,王莎莎,等.碳氮比对短程反硝化过程中N2O产生的影响[J].化工学报,2011(7):2049-2054.
[8] WANG S,ZHAO J,HUANG T.High NO and N2O accumulation during nitrite denitrification in lab-scale sequencing batch reactor: influencing factors and mechanism[J].Environmental Science and Pollution Research,2019,26(33):34377-34387.
[9] 巩有奎,李永波,苗志加.不同进水方式下短程反硝化过程中N2O产量[J].环境工程,2018(10):59-63.
[10] 赵日祥,赵剑强,丁晓倩,等.氨对胞内贮存物短程反硝化N2O产生量的影响[J].环境科学与技术,2017(12):38-43.
[11] WANG S,ZHAO J,DING X,et al.Nitric oxide and nitrous oxide production in anaerobic/anoxic nitrite-denitrifying phosphorus removal process:effect of phosphorus concentration[J].Environmental Science and Pollution Research,2020,27(36):45925-45937.
[12] 樊磊磊.曝气生物滤池N2O产生机制及生物膜内氮形态分布特性[D].重庆:重庆大学,2015.
[13] 付昆明,张晓航,刘凡奇,等.葡萄糖碳源条件下C/N对反硝化和N2O释放性能的影响[J].环境工程学报,2021(4):1279-1288.
[14] 胡筱敏,李微,刘金亮,等.pH对以亚硝酸盐为电子受体反硝化除磷的影响[J].中南大学学报(自然科学版),2013(5):2144-2149.
[15] WANG S,ZHAO J,DING X,et al.Effect of starvation time on NO and N2O production during heterotrophic denitrification with nitrite and glucose shock loading[J].Process Biochemistry,2019,86:108-116.
[16] YU Y,ZHAO J,WANG S,et al.Nitrogen removal and electricity production at a double-chamber microbial fuel cell with cathode nitrite denitrification[J].Environmental Technology,2017,38(24):3093-3101.
[17] SOTRES A,CERRILLO M,VINAS M,et al.Nitrogen removal in a two-chambered microbial fuel cell:Establishment of a nitrifying-denitrifying microbial community on an intermittent aerated cathode[J].Chemical Engineering Journal,2016,284:905-916.
[18] 郑旭文,陈永兴,陈振国,等.沸石SBR/缺氧上升流污泥床实现氧化铁红废水脱氮[J].中国给水排水,2021(1):1-8.
[19] 杨小龙,刘莉华,吴秉奇,等.一个氨氧化菌群的筛选及除氮特性[J].微生物学报,2015(12):1608-1618.
[20] 张宇燕,贺根和,陆丽君,等.好氧反硝化菌的筛选鉴定及其脱氮特性研究[J].井冈山大学学报(自然科学版),2014(4):1-6.
[21] TONG J,TANG A,WANG H,et al.Microbial community evolution and fate of antibiotic resistance genes along six different full-scale municipal wastewater treatment processes[J].Bioresource Technology,2019,272:489-500.
[22] 林兵.盐胁迫下好氧颗粒污泥微生物种群变化及生态响应机制[D].镇江:江苏科技大学,2014.
[23] BERGAUST L,MAO Y,BAKKEN L R,et al.Denitrification response patterns during the transition to anoxic respiration and posttranscriptional effects of suboptimal pH on nitrous oxide reductase in Paracoccus de-nitrificans[J].Applied Environmental Microbiology,2010,76(19):6387-6396.
[24] 韩文杰,吴迪,周家中,等.长三角地区MBBR泥膜复合污水厂低温季节微生物多样性分析[J].环境科学,2020(11):5037-5049.
[25] 彭永臻,尚会来,张静蓉,等.ρ(C)ρ/(N)對污水反硝化过程中N2O产生的影响[J].北京工业大学学报,2010(4):517-522.
[26] BAO Z,RIBERA-GUARDIA A,SPINELLI M,et al.The effect of temperature shifts on N2O and NO emissions from a partial nitritation reactor treating reject wastewater[J].Chemosphere,2018,212:162-169.
[27] NI B J,YUAN Z.A model-based assessment of nitric oxide and nitrous oxide production in membrane-aerated autotrophic nitrogen removal biofilm systems[J].Journal of Membrane Science,2013,428:163-171.
[28] ZHOU Y,OEHMEN A,LIM M,et al.The role of ni-trite and free nitrous acid (FNA) in wastewater treat-ment plants[J].Water Res,2011,45(15):4672-4682.
[29] 鞏有奎,任丽芳,彭永臻.电子竞争机制下内源反硝化过程N2O变化特性[J].环境科学与技术,2019(5):168-173.
【责任编辑 牛怀岗】
Effect of COD/N on NO and N2O Accumulation During Short-Cut Endogenous Denitrification
WANG Sha,LI Bin,SUN Jianghua
Abstract: A sequencing batch activated sludge reactor was used this study to investigate the effect of different carbon to nitrogen ratios (COD/N) (1,3,4,6) on pollutant removal performance and NO and N2O accumulation in the short-cut endogenous denitrification. The results showed that chemical oxygen demand and nitrite nitrogen removal were better when COD/N was greater than 3. The peak of NO accumulation increased first and then decreased with the increase of COD/N, and the maximum of 0.45 mg/L was achieved when COD/N was 4. While N2O accumulation showed a trend of decreasing first and then increasing. the peak of N2O accumulation was the smallest (3.7 mg / L) when COD/N was 3. The NO accumulation was related to the COD/N, anaerobic time, NO and free nitrous acid inhibition. The N2O accumulation was caused by COD/N, NO, and free nitrous acid.
Key words:carbon to nitrogen; short-cut endogenous denitrification; nitric oxide; nitrous oxide; denitrifying reductase

