振动胁迫对蓝莓花色苷代谢及相关基因表达的影响
韩延超,陈慧芝,2,牛 犇,2,张小栓,韩树人,王晓艳,王冠楠,刘瑞玲,郜海燕,
(1.浙江省农业科学院 食品科学研究所,全省生鲜食品智慧物流与加工重点实验室,中国轻工业果蔬保鲜与加工重点实验室,浙江 杭州 310021; 2.农业农村部果品采后处理重点实验室,浙江 杭州 310021; 3.中国农业大学 工学院,北京 100083; 4.鲜丰水果股份有限公司,浙江 杭州 310000)
蓝莓中花青素含量较高且种类丰富,有研究表明蓝莓中的花青素含量是所有蔬菜和水果中最高的,主要集中在其紫色果皮部位[1]。蓝莓花色苷具有抗氧化、改善视力等功能特性,深受消费者喜爱[2]。随着我国果蔬电商物流产业的飞速发展,蓝莓远距离销售的需求迅速增加,但是物流过程中振动易造成蓝莓腐败、衰老等现象,外在因素的变化极易导致花色苷降解,影响蓝莓果实的贮藏品质和营养价值。蓝莓在物流过程中容易遭受振动胁迫,花色苷积累加速,振动时间越久,达到峰值的时间越短,随后降解速度也越快[3]。
花色苷是天然水溶性色素,广泛存在于植物的花、果实、种子和叶片中,属黄酮多酚类化合物。它主要是通过苯丙烷类代谢和类黄酮途径进行生物合成,合成过程中重要酶有苯丙氨酸解氨酶(PAL)、二氢黄酮醇还原酶(DFR)、查尔酮异构酶(CHI)、类黄酮糖基转移酶(UFGT)等,而参与花色苷降解的酶有花色苷-β-糖苷酶、多酚氧化酶(PPO)和过氧化物酶(POD)[4]。果蔬花色苷的代谢与基因表达有关,通过促进或抑制花色苷合成和降解基因的表达能够延缓贮藏过程中花色苷的降解。在葡萄[5]、无花果[6]、蓝莓[7]等果实中研究发现,PAL、UFGT、DFR等基因表达与花色苷的合成密切相关,说明花色苷积累与苯丙烷代谢和类黄酮合成途径中的酶活性密切相关。Li等[8]研究也发现,黄酮醇和原花青素的合成在草莓成熟过程中受抑制,而蔗糖处理上调了除FaF3′H之外的类黄酮途径相关基因表达,加快花青素积累。POD、PPO和花色苷-β-糖苷酶是花色苷降解过程中的重要酶,可以抑制降解酶基因的表达,延缓果蔬花色苷的降解。Fang等[9]研究表明,热处理引发荔枝果实快速褐变和花青素损失,而热酸处理通过降低花青素降解酶活性及LcPOD基因表达,使荔枝果皮酸化从而达到护色目的。
本文主要研究物流振动对蓝莓花色苷组分和花色苷代谢相关酶活性的影响,并探究振动胁迫对蓝莓贮藏过程中花色苷合成和降解相关基因表达的影响,阐明物流振动对花色苷的作用机理,为后续研发蓝莓物流过程中的花色苷等品质保持技术提供理论依据。
1 材料与方法
1.1 试验材料与试剂
本文采用的实验原料为蓝美人品种蓝莓,采摘于浙江新昌兆丰生态园。果实于温度较低的清晨采摘,挑选大小均匀、成熟度一致、无机械损伤的蓝莓果实30 kg,置于4 ℃保鲜库预冷待用。
试剂:乙醇、三氯乙酸、硫代巴比妥酸、氯化铁、福林酚、浓盐酸、抗坏血酸、磷酸、碳酸钠、没食子酸、氢氧化钠、硝酸钠、硝酸铝、氯化钾、醋酸钠、冰醋酸,所有试剂均为分析纯。
1.2 仪器设备
Waters e2695高效液相色谱仪,美国WATERS公司;SpectraMax M2酶标分析仪,美国Molecular Devices公司; BioSpec-nano超微量分光光度计,日本岛津;Mastercycler nexus恒温扩增PCR仪,Eppendorf生命科技有限公司;StepOnePlusTM实时荧光定量PCR仪,美国Thermo Fisher Science公司。
1.3 振动实验
模拟车辆高速路面行驶,根据预实验中大部分蓝莓有轻微振动现象,设置振动频率4 Hz,物流振动中蓝莓最大可承受时间18 h为振动组,未振动胁迫为对照组。样品贮藏在4 ℃恒温箱中,每4 d取样一次,贮藏期24 d。
1.4 花色苷组分及含量测定
参考Hutabarat等[10]的方法,通过HPLC分析花色苷组分。称取1 g蓝莓果实样品,以料液比1∶20加入含0.2% HCl的60%乙醇溶液,离心取上清,过滤后用于HPLC分析。C18反相色谱柱,柱温:25 ℃,流速:0.6 mL·min-1,进样体积:10 μL,检测波长:520 nm,流动相A:1%磷酸溶液,流动相B:100%乙腈。
1.5 花色苷代谢相关酶活性测定
PAL活性测定:称取5 g蓝莓样品,加5 mL提取缓冲液(40 g·L-1PVP、2 mmol·L-1EDTA、5 mmol·L-1β巯基乙醇),离心后上清液低温保存,取2支试管加入3 mL 50 mmol·L-1pH 8.8硼酸缓冲液和0.5 mL苯丙氨酸溶液,分别加入0.5 mL酶提取液和煮沸5 min失活的酶液,37 ℃保温60 min,结束后加入0.1 mL 6 mmol·L-1HCl终止反应,290 nm处测定吸光度值。以每克蓝莓鲜样每分钟吸光度值增加0.01为一个活性单位U,单位用U·g-1表示。CHI、DFR、UFGT和花色苷-β-糖苷酶活性测定:分别使用CHI、DFR、UFGT酶联免疫(ELISA)试剂盒测定。POD、PPO活性测定:参考曹建康等[11]、黄欣莉等[12]、严锐等[13]的方并略作改动。POD活性测定具体方法如下: 取 1.0 g 蓝莓果品样品于 10 mL 离心管,加 入5 mL 0.1 mol·L-1磷酸缓冲液(Solabio),12 000 r·min-1离心25 min,取上清液(粗酶液)。 反应体系:0.3 mL粗酶液,0.3 mL 6 mmol·L-1愈创木酚,2.4 mL 5 mmol·L-1H2O2。反应 15 s 后,测定470 nm 处 3 min 内的吸光度值变化。PPO活性测定具体方法如下:取1 g蓝莓果实,充分研磨,加入5 mL 0.1 mol·L-1磷酸钠缓冲液,混匀,12 000 r·min-1离心20 min,收集上清液(粗酶液)。采用1.0 mL 0.05 mol·L-1邻苯二酚、4.0 mL磷酸钠缓冲液和200 μL粗酶液,混匀,于25 ℃水浴30 s,以磷酸钠缓冲液为空白对照,测定420 nm波长处的吸光度,每30 s记录1 次。以每克样品在每分钟吸光度变化0.01为1个酶活力单位(U),单位为U·g-1,重复3 次。
1.6 实时荧光定量PCR(real time fluorescent quantitative PCR,qRT-PCR)
本实验选择已知的欧洲越橘GAPDH(VcGAPDH)作为内参基因,通过Primer 5.0设计蓝莓花色苷代谢相关酶基因引物,杭州有康生物科技有限公司进行引物合成(表1)。对合成的引物进行PCR扩增,扩增产物通过凝胶电泳检测,条带清晰单一且无二聚体,可进行qRT-PCR实验,检验引物熔解曲线单一(无特异性产物)。qRT-PCR实验具体参考我们前面的方法[14-15]。反应体系(20 μL):SYBR Green PCR Supermix 10 μL,5 μmol·L-1上游和下游荧光定量引物 各1 μL,cDNA 模板 1 μL,加 ddH2O到20 μL。反应程序:94 ℃预变性 4 min,然后进行如下循环:94 ℃变性 5 s,55 ℃退火 10 s,72 ℃延伸30 s,共40个循环。
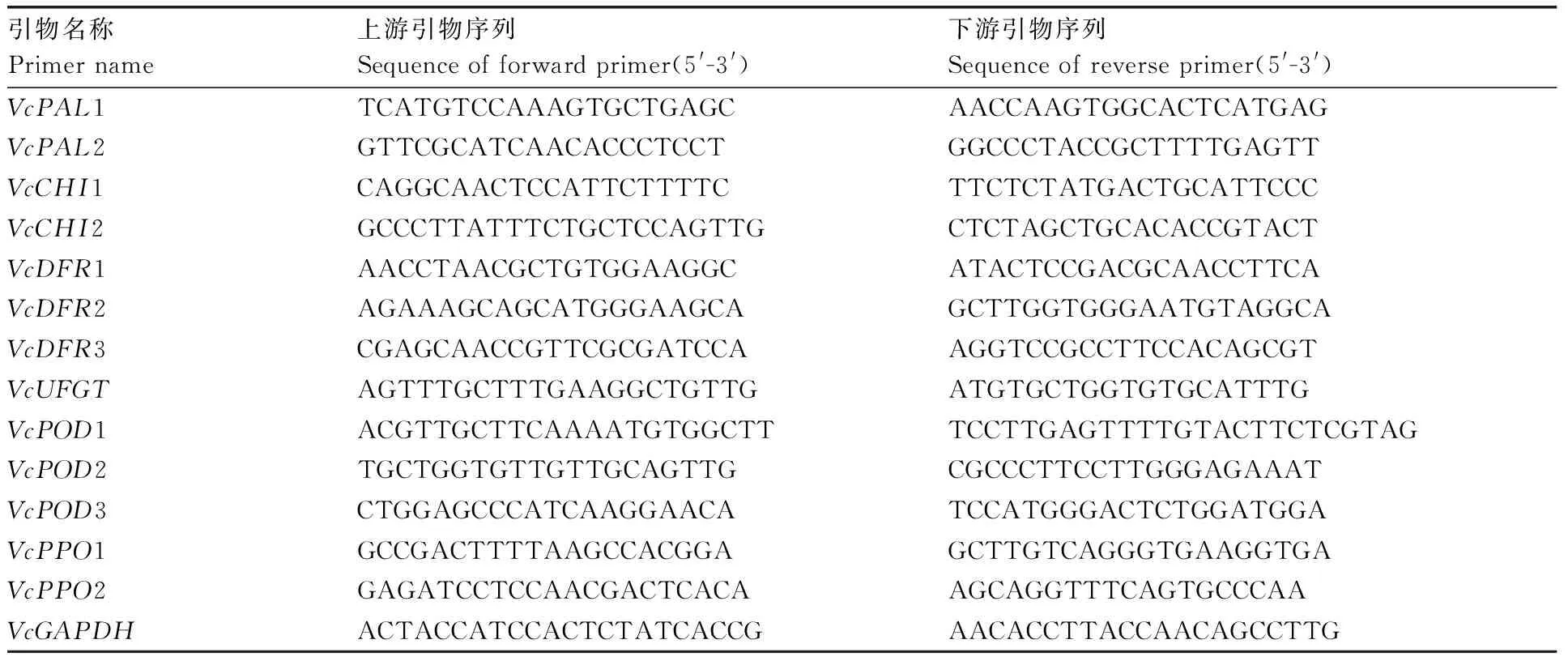
表1 荧光定量PCR引物序列Table 1 Fluorescent quantitative PCR primer sequence
1.7 数据处理
采用Excel 2010进行数据整理分析,采用SPSS 23.0软件进行Duncan显著性分析(P<0.01,表示差异极显著;P<0.05,表示差异显著)。使用Graphpad Prism 8.0.2软件进行绘图。
2 结果与分析
2.1 振动胁迫对蓝莓花色苷组分及含量的影响
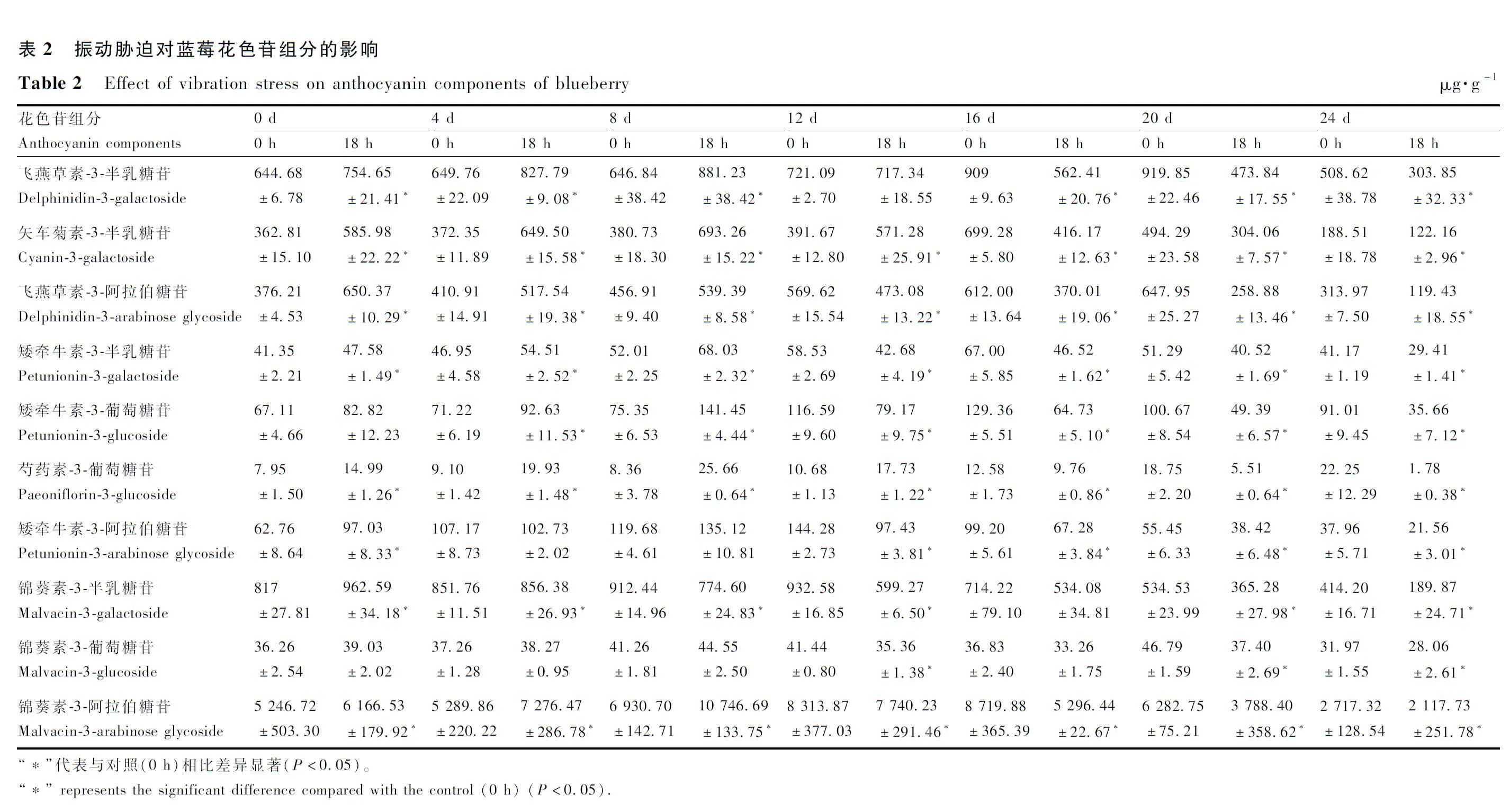
如表2所示,各单体花色苷含量随贮藏时间呈先上升后下降的趋势,振动胁迫组各单体花色苷含量大部分在贮藏8 d时达到峰值,而对照组则大部分在贮藏16 d时花色苷积累量最多,因此振动胁迫能够加速各花色苷单体含量峰值的到达,贮藏后期振动胁迫组各组分含量显著低于对照组,贮藏24 d时,各花色苷组分含量最低。蓝莓贮藏过程中锦葵色苷含量最高,其中锦葵素-3-阿拉伯糖苷含量最高,对照组和振动组中其含量分别在16 d和8 d达到最高值8 719.88 μg·g-1和10 746.69 μg·g-1,分别占总量的72.67%和76.49%,而芍药素-3-葡萄糖苷含量最少,其对照组和振动组分别在贮藏24 d和8 d达到最高点,含量仅22.25 μg·g-1和25.66 μg·g-1,仅占总量的0.51%和1.82%。
通过HPLC分析共检测出10种花色苷单体,使用SMICA-P 14.1软件对花色苷组分进行PCA主成分分析,如图1所示,第一主成分和第二主成分贡献率分别为70.6%和10.4%。对照组多分布在第三、四象限而振动胁迫组主要分布在第一和第二象限,说明振动对花色苷组分具有一定的影响。
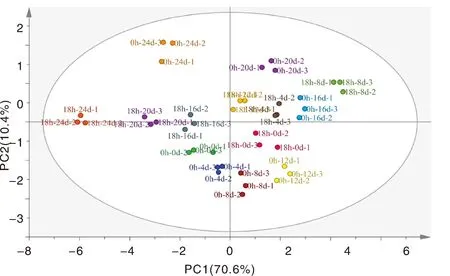
图1 对照和振动胁迫蓝莓花色苷组分变化的PCA得分图Fig.1 PCA score diagram of anthocyanin components of blueberry under control and vibration stress
2.2 振动胁迫对蓝莓花色苷合成相关酶活性的影响
如图2所示,蓝莓采后贮藏过程中PAL活性呈先升后降趋势,对照组在贮藏20 d时,PAL活性达到最高,为162.30 U·g-1,振动组在贮藏4 d时,PAL活性达到最高(170.05 U·g-1)。贮藏后期,振动组PAL活性显著低于对照组,贮藏24 d时,PAL活性最低,仅141.68 U·g-1。蓝莓CHI活性随贮藏时间整体呈先上升后下降的趋势,对照组在贮藏16 d时,CHI活性最高8.69 U·g-1,随后开始下降,24 d时活性仅6.74 U·g-1;振动胁迫组在贮藏第8 d时,CHI活性达到最高点(8.92 U·g-1),24 d时活性下降为5.56 U·g-1。蓝莓贮藏过程中DFR活性先上升后下降,贮藏16 d以前, DFR活性变化较为平缓,贮藏16 d时达到最大值,随后迅速下降,至24 d时,对照组和振动组DFR活性分别为98.81 U·g-1和75.34 U·g-1,相比最高点下降了33.28%和49.87%。贮藏后期,振动胁迫极显著抑制了蓝莓DFR活性。蓝莓UFGT活性随贮藏时间的延长呈先升后降趋势,贮藏8 d时,振动组活性达到最高,为20.03 U·g-1,显著高于对照组,随后开始下降,贮藏20 d时,活性最低,为16.24 U·g-1,相比最高点下降了11.98%;而贮藏后期对照组UFGT活性极显著高于振动组,贮藏20 d时,对照组活性最高为18.85 U·g-1,比贮藏0 d上升了7.48%。
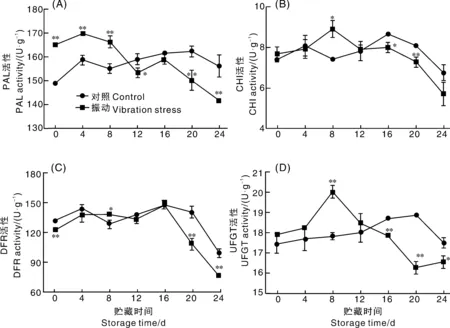
*或**分别表示与对照相比差异达显著(P<0.05)或极显著(P<0.01)水平。下同。* or ** represents the significant (P<0.05) or very significant(P<0.01) difference compared with the control. The same as below.图2 振动胁迫对蓝莓花色苷合成相关酶活性的影响Fig.2 Effect of vibration stress on anthocyanin synthesis related enzymes activity of blueberry
2.3 振动胁迫对蓝莓花色苷降解相关酶活性的影响
如图3所示,在蓝莓贮藏过程中,对照组花色苷-β-糖苷酶活性整体呈下降趋势,贮藏24 d时活性为4.08 U·mg-1,相比0 d下降了33.87%;而振动胁迫组花色苷-β-糖苷酶活性整体呈先上升后下降趋势,贮藏4 d时活性达到最高点6.58 U·mg-1,极显著高于对照组,随后迅速下降,贮藏24 d时活性下降为3.60 U·mg-1,比对照组低11.76%。蓝莓贮藏过程中,POD活性随蓝莓果实成熟衰老,不断下降。贮藏0 d时,振动组POD活性为8.89 U·g-1,为对照组的1.4倍,贮藏前4 d,振动组POD活性极显著高于对照组,随后振动组POD活性迅速下降至贮藏8 d的4.56 U·g-1,之后其活性变化趋于平缓;而对照组在整个贮藏过程POD活性极显著低于振动组,贮藏24 d时其活性最低仅0.94 U·g-1,比振动组低2.66 U·g-1。在蓝莓果实贮藏期间,PPO活性呈下降趋势,振动组PPO活性显著高于对照组,贮藏0 d时,振动组和对照组PPO活性分别为8.35 U·g-1和5.41 U·g-1;贮藏前期振动组PPO活性下降趋势较为明显,12 d时,其活性为4.32 U·g-1,下降48.26%,12 d以后趋于平缓;而对照组整个贮藏过程PPO活性下降趋势较为平缓,0 d到24 d活性下降了41.22%。与对照组相比,振动胁迫组PPO活性较高,能够加速花色苷降解。
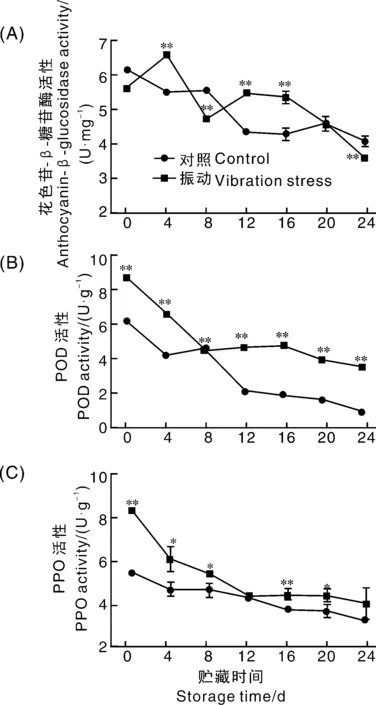
图3 振动胁迫对蓝莓花色苷降解相关酶活性的影响Fig.3 Effect of vibration stress on to anthocyanin degradation related enzymes activity of blueberry
2.4 振动胁迫对蓝莓花色苷合成相关酶基因表达的影响
蓝莓花色苷合成相关基因VcPAL1和VcPAL2在贮藏过程中的表达情况如图4所示,随贮藏时间延长蓝莓VcPAL1和VcPAL2基因表达变化趋势一致,相对于贮藏初期出现先上调后下调的趋向,其中对照组VcPAL1和VcPAL2基因相对表达量分别在12 d和16 d最高,而振动组蓝莓VcPAL1和VcPAL2基因则均在8 d时达到最高点,贮藏后期振动组VcPAL1和VcPAL2基因相对表达量逐渐下降且极显著低于对照组。
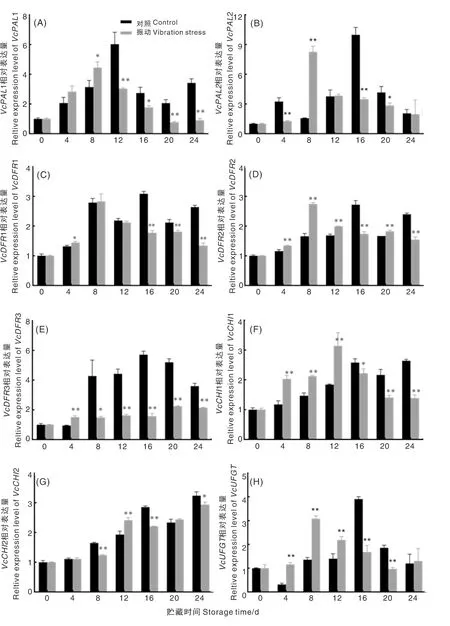
图4 振动胁迫对蓝莓花色苷合成相关酶基因相对表达量的影响Fig.4 Effect of vibration stress on relative expression of anthocyanin synthesis enzymes related genes in blueberry
由图4可知,对照组蓝莓在贮藏期间VcDFR1、VcDFR2和VcDFR3基因相对表达量均呈先上升后下降趋向,均在贮藏16 d时表达量最高。振动组VcDFR1和VcDFR2基因相对表达量变化趋势与对照组一致,在贮藏前8 d时相对表达量上升达到最高值,随后开始下降,贮藏16 d到24 d振动组VcDFR1和VcDFR2基因相对表达量极显著低于对照组。而振动组VcDFR3基因相对表达量相对于贮藏初期逐渐上调,贮藏8 d开始其VcDFR3基因相对表达量极显著低于对照组,振动胁迫显著抑制贮藏后期VcDFR基因的表达。
蓝莓贮藏过程中VcCHI1和VcCHI2基因表达量的变化如图4所示,对照组VcCHI1基因相对表达量逐渐上调,而振动组VcCHI1基因表达量在贮藏前12 d上调且其表达量极显著高于对照组,贮藏后期振动组VcCHI1基因表达逐渐下调且极显著低于对照组。对照组和振动胁迫组VcCHI2基因表达量变化趋势一致,均随贮藏时间逐渐上升,但是贮藏后期振动组VcCHI2基因表达量显著低于对照组。振动诱导了贮藏前期VcCHI1基因的表达,也抑制了贮藏后期VcCHI1和VcCHI2基因的表达。
VcUFGT表达量在对照和振动胁迫组中变化一致,均呈现先升后降趋势,分别在贮藏16 d和8 d最高,与初始值相比分别上调了74.42和67.53%。在贮藏前期4~8 d振动组VcUFGT基因相对表达量显著高于对照组(P<0.01),16 d和20 d表达量下降且极显著低于对照组。振动胁迫诱导贮藏前期VcUFGT基因相对表达量上调,加速贮藏前期花色苷的积累。
2.5 振动胁迫对蓝莓花色苷降解相关酶基因表达的影响
振动胁迫对蓝莓贮藏期间VcPOD1、VcPOD2、VcPOD3基因相对表达量的影响如图5所示,对照和振动胁迫组VcPOD2表达量均呈现先升后降趋向,在贮藏8 d达到最高峰;而VcPOD1和VcPOD3表达量随贮藏时间延长而降低,VcPOD1基因在贮藏20 d和24 d时的表达量显著高于对照组,VcPOD3表达量从8 d开始极显著高于对照组。对照组VcPPO1表达量随贮藏时间逐渐下降,而振动胁迫组VcPPO1呈先上调后下调趋势,贮藏8 d表达量最高。VcPPO2在蓝莓贮藏过程中的表达量呈先升后降趋势,但是与对照组相比,振动组极显著抑制了VcPPO2基因的表达。
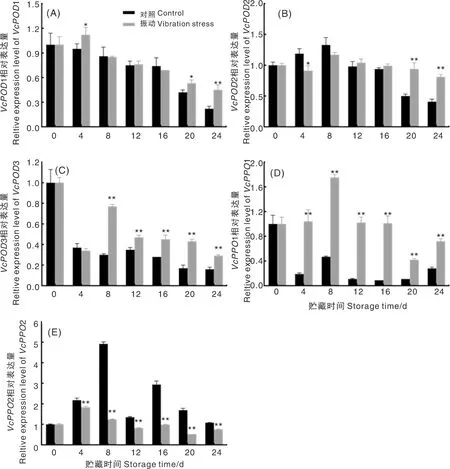
图5 振动胁迫对蓝莓花色苷降解相关酶基因相对表达量的影响Fig.5 Effect of vibration stress on relative expression of anthocyanin degradation enzymes related genes in blueberry
3 讨论
蓝莓果实采后贮藏过程中,随着果实的成熟,蓝莓花色苷含量呈现先上升后下降的趋势,但其花色苷种类没有明显的变化。在本实验所用蓝美人品种蓝莓果实中共检测到5种花青素,其中以锦葵色素为主,芍药色素含量最少。此结果与南京市种植的兔眼蓝莓中测到的花青素种类相似[10]。花色苷主要是由花青素和单糖键合而成,本实验中检测到的花青素主要被葡萄糖、半乳糖和阿拉伯糖糖基化形成10种花色苷单体,其中锦葵素-3-阿拉伯糖苷含量最高。Li等[16]通过对蓝莓中花青素的HPLC和主成分分析发现,17种不同品种花色苷图谱相似,但其占比取决于种类,而检测到的花色苷主要有锦葵苷、飞燕草苷和矮牵牛苷,分别占比41.0%、33.1%、17.3%,占总花色苷含量的90%以上。在贮藏过程中蓝莓花色苷含量呈先上升后下降的趋势,对照组和振动胁迫组花色苷总量分别在16 d和8 d时达到峰值,各组分含量也随之发生变化,振动组处理加速了花色苷含量峰值的到达,随后下降过程中,其含量显著低于对照组。
PAL是花色苷生物合成途径的第一个酶。王惠聪等[17]发现,荔枝果皮中花色苷含量与PAL活性没有相关性;邱雪[4]和黎欢欢等[18]研究表明,PAL活性与花色苷含量变化呈显著正相关。本实验结果表明,PAL活性与花色苷含量变化相似,均呈现先上升后下降的趋势,贮藏前期活性较高,蓝莓果实开始大量合成类黄酮类物质,贮藏后期振动组PAL活性下降迅速,振动胁迫加快了花色苷的合成进程,后期花色苷分解加快花色苷含量逐渐下降,PAL活性随之下降,说明PAL是花色苷合成途径的重要酶。Feng等[19]研究表明,CHI与花青素的合成密切相关。在本实验中,花色苷含量呈先上升后下降的趋势,而CHI、DFR、UFGT活性变化与花色苷含量变化相似,振动胁迫组PAL、CHI、DFR、UFGT活性在贮藏8 d左右达到最高点,随后开始下降,贮藏后期振动组花色苷合成酶活性显著低于对照组。因此,CHI、DFR、UFGT可能都是花色苷合成途径的重要酶。Lister等[20]研究发现,在苹果生长发育过程中,CHI仅在苹果果皮发生转色时,其活性与花色苷变化协同。王惠聪等[17]通过研究荔枝果皮中花色苷含量以及PAL、DFR、CHI、UFGT等活性变化发现,仅有UFGT活性变化与花色苷合成趋势相吻合。刘晓静[21]和王庆菊等[22]也研究发现,DFR活性变化与花色苷含量呈正相关,说明DFR能够加速花色苷的合成。
花色苷不能直接作为PPO和POD的底物,必须在儿茶酚等酚类物质以及过氧化氢的存在下,花青素才能被PPO和POD降解[23-24]。在蓝莓贮藏过程中对照组和振动组PPO、POD和花色苷-β-糖苷酶活性随贮藏时间逐渐下降,且振动组PPO和POD活性显著高于对照组,说明振动胁迫加速了花色苷降解。Fang等[9]通过研究荔枝果皮中花色苷降解发现,贮藏过程中荔枝果皮POD、PPO和花色苷-β-糖苷酶活性逐渐下降,热酸处理与对照相比显著降低了降解酶活性,保护了荔枝果皮颜色。
花色苷是在植物次生代谢过程中通过苯丙烷代谢和类黄酮合成途径产生,花色苷的生物合成涉及到多种结构基因和调节基因[25]。本实验探究了花色苷合成和降解相关13种结构基因的表达,发现大部分基因表达与相关酶活性变化相对应。在蓝莓贮藏过程中花色苷合成相关VcPAL1、VcPAL2、VcDFR1、VcDFR2、VcCHI1、VcUFGT等结构基因的表达均呈现先上调后下调的趋势,与对照组相比振动胁迫诱导了蓝莓贮藏前期各结构基因表达,从而调控相关酶活性上升,加速贮藏前期花色苷积累。贮藏16 d开始到贮藏结束,振动胁迫组VcPAL1、VcPAL2、VcDFR1、VcDFR2、VcDFR3、VcCHI1、VcCHI2以及VcUFGT等基因表达下调且显著低于对照组,对应相关酶活性下降,花色苷合成减弱。在贮藏过程中花色苷合成相关酶基因表达量变化差异较大则说明VcPAL、VcDFR、VcCHI以及VcUFGT等基因在花色苷合成过程中发挥重要作用,调控花色苷的合成并具有一定的特异性[26-27]。花色苷生物合成相关基因的表达通常需要上游转录因子参与调控[28]。Yang等[29]研究发现,VuCHS、VuDFR、VuUFGT等花色苷合成相关基因的表达,在白色浆果中显著下调,与花青素合成密切相关。Liu等[30]发现,光敏转录因子PybZIPa通过识别G-box基序,结合并激活PyUFGT表达,从而调控梨皮中花青素的积累。
振动胁迫使蓝莓贮藏后期花色苷合成减弱,加速花色苷的降解。目前花色苷降解途径并不明确,但是有研究表明花色苷-β-糖苷酶、PPO和POD这3种酶能够参与花色苷降解,可通过抑制酶活性减少花青素损失[9,31]。我们通过qRT-PCR实验检测了VcPOD1、VcPOD2、VcPOD3、VcPPO1和VcPPO2基因的表达量,结果表明,振动胁迫组VcPOD1、VcPOD2、VcPOD3、VcPPO1基因的相对表达量显著高于对照组,抑制花色苷降解酶POD、PPO活性下降,加速花色苷降解。
4 结论
我们的研究发现,蓝莓果实中有10种花色苷单体,其中锦葵素-3-阿拉伯糖苷含量最高。在蓝莓贮藏前期,振动胁迫加速了花色苷的积累,显著提高了PAL和UFGT活性;而贮藏后期,振动组PAL、CHI、DFR、UFGT活性均显著低于对照组,同时振动胁迫延缓了花色苷降解相关的POD、PPO和花色苷-β-糖苷酶活性的下降。振动胁迫诱导了蓝莓贮藏前期花色苷合成相关基因VcPAL1、VcDFR2、VcCHI1、VcUFGT的表达,提前了基因表达量峰值的到达,在贮藏后期显著下调了花色苷合成相关酶基因的表达;振动胁迫显著促进了蓝莓贮藏过程中花色苷降解相关VcPOD1、VcPOD2、VcPOD3和VcPPO1等的基因表达。

