金属离子对Trichoderma longibrachiatum UN32石斛碱型生物碱产量的影响
秦一彤,余娧凡,钱旭,姚云君,金磊磊,陈集双,2*,虞龙*
1(南京工业大学 生物与制药工程学院,江苏 南京,211800)
2(遵义医科大学,生物资源健康利用研究中心,贵州 遵义,563000)
石斛碱型生物碱(dendrobine-type total alkaloids,DTTAs)是药用植物金钗石斛的特征成分[1],具有降血糖、抗肿瘤、抗白内障等成效[2],结构上属于倍半萜类生物碱[3]。近年,石斛碱医学价值不断提高,金钗石斛产业快速发展,以其制备的中成药年销售额已近40亿元[4]。由于传统获取生物碱的方式具有周期长、技术难以实现或经济性差的缺点,无法满足市场日益增长的需求[5]。大量能够产植物相似活性化合物的内生菌的发现,在天然化合物获得和生物制药中表现出巨大潜力[6]。但是内生真菌中产物表达不稳定现象普遍存在[7],为解决这一问题,前体饲喂、诱导子添加等策略被开发用于提高内生菌次生代谢物产量。除此之外,发酵条件和工艺也是提高产量常考虑的重要因素。
传统上,“单因素(one-factor-at-a-time,OFAT)”是优化发酵参数的常见方法。当涉及多变量时,OFAT易忽略参数间的相互作用,所以部分研究中会采用Plackett-Burman设计、Box-Behnken设计(Box-Behnken design,BBD)[8]和中心组合设计(central composite design,CCD)[9]等统计学方法,结合响应面(response surface methodology,RSM)来说明因变量和自变量之间的联系[10]。目前,利用RSM方法进行优化已大大增加了内生菌中重要代谢物的产量[11]。例如,通过利用RSM制定的最佳培养基培养青霉属H1,紫金草皂苷的产量提高到37.16 mg/L[12]。BEN MEFTEH等[13]在使用RSM优化后,Penicilliumbilaiae分离物TDPEF30的蛋白酶产量增加了1 086倍。
TrichodermalongibrachiatumMD33是本课题组首次分离报道的具有产DTTAs能力的内生真菌[14-15]。通过复合诱变后,获得产量稳定的正突变体T.longibrachiatumUN32,DTTAs产量是出发菌株MD33的2.62 倍[16]。金属离子会对部分酶活性产生影响,从而影响代谢产物的合成[17],而在优化发酵培养基过程中,发现众多金属离子能够提高DTTAs的产量。本研究在前期基础上,拟以Cu2+、Zn2+、Mn2+、K+、Na+、Fe2+、Ca2+和Mg2+共8种金属离子为对象,通过RSM优化,以DTTAs产量为筛选标准,建立UN32发酵最适金属离子体系。
1 材料与方法
1.1 菌株及试剂
T.longibrachiatumUN32是本试验所用菌株,是由T.longibrachiatumMD33菌株经紫外和氮离子束复合诱变,获得稳产DTTAs的正突变株,现保藏于本实验室。
马铃薯,当地永辉超市;葡萄糖、琼脂、邻苯二甲酸氢钾、氢氧化钠、溴甲酚绿、CuSO4、ZnSO4、CoCl2、MnSO4、CaCl2、MgSO4、FeSO4和KCl均为分析纯,国药试剂。
1.2 仪器与设备
PYX-DHS-49X50-BS恒温培养箱,Thermo Fisher Scientific;BXM-110VE立式压力蒸汽灭菌器,博迅医疗生物仪器股份有限公司;BLM-1000超净工作台,苏州净化设备有限公司;GL21M离心机,盐城凯特实验仪器有限公司;Spectrum lab 752S紫外分光光度计,Grant公司;GZX-9070 MBE电热鼓风管干燥箱,上海博讯实业有限公司;QQ-201离心管振荡器,上海启前电子科技有限公司;ZQZY-BG振荡培养箱,上海知楚仪器有限公司。
1.3 培养基、无机盐溶液及生物碱检测相关溶液
a)马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基(g/L):马铃薯200,葡萄糖20,琼脂20,121 ℃高压灭菌20 min后备用。马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基无琼脂加入。
b)无机盐溶液母液:使用蒸馏水配制浓度为0.1 mol/L的CuSO4、ZnSO4、CoCl2、CaCl2、MnSO4、MgSO4、FeSO4、KCl溶液,使用0.22 μm滤头过滤除菌。
c)生物碱检测相关溶液:
邻苯二甲酸氢钾-氢氧化钠缓冲液:分别配制0.2 mol/L的邻苯二甲酸氢钾与氢氧化钠溶液,使用氢氧化钠溶液调节邻苯二甲酸氢钾溶液pH值至4.55。
0.4 g/L溴甲酚绿酸性染料:取0.04 g溴甲酚绿粉末,用100 mL邻苯二甲酸氢钾-氢氧化钠缓冲液溶解。
碱性乙醇溶液:以无水乙醇为溶剂配制0.01 mol/L的氢氧化钠溶液。
1.4 实验方法
1.4.1 菌丝培养及收集
无菌条件下,使用打孔器于活化平板外围挑取直径为1 cm的菌饼,接入装液量为100 mL PDB液体培养基的250 mL锥形瓶中,在120 r/min,28 ℃恒温摇床中振荡培养10 d。
发酵液中的菌体通过抽滤收集,于45 ℃鼓风干燥箱内干燥至恒重,分析天平称重获得菌体干重。
1.4.2 生物碱提取及检测
对传统生物碱提取方法[18]进行步骤改进,将烘干后的菌丝研磨成粉末,称取0.3 g放入试管内,加入30 mL的2%盐酸水溶液进行提取,超声破碎10 min,浸提过夜;取10 mL上清液,加入氨水调节pH值至10,加入10 mL二氯甲烷振荡后进行萃取,取下层进行生物碱含量检测。采用“邻苯二甲酸氢钾-溴甲酚绿”比色法[19]进行生物碱测定。
1.4.3 生物碱标准曲线测定
配制100 μg/mL的标准品溶液,用二氯甲烷稀释到质量浓度分别为0.2、0.5、1.0、3.0、5.0、10、15 μg/mL,然后各取不同浓度对照品溶液5 mL加入3 mL缓冲液和2 mL溴甲酚绿酸性染料,振荡后静置30 min,取下层2.5 mL,加入0.5 mL碱性乙醇溶液,以二氯甲烷作为空白对照,在620 nm波长处测定吸光度作为纵坐标,以标准品溶液浓度作为横坐标进行线性拟合,得到线性回归方程。
1.4.4 OFAT
分别在培养基中加入不同浓度(0.5、1.0、1.5、2.0、2.5 mmol/L)的无机盐溶液,初步探究不同金属离子对生物碱产量的影响。
1.5 响应面设计优化产生物碱培养基
1.5.1 Plackett-Burman试验设计
根据单因素试验结果,确定Cu2+、Mg2+、Mn2+、K+、Fe2+、Zn2+、Na+和Ca2+8种离子的高(1)低(-1)水平,使用软件Design expert 10.0进行Plackett-Burman设计(表1)。每组试验重复3次,最终结果取平均值。根据PB试验结果拟合出方程如公式(1)所示:
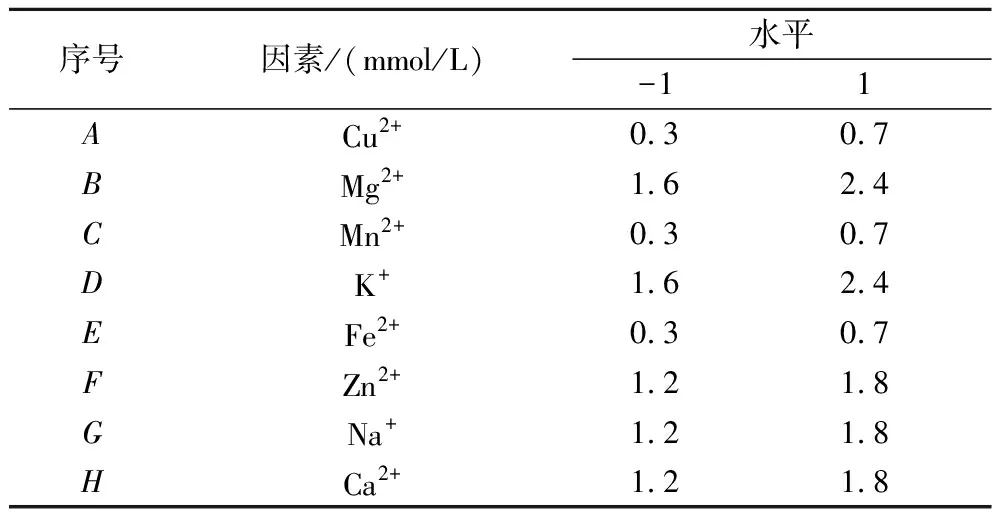
表1 Plackett-Burman设计因素水平
Y=α0+∑αiXi
(1)
式中:Y,响应结果生物碱量;α0、αi,常系数;Xi,试验探究的因素。
1.5.2 金属离子最佳添加时间
金属离子加入的时间也是影响代谢物合成的原因之一[20]。由Plackett-Burman试验结果筛选出了对生物碱产量影响最大的3种金属离子,分别在发酵第0、3、6、9天加入不同浓度的离子,进一步优化加入浓度和时间。
1.5.3 Box-Behnken响应面设计
结合Plackett-Burman试验与最佳加入时间实验结果,得到贡献值最大的3种因素的最优浓度范围,确定每种因素的3个水平(-1、0、1)如表2所示,使用Design expert 10.0设计BBD试验,按照设计每组试验进行3次重复,结果求取平均值。

表2 Box-Behnken设计中各因素的变量水平
将BBD试验得到的结果进行拟合,得到的回归方程如公式(2)所示:
(2)
式中:Y,预测的响应值;Xi和Xj,各独立因素;α0,此模型的截距;αi,线性系数;αii,二次系数;αij,交互作用系数。
2 结果与分析
2.1 生物碱标准曲线
以石斛碱标准品浓度作为横坐标,620 nm处测得的吸光度值为纵坐标进行标准曲线的拟合后,结果得回归方程y=0.100 9x+0.095 6(R2=0.998 0),因为相关系数R2>0.99,说明线性关系良好,可用于后续实验。
2.2 单因素试验结果
各金属离子对生物碱产量的影响如图1所示,当Cu2+、Mn2+和Fe2+浓度为0.5 mmol/L时,Zn2+、Na+和Ca2+浓度为1.5 mmol/L时,Mg2+和K+浓度为2.0 mmol/L时,生物碱的产量最高。将此单因素试验的结果作为Plackett-Burman试验中各因素的中心水平设计试验,用于后续研究。

a-Cu2+;b-Mg2+;c-Mn2+;d-K+;e-Fe2+;f-Zn2+;g-Na+;h-Ca2+
2.3 Plackett-Burman试验结果
根据设计的组合进行Plackett-Burman试验,试验结果见表3,使用软件对结果数据进行分析处理,挑选出了3种贡献度最大的因素:Cu2+、Fe2+和Zn2+进行显著性分析和方差分析,结果见表4。
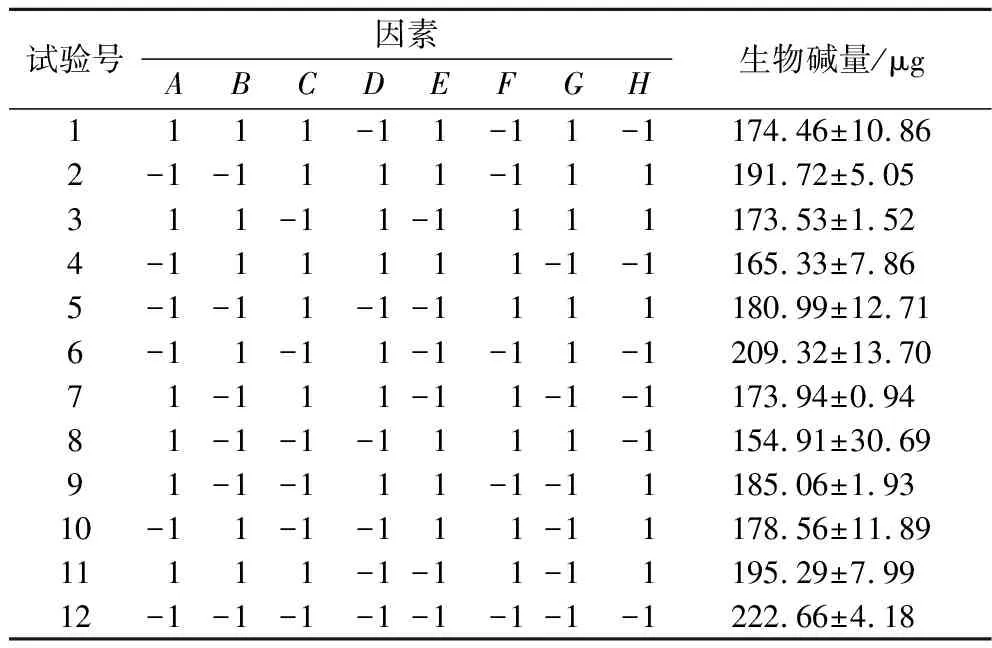
表3 Plackett-Burman试验设计及结果

表4 Plackett-Burman试验显著性分析及方差分析
在设计的高低水平范围中,这几种因素对响应结果影响值的大小顺序为Zn2+>Fe2+>Cu2+>Mn2+>Na+>Mg2+>K+>Ca2+,除Ca2+对响应结果生物碱量为正效应外,其他因素对结果影响都为负效应。各因素中Zn2+贡献度最大,占比有47.84%。由上可知影响UN32生物碱产量最重要的3个因素为Zn2+、Fe2+和Cu2+,对这3个因素与响应结果进行拟合,得到回归方程如公式(3)所示:
生物碱量=279.49-38.08×A-44.03×E-42.02×F
(3)
式中:A,Cu2;E,Fe2+;F,Zn2+。
各因素方差分析结果显示(表4),本次Plackett-Burman试验整体模型P值为0.000 1,说明该模型是极显著的,可以用于后续数据分析,同时由贡献值筛选出的这3种因素的P值分别为0.003 3、0.001 4、0.000 1,均小于0.05,说明这3种因素对于本模型都是显著的,可以有效促进UN32生产生物碱,所以选择这3种因素进行后续的分析。
2.4 金属离子添加浓度和时间优化
金属离子的添加时间是影响真菌代谢的关键因素。上述Plackett-Burman实验中虽发现Cu2+、Fe2+和Zn2+能提高DTTAs产量,对结果的影响呈现负效应,这可能和他们的浓度和添加时间不适相关。因此,对他们的添加浓度和时间进行优化。结果(图2)表明,Cu2+的最佳添加浓度和时间为0.5 mmol/L(第6天添加),生物碱量达到(304.77±12.51) μg;Fe2+的最佳添加浓度和时间为0.4 mmol/L(第6天添加),生物碱量为(275.32±13.15) μg;Zn2+的最佳添加浓度和时间为0.7 mmol/L(第3天添加),生物碱量为(285.16±13.26) μg。

a-Cu2+(A~G代表培养基中Cu2+的浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.7 mmol/L);b-Fe2+(A~G代表培养基中Fe2+的浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.7 mmol/L);c-Zn2+(A~G代表培养基中Zn2+的浓度为0.1、0.3、0.5、0.7、0.9、1.1、1.3 mmol/L)
2.5 Box-Behnken试验结果
根据前期试验结果,确定这3种因素的低(-1)和高(1)水平,使用Design expert 10.0设计BBD试验,共进行17组试验,测定的结果如表5所示,能够看出,每组试验的实际结果与预测的结果是接近的,说明结果可信度较高。
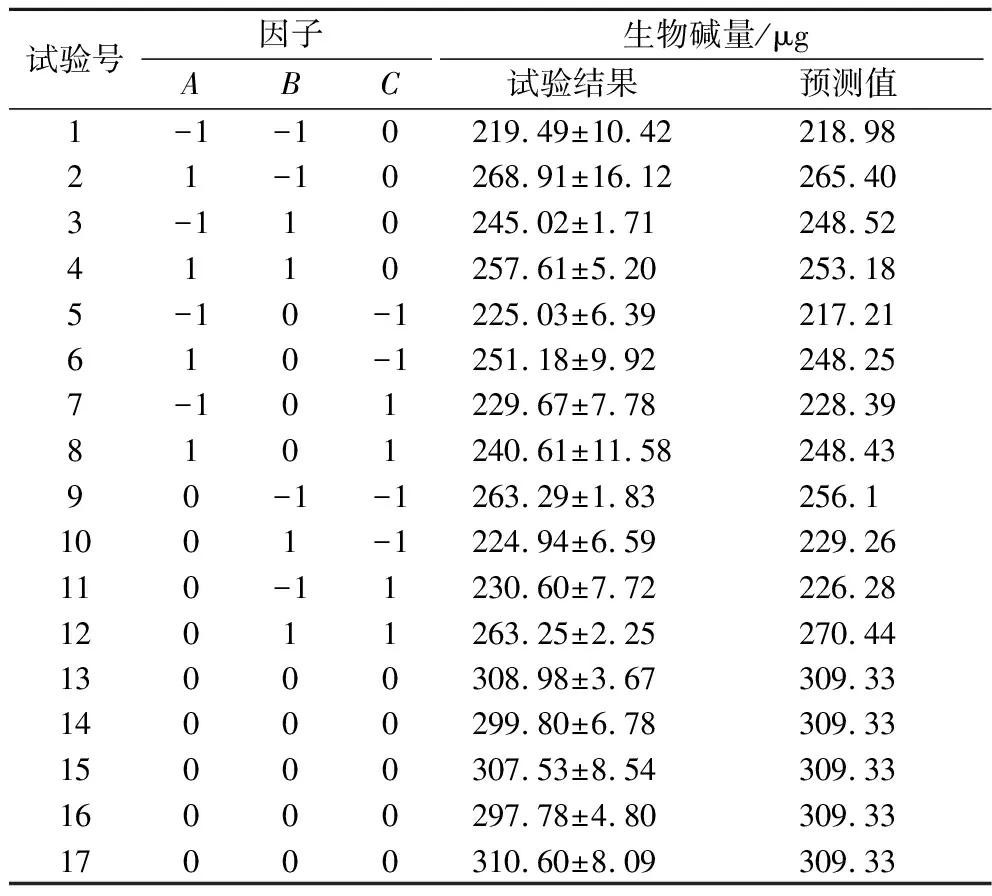
表5 BBD实验设计矩阵及响应预测结果
对模型进行方差分析,由模型拟合得到的回归方程如公式(4)所示:
生物碱量=-197.39+1 033.40×A+337.53×B+545.74×C-153.47×AB-95.07×AC+295.83×BC-826.00×A2-268.26×B2-881.85×C2
(4)
式中:A,Cu2+;B,Zn2+;C,Fe2+。
模型方程的决定系数R2为0.983 6,接近于1,说明此模型的拟合度高,并且预测结果与实际结果之间的相关性好;变异系数为2.40,是指此模型中的数据仅有2.40%与实际的结果不符合;同时AdjR2=0.962 5,PredR2=0.851 1,两者差值小于0.2,信噪比Adeq Precision=17.520>4,这些数值能够表示此模型受到外界因素的干扰较小。
由模型的方差分析结果(表6)可知,此模型的P值<0.000 1,说明是极显著的,能够准确预测响应结果,其他项数值如A、AB、BC、A2、B2、C2的方差检验P值均小于0.05,说明这些参数都是显著的。失态项指的是回归模型得到的预测数值与进行的试验实际结果不相符合的概率,而由分析结果可知本实验拟合的模型失态项P值为0.354 8>0.05,说明是不显著的,表示此模型能够准确预测结果。

表6 Box-Behnken Design试验拟合模型的方差分析
2.6 响应面二维等高线图与三维曲面图分析
使用软件Design expert 10.0在进行响应面分析时,能够生成两两因素与响应结果间的等高线图,其所呈现出来的形状可以一定程度表达出这2个因素之间是否存在着交互关系,若二维图呈圆形则表示关系不显著,椭圆形则表示关系显著。本试验结果拟合的模型绘制出的响应图如图3所示。

a、b-Cu2+和Zn2+对生物碱量交互影响的二维等高线图和三维曲面图;c、d-Cu2+和Fe2+对生物碱量交互影响的二维等高线图和三维曲面图;e、f-Zn2+和Fe2+对生物碱量交互影响的二维等高线图和三维曲面图
图3-a展示了生物碱量随Cu2+和Zn2+浓度变化的二维和三维响应面图,二者交互关系绘制的图是椭圆形,证明其相互作用对响应结果生物碱量产生的作用效果显著。图3-b表示当ZnSO4浓度保持在0.7 mmol/L时,Cu2+和Fe2+浓度与生物碱产量变化的响应面图。Zn2+与Fe2+相互作用的响应面图如图3-c所示,能够看出二者交互关系绘制的图为椭圆形,表示其相互作用对响应结果生物碱量产生的作用效果也是显著的。各图中不同因素对生物碱产量的影响相似,在本模型所选择的取值范围内,生物碱产量先随着两种因素浓度的增加而增加,当响应结果达到最大值后,随着2种因素浓度的增加而减少。
2.7 验证试验
对此模型结果拟合出的回归方程求解,能够得到当预测响应结果生物碱产量达到最大时,这几种因素的浓度取值为:Cu2+0.54 mmol/L,Zn2+0.69 mmol/L,Fe2+0.39 mmol/L。分别使用优化后的培养基与基础发酵培养基对UN32进行液体发酵及平板培养,对菌丝的生物碱产量进行对比。优化后的培养基配方为:马铃薯200 g/L,葡萄糖20 g/L,CuCl20.54 mmol/L,ZnSO40.69 mmol/L,FeSO40.39 mmol/L。
优化后的培养基中发酵UN32,生产的生物碱量为(317.36±6.48) μg,达到了模型预测值(309.33 μg)的102.60%,与预测结果基本一致,比起基础发酵培养的结果[(183.78±7.54) μg],产量提高了72.68%。
3 结论
本试验对真菌发酵培养基所需营养物质无机盐进行优化探究,首先研究了金属离子对UN32产石斛碱的作用。基于单因素试验结果,进行Plackett-Burman试验,发现Zn2+、Cu2+和Fe2+3种金属离子在适当浓度下对石斛碱的生成具有最显著的影响作用。对它们的添加时间和浓度进行进一步研究,发现各离子的最优添加浓度和时间分别为Cu2+0.5 mmol/L(第6天),Fe2+0.4 mmol/L(第6天),Zn2+0.7 mmol/L(第3天)。随后基于BBD和RSM的统计方法,进一步优化Zn2+、Cu2+和Fe2+在石斛碱生产中的相互作用,最终得到当响应结果生物碱量达到最大值,3种离子的浓度分别为Cu2+0.54 mmol/L,Zn2+0.69 mmol/L,Fe2+0.39 mmol/L,优化后的培养基培养UN32的生物碱产量,实验值与预测值之间无显著差异,说明模型拟合程度较高,可以指导内生真菌UN32在液体培养过程中产生石斛碱。试验结果显示,添加金属离子在液体发酵培养UN32产生石斛碱,是未来石斛碱进行大规模工厂生产的有效策略。由于本工作只着重研究了金属离子对石斛碱生产促进作用的组合效应,因此在今后的工作中可以考虑在发酵培养中的碳源,氮源,前体物质等的优化。当然除了发酵培养基的优化外,还可以从UN32的发酵条件如温度、接种量、转速等方面使用响应面法进行优化,或者通过基因编辑等手段进一步提高生物碱产量。

