裂解性噬菌体对肉仔鸡感染肠炎沙门菌的治疗效果
郑 琳,魏炳栋*,滑 峰,陈 龙,丁 媛
(1.吉林省农业科学院 动物营养与饲料研究所,公主岭 136100;2.吉林农业大学生命科学学院,长春 130118)
沙门菌属于肠杆菌科、革兰阴性兼性厌氧菌。目前,已经鉴定的沙门菌属有6个亚种和超过25万种的血清型,其中大多数血清型来自肠炎沙门菌,且血清型的数量每年都在增加[1]。在这些亚种中,除鼠伤寒(Typhimurium)和肠炎(Enteritidis)沙门菌在全球分布外,其余4种具有明显的区域性[2]。家禽是沙门菌最易感的宿主,致病性沙门菌可引起雏鸡大批死亡,成年鸡产蛋率和生产性能下降,但是大多数患病鸡以无症状肠道定植为特征,并不会引发全身性症状,这些隐性感染的沙门菌常以蛋、肉、粪便、污水为媒介,引起人类食源性感染。据世卫组织报道,每年全球有超过9 380万人感染沙门菌,因此而死亡的人数达到15.5万[3]。环丙沙星、左氧氟沙星等喹诺酮类及头孢类抗生素是治疗沙门菌感染的一线用药。但是,随着抗生素的大量使用或滥用,引起的多重耐药愈发严重。Gong等[4]统计了我国东部地区从1962至2010年沙门菌的耐药情况,1962—1968年耐药率仅为9.4%,到70年代和80年代,耐药率分别为64.6%和78.7%,到了1990至2010年,耐药率已高达96.6%,尤其对头孢羟唑、甲氧苄啶耐药性尤为突出。2019年7月10日,农业农村部发布194号公告,自2020年7月1日起,饲料生产企业停止生产含有促生长类药物饲料添加剂(中草药除外)的商品饲料,我国饲料业正式迈入“无抗时代”。因此,研发安全、高效的抗生素替代品是保障动物源食品安全、提高养殖业水平,以及促进社会发展的必然需求。
噬菌体是一类能够感染细菌、真菌、放线菌或螺旋体等微生物的总称。噬菌体也是目前自然界数量最为丰富、最具多样性的微生物,据估算,噬菌体的总量可达1031~1032,每种细菌细胞则有大约10种噬菌体颗粒[5]。在多重耐药菌日益严重的今天,噬菌体作为对抗细菌感染的利器,不仅应用于人类疾病中,而且还广泛应用到动物、食品及饲料中病原菌的清除、细菌生物被膜的裂解等方面[6]。噬菌体在防控家禽肠炎沙门菌感染方面相关研究较多,但大多数研究集中于防控鸡肉、鸡蛋等的沙门菌感染,有关养殖环境中对雏鸡沙门菌感染的防治研究相对较少。王曦等[7]通过粪菌移植结合噬菌体的疗法,降低了雏鸡沙门菌感染导致的死亡,减少了沙门菌在雏鸡肠道内的定植,提高雏鸡免疫水平。宋新慧等[8]研究发现,噬菌体可有效降低沙门菌感染雏鸡的死亡率。Nabil等[9]和Wong等[10]研究也表明,噬菌体可有效降低鸡肠道中沙门菌的定植,但有关噬菌体对沙门菌感染雏鸡肠道免疫的相关研究甚少。本课题组经过大量前期试验发现,噬菌体的给药剂型对沙门菌感染仔鸡的防控效果有显著的差异,前人研究多以灌服方式给予治疗,本研究以肠炎沙门菌为宿主菌,分离筛选具有高稳定性和裂解活性的噬菌体S13-21,建立肉仔鸡肠炎沙门菌感染模型,采用腹腔注射方式探究噬菌体对雏鸡感染肠炎沙门菌的治疗作用,评估噬菌体在防控雏鸡沙门菌感染中的应用潜力。
1 材料与方法
1.1 试验材料
裂解性噬菌体S13-21由吉林省农业科学院动物营养与饲料研究所分离并保藏;肠炎沙门菌购自国家兽医微生物菌(毒)种保藏中心(菌种编号:CVCC 3378),由吉林省农业科学院动物营养与饲料研究所保藏;抗生素选用硫酸庆大霉素,购自九江礼涞科技集团有限公司。SS固体培养基购自青岛海博生物技术有限公司,胰蛋白胨、酵母浸粉、氯化钠、琼脂粉、PBS磷酸盐干粉购自北京索莱宝科技有限公司。
1.2 培养基配制
SS固体培养基:称取本品63.53 g,溶解于1 000 mL蒸馏水中,加热煮至沸,不必高压蒸汽灭菌,冷却至45~50 ℃倒成平板。
LB液体培养基:胰蛋白胨10 g,酵母浸粉5 g,NaCl 10 g,溶解于蒸馏水中,用5 mol·L-1NaOH调pH至7.0,用蒸馏水定容至1 L,121 ℃高压灭菌20 min。
LB固体培养基:在LB液体培养基中加入占总体积1.5%的琼脂粉,灭菌后冷却至45~50 ℃倒成平板。
LB半固体培养基:在LB液体培养基中加入占总体积0.7%的琼脂粉,灭菌后冷却至45~50 ℃倒成平板。
PBS:用蒸馏水溶解,定容至2 L,4 ℃保存。
1.3 攻毒用沙门菌菌液配制
在无菌条件下将沙门菌划线接种于SS固体培养基中,37 ℃培养24 h,挑取单一菌落接种于5 mL LB液体培养基中,37 ℃、180 r·min-1摇床培养至对数期(5 h)获得新鲜菌液,将所得菌液以1%的接种量接种于200 mL LB液体培养基中,37 ℃、180 r·min-1摇床培养至对数期(5 h),将所得菌液离心后收集菌体,用PBS洗涤、浓缩菌体,充分震荡混匀进行10倍梯度稀释后用于菌落计数。将已知浓度的浓缩菌液稀释至攻毒浓度(LD50)备用。
1.4 治疗用噬菌体配制
挑取已纯化好的噬菌斑于1 mL PBS中,4 ℃静置1 h,12 000 r·min-1离心7 min,吸取上清液800 μL经0.22 μm滤膜过滤后加入5 mL LB中,每管加入100 μL宿主菌菌液,37 ℃、180 r·min-1摇床培养,观察培养液澄清度,以宿主菌菌液为对照。将澄清培养液12 000 r·min-1离心7 min,经0.22 μm滤膜过滤后分装于5 mL LB中,每管加入100 μL宿主菌菌液,800 μL噬菌体原液继续扩增培养,观察培养液澄清度,以宿主菌菌液为对照。将澄清培养液12 000 r·min-1离心7 min,经0.22 μm滤膜过滤后分装于4 mL离心管中,4 ℃冰箱保存备用。配制200 mL LB液体培养基,加入1 mL宿主菌液,37 ℃、180 r·min-1摇床培养1.5 h,加入8 mL噬菌体原液,继续培养至溶液澄清后8 000 r·min-1离心10 min,分装于50 mL离心管中,4 ℃备用。经点滴法检验,无沙门菌生长。
1.5 试验设计及饲养管理
选用1日龄AA肉仔鸡72只,饲养至4日龄随机分为4组,每组6个重复,每个重复3只鸡,即空白对照组(C)、沙门菌感染组(S)、噬菌体治疗组(S+P)和抗生素治疗组(S+A)。各组饲喂基础饲粮,试验期12 d,治疗期7 d,观察期5 d。基础饲粮参照中华人民共和国农业行业标准《鸡饲养标准》(NY/T 33—2004)配制,饲养试验在吉林省农业科学院动物营养与饲料研究所试验场进行,试验动物自由采食,充足饮水。
1.6 试验流程
于4日龄采用腹腔注射攻毒的方式对S组、S+P组和S+A组肉仔鸡进行沙门菌感染,攻毒剂量为200 μL·只-1(1.0×109CFU·mL-1)。6 h后对S+P组和S+A组肉仔鸡进行治疗,按腹腔注射方式噬菌体剂量1 mL·只-1(1.0×1012PFU·mL-1),抗生素200 μL·只-1(硫酸庆大霉素,800 IU·只-1),连续治疗7 d,间隔12 h,治疗结束后第5天每组随机选取6只肉仔鸡经颈动脉放血致死,采集血液,分离血清,并对其进行无菌剖检,采集肝、胸腺、脾、法氏囊及肠道组织和内容物样本,用于后续指标检测。
1.7 检测指标与方法
1.7.1 存活率和终末体重 试验期间,每日观察鸡只健康情况,记录死亡数。试验结束时,以重复为单位,进行空腹称重。
存活率(%)=(每组肉仔鸡总数-死亡数)/每组肉仔鸡总数×100。
1.7.2 免疫器官重和器官指数 屠宰后,称取胸腺、脾、法氏囊重量,并计算免疫器官指数,公式如下:
器官指数(%)=器官鲜重(g)/活重(g)×100。
1.7.3 肠道载菌量
1.7.3.1 引物设计与合成:根据已发表文献中肠道微生物基因序列,由生工生物工程(上海)有限公司合成,其序列分别如下:
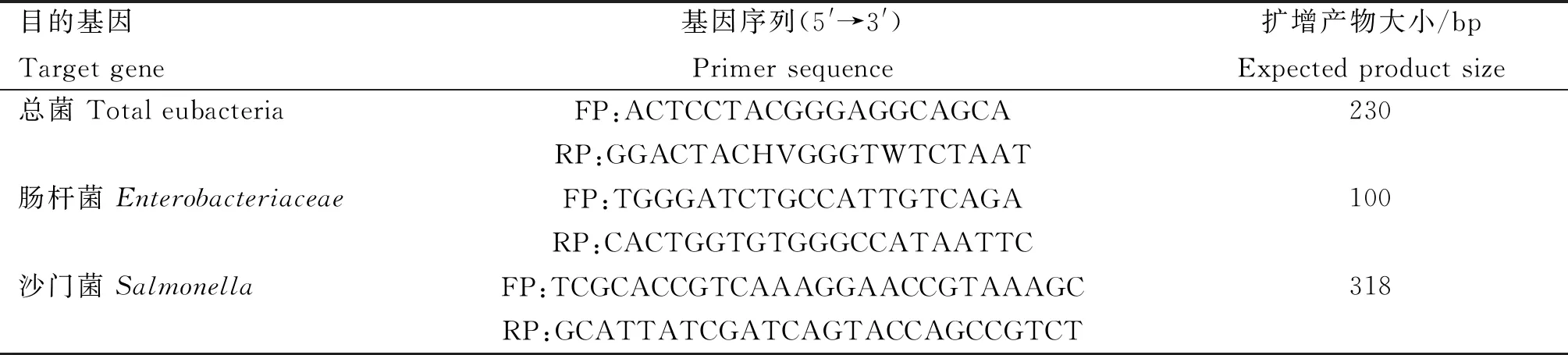
表1 肠道微生物扩增目的基因的引物序列
1.7.3.2 DNA模板制备:DNA采用粪便基因组DNA提取试剂盒(TIANamp Stool DNA Kit: TIANGEN)提取空肠、回肠和盲肠内容物,试验操作步骤严格按照试剂盒说明书进行。
1.7.3.3 PCR扩增:PCR反应体系:ddH2O 10 μL,2×Green qPCRMix 12 μL,上、下游引物各1 μL,cDNA模板1 μL,总体积25 uL。
PCR反应程序:95 ℃预变性2 min;95 ℃变性15 s,55 ℃~68 ℃延伸20~60 s,进行35~45个循环;45 ℃降温20 s;45 ℃~90 ℃熔解曲线。延伸和熔解曲线要选荧光定量。PCR延伸温度可根据引物的Tm值和GC含量设定。取5 μL PCR产物经2%琼脂糖凝胶电泳进行成像。
1.7.3.4 标准曲线的制作及结果处理:使用试剂盒(E.Z.N.A. Cycle-Pure OMEGA,美国)纯化PCR产物,试验操作步骤严格按照试剂盒说明书进行,纯化后的产物经上海宏石SLAN-96P PCR仪测定浓度。采用ΔΔCT法对试验结果进行处理,计算公式如下:
A=CT(目的基因,待测样本)-CT(内标基因,待测样本);
B=CT(目的基因,对照样本)-CT(内标基因,对照样本);
K=A-B;
表达倍数=2-K。
将标准品按比例稀释,将已知标准曲线浓度的lg为X轴,以Ct值为纵坐标,绘制标准曲线。再以待测样品的Ct值从标准曲线上推算出样品浓度的log值。
1.7.4 血清、肝及肠道噬菌体载量 准确称取组织及肠道内容物样品0.1 g,加入0.9 mL生理盐水制成匀浆,吸取0.1 mL组织匀浆或血清,梯度稀释,每个样品稀释梯度取100 μL加入250 μL宿主菌(对数期),37 ℃孵育20 min,采用双层平板法测定噬菌体载量,每个样品做3个平行。
1.7.5 血清及组织抗氧化指标 测定血清与肝、肠道组织匀浆中丙二醛(MDA)含量以及总超氧化歧化酶(T-SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性,试剂盒购自南京建成生物工程研究所,按说明书方法测定,并用考马斯亮蓝法定量组织匀浆中蛋白质含量。
1.7.6 血清及组织细胞因子和免疫球蛋白指标 采用酶联免疫法(ELISA)测定血清与肠道组织匀浆中分泌型免疫球蛋白A(sIgA)、肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)及白细胞介素6(IL-6)含量,试剂盒购自北京华英生物,按照说明书操作。
1.8 统计分析
试验数据先用Excel 2016初步处理后,用SPSS 22.0统计软件进行单因素方差分析(one-way ANOVA),Duncan氏法进行多重比较。试验结果以“平均值±标准差”表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 噬菌体对感染沙门菌肉仔鸡存活率的影响
由图1中可以看出,肉仔鸡感染肠炎沙门菌死亡率很高,攻毒后第1天,S组存活率下降至77%,第2天下降至64%,第5天时存活率仅为59%;经噬菌体和抗生素治疗后,存活率大幅提高,与S组相比,存活率提高25%以上,但是S+P组的存活率较S+A组低6%~12%。
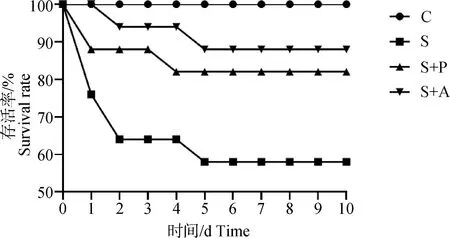
C. 空白对照组;S. 沙门菌感染组;S+P. 噬菌体治疗组;S+A. 抗生素治疗组。下同C. Blank control group; S. Salmonella infection group; S+P. Phage treatment group; S+A. Antibiotic treatment group. The same as below
2.2 噬菌体对感染沙门菌肉仔鸡体重的影响
由图2可以看出,肉仔鸡感染肠炎沙门菌对体重产生极显著影响,S组体重极显著低于C组、S+P组和S+A组(P<0.01),经噬菌体和抗生素治疗后能够一定程度上恢复生长,但是较C组体重低6%~7%,且S+P组与S+A组差异不显著(P>0.05)。
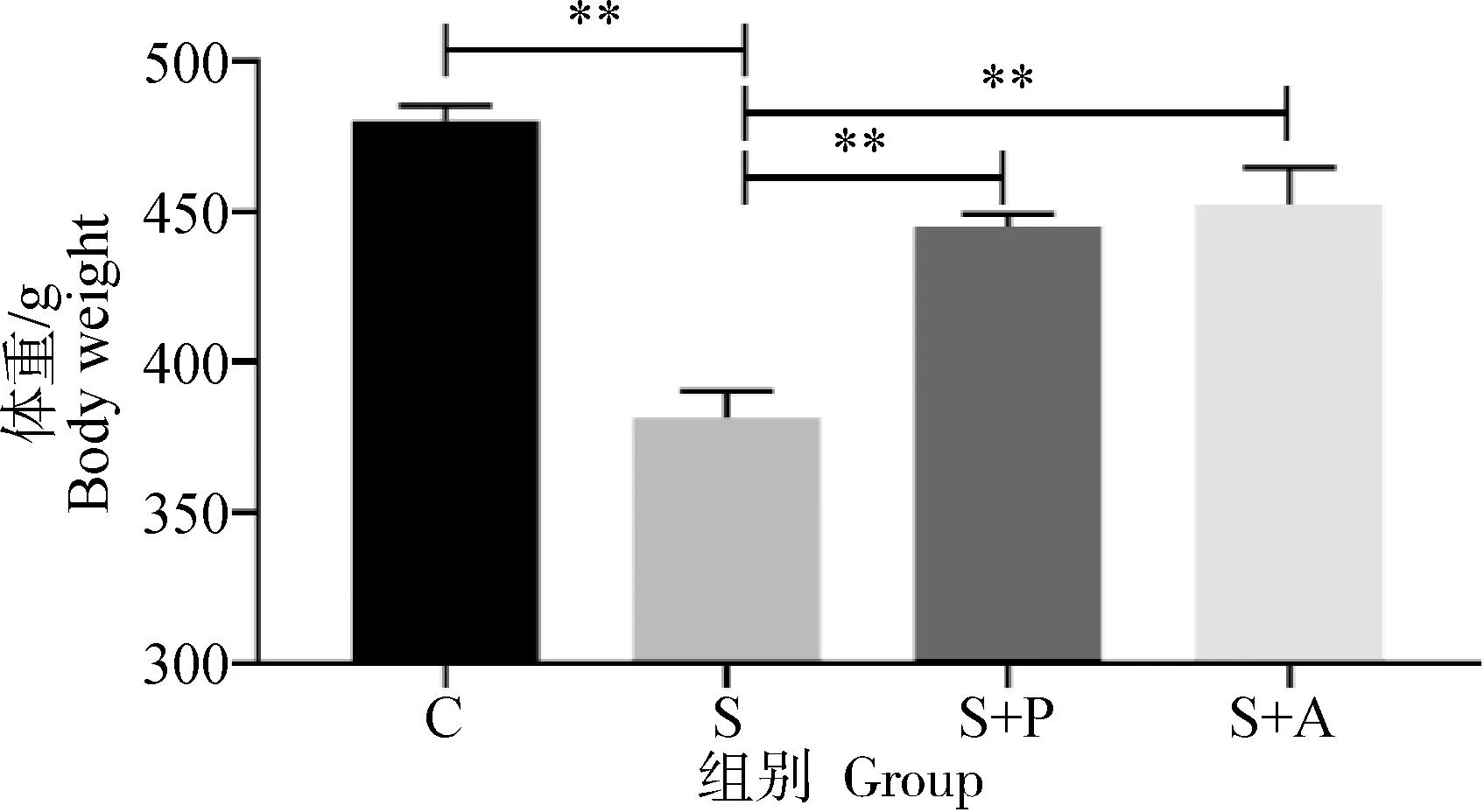
“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。下同"*" indicates significant difference (P<0.05), and "**" indicates extremely significant difference (P<0.01). The same as below
2.3 噬菌体对感染沙门菌肉仔鸡免疫器官的影响
由表2可知,沙门菌攻毒后可使脾重量增加,与C组相比S组脾的重量差异不显著(P>0.05),S+P组和S+A组均极显著高于C组(P<0.01),但与S组差异不显著(P>0.05);胸腺、法氏囊重及免疫器官指数各组间差异均不显著(P>0.05)。
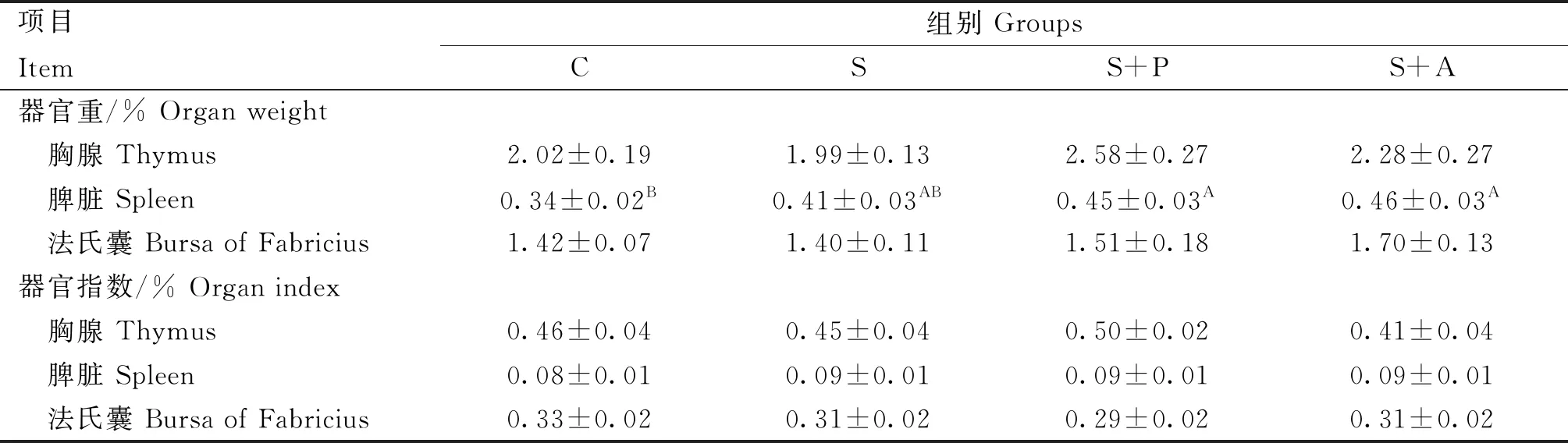
表2 噬菌体对感染沙门菌肉仔鸡免疫器官的影响
2.4 噬菌体对感染沙门菌肉仔鸡肠道菌群的影响
由表3可知,在空肠中,攻毒后可极显著提高S组和S+A组总菌数(P<0.01),以及S组、S+P组和S+A组肠杆菌数(P<0.01),但是并未检测出沙门菌,噬菌体和抗生素治疗后,总菌落数和肠杆菌数与S组差异不显著(P>0.05);在回肠中,攻毒后总菌数极显著降低(P<0.01),沙门菌数极显著升高(P<0.01),与S组相比,S+P组和S+A组极显著的降低了沙门菌数量(P<0.01),并且抗生素的杀菌效果(减少3.26 lgCFU·kg-1)要极显著强于噬菌体(减少2.25 lgCFU·kg-1)(P<0.01);在攻毒后极显著地提高了盲肠中总菌落和沙门菌数量(P<0.01),但是与C组相比,S+A组的总菌落数极显著降低(P<0.01),与S组相比,噬菌体和抗生素治疗后能够极显著降低沙门菌数量(P<0.01),且S+P组与S+A组治疗效果相似(P>0.05)。
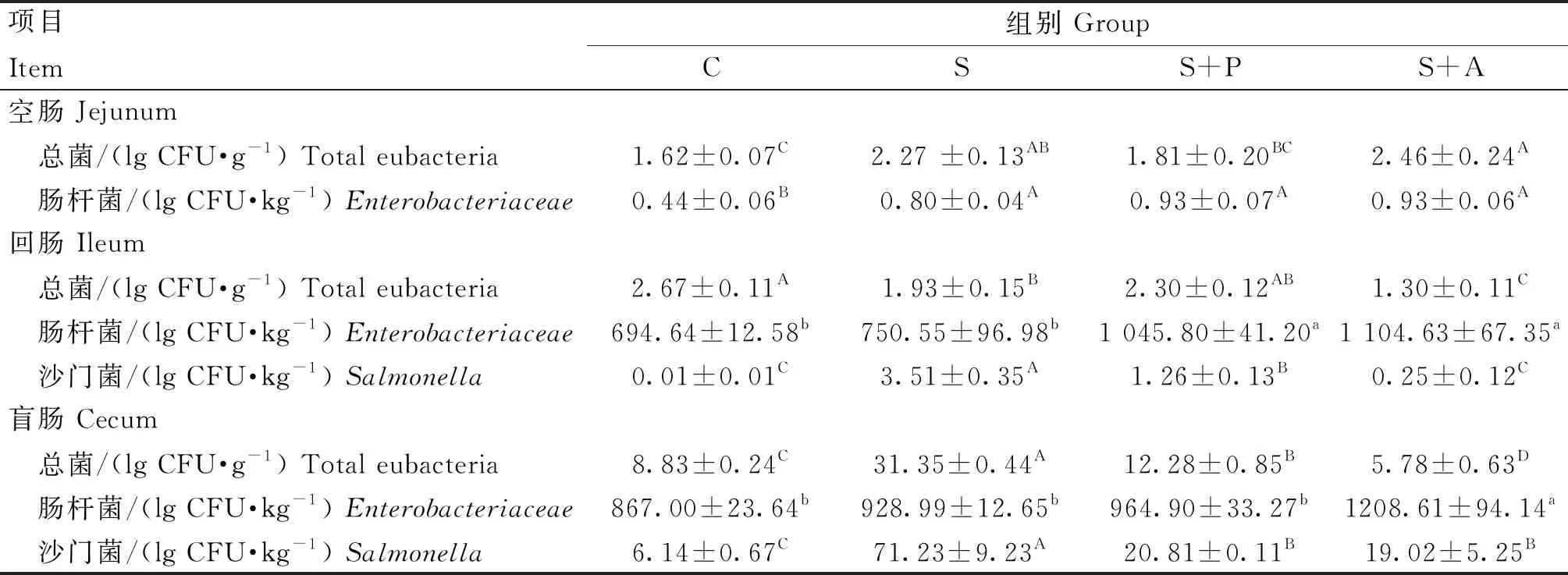
表3 噬菌体对感染沙门菌肉仔鸡肠道菌群的影响
2.5 噬菌体对感染沙门菌肉仔鸡血清及组织噬菌体载量的影响
由图3可知,在血清和肝中S+P和S+A组的噬菌体效价极显著高于C组和S组(P<0.01),且S+P组噬菌体显著高于S+A组(P<0.05);由图4可知,在肠道中,S+P组噬菌体效价显著(P<0.05)或极显著(P<0.01)高于其余三组,而且消化道后端的噬菌体效价高于前端。
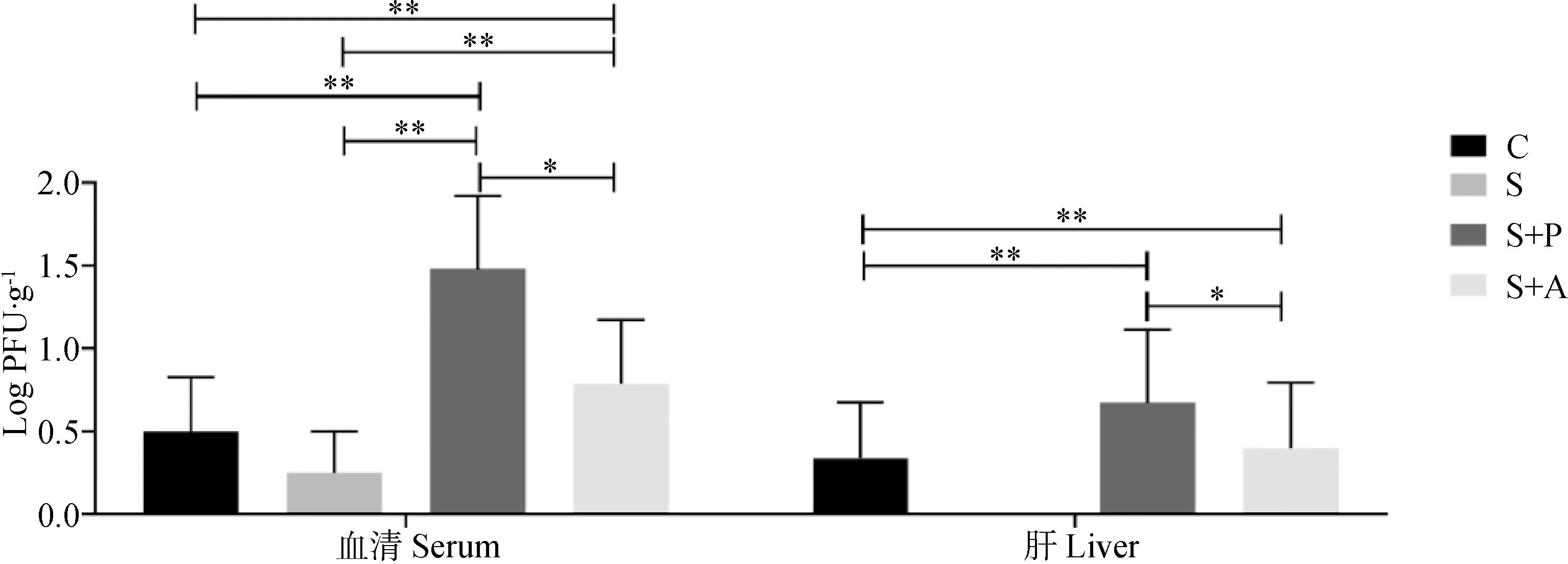
图3 噬菌体对感染沙门菌肉仔鸡血清和肝中沙门菌噬菌体载量的影响Fig.3 Effects of phage on phage burden in blood and liver of chickens infected with Salmonella enteritidis

图4 噬菌体对感染沙门菌肉仔鸡肠道中沙门菌噬菌体载量的影响Fig.4 Effects of phage on phage burden in intestinal tract of chickens infected with Salmonella enteritidis
2.6 噬菌体对感染沙门菌肉仔鸡抗氧化指标的影响
由表4可知,肉仔鸡感染沙门菌对血清、肝及肠道抗氧化能力有极大的影响。在血清中,与C组相比,S组、S+P组和S+A组T-SOD和GSH-Px活性极显著降低(P<0.01),且MDA含量极显著升高(P<0.01);在肝中,S组和S+P组T-SOD和GSH-Px活性极显著低于C组(P<0.01),且MDA含量极显著高于C组(P<0.01),但是S+A组抗氧化指标与C组差异不显著(P>0.05);在空肠中,S组T-SOD活性极显著低于其他三组(P<0.01),而MDA含量极显著高于其他组(P<0.01),且其余各组间差异不显著(P>0.05),S组和S+P组GSH-Px活性极显著低于C组(P<0.01),且S组极显著低于S+A组(P<0.01),但是S+A组GSH-Px活性与C组和S+P组差异均不显著(P>0.05);同样,在回肠中S组、S+P组和S+A组T-SOD和GSH-Px活性极显著低于C组(P<0.01),S组和S+P组MDA含量极显著高于C组(P<0.01),而S+A组与C组差异不显著(P>0.05),且S+P组和S+A组差异也不显著(P>0.05)。
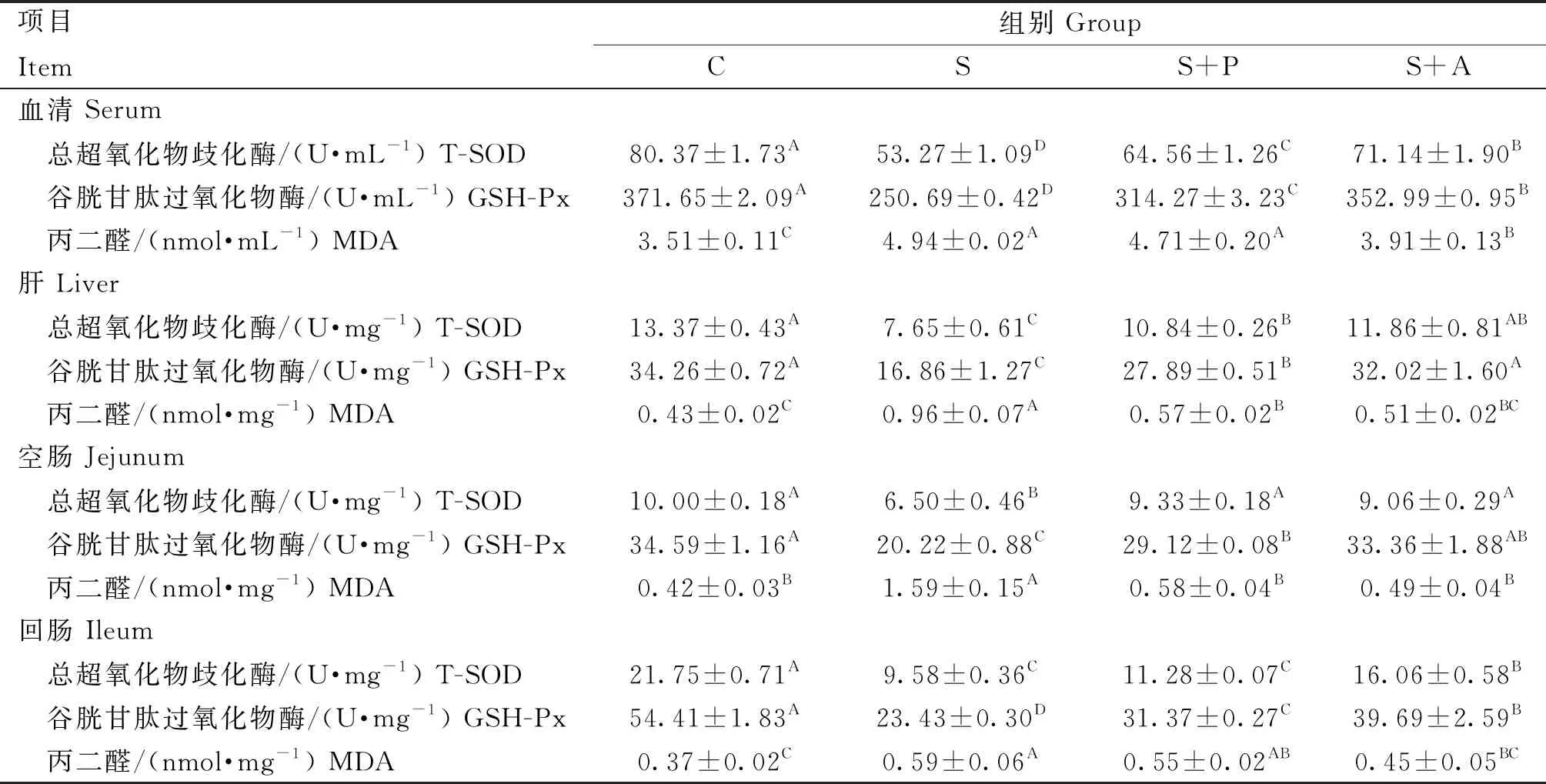
表4 噬菌体对感染沙门菌肉仔鸡抗氧化指标的影响
2.7 噬菌体对感染沙门菌肉仔鸡细胞因子和免疫球蛋白含量的影响
由表5可知,肉仔鸡感染沙门菌对细胞因子和免疫球蛋白影响较大。在血清中,S组、S+P组和S+A组TNF-α、IFN-γ和IL-6细胞因子含量极显著高于C组(P<0.01),治疗后S+P组和S+A组的细胞因子含量极显著低于S组(P<0.01),且S+P组极显著高于S+A组(P<0.01);在空肠中,S组sIgA含量最低,且显著低于S+P组(P<0.05),其余三组间差异不显著(P>0.05),与C组相比,除S+A组IL-6含量差异不显著(P>0.05)外,其余各组TNF-α、IFN-γ和IL-6细胞因子含量极显著升高(P<0.01),且S+P组TNF-α和IFN-γ含量极显著高于S+A组(P<0.01);同样,在回肠中S组sIgA含量最低,且极显著低于S+P组和S+A组(P<0.01),且S+P组极显著高于C组(P<0.01),S+A组与C组差异不显著(P>0.05),S组TNF-α、IFN-γ和IL-6细胞因子极显著高于C组(P<0.01),治疗后,与S组相比,S+A组TNF-α以及S+P组IFN-γ和IL-6含量极显著降低(P<0.01),且S+P组和S+A组差异不显著(P>0.05)。
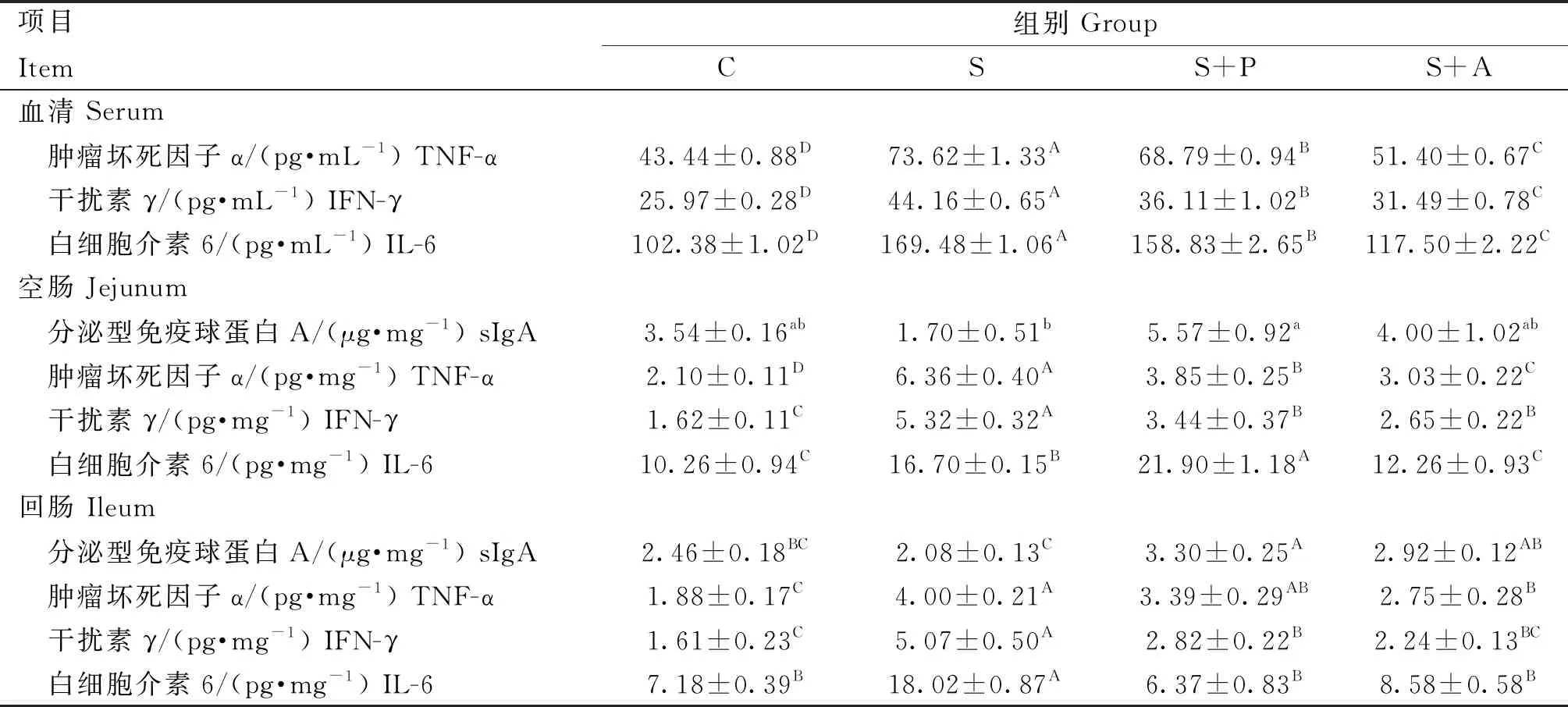
表5 噬菌体对感染沙门菌肉仔鸡细胞因子和免疫球蛋白含量的影响
3 讨 论
3.1 噬菌体对感染沙门菌肉仔鸡存活率和体重的影响
由于雏鸡消化道和免疫功能尚未发育完全,因此雏鸡是肠炎沙门菌的易感宿主,尤其对1~3日龄的雏鸡毒力极高,死亡率也很高,对成年鸡的感染大多以症状不明显的隐性感染为主[11]。目前,已有大量的研究表明[12-15],肉仔鸡感染沙门菌后,死亡率增加且生长性能大幅下降。在本研究中,攻毒后第1天,攻毒组存活率下降至77%,第2天下降至64%,第5天时存活率仅为59%,此后死亡率没有大幅变化,这也进一步说明,肠炎沙门菌对1~5日龄雏鸡毒力极大。目前,关于噬菌体治疗沙门菌感染肉仔鸡的效果大多为积极的结果。Tie等[16]研究表明,随着噬菌体治疗剂量的增加,肉仔鸡存活率也明显呈现出剂量依赖性,口服噬菌体效价1010PFU·mL-180 μL的存活率显著高于攻毒组,说明噬菌体对沙门菌感染具有较好的治疗作用,但是其存活率略低于呋喃唑酮组;在Berchieri等[17]的研究中,效价为1010PFU·mL-1的噬菌体组死亡率显著低于攻毒组,但是稀释100或10 000倍后,死亡率与攻毒组差异不显著,说明噬菌体在体内发挥作用需要一定的效价保证;Toro等[18]研究指出,肠炎沙门菌攻毒后肉仔鸡生长性能显著降低,在整个试验期都保持较低的体重,噬菌体治疗后体重有不同程度恢复,18日龄时,噬菌体组体重较攻毒组提高15.3%。本研究中肉仔鸡经噬菌体治疗后,存活率大幅提高,与攻毒组相比,存活率提高25%以上。同样,沙门菌感染极大地影响了肉仔鸡的生长性能,攻毒组体重极显著低于对照组、噬菌体组和抗生素组,经治疗后能够在一定程度上恢复生长,但是较对照组体重低6%~7%,且噬菌体治疗组与抗生素组差异不显著,这也说明了噬菌体对宿主菌感染有较强的治疗作用,在生存率和恢复生长方面与抗生素作用相当。
3.2 噬菌体对感染沙门菌肉仔鸡免疫器官的影响
家禽免疫器官指数是反映免疫器官生长发育状况的重要指标,指数的高低在一定程度上可以反映出机体的免疫防御功能。脾是禽类最大的外周免疫器官,是淋巴细胞定居和对抗原刺激进行免疫应答的场所,含有树突状细胞、B淋巴细胞、巨噬细胞和浆细胞等,具有较强的吞噬和过滤作用;胸腺是家禽的中枢免疫器官,淋巴干细胞进入胸腺后在胸腺肽的诱导下,发育分化为成熟的T细胞,家禽性成熟后,胸腺逐渐退化;法氏囊是禽类特有的免疫器官,来自骨髓的干细胞在法氏囊囊素的诱导下分化为成熟的B细胞,家禽性成熟后,法氏囊逐渐退化[19]。本研究中,肉仔鸡沙门菌感染后可导致脾重量增加,指数升高,但是对法氏囊和胸腺没有显著影响,经噬菌体和抗生素治疗后,脾重量和指数改善不明显,与攻毒组差异不显著。目前已有研究表明,雏鸡[20]、雏鸭[21]和小鼠[22]感染沙门菌可导致脾肿大,脾脏指数升高,这与本试验研究结果相一致。
3.3 噬菌体对感染沙门菌肉仔鸡肠道菌群的影响
肠道菌群包括黏膜菌群和肠腔菌群,黏膜菌群以乳酸菌和双歧杆菌为主,肠腔菌群大多以大肠杆菌和肠球菌为优势菌群,肠腔菌群黏附在肠黏膜上,形成了多层次的肠道微生物屏障[23]。机体在健康状态下,肠道微生物的数量、种类和分布相对稳定,但是易受饲料、环境、病原体、免疫、应激等因素的影响,导致肠道菌群失调、功能紊乱,在临床上表现为生长缓慢、腹泻、免疫力低下等,给畜禽生产造成极大地损失。进入肠道的沙门菌在远端空肠、回肠和大肠侵入肠黏膜,首先穿越肠上皮屏障,引发机体免疫反应,刺激吞噬细胞增殖,沙门菌在吞噬细胞内大量繁殖,诱导吞噬细胞凋亡或坏死,最后通过血液达到全身各个组织器官。本试验中,肉仔鸡感染肠炎沙门菌后,各肠段总菌数、肠杆菌数和沙门菌数极显著增加,但是在空肠中并未检出沙门菌,这可能是由于空肠中沙门菌定植量低。噬菌体治疗沙门菌感染的效果受攻毒后给药时间、噬菌体效价及疗程等多方面的影响。沙门菌攻毒后噬菌体干预越早,治疗效果就越好。Toro等[18]用沙门菌攻毒4 h后采用噬菌体鸡尾酒疗法,能够极显著降低肉鸡小肠、盲肠和脾的沙门菌载量;同样,在Atterbury等[24]的研究中,沙门菌攻毒24 h内采用噬菌体治疗,能够极显著降低肉鸡盲肠中沙门菌数量;Bardina等[25]对沙门菌感染后第4或5天雏鸡采用噬菌体鸡尾酒疗法,每天按1010PFU·只-1口服两次,连续治疗2 d,结果表明,当沙门菌在肠道定植后再用噬菌体治疗,肠道沙门菌数量并没有显著降低。在本研究中,攻毒6 h后就采用噬菌体干预,能够极显著降低回肠和盲肠中沙门菌数量,抗生素组的各肠段载菌量趋势与噬菌体组基本一致,但是总菌数极显著低于噬菌体组,且回肠沙门菌数极显著低于噬菌体组,但是盲肠中沙门菌数与噬菌体组差异不显著。这也进一步说明,噬菌体宿主专一性强,对其有较强的杀菌能力且作用与抗生素相当,而抗生素抗菌谱广,对总菌落数有显著影响,在杀灭有害菌的同时对其他菌也有影响。
3.4 噬菌体对感染沙门菌肉仔鸡血清及组织噬菌体载量的影响
噬菌体效价浓度同样也影响着治疗效果。目前,大多数噬菌体治疗成功的动物模型均采用了较高的噬菌体/致病菌比例(较高的感染复数MOI),效价浓度要高于致病菌浓度,尽管在理论上噬菌体的增殖是按照指数式增长(200n/20 min),因而可以使用较小剂量进行治疗,但是足够多的噬菌体是有效治疗全身性细菌感染的保证[26]。Atterbury等[24]用浓度为3×103CFU·只-1肠炎沙门菌攻毒,1 h后用109PFU·只-1治疗,能够极显著降低肉鸡盲肠中沙门菌数量;同样在Andreatti Filho等[27]、Waseh等[28]研究中,也得到了相类似的结果。本研究中,肠炎沙门菌攻毒浓度为109CFU·mL-1,噬菌体的效价为1012PFU·mL-1,与上述研究结果相一致。
为保证噬菌体治疗效果,除了以致病菌为宿主分离筛选出具有高裂解活性的噬菌体外,给药形式对其效果的发挥也起着关键作用。目前,常用的噬菌体给药途径一般为口服和非消化道途径(皮下注射、肌肉注射等),随着噬菌体治疗细菌性感染应用的进一步广泛,一些新型的给药方式如局部表面、喷雾、口腔、介入等相继出现[29]。口服给药是噬菌体治疗胃肠道细菌性感染的有效途径,但是易受胃酸、胆汁酸、消化酶以及肠道菌群的影响而失活,治疗效果不易控制[30]。注射方式操作简单,治疗效果好,是目前最常用的噬菌体给药方式。Mcvay等[31]比较了肌肉注射、皮下注射和腹腔注射噬菌体对绿脓杆菌感染小鼠的保护作用,结果表明,与对照组(存活率6%)相比,这三种治疗方式均能显著提高小鼠的存活率,其中腹腔注射的存活率可达87%,而肌肉注射和皮下注射的存活率分别为28%和22%,其主要原因可能是由于腹腔注射方式给药剂量更高,时间更早,更持久,能够持续地传递到血液、脾和肝中。因此,本研究采用腹腔注射的方式,按剂量1 mL·只-1(1012PFU·mL-1),连续治疗7 d,间隔12 h。
注射是噬菌体最有效的给药方式之一,可通过血液循环到达包括神经中枢在内的所有器官与组织。注射噬菌体不仅有效,而且传递速度很快,有研究表明,噬菌体在1 h内(最短仅需要5 min)就可以达到体内循环[32]。与皮下注射和肌肉注射相比,腹腔注射噬菌体到达血液的时间更快,血液中噬菌体的滴度更高[33]。进入血液循环的噬菌体浓度很大程度上受给药剂量的影响,呈现出很强的剂量依赖关系[34]。在早期的研究结果中[35],静脉注射噬菌体2.5 min后,兔血液中实际噬菌体滴度比通过血液容积计算的理论噬菌体滴度低了100倍;同样,小鼠静脉注射噬菌体1~5 min和0.5 h后血液噬菌体理论滴度分别为0.4和0.068,但是实际滴度仅为0.02和0.003[36]。其主要原因在于,噬菌体进入体循环后,不仅受到血液容积的影响会被体液稀释,还会被网状内皮细胞捕获或吞噬[37]。肝和脾是噬菌体聚集的主要场所,在数分钟内就可达到,1~3 h就可达到滴度高峰[38],尤其是脾,是噬菌体存活最长的器官,甚至给药多天后仍能检测出噬菌体的存在。本研究中噬菌体治疗采用腹腔注射,每天2次,连续7 d,在血液和肝中均能检测出噬菌体,且噬菌体效价极显著高于其他组,这与上述研究结果基本一致,但是肝中噬菌体效价低于血液,这可能是受采样先后顺序的影响。目前,关于噬菌体在消化道分布的研究集中在口服给药方面,注射途径的研究较少。Smith和Huggins[39]研究指出,口服噬菌体在肠淋巴结中聚集,而在血液和脾中滴度很低,这也表明肠淋巴结是导致不同给药途径噬菌体效率不同的原因;Bao等[40]研究指出,口服噬菌体仅有一小部分能够在胃酸环境中存活并进入消化道,消化道中的噬菌体仅占原始噬菌体的1%,在消化道各肠段中,盲肠噬菌体效价最高(104~105PFU·mL-1),大部分噬菌体通过粪便排出。本研究中,噬菌体组血清、肝和肠道中的噬菌体效价极显著高于其余三组(P<0.01),而且盲肠的噬菌体效价高于空肠和回肠,且消化道噬菌体效价远高于血液和肝,这也进一步说明,通过腹腔注射噬菌体能够达到肠道的不同部位,传递效率要优于口服途径,受消化酶、胃酸、饲料等因素影响,消化道后端的噬菌体效价要高于前端。
3.5 噬菌体对感染沙门菌肉仔鸡抗氧化指标的影响
机体抗氧化能力与健康程度密切相关。T-SOD和GSH-Px是特异性消除超氧自由基和过氧化物的抗氧化酶类,主要防御过氧化作用引起的组织损伤;MDA是脂质过氧化产物,其含量反映了机体脂质过氧化程度,间接反映细胞的损伤程度。沙门菌等病原微生物的感染会导致肠道中性粒细胞迁移至炎症部位吞噬沙门菌,引起呼吸爆发,并产生大量的强氧化物质(ROS),破坏肠上皮细胞,引起肠黏膜屏障功能损伤[41]。肠道黏膜受损就会导致细菌位移,毒素等有害物质进入到血液循环,从而引起全身性的氧化应激反应,在临床上往往表现为试验动物肝、脾及各消化道SOD、GSH-Px等抗氧化酶活性降低,MDA含量上升的全身性症状[42]。在本研究中,采用腹腔注射的方式攻毒,剂量为200 μL·只-1(109CFU·mL-1),可导致肉仔鸡血液、肝及肠道T-SOD和GSH-Px活性降低,MDA含量增加,说明试验动物氧化还原状态失衡,发生氧化应激,造成全身性症状。目前,关于噬菌体治疗对机体抗氧化能力影响的研究报道较少,刘燕坤等[43]研究指出,噬菌体鸡尾酒有升高断奶仔猪血液CAT活性的趋势,但是对其他抗氧化指标没有显著影响;杨瑞思等[44]采用噬菌体复合裂解酶制剂(200 mg·kg-1)能够极显著提高肉鸡肝中抗氧化酶活性。本试验中,经噬菌体治疗后,血液、肝及肠道SOD和GSH-Px活性较攻毒组极显著升高,但是仍极显著低于对照组,同样MDA含量较攻毒组降低,但也高于对照组,与抗生素组差异不显著,与上述结果一致,这也进一步说明,噬菌体能够通过清除病原菌而减缓机体氧化损伤。
3.6 噬菌体对感染沙门菌肉仔鸡细胞因子和免疫球蛋白含量的影响
肠炎沙门菌在侵染机体的过程中,启动先天免疫激活了中性粒细胞、巨噬细胞等,产生大量的TNF-α、IL-6及INF-γ等炎症因子,造成肠绒毛融合和扁平化[45]。IFN-γ通过影响巨噬细胞激活的程度在控制持续性感染中起着核心作用[46]。在本研究中,通过检测血液及肠道中TNF-α、IL-6及IFN-γ含量发现,沙门菌感染后细胞因子极显著升高,这与赵景鹏等[13]、梁桂星[47]、石水琴[48]等研究结果一致。分泌性免疫球蛋白A(sIgA)主要存在于唾液、乳液、胃肠液和呼吸道分泌物等外分泌液中,在肠道黏膜免疫中通过维持肠道黏膜内环境稳态,干扰病原体和上皮细胞受体结合,免疫排异清除病原体和降低病原菌毒力,从而实现对机体的保护[49],此外,sIgA还能调控肠道微生物的组成,确保微生物与宿主的共生关系[50]。经过长期的进化,病原微生物能够分泌出一种水解肠道黏膜sIgA的酶类,有助于微生物的定植。本研究中,沙门菌攻毒后空肠和回肠中sIgA含量较对照组极显著降低,表明了肠道黏膜免疫能力的下降,这与Yang等[12]和Song等[51]研究结果相一致。目前,已有相关研究表明,噬菌体通过影响NF-κB途径,对机体细胞因子的产生有较强的调控作用[52]。从动物应用的成功案例来看,噬菌体改善了与细菌感染相关的细胞因子的升高。Zimecki等[53]研究指出,噬菌体能够显著降低金黄色葡萄球菌感染小鼠血液中TNF及IL-6细胞因子的含量,显著增加淋巴细胞系中性粒细胞和未成熟细胞的百分比,以及骨髓中骨髓细胞和未成熟中性粒细胞的百分比;同样,在Kumari等[54]的研究中,肺炎克雷伯菌噬菌体能够显著降低烧伤小鼠血液及肺中IL-1b、TNF-α和IL-10细胞因子的含量,从而有效提高了存活率。本研究中,采用噬菌体治疗后,血液、空肠及回肠中TNF-α、IFN-γ和IL-6细胞因子含量极显著低于攻毒组,与上述结果相一致。目前,关于噬菌体对sIgA含量影响的研究很少,从现有研究结果来看,对沙门菌感染有治疗作用的益生菌[12]、植物提取物[51]等均能诱导机体分泌sIgA。本研究中,与攻毒组相比噬菌体能够显著或极显著提高空肠和回肠中sIgA含量,优于抗生素组(未达到差异显著水平),说明在一定程度上能够增强肉仔鸡的肠道黏膜免疫力。
4 结 论
肉仔鸡感染肠炎沙门菌可破坏肠道黏膜屏障,造成生长受阻、组织损伤及全身性炎症反应,通过噬菌体治疗可通过宿主专一性杀灭肠炎沙门菌,从而显著提高机体抗氧化能力和肠道黏膜屏障,缓解氧化应激和炎症反应,具有较强的保护作用,在一定程度上能够恢复肉仔鸡生长。

