肝癌患者营养不良危险因素的Meta分析*
陈春霞 陈向凡 顾海燕 徐冠华 崔志明△
1.南通大学第二附属医院医学影像科 (江苏 南通, 226014) 2.南通大学第二附属医院药学部 3.南通大学第二附属医院护理部 4.南通大学第二附属医院脊柱外科
我国是肝癌的高发国家,肝癌发生率约占全球50%[1],原发性肝癌(PLC)是目前我国第4位常见恶性肿瘤及第2位肿瘤致死病因[2],死亡率在消化系统恶性肿瘤疾病患者中最高。营养不良是指由于饥饿、老年、疾病等因素,机体对营养的摄入或吸收不足,导致机体组成(主要为无脂细胞群减少)与体细胞群改变,认知和生理功能降低,患者发生不良临床结局的一组综合征[3]。营养不良是影响肝癌患者病死率和预后的独立危险因素[4],采用不同的方法对肝癌患者进行营养评估,营养不良检出率为33.5%~80%[5-7]。PLC患者较其他肿瘤患者营养不良风险高。近年来,肝癌患者发生营养不良的危险因素已有较多的研讨,但研究结果存在差异,需要进一步综合评价。本研究采用Meta分析的方法探讨肝癌患者营养不良发生的主要危险因素,旨在为临床工作中早期识别,及早预防、治疗与干预肝癌患者的营养不良提供参考依据。
1 资料与方法
1.1 检索策略 本研究采用关键词和主题词结合检索的方法,以“肝癌、原发性肝癌、肝肿瘤、肝脏肿瘤、营养不良、营养风险”为检索词,在中国知网(CNKI)、万方数据知识服务平台、维普中文期刊服务平台检索中文文献,以“liver neoplasms, experimental; liver neoplasms;hepatocellular carcinoma;primary liver cancer;malnutrition”为检索词在PubMed、Cochrane Library、EmBase数据库检索英文文献,并再检索纳入研究的参考文献。检索时间为建库至2022年4月30日之间发表的相关病例对照研究。
1.2 纳入标准
1.2.1 研究类型 所有针对肝癌患者发生营养不良危险因素的病例对照研究。
1.2.2 营养风险评价标准 NRS2002营养风险评估量表:NRS-2002≥3分,患者存在营养风险;NRS-2002<3分,患者暂时不存在营养风险[8]。
1.2.3 研究对象 ①符合原发性肝癌诊疗指南诊断标准[2];②文献为国内外公开发表的影响肝癌患者发生营养不良因素的病例对照研究;③研究有可用的原始数据。
1.3 排除标准 ①无法获得全文的文献;②文献提供信息不全;③研究方法或统计学方法错误;④来源不明的文献。
1.4 文献筛选及质量评价
1.4.1 文献筛选 本研究对检索到的文献经去除重复文献、阅读题目及摘要后初步排除文献;再对初步纳入的文献进行全文查找并阅读、质量评价,排除混杂非肝癌患者、无法获得全文等不符合纳入标准的文献后,最终纳入符合质量评价标准的文章。
1.4.2 文献质量评价 本次文献质量评价由2名经过循证医学系统培训的研究员根据纳入排除标准进行两轮独立筛选,过程如下:①2名研究员独立阅读文章题目及摘要进行初步筛选,对符合纳入标准的文章进行记录,在独立完成初步筛选后进行纳入文献的交叉比较,存在争议的文献交由第3名研究员决定是否纳入;②对于初筛后的文献再由2名研究员独立阅读全文进行筛选并核对比较,如仍存在争议文献,则交由第3名研究员决定是否纳入。根据纽卡斯尔-渥太华量表评价标准对纳入文献进行质量评价,量表各项目总计9分,分值与文献质量成正比,7~9分说明文献质量较好。
1.5 资料提取 最终纳入的文献所呈现的原始数据,均由2名研究员逐一独立提取。在提取完毕后进行数据交叉核对,保证数据完整、准确。提取的资料包括作者、发表年度、患者年龄、样本量、研究涉及的危险因素等。
1.6 统计学方法 采用Cochrane协作网提供的RevMan 5.4软件进行Meta分析。计量资料采用均数差(MD),二分类变量采用风险比(RR)为效应尺度,计算其合并后的点估计值以及95%置信区间,检验水准α=0.05。纳入研究结果间的异质性采用χ2检验进行分析(检验水准为α=0.1),若各研究结果间无统计学异质性(P>0.1,I2<50%)时,使用固定效应模型分析;当各研究间存在统计学异质性(P<0.1,I2>50%)时,采用随机效应模型分析。Meta分析结果使用森林图表示。
2 结果
2.1 文献检索结果与方法学质量评价 经过初步文献检索,共获得相关文献1 562篇,阅读题目和摘要初筛,剔除不符合要求的文献1 320篇,剩余242篇;进行全文阅读复筛,剔除不符合要求文献229篇,最终纳入13篇文献。文献筛选流程见图1。

图1 文献筛选流程
本次纳入的13篇文献总体质量良好,其中4篇文献的质量评价为8分[9-12],9篇文献质量评价为7分[7,13-20]。各文献的质量评价结果见表1。

表1 纳入文献方法学质量评价
2.2 纳入研究的文献基本特征 纳入研究的13篇文献共计2 353名患者,纳入研究的文献基本信息见表2。

表2 纳入研究的文献基本特征
2.3 肝癌患者营养不良各危险因素的Meta分析结果 本研究共纳入13篇文献进行Meta分析,其中年龄、BMI、肝癌TNM分期、Child-pugh分级、血红蛋白、血清白蛋白、血清前白蛋白7项危险因素具有统计学意义;性别、ALT、AST、婚姻状况以及乙肝病毒感染等因素无明显统计学意义。
2.3.1 年龄对发生营养不良风险的影响 纳入的13项研究中有3项讨论了年龄对肝癌患者营养不良风险的影响[9-11],各项研究间不存在统计学的异质性(P=0.68,I2=0),采用固定效应模型进行Meta分析。结果显示,高龄是肝癌患者营养不良风险的重要影响因素,有统计学意义(RR=1.35,95%CI:1.13~1.60,P=0.000 7),见图2。
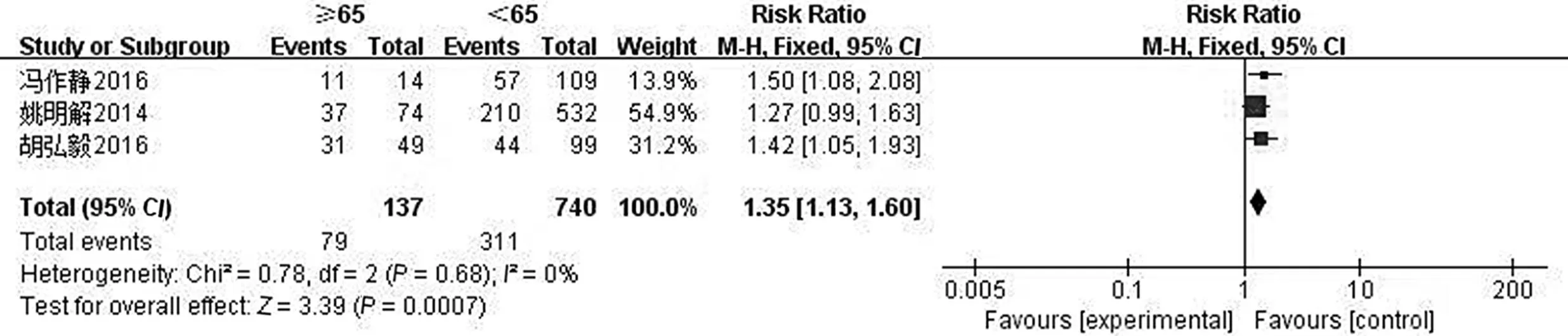
图2 年龄对发生营养不良风险的影响
2.3.2 性别对发生营养不良风险的影响 纳入的13项研究中有12项[7,9-19]讨论了性别对肝癌患者营养不良风险的影响,各项研究间不存在统计学的异质性(P=0.48,I2=0),采用固定效应模型进行Meta分析。结果示:性别并非肝癌患者营养不良风险的影响因素,合并效应无统计学意义(RR=1.00,95%CI:0.91~1.10,P=0.96),见图3。
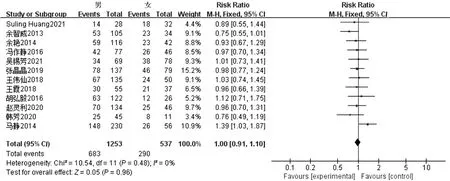
图3 性别对发生营养不良风险的影响
2.3.3 BMI对发生营养不良风险的影响 纳入的13项研究中有8项讨论了BMI对肝癌患者营养不良风险的影响[7,9-12,18-20],各项研究间存在统计学的异质性(P<0.000 1,I2=84%),采用随机效应模型进行Meta分析。结果显示,BMI是肝癌患者营养不良风险的重要影响因素,有统计学意义(RR=1.52,95%CI:1.12~2.07,P=0.008),见图4。

图4 BMI对发生营养不良风险的影响
2.3.4 伴有乙型肝炎对发生营养不良风险的影响 纳入的13项研究中有6项讨论了是否伴有乙肝对肝癌患者营养不良风险的影响[7,9-10,12,18-19],各项研究间存在统计学的异质性(P=0.01,I2=66%),采用随机效应模型进行Meta分析。结果显示,是否伴有乙型肝炎并非肝癌患者营养不良风险的影响因素,合并效应无统计学意义(RR=1.21,95%CI:0.96~1.51,P=0.10),见图5。

图5 乙型肝炎对发生营养不良风险的影响
2.3.5 肝癌TNM分期对发生营养不良风险的影响 纳入的13项研究中有4项讨论了肿瘤TNM分期对肝癌患者营养不良风险的影响[7,13,17,19],各项研究间不存在统计学的异质性(P=0.79,I2=0),采用固定效应模型进行Meta分析。结果显示,TNM分期是肝癌患者营养不良风险的重要影响因素,有统计学意义(RR=0.37,95%CI:0.26~0.52,P<0.000 1),见图6。
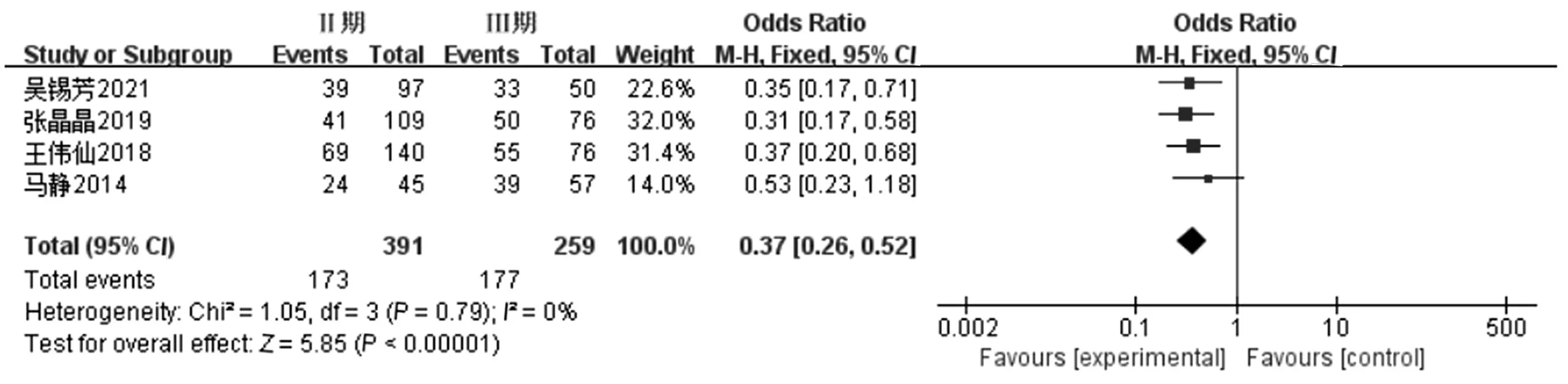
图6 肝癌TNM分期对发生营养不良风险的影响
2.3.6 Child-pugh分级对发生营养不良风险的影响 纳入的13项研究中有8项讨论了Child-pugh分级对肝癌患者营养不良风险的影响[7,9-10,12-13,16,18-19],各项研究间存在统计学的异质性(P<0.000 1,I2=88%),采用随机效应模型进行Meta分析。结果显示,Child-pugh分级是肝癌患者营养不良风险的重要影响因素,有统计学意义(RR=0.66,95%CI:0.50~0.86,P=0.002),见图7。

图7 Child-pugh分级对发生营养不良风险的影响
2.3.7 血红蛋白(贫血)对发生营养不良风险的影响 纳入的13项研究中有3项讨论了贫血对肝癌患者营养不良风险的影响[7,13,19],各项研究间不存在统计学的异质性(P=0.89,I2=0),采用固定效应模型进行Meta分析。结果显示,贫血是肝癌患者营养不良风险的重要影响因素,有统计学意义(RR=1.87,95%CI:1.61~2.18,P<0.000 1),见图8。
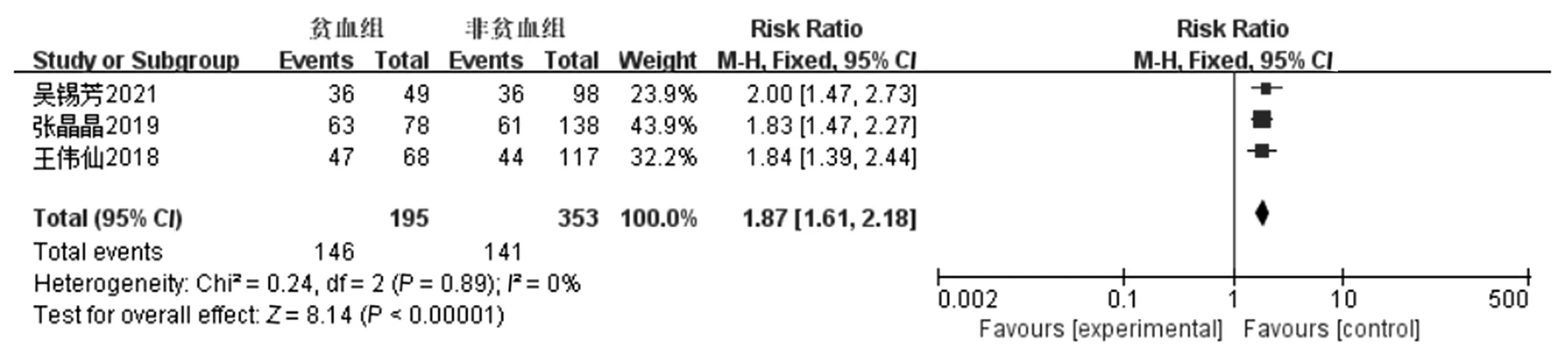
图8 贫血对发生营养不良风险的影响
2.3.8 血清白蛋白对发生营养不良风险的影响 纳入的13项研究中有6项讨论了血清白蛋白对肝癌患者营养不良风险的影响[10-12,14,18,20],各项研究间存在统计学的异质性(P<0.000 1,I2=88%),采用随机效应模型进行Meta分析。结果显示,血清白蛋白是肝癌患者营养不良风险的重要影响因素,有统计学意义(WMD=-0.89,95%CI:-1.44~-0.34,P=0.002),见图9。

图9 血清白蛋白对发生营养不良风险的影响
2.3.9 血清前白蛋白对发生营养不良风险的影响 纳入的13项研究中有5项讨论了血清前白蛋白对肝癌患者营养不良风险的影响[10-12,18,20],各项研究间存在统计学的异质性(P<0.000 1,I2=91%),采用随机效应模型进行Meta分析。结果显示,血清前白蛋白是肝癌患者营养不良风险的重要影响因素,有统计学意义(WMD=-29.52,95%CI:-52.99~-6.05,P=0.01),见图10。

图10 血清前白蛋白对发生营养不良风险的影响
3 讨论
本研究结果显示,血清白蛋白、血清前白蛋白、血红蛋白(贫血)、BMI与肝癌患者营养不良危险因素密切相关。肝癌患者肝细胞受损,合成功能受影响;患者食欲下降、消化吸收能力降低,致供能三大营养物质在内的营养素普遍摄入不足,合成原料不足;肿瘤坏死因子使机体分解代谢增强;肌肉分解增加、机体总蛋白合成减少、分解代谢高于合成代谢、机体呈现负氮平衡状态,白蛋白下降[21],增加伤口感染、肺炎及脓毒血症等术后并发症发生风险,导致患者住院时间增加。许多研究表明白蛋白水平反映慢性病患者的重要预后因素[22]。低蛋白血症、血浆胶体渗透压下降、广泛组织水肿进一步影响消化与吸收,必然导致BMI下降[23],甚至出现恶病质。低BMI、营养枯竭、肌肉无力和代谢改变进一步影响了患者机体对炎症和伤口愈合过程的反应[24]。BMI也与TBil、肿瘤大小、肿瘤分化、PVTT、TNM分期和复发呈负相关[25]。血清白蛋白半衰期为20 d左右,而血清前白蛋白半衰期为1.9 d左右,对肝脏功能受损的反映较血清白蛋白迅速,反映营养水平的及时性、敏感度和特异度更高,特别是在临床症状出现之前[26]。血红蛋白是机体血液中载氧的关键蛋白,主要由含铁的血红素和珠蛋白构成,血红蛋白下降,必然导致组织脏器氧供不足,影响组织代谢和脏器功能。血红蛋白水平与白蛋白水平呈正相关,肝癌患者因消化道出血、门脉高压脾功能亢进、营养不良、慢性失血等贫血较常见。住院的肝癌患者中有贫血的营养风险是无贫血患者的2.311倍[7],贫血越重,并发症越严重,严重影响患者的生活质量。
Child-pugh评分(CP评分)B、C级及肝癌分期Ⅲ期是肝癌住院患者营养风险的危险因素[27]。CP 评分是目前临床最常用、最基本、使用时间最长的肝功能评估指标[28],其中有肝性脑病、腹水、血清胆红素、Alb及PT 5个指标。肝功能不全患者多有恶心、腹泻、厌食和饱胀等症状,影响患者营养摄入;由于腹水限制水、钠;肝性脑病限制蛋白质;淤胆性肝病的胆盐缺乏常致脂肪泻和脂溶性维生素的缺乏都促进营养不良的发生。有研究证明CP评分B级的肝癌住院患者的营养风险是评分A级的2.752倍[7]。肝功能越差,机体代谢能力越低,营养风险发生率越高[29,30],患者预后越差。Ⅲ期肝癌原发肿瘤瘤体较Ⅱ期大和/或多,亦有侵犯门静脉或肝静脉分支,更多肿瘤负荷营养消耗越大,当摄入、消化吸收、合成量小于分解代谢时营养风险发生。ALT、AST与肝癌术后复发、预后、营养的相关性不大[31]。
高龄是肝癌患者营养不良发生的重要危险因素。老年人营养不良的原因是多方面的:蛋白质摄人减少,体内细胞衰亡和各种代谢可引起蛋白质丢失,且随着机体老化,体内分解代谢加强,氮的负平衡难以避免,又影响机体的功能,加重器官的衰老。老年人牙齿松动、消化液分泌量下降等影响多种营养元素(如钙、铁、维生素B2、叶酸和维生素B6 )的溶解和吸收,也是多种营养物质吸收不良的常见原因[23,32-34]。老年患者由于独居、收人减少等社会经济的原因使营养不良的发生风险更高[35]。年龄≥60岁患者的营养不良发生率是<60岁病人的1.34倍[23],>65岁的老年患者年龄每增加1岁,营养风险发生概率增加7%,营养不良风险随着年龄的增长而增高[36],提示我们必须正视年龄对营养和疾病的影响[34]。虽然肝癌的男性病例数大概是女性患者的4倍[37],但性别并不是预测肝癌患者术后并发症的因素[38]。此外,是否感染乙型肝炎病毒并不是肝癌患者营养不良的重要影响因素可能与肝炎的有效控制,特别是对年轻人和中年人肝癌发病趋势的缓解有关[39]。
肝癌患者发生营养不良危险因素较多,其中BMI下降、肝癌TNM高分期、Child-pugh分级B、C级、血红蛋白下降(贫血)、血清白蛋白下降、血清前白蛋白下降、高龄7项为高危险因素,医护人员需要充分认识这些因素对肝癌患者营养不良影响的严重程度,积极治疗干预,以降低肝癌患者营养不良的发生。但由于肝癌患者营养不良病因复杂,比较难分析各因素之间是否存在交互作用;其次,因为肝癌在东亚特别是我国高发,相关外文文献研究提及不多,可能存在研究样本的偏倚,因此还需要有更多多中心、前瞻性的随机对照研究支持。

