燕麦蛋白耦合异源共架技术对大米蛋白水溶性的影响
黄馨禾,王长艳,范龙彬,常雅宁,*
(1.华东理工大学食品科学与工程系生物反应器工程国家重点实验室,上海 200237;2.上海徐汇区地下空间开发有限公司,上海 200030)
大米是我国最常见的粮食之一,其中大米蛋白以极低的致敏性而备受瞩目[1],与其他谷物蛋白相比,大米蛋白表现出优良的氨基酸组成,总必需氨基酸含量约为41.1~41.7 g/100 g,赖氨酸(谷类第一限制氨基酸)的含量高达4.1 g/100 g[2],同时净蛋白质利用率(73.8)、生物价(61)和氨基酸评分(0.66)也远高于其他粮食作物[3],因此大米蛋白作为高附加值成分具有应用于多种食品体系之中的潜在价值。
尽管大米蛋白的营养价值很高,但它含有约80%的谷蛋白[4],谷蛋白会通过分子间二硫键的交联形成大分子聚合物,令大米蛋白在pH4~10 的条件下溶解度、发泡和乳化性能相对较差[5],限制了大米蛋白作为功能组分在食品中的应用。研究人员采用了多种技术来提高大米蛋白的溶解度,其中以化学改性、生物酶法改性以及物理改性为主。化学改性与酶改性的反应过程难以控制且会产生苦味成分[6],物理改性对设备要求高,能耗成本大,不利于实际生产应用[7]。因此开发一种安全、操作简便的增溶方式尤为重要。
异源共架技术基于pH-循环技术,利用外界环境的改变,从动力学角度出发,改变两种不同原料之间的非共价作用,构建两者之间的共架骨架,从而使得复合材料可以在中性水体系中获得动态稳定性。该技术因为具备工艺简单、安全性高、能够保留原料的营养特性和生理活性等优点而被广泛应用于食品行业,尤其是蛋白质改性中。在异源共架的过程中,两种蛋白质发生共折叠,使疏水基团暴露,从而达到增溶的效果[8]。He 等[9]利用大豆蛋白耦合异源共架技术加工小麦面筋蛋白,以实现对小麦面筋蛋白的增溶效果。Wang 等[10]通过大豆分离蛋白耦合异源共架技术改变大米蛋白结构,设计新型的蛋白质复合材料,使大米蛋白的溶解度增加。但大豆蛋白的高致敏性限制了复合材料的实际应用。与大米蛋白相似,燕麦蛋白同样具有低致敏性、氨基酸配比合理、高生物相容性的特点,因此本研究选择燕麦蛋白与大米蛋白一同构建异源共架体,提高大米蛋白的溶解度,这是第一次使用燕麦蛋白耦合大米蛋白。
中国是全球大米的主要进口国之一,在储存和运输过程中,大米的主要副产品碎米的数量不可低估[11]。因此本文从碎米中提取大米蛋白,并采用异源共架的技术引入燕麦蛋白对其进行增溶改性,扩大其应用范围,以实现从低价值资源向高价值产品的合理转化,从而获得良好的经济效益和社会效益。
1 材料与方法
1.1 材料与仪器
碎米 山东鹤来香食品有限公司;燕麦蛋白粉纯度98%,陕西世纪千寻生物科技有限公司;SDSPAGE 凝胶配制试剂盒 上海碧云天生物技术有限公司;食用大豆油 益海嘉里金龙鱼粮油食品股份有限公司;透析袋 北京怡康盛世生物科技有限公司;考马斯亮蓝、氢氧化钠、盐酸和其余常用化学试剂均为分析纯,上海泰坦科技股份有限公司。
PHS-3CU 数显台式pH 计 上海越平科学仪器有限公司;CP213 电子分析天平 奥豪斯仪器(上海)有限公司;DF-101S 集热式恒温加热磁力搅拌器上海秋佐科学仪器有限公司;DL-5-B 多管离心机上海安亭科学仪器厂;FJ200-T 高速均质乳化机 韬越上海机械科技有限公司;UV-2000 紫外分光光度计 尤尼柯(上海)仪器有限公司;Scientz Z-10N 真空冷冻干燥机 郑州科达机械仪器设备有限公司;FTIR5700 傅里叶红外光谱仪 安捷伦科技(中国)有限公司;JSM-6390A 扫描电子显微镜 日本电子株式会社;S3500 激光粒度仪 美国麦奇克有限公司。
1.2 实验方法
1.2.1 大米蛋白的制备 参照Qadir 等[12]的方法并稍加修改。将碎米粒浸入去离子水中,在4 ℃环境下冷藏12 h,浸泡过的碎米粒与4 ℃的去离子水以1:10(w/v)的比例混合打浆。将混合浆料稀释10倍,用1 mol/L NaOH 将pH 调至12,在室温下搅拌4 h。在4 ℃下10000 r/min 离心15 min,取上清液。上清液用1 mol/L HCl 调节pH 至4.5 进行蛋白质沉降,在4 ℃下以10000 r/min 离心15 min,收集沉淀。用去离子水洗涤3 次,再用1 mol/L NaOH将pH 调至7。冷冻干燥后,得到大米蛋白粉末,在4 ℃的环境下储存备用。
1.2.2 大米-燕麦蛋白新型复合材料的制备 参照Zhu 等[13]的方法并稍加修改。向1%(w/v)的大米蛋白中加入不同质量的燕麦蛋白,将大米蛋白与燕麦蛋白的质量比记作1:0.2、1:0.4、1:0.6、1:0.8、1:1,得到大米-燕麦蛋白溶液。另取大米蛋白和燕麦蛋白分别制得1%(w/v)的溶液作为对照组。将上述大米-燕麦蛋白溶液、大米蛋白溶液和燕麦蛋白溶液用1 mol/L NaOH 调至pH 为12,在室温下用磁力搅拌器搅拌4 h 后,用0.1 mol/L HCl 缓慢中和溶液至pH 为7 后,在4 ℃下以10000 r/min 离心15 min,将上清液用透析袋(3500 Da)在4 ℃下透析24 h 除去盐分,冷冻干燥后,得到大米-燕麦蛋白粉末和对照组大米蛋白粉末、燕麦蛋白粉末,在4 ℃的环境下密封储存,用以后续表征分析。沉淀经冷冻干燥后,采用SDS-PAGE 进行分析。
1.2.3 蛋白质浓度的测定 蛋白质的浓度使用考马斯亮蓝法[14]进行测定。
1.2.4 溶解度的测定 参照赵方园等[15]的方法并稍加修改,取大米-燕麦蛋白、大米蛋白和燕麦蛋白粉末各0.1 g,分别分散于10 mL 去离子水中,配制成7 份1%(w/v)的大米-燕麦蛋白、大米蛋白和燕麦蛋白溶液,搅拌2 h 后置于4 ℃冰箱过夜,使其充分水合,再将溶液以5000 r/min 离心15 min。溶解度的计算公式如下:
其中,M1是上清液中蛋白质的含量,单位mg;M2是样品中总蛋白质的含量,单位mg。
1.2.5 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE) 参照Laemmli 等[16]的方法并稍加修改。分别取0.2 g 大米-燕麦蛋白、大米蛋白、燕麦蛋白粉末于7 个离心管中,加入10 mL 去离子水,充分分散后与4 倍体积的5×缓冲液混合均匀。将异源共架过程中产生的不溶性沉淀分别分散在缓冲液中,令其浓度为0.2%(w/v)。沸水浴3~5 min 后,各取6.5 μL,上样加入预制胶(浓缩胶4%、分离胶12%)进行电泳。初始电压设置为80 V,样品进入分离胶后调整至120 V,直至电泳结束。电泳结束后染色、脱色至可以看见明显条带。
1.2.6 浊度的测定 参照Wang 等[17]的方法并稍加修改。分别将0.1 g 的大米-燕麦蛋白、大米蛋白、燕麦蛋白粉末加入到100 mL 去离子水中,用1 mol/L NaOH 调节pH 至12。磁力搅拌充分溶解后,用0.1 mol/L HCl 缓慢将蛋白溶液pH 调整为7,溶液pH 每降低0.5 取一次样,在600 nm 波长下测定不同pH 下样品的透过率。
1.2.7 粒径的测定 由1.2.4 的结果可知当大米蛋白/燕麦蛋白(w/w)为1:0.6 时溶解度达到最高,选择此样品进行后续实验。制备2 mg/mL 的大米-燕麦蛋白(1:0.6)、大米蛋白、燕麦蛋白的溶液,采用S3500 激光粒度仪对蛋白溶液的粒径进行湿法测定,光源为专利Tri-Laser 激光系统,固体二极管激光器,粒度测试范围0.01~2000 μm,测定温度为25 °C。
1.2.8 扫描电子显微镜(Search Engine Marketing,SEM) 将大米-燕麦蛋白、大米蛋白、燕麦蛋白粉末粘附在载物台上,然后在真空离子喷溅设备中进行喷金操作,使用扫描电子显微镜JSM-6390A 在15 kV的加速电压下观察蛋白的微观表面结构。
1.2.9 乳化特性的测定 采用Pearce 等[18]的方法并稍加修改。配制2 mg/mL 的大米-燕麦蛋白、大米蛋白、燕麦蛋白的溶液,取8 mL 样品于离心管中,加入2 mL 大豆油,以10000 r/min 的速度均质60 s,迅速从底部取出100 μL 的乳浊液,加入5 mL 0.1%的SDS 溶液稀释,摇匀后立即在500 nm 波长下测定吸光度A0。将剩余乳浊液静置10 min 后,在底部相同位置进行同样操作,测定吸光度A10。乳化活性指数(Emulsifying Activity Index,EAI)和乳化稳定性(Emulsifying Stability Index,ESI)计算公式如下:
式中,A0、A10分别为乳浊液刚制备完成和静置10 min 之后在500 nm 处的吸光度值;C 为蛋白质浓度,单位g/mL;φ为油相占比,此处为0.2;D 为稀释倍数,此处为51。
1.2.10 起泡特性的测定 参照Li 等[19]的方法并稍加修改。配制2 mg/mL 的大米-燕麦蛋白、大米蛋白、燕麦蛋白的溶液,将10 mL 样品溶液用高速均质乳化机以10000 r/min 的速度均质2 min,迅速将混合液转移至量筒中测量体积V0,静置30 min 后再次测量体积V30。起泡性(Foaming Capacity,FC)和泡沫稳定性(Foaming Stability,FS)的计算公式如下:
式中,V0为均质后0 min 时的体积,单位mL;V30为静置30 min 后剩余的体积,单位mL。
1.2.11 傅里叶红外光谱(Fourier Transform Infrared Spectroscopy,FTIR) 将2 mg 大米-燕麦蛋白、大米蛋白、燕麦蛋白粉末分别与200 mg KBr 混合,充分研磨后压制成薄膜,用FTIR 5700 傅里叶红外光谱仪对蛋白质进行扫描分析,扫描波数范围4000~400 cm-1,分辨率4 cm-1。
1.3 数据处理
所有实验数据均为3 个平行样本,用Microsoft Office Excel 2021、Origin 2021 以及SPSS statistics 20 软件进行数据分析并绘图,结果以“平均值±标准偏差”表示,并使用ANOVA 程序进行显著性分析(P<0.05)。
2 结果与分析
2.1 大米-燕麦蛋白复合材料的溶解度
如图1a 和图1b 所示,大米蛋白和燕麦蛋白在水中不能形成稳定的胶体,停止搅拌后,在极短的时间内就会沉淀。经过异源共架后,大米-燕麦蛋白(1:0.6)在水中能形成均匀的胶体(图1c),静置24 h后依然稳定。

图1 大米蛋白(a)、燕麦蛋白(b)和大米-燕麦蛋白(1:0.6,c)在水中分散液的相图Fig.1 Rice protein (a), oat protein (b) and rice protein-oat protein (1:0.6, c) dispersions in water
异源共架对溶解度的改善情况如图2 所示。相比大米蛋白和燕麦蛋白,大米-燕麦蛋白的溶解度显著提升(P<0.05),这可能是由于经过pH 循环后,大米蛋白和燕麦蛋白之间发生了相互作用。大米-燕麦蛋白的溶解度随燕麦蛋白添加比例的增加而增大。当比例为1:0.6 时,复合材料的溶解度达到最大,为93.07%±2.15%,约是大米蛋白溶解度(8.49%±1.53%)的10.96 倍。但是,燕麦蛋白添加量的继续增加导致大米-燕麦蛋白复合材料溶解度呈现下降的趋势,这可能是由于过量的燕麦蛋白会影响大米蛋白的分散性,阻碍均一、稳定胶体的形成[20]。

图2 大米蛋白、燕麦蛋白和大米-燕麦蛋白的溶解度Fig.2 Solubility of rice protein, oat protein and rice protein-oat protein
2.2 大米-燕麦蛋白复合材料的SDS-PAGE
破坏蛋白质的一级结构会影响其功能特性并造成营养的流失[21]。因此,通过SDS-PAGE 对样品的一级结构进行表征,结果如图3 所示。图3a 泳道2、3 分别代表了大米蛋白和燕麦蛋白的主要亚基条带。大米蛋白在15~20、25~37、49.6、70~100 kD 显示的条带分别对应大米谷蛋白的碱性亚基(β亚基)、酸性亚基(α亚基)、大米清蛋白和大米球蛋白[22-23]。燕麦蛋白在15~24、21、29.5、32~37 kD 以及55 和65 kD 显示的条带分别对应于12S 球蛋白β亚基、3S 球蛋白、清蛋白[24-25]、12S 球蛋白α亚基[26]以及7S 球蛋白的亚基[27]。
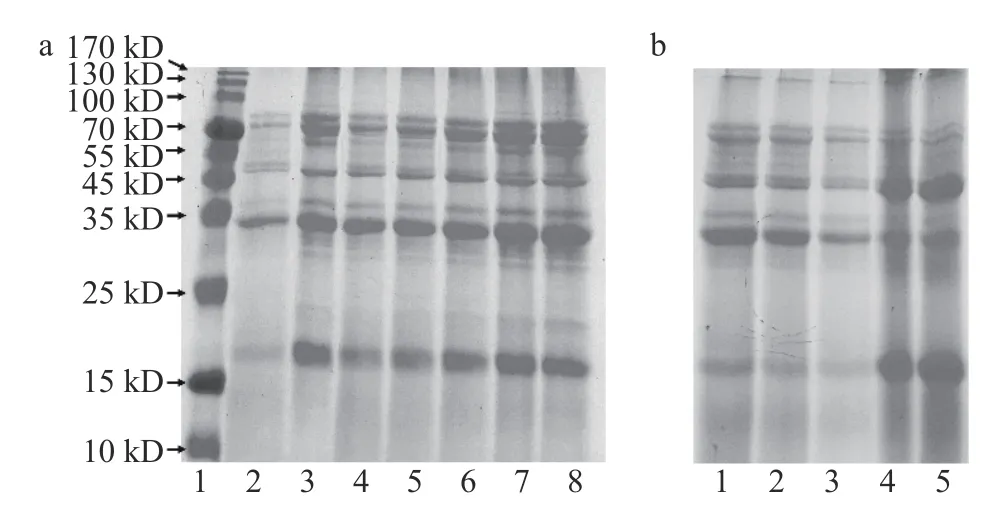
图3 不同样品的SDS-PAGE 图像Fig.3 SDS-PAGE images of different samples
不同比例蛋白复合物的SDS-PAGE 图像(图3a泳道4~8)清晰呈现出了两者的全部亚基,且无新的条带出现。上述结果表明,在异源共架的过程中,大米蛋白和燕麦蛋白两种蛋白质分子一级结构完整,且并未反应生成新的亚基。相比大米蛋白,大米-燕麦蛋白样品在49.6 kD 处的条带颜色更深,对应大米清蛋白的特征亚基[23],说明异源共架增加了大米-燕麦蛋白中的大米蛋白在中性条件下的溶解度。随着燕麦蛋白比例逐步增加,其在21、29.5 和65 kD 处的特征亚基条带颜色也逐步加深,说明大米-燕麦蛋白中共架的燕麦蛋白含量逐渐增加。异源共架过程中所产生沉淀的SDS-PAGE 图像如图3b 所示,图中只观察到大米蛋白的主要亚基,无法观察到燕麦蛋白的特征亚基,说明燕麦蛋白几乎完全溶解于水中,图2 中溶解度的增加主要来源于对大米蛋白的溶解度改善。
2.3 大米-燕麦蛋白复合材料的浊度
浊度的变化可以体现出溶液中溶质的聚集,以及溶质聚集体质量、大小的变化,在一定程度上可以反映出蛋白质的溶解性、聚集状态和粒径大小[28]。
如图4 所示,样品的浊度总体随pH 的增加呈现下降趋势,其中大米蛋白的下降速率最快。pH 为7 时,大米蛋白的透过率仅为13.17%,较pH 为12时降低了85.7%,说明此时大米蛋白分子聚集,悬浮于溶液中,使得透过率较低[29]。异源共架之后,大米-燕麦蛋白的透过率与大米蛋白相比明显增加,透过率的下降速率越来越慢,当大米蛋白/燕麦蛋白(w/w)为1:0.6 时透过率变化最小,原因可能是异源共架技术使得复合蛋白分子之间的静电斥力增加,从而形成更加均匀和稳定的蛋白质溶液[30]。透过率越大说明溶解度越好,与上文得出大米蛋白/燕麦蛋白(w/w)为1:0.6 时溶解度最高的结论相一致。
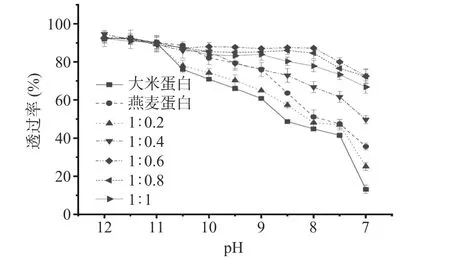
图4 大米蛋白、燕麦蛋白和大米-燕麦蛋白水溶液的透过率随pH 的变化Fig.4 Changes in the transmittance of rice protein, oat protein,and rice protein-oat protein aqueous solutions with pH
2.4 大米-燕麦蛋白复合材料的粒径分布情况
不同蛋白样的粒径分布如图5 所示,大米蛋白和燕麦蛋白样品的粒径较大,极易发生大分子间的聚集而沉降[13],与上文2.3 所得大米蛋白和燕麦蛋白溶液透过率很低的结果相一致。而经过异源共架处理的大米-燕麦蛋白复合物粒径为0.1 μm 左右,与单一组分蛋白相比,粒径明显降低,分子聚沉作用减弱,更利于在水中形成均匀稳定的胶体,从而达到增溶效果。

图5 大米蛋白、燕麦蛋白、大米-燕麦蛋白(1:0.6)在水中的粒径分布Fig.5 Particle size distribution of rice protein, oat protein, rice protein-oat protein (1:0.6) in water
2.5 大米-燕麦蛋白复合材料的结构表征
不同蛋白样品的微观形态可以通过SEM 观察。如图6 所示,大米蛋白表面光滑,且颗粒粒径不均一;燕麦蛋白的表面粗糙、凹凸不平,且颗粒聚集。大米-燕麦蛋白相较于大米蛋白结构更松散、均一,相较于燕麦蛋白表面更加光滑。这可能是异源共架技术改变了蛋白质的分子间作用力以及二硫键之间交联的平衡,使得大米蛋白和燕麦蛋白的结构展开,发生重组,蛋白颗粒变小[31],这使其更容易分散在水中。在不同燕麦蛋白比例的蛋白复合材料中,大米-燕麦蛋白(1:0.6)的颗粒最小,与其溶解度最高的结果相一致,而随着燕麦蛋白的比例进一步增加,颗粒逐渐增大,这可能是因为燕麦蛋白的含量过高,使得最终所得蛋白样品中存在未完全参与反应的燕麦蛋白,影响了均一结构的形成。
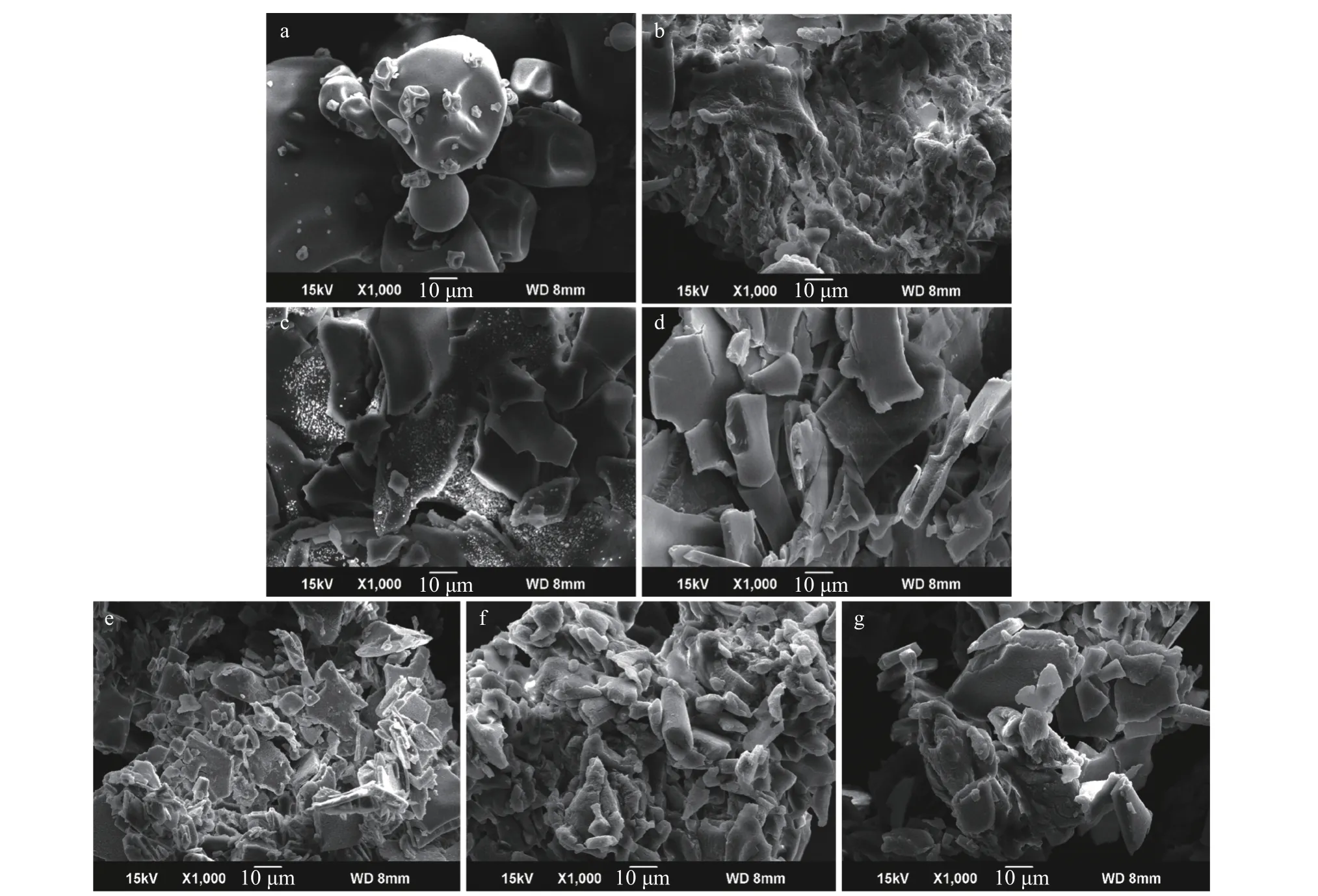
图6 大米蛋白、燕麦蛋白和大米-燕麦蛋白的微观结构Fig.6 Microstructure of rice protein, oat protein and rice protein-oat protein
2.6 大米-燕麦蛋白复合材料的乳化特性
异源共架处理后的蛋白乳化活性指数和乳化稳定性指数的变化如图7 所示。与大米蛋白(22.93 m2/g)不同,引入燕麦蛋白之后大米-燕麦蛋白的乳化活性显著提升(P<0.05),这是因为异源共架处理促进了蛋白质聚集物的部分解离和结构展开,暴露了疏水基团,从而促进了蛋白质在油水界面的扩散,提高了乳化性能[32],但大米蛋白与燕麦蛋白比例为1:0.2、1:0.4 时和1:0.6、1:0.8 时,乳化活性并未有显著性差异(P>0.05),说明对于乳化活性来说,异源共架技术带来的影响高于燕麦蛋白的加入量不同带来的影响。此外,蛋白质的高溶解性也有利于蛋白质在微小油滴表面迅速吸附[33],从而提高乳化活性,与图2 中的溶解度结果相一致。蛋白的乳化稳定性在大米蛋白/燕麦蛋白(w/w)为1:0.6 时达到最高(85.38%),比大米蛋白增加了8.11%,说明异源共架技术提高了大米-燕麦蛋白 在油水界面的固化[34],但燕麦蛋白比例进一步增加,破坏了蛋白质膜表面的结构特性稳定,反而使复合蛋白的乳化稳定性有所下降。
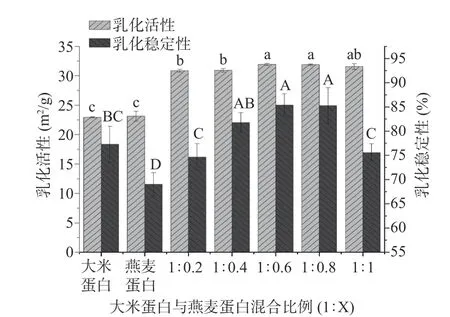
图7 大米蛋白、燕麦蛋白和大米-燕麦蛋白水溶液的乳化特性Fig.7 Emulsifying properties of rice protein, oat protein, and rice protein-oat protein aqueous solutions
2.7 大米-燕麦蛋白复合材料的起泡特性
起泡特性归因于蛋白质降低水-空气界面表面张力的能力[35],如图8 所示,大米蛋白的溶解性较差,界面浸润性差,导致起泡性低。而大米-燕麦蛋白表面经过异源共架之后暴露出充足的疏水基团,同时肽键的展开增加[36],可以在热力学驱动下更容易吸附在空气-水界面,形成厚实的泡沫层,以降低过多表面能,使得其起泡性高于大米蛋白和燕麦蛋白,在大米蛋白/燕麦蛋白(w/w)为1:0.6 时起泡性比大米蛋白提高4.9 倍。泡沫稳定性反映蛋白质稳定泡沫抵抗机械应力或重力的能力[35],燕麦蛋白表面的静电斥力可以有助于防止相邻气泡之间的接触,从而抵消泡沫的不稳定[37],因此,燕麦蛋白含量较高的大米-燕麦蛋白表现出更好的泡沫稳定性,随着燕麦蛋白比例的增加泡沫稳定性分别比大米蛋白提高了18.3%、37.4%、38.3%、45.1%和58.2%。

图8 大米蛋白、燕麦蛋白和大米-燕麦蛋白水溶液的起泡特性Fig.8 Foaming properties of rice protein, oat protein, and rice protein-oat protein aqueous solutions
2.8 大米-燕麦蛋白复合材料的傅里叶红外光谱(FTIR)
蛋白样品的FTIR 光谱如图9 所示。FTIR 光谱中的酰胺I 带(1600~1700 cm-1)是由肽键中C=O 拉伸振动引起的,酰胺II 带(1500~1600 cm-1)则是由于酰胺基团的C-N 拉伸振动和N-H 弯曲振动引起的[38]。图9 中大米-燕麦蛋白在此范围内的吸收峰强度均低于大米蛋白,尤其是大米-燕麦蛋白(1:0.6),这可能是因为异源共架技术使得羰基和氨基基团丢失,对蛋白的二级结构产生了影响[39]。而2800~3100 cm-1处的峰与-CH3和-CH2的C-H 拉伸振动有关,在2930 cm-1左右区域的变化反映了脂肪族氨基酸的暴露,代表了疏水相互作用,C-H 拉伸振动的降低意味着该区域的疏水相互作用增强[40]。异源共架的处理使得大米蛋白的峰值位置从2939.52 cm-1红移至2931.80~2937.59 cm-1,说明疏水相互作用可能是大米蛋白和燕麦蛋白之间的主要内驱力之一。此外,由于氢键效应带来的N-H 和O-H 的拉伸振动[41],产生了在3300 cm-1左右较宽的峰,大米蛋白的峰值位置从3288.63 cm-1蓝移至3298.28~3302.13 cm-1,说明氢键也在两者之间起到一定作用。
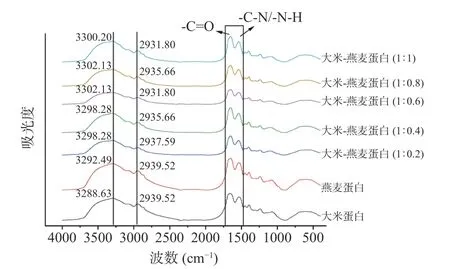
图9 大米蛋白、燕麦蛋白和大米-燕麦蛋白的傅里叶红外光谱图Fig.9 FTIR of rice protein, oat protein, and rice proteinoat protein
3 结论
本文通过燕麦蛋白耦合异源共架技术对大米蛋白进行增溶以增加其应用价值。异源共架技术可以增强大米蛋白和燕麦蛋白之间的疏水相互作用和氢键,在不破坏大米蛋白和燕麦蛋白一级结构的基础上,降低分子聚集程度及颗粒粒径,使蛋白微观结构更加松散,从而增强了大米-燕麦蛋白的溶解度。当大米蛋白/燕麦蛋白(w/w)为1:0.6 时,溶解度达到最高(93.07%±2.15%),显著高于大米蛋白(8.49%±1.53%)(P<0.05)。同时,大米-燕麦蛋白的乳化特性及起泡特性也随之提高。综上,本研究为扩大大米蛋白的应用及大米-燕麦蛋白异源共架体的进一步研究提供理论基础。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

