基于熵权TOPSIS 模型对白芨多糖脱蛋白体系的评价研究
袁高阳,秦心睿,聂晓兵,金文芳,杨玉玉,刘诗菡,范宝磊,苗潇磊,3,*
(1.湖北科技学院药学院,湖北咸宁 437100;2.辐射化学与功能材料湖北省重点实验室,湖北咸宁 437100;3.湖北省智慧康养产业研究院,湖北咸宁 437100)
白芨(Bletilla striata)最早出现于2000 年前的《神农本草经》,它属于兰科植物,在传统中药(TCM)中被广泛使用,是中医药著名的植物之一[1]。白芨多糖(BSP)已被证实是白芨生物功能中最重要的成分,现代药理学表明BSP 具有广泛的生物活性,如抗溃疡、止血[2]、抗炎[3]、抗氧化[4]、抗菌、抗纤维化[5]和抗衰老[6]等,在医疗、美容等方面具有较好的研究前景。
目前国内多糖纯化多采用Sevage 法[7]、盐酸法、三氯乙酸法、重复冻融法、蛋白酶法[8]、盐析法等。对于脱除多糖蛋白效果的评价大多只以多糖回收率和蛋白脱除率为指标,近年来何思辰等[9]、王莹等[10]、李媛媛等[11]将体外抗氧化活性与多糖结构表征也作为其效果的重要指标,增强了多糖脱蛋白评价的科学性和全面性,得到了医药行业广泛的认可。但多糖脱蛋白评价指标数量多且各指标重要程度未知,以至于目前的研究结果大多具有主观性和特殊性,对各指标的评价标准缺乏统一。因此,建立一种科学、操作性强、并且具有普遍性的多糖脱蛋白综合评价系统,对各种多糖脱蛋白方案进行综合评价是目前迫切需要解决的问题。
TOPSIS 法又称逼近理想解排序法[12],是一种多目标决策算法,多用于中药药材的质量综合评估[13-15],近年来在粮食安全[16]、电力[17]、矿业[18]、军事领域[19]也有较多应用。如图1 所示本研究采用三种方法(Sevage 法、乙腈法、TCA 法)对白芨多糖进行处理,从蛋白质脱除率和多糖保留率进行评价,同时考察其在结构和抗氧化活性方面的差异;不同于陈浩莹等[20]主观比较不同脱蛋白方法对白芨多糖的影响和效果的评价思路,本研究利用熵权TOPSIS 模型,将白芨多糖脱蛋白各项指标统一为一个体系,对其进行客观评价,结果更具有说服力,为未来白芨多糖纯化的评价研究提供新的思路。

图1 BSP 脱蛋白的概念流程图Fig.1 Conceptual flowchart of BSP deproteinization
1 材料与方法
1.1 材料与仪器
白芨 于2022 年9 月采摘,安徽省亳州市阳光新科药材种苗生产有限公司;纤维素酶(15000 U/g)、果胶酶(50 U/g) 国药集团化学试剂有限公司;标准品甘露糖(Man)、木糖(Xyl)、D-葡萄糖(Glc)、半乳糖(Gal)、鼠李糖(Rha)、1-苯基-3-甲基-5-吡唑啉酮(PMP) 上海阿拉丁生化科技股份有限公司;3,5-二硝基水杨酸、酒石酸钾钠、考马斯亮蓝G-250 染色液、无水四硼酸钠、正丁醇、1,1-二苯基-2-苦基肼(DPPH)、牛血清蛋白(BSA)、苯甲基磺酰氯、三氯乙酸、奎诺二甲基丙烯酸酯(Trolox)、偶氮二异丁脒盐酸盐(AAPH)、荧光素钠 分析纯,上海麦克林生化科技有限公司。
HPLC-16 高效液相色谱仪、UV-2700 紫外分光光度计、IRAffinity-1 红外吸收光谱仪 岛津仪器有限公司;Biotek synergy2 多功能酶标仪 美国伯腾仪器有限公司;LGJ-10A 冷冻干燥器 上海贺帆仪器有限公司;HR/20M 冷冻离心机 湖南赫西仪器装备有限公司。
1.2 实验方法
1.2.1 白芨粗多糖的提取 参考Zhao 等[21]的方法使用500 mL 90%乙醇作为溶剂对100 g 白芨粉末进行预处理4 h,以去除色素等乙醇可溶性成分。过滤后,收集残留物在真空干燥箱55 ℃下干燥,将干燥后的白芨粉末索氏提取6 h 除去脂肪,再次置于真空干燥箱中于50 ℃将有机溶剂充分挥发,得到预处理的白芨粉末。
将预处理的白芨粉末(20 g)和去离子水(1:30,w/v)溶解,加入相当于1%的果胶酶和纤维素酶(pH=5)在35 ℃、80 W 功率超声提取3 h,在此期间不断搅拌,结束后过滤,取滤液使用旋转蒸发仪浓缩体积至初始体积的1/3,向浓缩后的提取液中添加4 倍提取液体积的无水乙醇,4 ℃静置12 h,过滤后用无水乙醇洗涤,去离子水溶解,将水相用去离子水在25 ℃下透析48 h(截留相对分子质量3600 Da)后在-37 ℃冷冻干燥12 h 后得到粗白芨多糖。
1.2.2 白芨粗多糖脱蛋白方法的初步筛选 配制质量浓度为10 g/L 的粗白芨多糖水溶液。分别用TCA 法、Sevage 法、乙腈法脱除BSP 中的蛋白质,以多糖保留率和蛋白脱除率综合评分来筛选每种脱蛋白方法的最佳条件。
1.2.2.1 不同脱蛋白方法设计 a.Sevage 法:参考Chaubey 等[22]的方法,取5 组质量浓度为10 g/L 的BSP 水溶液50 mL,加入等体积的4:1 氯仿-正丁醇溶液,分别萃取1、2、3、4、5 次,6000 r/min 离心30 min 取上清液,将水相清液用去离子水在25 ℃下透析 48 h(截留相对分子质量3600 Da)后在-37 ℃下冷冻干燥 12 h,得到5 组精制的白芨多糖样品,分别记为Q1、Q2、Q3、Q4、Q5,再进行后续实验。
b.乙腈法:参考冷桃花等[23]的方法取5 组质量浓度为10 g/L 的BSP 水溶液50 mL,分别加入浓度为20%、40%、60%、80%、100%等体积的乙腈溶液,搅拌30 min,放入冰箱4 ℃静置12 h,取出后6000 r/min 离心30 min 取上清液,将水相清液用去离子水在25 ℃下透析48 h(截留相对分子质量3600 Da)后在-37 ℃下冷冻干燥12 h,得到5 组精制的白芨多糖样品,分别记为H1、H2、H3、H4、H5,再进行后续实验。
c.TCA 法:参考杨培等[24]的方法取5 组质量浓度为10 g/L 的BSP 水溶液50 mL,分别加入浓度为2%、5%、10%、15%、20%等体积的三氯乙酸溶液,搅拌30 min,放入冰箱4 ℃静置12 h,取出后6000 r/min离心30 min 取上清液, 将水相清液用去离子水在25 ℃下透析 48 h(截留相对分子质量 3600 Da)后在-37 ℃下冷冻干燥 12 h,得到5 组精制的白芨多糖样品,分别记为W1、W2、W3、W4、W5,再进行后续实验。
1.2.2.2 多糖保留率的计算 多糖含量参考Chen等[25]以总糖含量减去可溶性糖含量来计算。按式(1)计算多糖保留率。
a.总糖:参考Qin 等[26]的方法,葡萄糖作为标准品。绘制回归方程y=5.9037x+0.3751(R2=0.9991);通过回归方程计算样品总糖含量。
b.可溶性糖:参考《NY/T 2742-2015》测定,以葡萄糖作为标准品。绘制回归方程y=2.0161x+0.0387(R2=0.9992),通过回归方程计算样品可溶性糖含量。
式中:PO为多糖保留率(%);a1为样品脱除蛋白前总糖的质量浓度(mg/mg);a2为样品脱除蛋白后总糖的质量浓度(mg/mg);b1为样品脱除蛋白前可溶性糖的质量浓度(mg/mg);b2为样品脱除蛋白后可溶性糖的质量浓度(mg/mg)。
1.2.2.3 蛋白质脱除率的计算 蛋白质采用考马斯亮蓝法[27]测定,以牛血清白蛋白(BSA)作为标准品。绘制回归方程y=3.5184x+0.4851(R2=0.9958),通过回归方程计算样品蛋白质含量;按照式(2)计算蛋白质脱除率。
式中:PR为蛋白质脱除率(%);c1为样品脱除蛋白前蛋白质的质量浓度(mg/mg);c2为样品脱除蛋白后蛋白质的质量浓度(mg/mg)。
1.2.3 综合评分的计算 本实验采取加权计算法,测定了Sevage 法、乙腈法、TCA 法不同处理条件的精制白芨多糖样品的多糖保留率、蛋白质脱除率,以综合评分[28]作为各脱蛋白方法蛋白质脱除效果的评价指标,比较综合评分数值大小筛选出最佳条件,通过式(3)计算。
1.2.4 不同脱蛋白方法最优条件下纯化白芨粗多糖
根据1.2.2 得出的各种脱蛋白方法的较优条件进行脱蛋白处理,通过化学成分含量、结构表征和抗氧化活性来评价其影响评价其纯化效果。
1.2.5 多糖结构
1.2.5.1 BSP 单糖含量测定 BSP 单糖的测定参考甘小凤等[29]的PMP 柱前衍生法,高效液相色谱仪(HPLC)配岛津InertsilODS-3(250 mm×4.6 mm,5 μm)色谱柱;配备型号为SPD-16 紫外检测器;流动相为0.05 mol/L 磷酸盐缓冲液(含0.1%乙酸)(A)-乙腈(B),梯度洗脱:0~10 min,74% A,10~15 min,74%~78% A,15~25 min,78% A,柱温及检测器温度40 ℃;体积流量0.8 mL/min;检测波长254 nm;进样量20 μL。使用葡萄糖、果糖、半乳糖、木糖、甘露糖、鼠李糖作为标准,各单糖回归方程、决定系数、线性范围见表1。
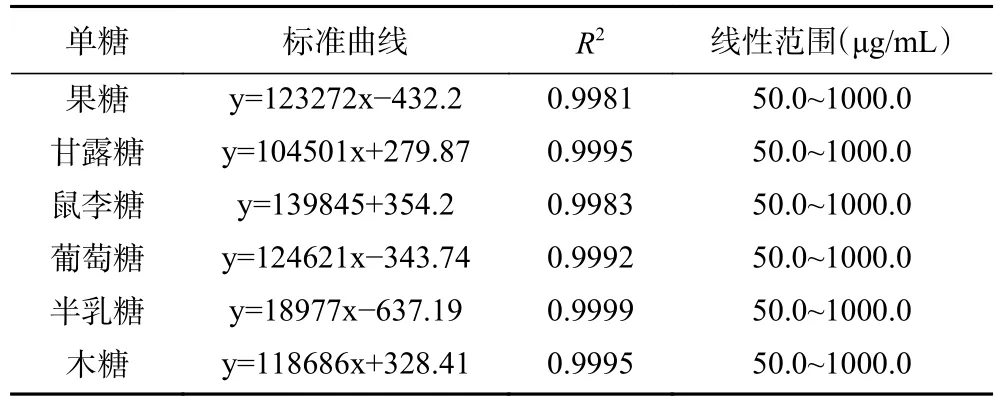
表1 各单糖标准曲线、决定系数、线性范围Table 1 Standard curve, determination coefficient, linear range for each monosaccharide
1.2.5.2 UV 测试 取少量经过不同脱蛋白方法处理后的多糖样品用适量去离子水溶解,用紫外分光光度计于200~800 nm 进行光谱扫描。
1.2.5.3 FTIR 测试 称取少量经过不同脱蛋白方法处理后的多糖样品置于研钵中,与干燥的KBr 粉末研磨和压片。使用傅里叶变换红外光谱仪进行测试,波数范围为4000~400 cm-1。
1.2.6 体外抗氧化活性检测
1.2.6.1 DPPH 自由基清除能力评价 参考Fan 等[30]的方法测定多糖样品自由基半数清除浓度IC50。配制成不同浓度样品液(2.0、4.0、6.0、8.0、10.0 mg/mL)各2.0 mL,加入2.0 mL 的DPPH 溶液,混合均匀,避光反应30 min 后,在517 nm 波长下测定吸光度,用50%体积分数的乙醇调零,每个样品开展3 次平行测定,取平均值。按式(4)计算DPPH 自由基清除率:
式中:A0:2.0 mL 50%体积分数乙醇代替多糖溶液的吸光度;A1:不同样品液的吸光度;A2:2.0 mL 50%体积分数乙醇代替DPPH 的吸光度。
1.2.6.2 氧自由基吸收能力(ORAC)评价 参照陈春[31]的方法,试剂和样品溶液均用磷酸钾缓冲液(75 mmol/L,pH7.4)配制。在孔板中加入20 μL 多糖样品溶液或20 μL 不同浓度Trolox 标准液(1.5625、3.125、6.25、12.5、25、50 μmol/L)随后加入200 μL 荧光素钠(0.0478 μmol/L)。设定酶标仪摇动混合物10 s,并在37 ℃下预孵化10 min。在每个孔中加入20 μL AAPH(119.4 mmol/L)后,使用酶标仪测量荧光强度,激发波长为485 nm,发射波长为538 nm,在37 ℃下每1.5 min 测定1 次。根据不同浓度的Trolox 标准溶液中的荧光猝灭净面积(NETAUC)得到标准曲线Y=4.312X+3.461(R2=0.9985)。ORAC 值以每克样品中Trolox 的质量分数(μmol TE/g)表示。
1.2.7 熵权TOPSIS
1.2.7.1 评价体系设计 在参考前人研究[32]的基础上,分别从化学成分(I1)、多糖结构(I2)、体外抗氧化活性(I3)3 个层面出发,设计了包括总糖保留率、还原糖保留率、蛋白脱除率等在内的9 个具体指标构成的不同方法脱蛋白评价体系。其中,评价指标分为正向指标和负向指标,如 表2 和表3 所示。

表2 白芨多糖除蛋白评价体系Table 2 BSP protein removal evaluation system
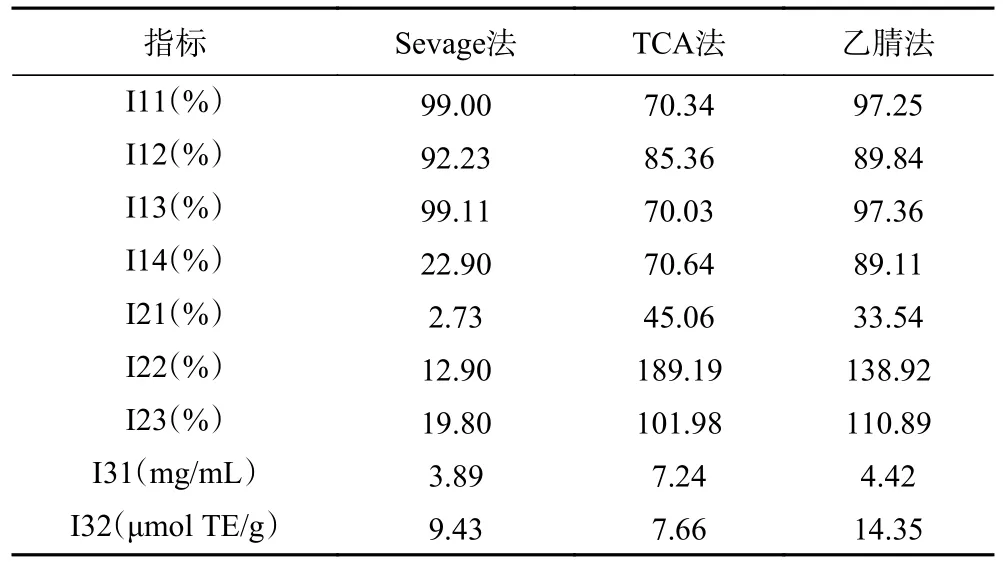
表3 白芨多糖除蛋白评价体系各指标Table 3 Indexes of the protein removal evaluation system of BSP
1.2.7.2 指标计算与说明 a.化学成分:供给指标共有4 个,以总糖保留率为例,本研究使用的指标计算公式为:
式中:Tx 为总糖保留率;a1为样品脱除蛋白前总糖的质量浓度;a2为样品脱除蛋白后总糖的质量浓度。
b.粗多糖结构:本文粗多糖结构的研究表明BSP 主要有葡萄糖、甘露糖、木糖组成,本研究主要以这三种单糖的占比变化为依据来评价。通过相对变化率来描述各单糖的受影响的强弱,在计算各单糖变化率时,还应考虑其在多糖中的占比。本研究设计的反应供给指标有3 个。以葡萄糖相对变化率为例,本研究使用的指标计算公式为:
式中:G 为葡萄糖相对变化率;G0为脱蛋白处理前葡萄糖占比;G1为脱蛋白处理后葡萄糖占比。
c.体外抗氧化活性:供给指标有2 个,以DPPH半数清除浓度为例,本指标的计算来源为DPPH 清除率达到50%时对应的BSP 浓度。
1.2.7.3 归一化处理 对原始实验数据进行归一化处理,计算指标性质为正,即越大越优型(X*ij);计算指标为负,即指标越小越优型(X*ij)。
式中:Xij表示第i 被评价主体中第j 指标的原始数值;表示是第i 个评价对象中第j 个指标的标准化值;min(Xj)表示该组原始数值中的极小值;max(Xj)表示该组原始数值中的极大值。
1.2.7.4 指标权重占比和信息熵的计算 根据公式(7)(8)(9)(10)(11)式计算出各评价指标的权重和信息熵。
式中:rij表示计算第j 项指标下第i 个评价对象的特征比重(贡献度);yij表示是第i 个评价对象中第j 个指标的标准化值;m 为评价对象的个数;n 为评价指标的个数;ej为信息熵;wj为权重。

1.3 数据处理
所有实验重复3 次,结果以“平均值±标准差”来表示,数据采用IBM SPSS Statistic 26 统计软件进行分析,图形采用Origin 2021、ChemDraw 20.0 进行绘制,显著性分析采用ANOVA 法,不同小写字母表示差异性显著(P<0.05)。
2 结果与分析
2.1 综合评分及最佳条件的筛选
图2A 为Sevage 法中不同萃取次数对综合评分及多糖保留率和蛋白质脱除率的影响。由图中观察和分析可知,Sevage 法(Q1、Q2、Q3、Q4、Q5)综合评分分别为61.01、52.08、52.70、52.43、44.82;随萃取次数的增加整体呈下降趋势,在萃取次数为1 次时综合评分最高。Sevage 法对BSP 蛋白质具有脱除效果,且蛋白质脱除率与萃取次数呈正相关,随萃取次数增加有明显的上升趋势,但效率较低,当萃取5 次后其脱除率只有55.36%;Sevage 试剂对BSP 存在损耗作用,保留率与萃取次数呈负相关,随萃取次数增加有明显下降趋势,当萃取2 次时多糖保留率大幅度下降至64.12%。其中的原因可能有以下两点:其一,氯仿对蛋白变性起主要作用,溶液中的蛋白质变性而分离清除蛋白质[33],处理次数越多,脱除率越高;其二,正丁醇对多糖溶解起一定作用[34],并且在纯化过程中,出现乳化现象[35],难免有多糖的损失。
图2B 为乙腈法中不同浓度乙腈对综合评分及多糖保留率和蛋白脱除率的影响。乙腈法(H1、H2、H3、H4、H5)综合评分分别为58.31、80.59、93.24、67.66、65.04;随乙腈浓度增加先升高后降低,当浓度达到60%时综合评分达到最高。蛋白脱除率与乙腈浓度呈正相关,随浓度升高有明显上升趋势,浓度达60%蛋白脱除率高达85%,并且当小于此浓度时,对于BSP 的损耗现象不明显,主要体现在具有较高的多糖保留率(>90%)。这可能是由于肽和一些小分子量蛋白能溶于乙腈溶液,而许多大分子蛋白被沉淀出去[36],当浓度达到60%时大分子沉淀完全,BSP 溶液蛋白质含量几乎不再改变。
图2C 为TCA 法中不同浓度TCA 对综合评分及多糖保留率和蛋白质脱除率的影响。分析可知,TCA 法(W1、W2、W3、W4、W5)综合评分分别为68.25、68.87、70.34、65.12、59.84;随TCA 浓度升高呈现出先升高后降低的趋势,在TCA 浓度达到10%时综合评分达到最高。TCA 试剂对与BSP 蛋白质有明显的脱除效果,TCA 浓度低于15%时蛋白质脱除率与TCA 浓度呈显著性相关(P<0.05),多糖保留率与TCA 浓度呈显著性相关(P<0.05);多糖保留率随TCA 浓度增大而降低,蛋白质脱除率随TCA 浓度增大而升高,而TCA 浓度达到15%以后变化不明显。具体原因可能存在以下两点:其一,TCA 与蛋白质形成了不溶性盐,并且TCA 使蛋白质构象发生改变,暴露出较多的疏水性基团而聚集沉淀[37],质量浓度达到15%时此现象达到了饱和;其二,除了游离蛋白质,TCA 的加入还促进了多糖-蛋白质复合物[38]降解,并且随TCA 量增多加剧了此现象。
比较三种处理方法不同处理条件综合指标,对处理条件的初步筛选,分别选择Sevage 法萃取1 次;乙腈法乙腈质量浓度为60%;TCA 法TCA 质量浓度为10%(Q1、H3、W3)进行后续的研究。
2.2 脱蛋白处理对多糖结构的影响
2.2.1 单糖组成 不同脱蛋白方法处理的BSP 中各单糖高效液相色谱图及其组分占比如图3 和表4 所示,未进行脱蛋白处理的BSP 主要由葡萄糖和甘露糖组成,并伴有较少量的木糖。各单糖的摩尔占比为18.6:80.39:1.01,其中木糖成分较少。TCA 法、Sevage 法、乙腈法对BSP 单糖组分均存在影响,Sevage 法更好地保持了各单糖组分的占比,而乙腈法和TCA 法增加了甘露糖占比,减少了葡萄糖占比,对其各单糖占比影响较大。结果表明,不同脱蛋白处理对BSP 的影响不同,Sevage 法纯化蛋白能更好地保持各单糖的组分占比。

表4 不同脱蛋白方法处理的BSP 中各单糖组分占比Table 4 Proportion of monosaccharide components in BSP treated by different deproteinization methods
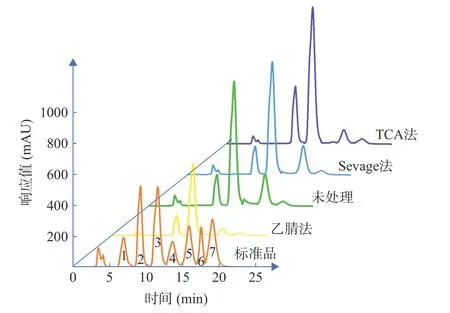
图3 不同脱蛋白方法处理的BSP 各单糖高效液相色谱图Fig.3 High performance liquid chromatograms of BSP monosaccharides treated by different deproteinization methods
2.2.2 UV 分析 图4 为不同脱蛋白处理BSP 的UV 分析图,未处理组BSP 溶液在280 nm 附近有较强的紫外吸收峰,经过三种不同脱蛋白处理紫外吸收强度均有降低。值得注意的是,乙腈法处理的BSP溶液其280 nm 处吸收强度下降最多,其原因可能是蛋白质中酪氨酸和色氨酸残基的苯环含有共轭双键,所以蛋白质溶液在275~280 nm 处具有一个吸收紫外吸收高峰[39],在一定浓度范围内,蛋白质溶液在最大吸收波长处的吸光度与其浓度成正比[40],表明乙腈法对于BSP 的蛋白脱除效果最好。
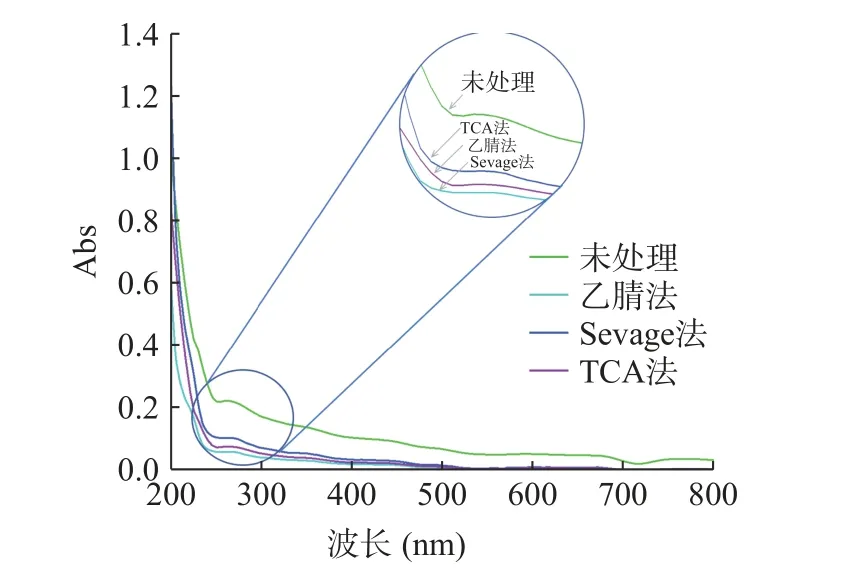
图4 不同脱蛋白方法处理BSP 的UV 分析图Fig.4 UV analysis plot of BSP treated with different deproteinization methods
2.2.3 FTIR 分析 不同脱蛋白方法处理BSP 的FTIR 谱图如图5 所示,各FTIR 图谱中的吸收峰均表明,出现在3200~3500 cm-1波段是由拉伸振动OH 引起的,在约2900 cm-1的弱信号峰表明C-H 的不对称拉伸振动,出现在1000~1200 cm-1的波段是由吡喃糖中的C-O-C 苷键拉伸振动[41]引起的。在1600 cm-1处没有明显的吸收峰,可以推断白芨多糖中几乎不含糖醛酸,799 cm-1和884 cm-1处的吸收峰为甘露糖和葡萄糖残基,有α-构型和β-构型的存在[42],这与单糖组成研究的结果相对应。结果表明不同脱蛋白方式对于BSP 的FTIR 图谱存在影响,但其特征峰基本没有变化。
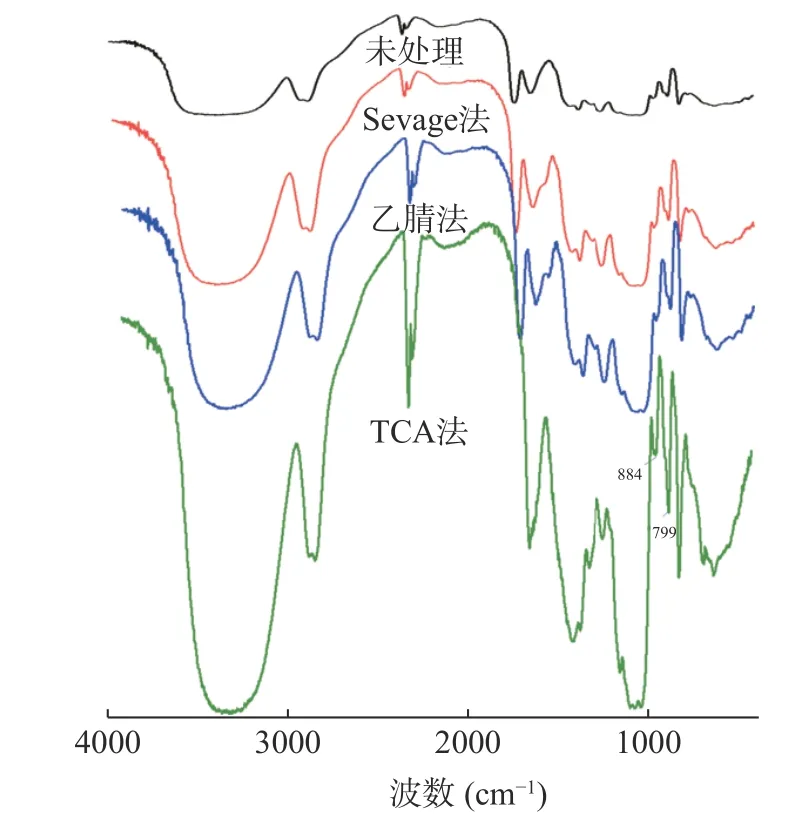
图5 不同脱蛋白方法处理BSP 的FTIR 谱图Fig.5 FTIR spectra of different deproteinization methods for BSP
2.3 脱蛋白处理对多糖体外抗氧化活性的影响
不同脱蛋白方法对BSP 体外抗氧化活性的影响如图6 所示。经过不同脱蛋白方法处理的BSP 体外抗氧化活性发生明显变化,具体体现在DPPH 半数清除浓度IC50和氧化自由基能力的改变,从强到弱依次为Sevage 法、乙腈法、TCA 法。未进行除蛋白处理的BSP 作为阳性对照组,DPPH 半数清除浓度IC50为3.78 mg/mL,ORAC 值为12.34 μmol TE/g;值得注意的是乙腈法处理后的BSP 氧化自由基能力显著高于阳性对照组(P<0.05)。不同方式处理的BSP在体外抗氧化活性上存在具体差异可能与其BSP 结构的改变[43]和某些多肽物质的保留有关,多糖具有-OH、-COOH 等可供氢官能团,这些官能团可以提供氢离子中和自由基中的未配对电子[44],实现自由基的清除;分子量较小的多肽因其具有较小的空间位阻,能更好地与自由基发生反应[45],表现出较高的DPPH 自由基清除率,这与有着保留较好多糖结构和较高蛋白含量的Sevage 法处理的白芨多糖的抗氧化活性研究结果相一致。
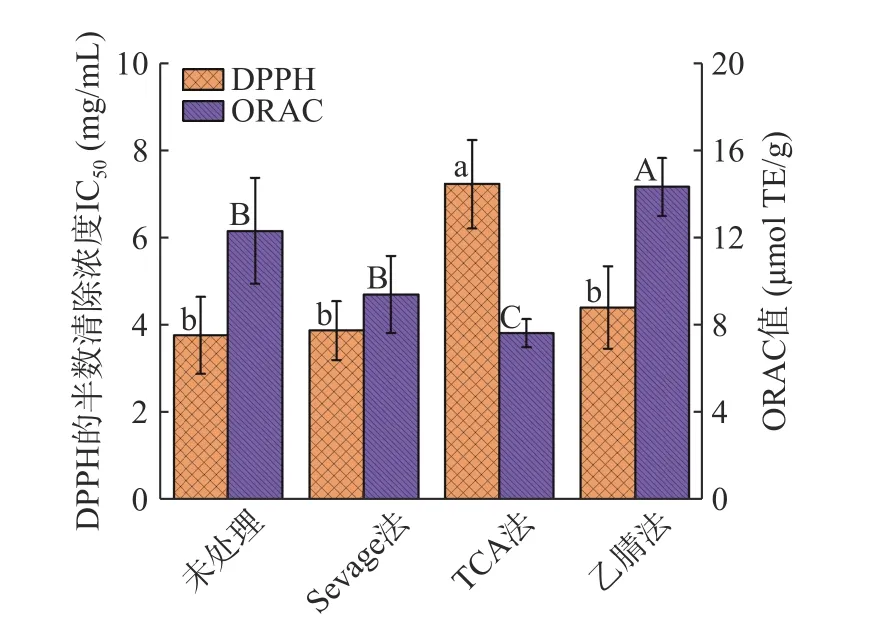
图6 不同脱蛋白方法处理对BSP 体外抗氧化活性的影响Fig.6 Effects of different deproteinization treatments on antioxidant activity of BSP in vitro
2.4 熵权TOPSIS 分析
2.4.1 指标权重占比和信息熵的评价 结果见表5,一级指标中,化学成分占比最高(38.18%),体外抗氧化活性占比最低(23.12%),二级指标中木糖相对变化率最高(17.10%),总糖保留率、多糖保留率、葡萄糖相对变化率占比最低(9.51%)。表明一级指标中化学成分的变化在脱蛋白评价系统中占最重要的因素,而体外抗氧化活性在脱蛋白评价体系中重要性偏低;二级指标中总糖保留率、多糖保留率、葡萄糖相对变化率在评价体系中的影响相同,木糖相对变化率影响最大。

表5 各指标权重占比和信息熵Table 5 Weight ratio and information entropy of each indicator
2.4.2 指标TOPSIS 综合评价 结果见表6,对各指标TOPSIS 综合评价,得出三种处理方法的综合评价大小顺序为Sevage 法>乙腈法>TCA 法,其中Sevage 法值最大,说明Sevage 法与理想解最逼近,表明Sevage 法最优,与秦宇等[46]和杨斌旺等[47]的研究结果相符,符合预期结果。

表6 三种除蛋白方案综合评价Table 6 Comprehensive evaluation of three protein removal regimens
3 结论
本研究采用三种不同的除蛋白方法,对BSP 进行处理,通过计算多糖保留率和蛋白质脱除率的均值筛选最佳处理条件,同时对最佳处理条件得到的三种多糖进行多糖结构和抗氧化活性的分析,并对三种处理条件BSP 进行了UV 和FTIR 图谱表征,最后通过熵权TOPSIS 法进行综合评价。结果表明:通过综合评价筛选出最佳处理条件为Sevage 法最佳萃取次数为1 次,此时的蛋白质脱除率为22.9%,多糖保留率为99.11%;乙腈法最佳质量浓度为60%,蛋白质脱除率为89.11%,多糖保留率为97.36%;TCA 法最佳质量浓度为10%,蛋白质脱除率为70.64%,多糖保留率为70.03%;根据各项检测指标可以看出,不同处理方法对BSP 的影响存在明显差异,Sevage 法对BSP 结构、体外抗氧化活性影响最小,对BSP 生物活性有较好的保留;TCA 法对BSP 结构等有较大的改变,其FTIR 图谱也证实了这个结论;乙腈法对BSP 损耗效果最小,蛋白脱除效果最好,与UV 扫描结果相吻合;三种脱蛋白处理方案对BSP 的FTIR图谱均有影响,但其特征峰基本不变。研究结果表明熵权TOPSIS 可以作为白芨多糖脱蛋白体系的客观评价,对白芨多糖脱蛋白工艺研究具有一定的参考价值。然而本研究也存在评价体系复杂、个别指标权重占比不合理的问题,从此次综合排名来看,Sevage法明显效果更好,该法具有较高的多糖保留率并且对于BSP 结构和抗氧化活性影响较小,但存在蛋白质脱除率低、操作复杂等缺陷;如何简化体系、合理分配各指标权重占比、将操作难易程度等非数据因素并入体系内是在今后的研究中需要进行探索和解决的问题。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

