15三体嵌合体:羊水穿刺产前诊断及胎儿组织的遗传检测*
孙惠霖,刘建兵,许孟军,张庆娥,应菲菲,安 宁,李 敏**
[扬州大学医学院附属盐城妇幼保健院(盐城市妇幼保健院)a.医学遗传中心;b.产前诊断中心,盐城 224007]
常染色体三体的胚胎和胎儿流产风险较高,其中15三体占所有三体自然流产的7.6%,是自然流产中最常见的细胞遗传学异常之一[1]。完全型15三体无生存能力,出生后会因严重畸形而过早死亡,关于15三体表型的报道多见于15三体嵌合体。减数分裂不分离导致的三体自救和胚胎有丝分裂不分离是15三体嵌合体形成的可能原因[2]。由于遗传背景和临床表现的广泛异质性,15三体嵌合体的临床表型尚未有明确的描述。对已报道的15三体及嵌合体活产儿进行总结,其大多存在严重的宫内生长迟缓、多器官畸形、先天性心脏缺陷、颅面畸形和非免疫性水肿等情况[3-4]。胎儿染色体嵌合体的诊断及处理一直是产前遗传咨询的难点,及时进行产前诊断可减少此类严重出生缺陷的发生,减轻家庭和社会的经济压力及精神负担。无创胎儿DNA筛查(non-invasive prenatal testing,NIPT)通过检测孕妇血液中胎儿游离的DNA评估胎儿非整倍体的风险,但仍存在检测结果与真实核型不一致的情况。本研究应用染色体核型分析、染色体微阵列分析(chromosomal microarray analysis,CMA)对1例NIPT升级版提示15号染色体异常的孕妇进行产前诊断,并采用荧光原位杂交技术(fluorescence in situ hybridization,FISH)对流产物进行鉴定,为15三体嵌合体的产前诊断和遗传咨询提供依据。
1 资料与方法
1.1 基本资料 孕妇,34岁,G4P1,平素月经规律,否认近亲结婚,否认家族遗传病史,否认不良接触史,本次妊娠无不适。孕16+4周于本中心行产前筛查,经知情同意,自愿选择NIPT升级版进行产前筛查。后因NIPT升级版报告提示15号染色体异常进行产前诊断及遗传咨询,告知羊膜腔穿刺术风险及染色体核型分析与CMA的局限性,签署知情同意书后,孕20周在超声引导下行羊膜腔穿刺术。胎儿羊水染色体核型及CMA检测结果均为15三体嵌合体,建议二次羊膜腔穿刺产前诊断行FISH检测进一步明确嵌合比例。经遗传咨询,充分告知且知情同意下,孕妇及其家属拒绝二次产前诊断,决定孕23周结束妊娠,拒绝引产胎儿病理检查,接受取少许羊水及胎盘FISH检测验证。本研究经本院伦理会审查批准。
1.2 方法
1.2.1 样本采集 经充分知情同意,孕妇行超声下经腹羊膜腔穿刺术,抽取羊水。为避免母体细胞污染弃最初的1~2mL,留30~40mL羊水。其中20mL细胞培养行染色体核型分析,10mL行染色体微阵列分析。取流产羊水10mL及胎盘组织行FISH检测验证。
1.2.2 染色体核型分析 将20mL羊水注入2支无菌离心管,每支10mL,离心后在无菌操作条件下接种于2个培养瓶,在2个培养箱中静置进行双线培养。设置培养条件温度为37℃,CO2浓度为5%~6%。经培养、换液、收获、制片及G显带进行核型分析,计数20个分裂相,分析5个核型,因嵌合型加大计数至60个。
1.2.3 染色体微阵列分析 对未培养的10mL羊水进行基因组DNA提取。使用核酸提取磁珠试剂盒(厦门致善),使用高密度SNP芯片Affymetrix CytoScan 750K,对胎儿进行全基因组染色体拷贝数检测,应用ChAS(Thermo Fisher,Affymetrix,美国)软件针对芯片扫描结果。实验包括质控、酶切、PCR、纯化、标记、杂交及扫描等步骤,操作过程严格按试剂和仪器操作说明书进行。通过DGV(人群多态性数据库)、ClinGen(人类基因组变异数据库)、ClinVar(人类基因组变异数据库)、Decipher(疾病数据库)及本地数据库对拷贝数变异进行评估。
1.2.4 FISH检测 采用CEP15探针对经处理、变性、杂交、洗涤等操作的羊水及胎盘组织进行荧光原位杂交,在荧光显微镜下观察荧光信号,计数100个,分析100个。
2 结 果
羊水染色体核型分析结果47,XN,+15[4]/46,XN[56]即胎儿为15三体嵌合体,嵌合比例约为6.67%,见图1。羊水CMA检测结果提示未见有临床意义的杂合性缺失,arr(15)×2~3,15号染色体嵌合型重复(拷贝数=2~3),即胎儿为15三体嵌合体,嵌合比例约为70%,见图2。孕23周羊水FISH检测验证结果为nuc ish(D15Z1)x3[48]/(D15Z1)x2[52],即为15三体嵌合体,嵌合比例约为48%,见图3;流产胎盘检测结果为nuc ish(D15Z1)x3[39]/(D15Z1)x2[61],即为15三体嵌合体,嵌合比例约为39%,见图4。
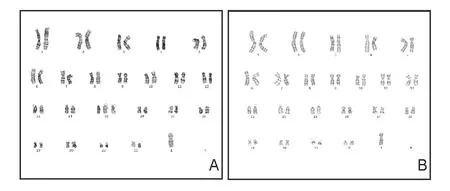
图1 羊水细胞染色体核型A:47,XN,+15;B:46,XN
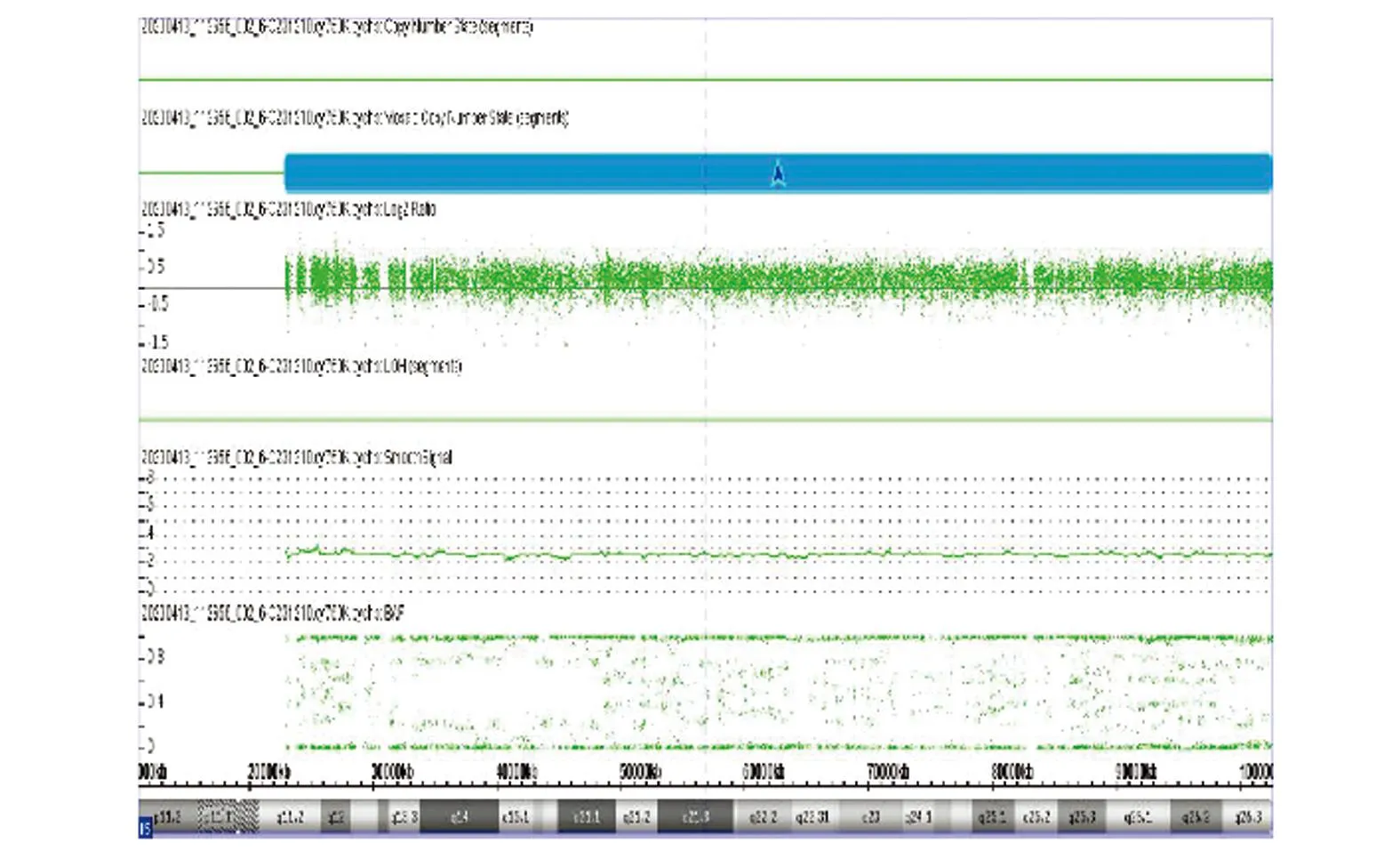
图2 羊水CMA检测分析

图3 流产羊水FISH检测A:nuc ish(D15Z1)x3;B:nuc ish(D15Z1)x2
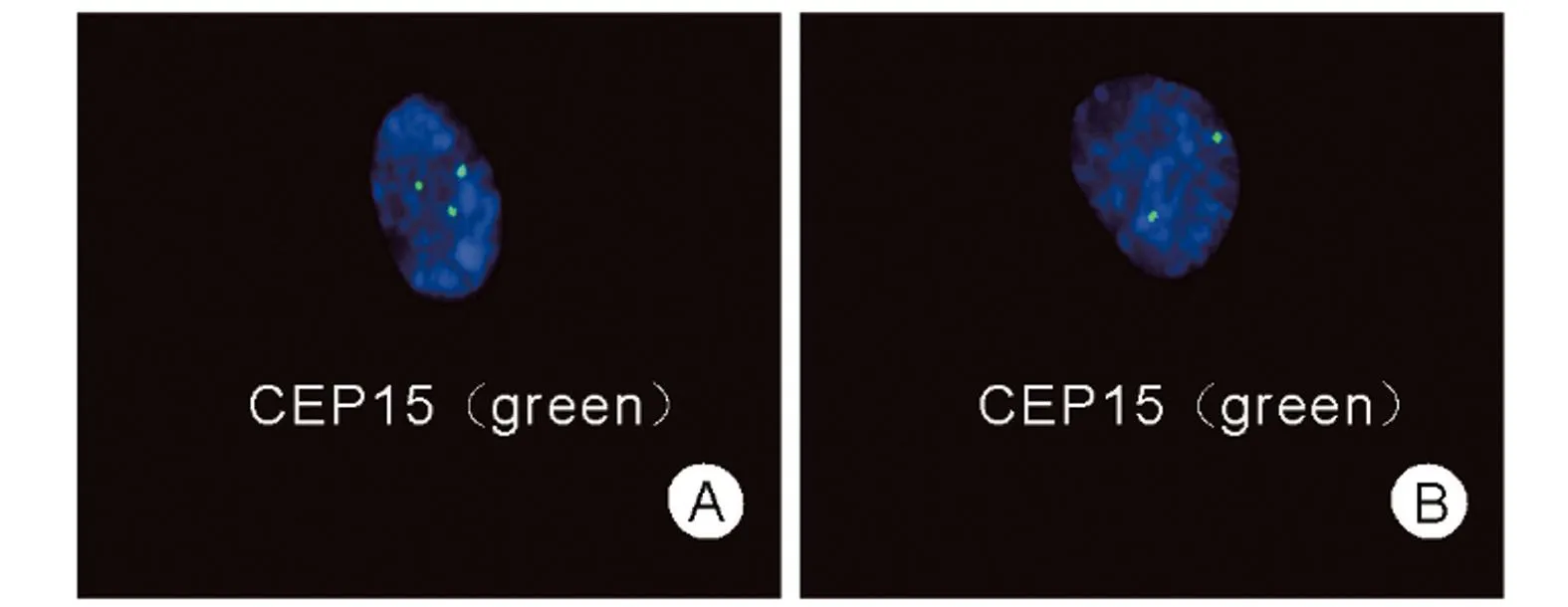
图4 流产胎盘FISH检测A:nuc ish(D15Z1)x3;B:nuc ish(D15Z1)x2
3 讨 论
目前NIPT已成为我院孕妇产前筛查的常规项目,全基因组测序技术除可检测目的染色体的非整倍体(21三体、18三体以及13三体)之外还能发现其他染色体数目异常或部分染色体缺失重复,但阳性预测值较低。孕妇血浆中游离的胎儿DNA主要来源于滋养层或胎盘细胞的凋亡,局限性胎盘嵌合(confined placental mosaicism,CPM)、母体染色体嵌合体、母体肿瘤、母体拷贝数变异和消失的双胎等因素均会造成NIPT结果的假阳性[5]。胎盘存在两种或多种细胞系嵌合而胎儿染色体核型正常即为CPM,这会导致胎儿染色体虽为正常的二倍体而NIPT结果呈阳性,是NIPT假阳性的主要生物学原因[6-7]。羊水细胞包含了来自胚胎三个胚层从未分化的祖细胞到成熟分化的细胞,包括泌尿生殖道、呼吸道和上皮系统,含有肾、心、肺、肝和造血细胞系的细胞,能更真实地反应胎儿血浆状况[8-9]。为排除假阳性,且考虑胎儿15三体嵌合体的可能,我院对该NIPT阳性结果孕妇进一步产前诊断,行侵入性羊水穿刺术进行染色体核型分析和CMA检测。
染色体核型分析一直被视为产前诊断中判断胎儿染色体异常与否的“金标准”,但该方法仍存在培养周期长、分辨率较低等不足[10]。此外,细胞培养倾向于促进嵌合体中整倍体细胞的生长,这导致染色体核型分析对低比率的嵌合漏检,核型分析对嵌合比例的检测下限约为5%[11]。对未经培养的胎儿绒毛膜或羊水细胞进行CMA检测周转时间更短、分辨率更高且能避免细胞培养带来的影响,但仍存在无法检测平衡易位,倒位及低比例嵌合等缺点。本研究中使用的750K SNP微阵列对嵌合体的检测下限达10%[12]。产前染色体嵌合体诊断的原则要求至少两种检测技术均检出嵌合才能确立真性嵌合体[13],细胞遗传学和分子遗传学技术联合使用可有效避免假性嵌合导致的不必要的产前干预。
经检测,该胎儿为真性嵌合体,但检出的三体嵌合比例存在较大差异。嵌合比例会影响患者表型,一般认为非整倍体染色体的嵌合程度与疾病严重程度呈正相关,嵌合比例低表型相对温和,嵌合比例高表型更为严重[11,14]。对16例15三体嵌合体胎儿表型的回顾性分析证实上述观点[15]。准确检测妊娠期染色体的嵌合比例可有效评估疾病的严重程度,便于产前诊断遗传咨询中患者及家属对生育做出更好的知情决定。回顾实验流程和各项记录排除人为差错,对此差异展开分析。优势生长和细胞株变异会导致不同核型的细胞在培养和未培养样本之间结果不一致[16]。Chen等[17]发现未培养的羊水经细胞遗传学和分子遗传学检测均显示为15三体嵌合体,而培养后的羊水经两种方法均未检测到15三体,认为羊水细胞中15三体细胞系可能在细胞培养后消失。Wan等[12]对NIPT检出的8号染色体三体胎儿进行羊水穿刺产前诊断,CMA检测结果显示8号染色体三体嵌合比例为40%,而羊水培养分析50个细胞均为正常核型。综合分析,本研究中46,XN细胞系在羊水细胞培养过程中可能存在优势生长,而凋亡的15号染色体三体细胞仍可被分子生物学技术检测出,从而出现细胞培养的染色体核型分析检出15三体嵌合比例仅为约6.67%,而未培养的CMA检测出嵌合比例约70%。
FISH技术是染色体嵌合体验证的常用方法。染色体核型分析或CMA结果可协助FISH技术选择相应分子生物检测探针。该技术无须细胞培养,将探针与细胞核内的DNA靶序列进行杂交,能更真实地反映细胞嵌合的状况[18]。流产羊水及胎盘FISH的检测结果均为15三体嵌合体,羊水中15三体嵌合比例约为48%,胎盘中15三体嵌合比例约为39%,嵌合比例均位于此前染色体核型分析和CMA的比例中间,与我们的推测相符。同为未培养的羊水样本,孕20周CMA检测与孕23周FISH检测出的嵌合比例不同,除考虑检测技术不同带来的结果差异,还需考虑孕周增加羊水中脱落细胞的胚层组成变化及三体拯救引起三体嵌合比例逐渐降低。
综上所述,对产检过程中NIPT筛查出的15号染色体异常孕妇进行产前诊断时需考虑15三体嵌合体的可能。羊水穿刺联合细胞遗传学染色体核型分析及分子遗传学CMA进行遗传检测可为15三体嵌合体的产前诊断遗传咨询提供有效参考。对于终止妊娠的病例,对妊娠产物(如胎盘等)进行FISH检验复核可验证产前诊断的准确性。

