冷冻消融协同仑伐替尼和程序性死亡受体1单抗治疗不可切除肝细胞癌的效果及安全性分析
刘腾, 常秀娟, 何权威, 徐然, 杨永平
解放军总医院第五医学中心肝病医学部, 北京 100039
肝细胞癌(HCC)是世界第4位的癌症相关死亡原因,也是肝硬化患者死亡的主要原因之一[1]。然而,只有15%的肝癌患者有机会接受根治性治疗[2],大多数HCC患者诊断即为晚期,因此,探索不可切除性肝细胞癌(uHCC)的治疗策略是改善预后的关键。
目前局部和系统联合治疗成为uHCC临床研究的热点。常见的局部治疗包括射频消融、微波消融、冷冻消融、介入治疗等。其中冷冻消融术以其对大血管损伤小、可以降低血管相关的并发症风险、疼痛发生率低、冰球形成可控等优点得到了越来越广泛的应用[3-4]。冷冻消融也可以产生“异位抑瘤效应”,从而使局部治疗和免疫治疗获得更加持久的作用,为冷冻消融联合靶向及免疫治疗提供了理论依据[5]。
近年来,肝癌系统性治疗如索拉非尼、仑伐替尼和多纳非尼被推荐为uHCC的一线治疗药物[6-7];程序性死亡受体1(PD-1)单抗(纳武单抗、派姆单抗等)和PD-L1单抗(阿替利珠单抗)等已经获得FDA批准用于uHCC治疗[1]。尽管靶向和免疫治疗在控制肝癌进展中起着重要作用[8],但是其客观缓解率(ORR)仍不足30%,其中HCC的一线治疗方案贝伐珠单抗联合PD-L1(T+A),其ORR只有27%[9]。因此,局部联合系统治疗成为提高uHCC长期生存的关键。文献[10-11]报道,经肝动脉化疗栓塞(TACE)联合靶向药较单独靶向药相比延长了患者中位总生存期(OS)和中位无进展生存期(PFS)(P<0.05)。有研究[12-13]表明,免疫检查点抑制剂联合消融治疗提高了肝癌患者中位OS(P<0.05)。由此可以看出对于uHCC患者,局部消融联合靶向或者免疫药物治疗可以使患者获得生存受益。此外,局部冷冻消融,作为一项重要的局部治疗方式,具有其独特的优势,其可通过释放肿瘤特异性抗原引起特异性肿瘤免疫反应。因此,在冷冻消融治疗的基础上联合靶向及免疫治疗,为实现持久且强化的抗肿瘤免疫反应创造了条件[14]。然而,局部冷冻消融联合仑伐替尼和PD-1单抗治疗的疗效和安全性尚不明确。
本研究通过回顾性队列分析,探索局部冷冻消融联合仑伐替尼和PD-1单抗三联治疗uHCC的疗效和安全性。为改善uHCC患者的生存期提供新的治疗策略及循证医学依据。
1 资料与方法
1.1 研究对象 收集2018年1月—2022年12月在本中心治疗的uHCC患者。纳入标准:(1)根据美国肝病学会实践指南,经影像学(增强CT/MRI或病理学活检)诊断且接受了冷冻消融联合仑伐替尼治疗(二联)或冷冻消融联合仑伐替尼和PD-1单抗治疗(三联)的uHCC患者;(2)Child-Pugh A或B级(评分≤7分);(3)BCLC B或C期;(4)体力状况评分(ECOG PS)0~1分。排除标准:(1)合并肝转移瘤及胆管细胞癌;(2)仑伐替尼治疗周期<1个月;(3)PD-1单抗使用次数<4次;(4)有严重的合并症,包括严重的心脏、肺、肾或凝血功能障碍及其他不可控制的慢性疾病及精神病患者;(5)HIV感染者;(6)孕妇及儿童;(7)无完整的临床资料和失访患者(图1)。
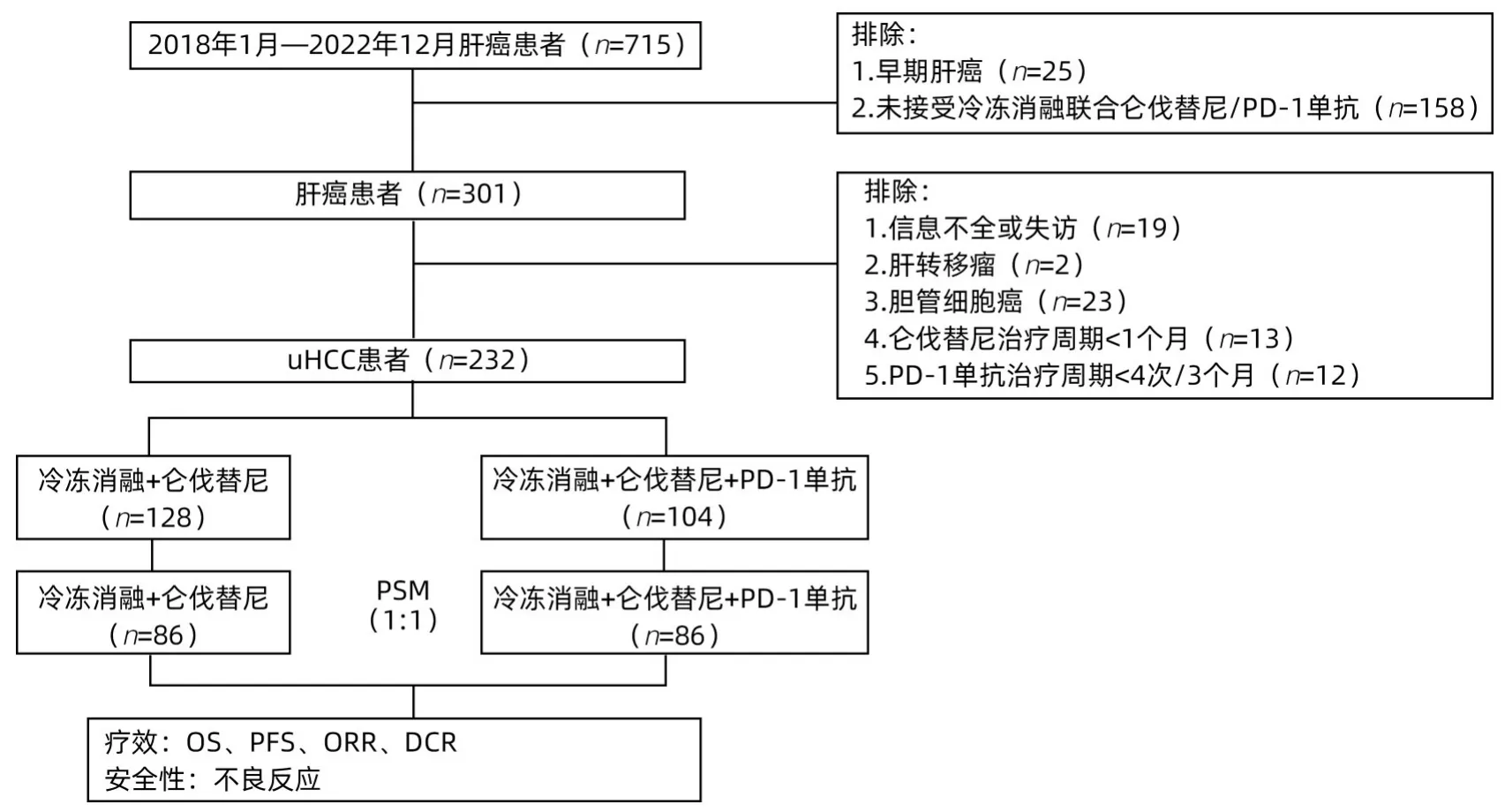
图1 患者入组流程图Figure 1 Flow chart of patient enrollment
1.2 研究方法 冷冻消融过程:使用Cryo-care system(Endocare),并在CT引导下使用冷冻探头进行双重冷冻-解冻循环。冷冻探头的位置、数目和大小根据指南确定,以确保低温探头放置在距肿瘤边缘1 cm以内,探头之间的间隔不超过2 cm。双重冻结-解冻周期包括20 min冻结,然后10 min解冻和15 min冻结。冷冻探头温度1 min内降低至(-165±2)℃。实时超声监测消融过程,以避免消融延伸至周围关键结构。一旦这些循环完成,就取出冷冻探头和止血明胶海绵(强生公司)。将止血明胶海绵塞入鞘中,填塞止血,然后将鞘取出。
根据体质量按8 mg(<60 kg)或12 mg(≥60 kg)口服仑伐替尼,每日1次。PD-1单抗200 mg静滴,每3周1次。药物剂量调整根据药物说明书进行。每隔8~12周使用修订的实体肿瘤反应评估标准(mRECIST)评估患者对治疗的反应。直到病情进展或不可接受的毒性或其他原因停药。
1.3 疗效评价 OS指从治疗开始至(因任何原因)死亡或最后1次随访之间的时间。PFS指从治疗开始到肿瘤发生(任何方面)进展或(因任何原因)死亡或最后1次随访之间的时间(已先发生者为准)。根据mRECIST标准进行疗效评价,包括肿瘤反应完全反应(complete response,CR)、部分反应(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)、客观缓解率(ORR)、疾病控制率(DCR);ORR定义为CR与PR之和;DCR定义为CR、PR和SD的总和。
1.4 安全性评价 根据CTCAE 5.0版评估不良事件等级,1级:轻度;无症状或轻微;仅为临床或诊断所见;无需治疗。2级:中度;需要较小、局部或非侵入性治疗;与年龄相当的工具性日常生活活动受限。3级:严重或者具重要医学意义但不会立即危及生命;导致住院或者延长住院时间;致残;自理性日常生活活动受限。4级:危及生命;需要紧急治疗。5级:与不良事件相关的死亡。
1.5 随访 最后1次随访于2023年5月30日结束。疗效随访为初始治疗后每3个月进行定期随访。每次随访包括详细病史,体格检查,血液学和生化检查,腹部增强CT或MRI,胸部CT和其他影像学检查,实验室检查具体包括PLT、肝功能、AFP等。在随访期间,如果出现无法忍受的毒性反应、肿瘤进展或改变治疗计划,则可停止治疗。根据多学科小组的讨论结果和患者的要求,确定后续治疗的选择,如二线靶向药物、PD-1抑制剂(用于二联治疗的患者)、放疗(包括I125粒子近距离放疗)、TACE、肝动脉灌注化疗(HAIC)或最佳支持治疗。
1.6 统计学方法 通过SPSS 26、GraphPad Prism 9、R 4.0软件来进行数据分析。为了避免回顾性队列研究中的选择偏倚,使用倾向性匹配法(PSM)1∶1配对。通过使用Logit模型,确定了可能影响疗效的因素,包括ECOG表现状态、年龄、性别、BMI、疾病病因、基线肝功能、门静脉癌栓程度、基线AFP水平、既往接受的治疗、BCLC分级、Child分级、门静脉高压、有无远处转移等。定量资料若符合正态分布则采用表示,2组间比较采用成组t检验;非正态分布则采用M(P25~P75)表示,2组间比较采用Mann-WhitneyU检验。定性资料采用χ2检验用于2组间比较。绘制生存曲线,运用Kaplan-Meier法得出2组患者的生存率,并利用Log-rank检验比较2组差异。通过Cox回归模型计算风险比(HR)和95%置信区间(95%CI),实现预后影响因素的单因素及多因素分析。P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料 232例患者被纳入PSM分析,经匹配后,选择172例可比较的HCC患者(1∶1匹配)进行分析,三联和二联组均86例(图1)。匹配后减少了2组间差异,所纳入分析因素在2组中都均衡(P值均>0.05)。PSM后整体队列中<60岁的患者比例高于≥60岁,而且男性占比高。157例(91.2%)患者HBV单一感染,三联组和二联组占比分别为93.0%和89.5%;仅有2例患者无肝硬化病史。多数入组患者为多发病灶,三联有74例(86%),二联有69例(80.2%)。多数患者有血管侵犯,三联55例(64.0%),二联58例(67.4%),2组远处转移患者分别有34例(39.5%)、28例(32.6%)。124例(73%)BCLC C期患者,三联和二联组分别为60例(69.8%)、64例(74.4%);大多数患者为Child A期,三联和二联组分别有55例(64.0%)、60例(69.8%)。ALBI分级2级人群最多,三联和二联分别有65例(75.6%)、62例(72.1%)。匹配后ECOG评估均为1分,大多数患者曾接受过癌症相关治疗(表1)。
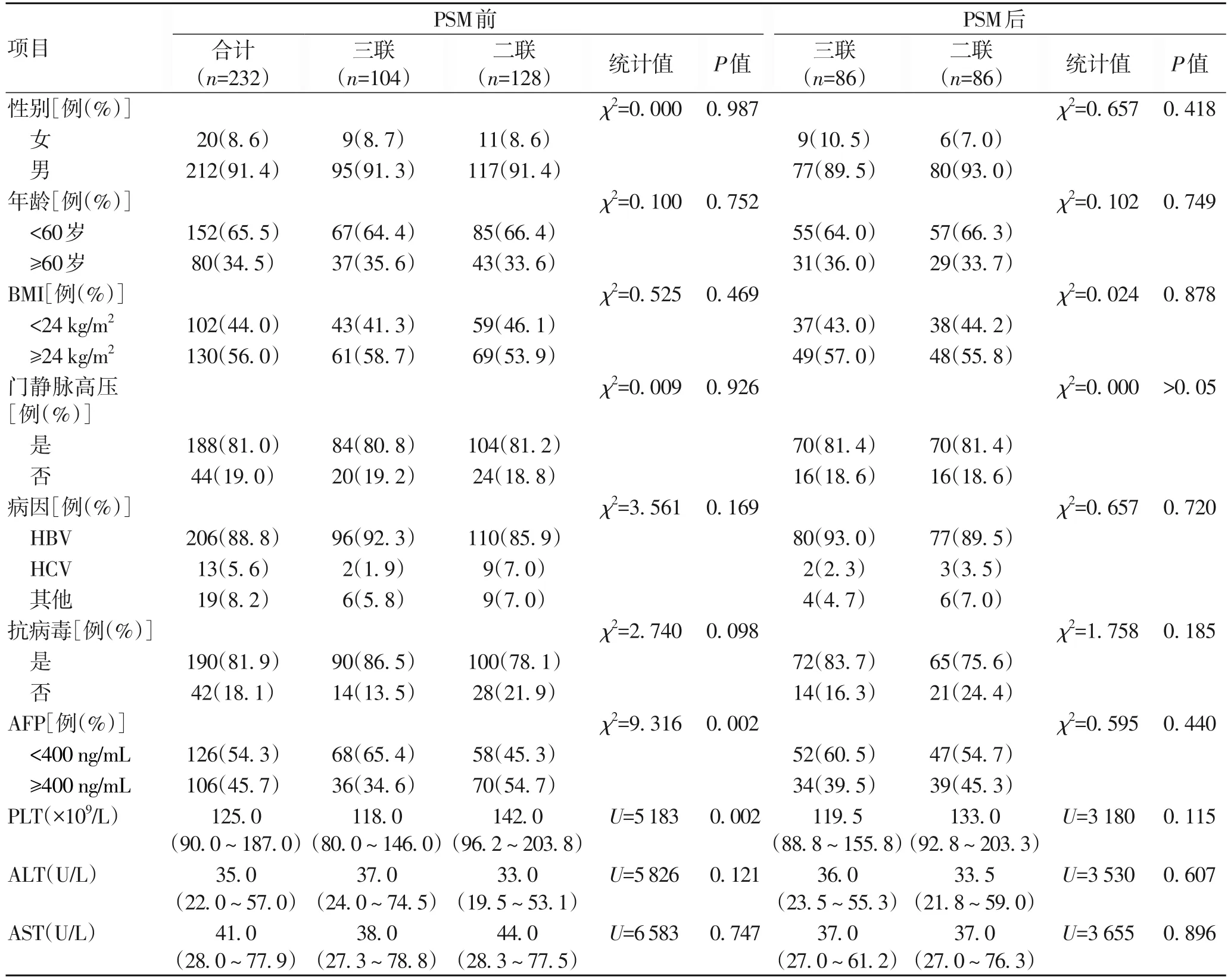
表1 冷冻消融+仑伐替尼+抗PD-1组(三联)和冷冻消融+仑伐替尼组(二联)PSM前后的临床特征Table 1 Clinical features before and after PSM in Cryo+Lenvatinib+anti-PD-1 group and Cryo+Lenvatinib group
2.2 两组OS和PFS的比较 中位随访时间为28个月。随访期间,三联组死亡33例(38%),二联组死亡40例(46.0%)。与二联组相比,三联组患者的生存比例明显提高。三联组的OS和PFS分别是34.6个月(95%CI:18.9~50.3)和8.0个月(95%CI:6.6~9.4),二联组OS和PFS分别是19.0个月(95%CI:12.0~26.0)和6.0个月(95%CI:4.2~7.8),2组之间OS和PFS差异均有统计学意义(P值分别为0.045和0.026)(图2)。
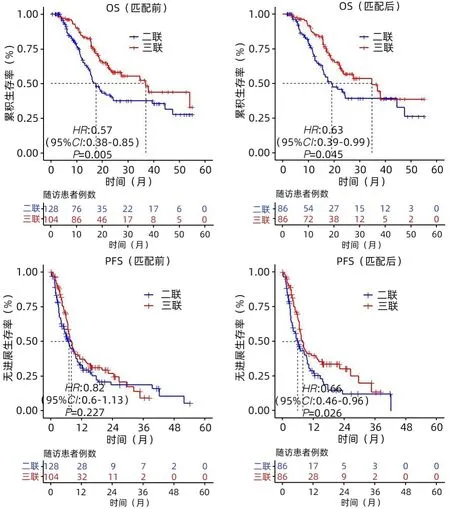
图2 两组患者PSM前后的OS和PFS比较Figure 2 Comparison of OS and PFS before and after PSM between the two groups of patients
PSM后Cox回归分析显示治疗方案、AFP水平是影响OS的独立因素(P值均<0.05);治疗方案、糖尿病、之前是否接受过局部治疗、是否有远处转移是影响PFS的独立因素(P值均<0.05)(表2)。PSM前的Cox回归分析显示治疗方案、AFP水平、之前进行局部治疗、冷冻消融次数是影响OS的独立因素(P值均<0.05)(表3);可以看出在PSM前、后进行的Cox回归分析均显示治疗方案、AFP水平是OS的独立影响因素。

表2 PSM后影响患者OS和PFS的Cox单因素及多因素回归分析Table 2 Cox single and multi-factor regression analysis of influencing OS and PFS after PSM
2.3 两组肿瘤反应的比较 三联组的ORR(35.6% vs 14.5%)、DCR(86.1% vs 64.1%)比二联治疗组提高,差异均有统计学意义(P值分别为0.008、0.003)。与二联组比较,三联组PR较高(25.6% vs 11.6%),PD较低(18.3% vs 36.0%),差异均有统计学意义(P值分别为0.019、0.003)(表4)。

表4 肿瘤反应Table 4 Tumor response

表5 PSM后不良反应Table 5 Adverse reactions after PSM
2.4 亚组分析 在二联组中接受>1次的冷冻消融可以延长患者OS(24.2个月 vs 12.6个月,P=0.008)(图3);在Child-Pugh A级患者中,与二联组比较,三联组的中位OS显著延长(36.97个月 vs 17.55个月,P=0.034)(图4);对BCLC B和C期患者,三联治疗较二联治疗中位OS无明显差异(P值分别为0.198、0.133)(图5)。在有远处转移的患者中,与二联组比较,三联组中位OS显著延长(34.6个月 vs 15.5个月,P=0.048)(图6)。
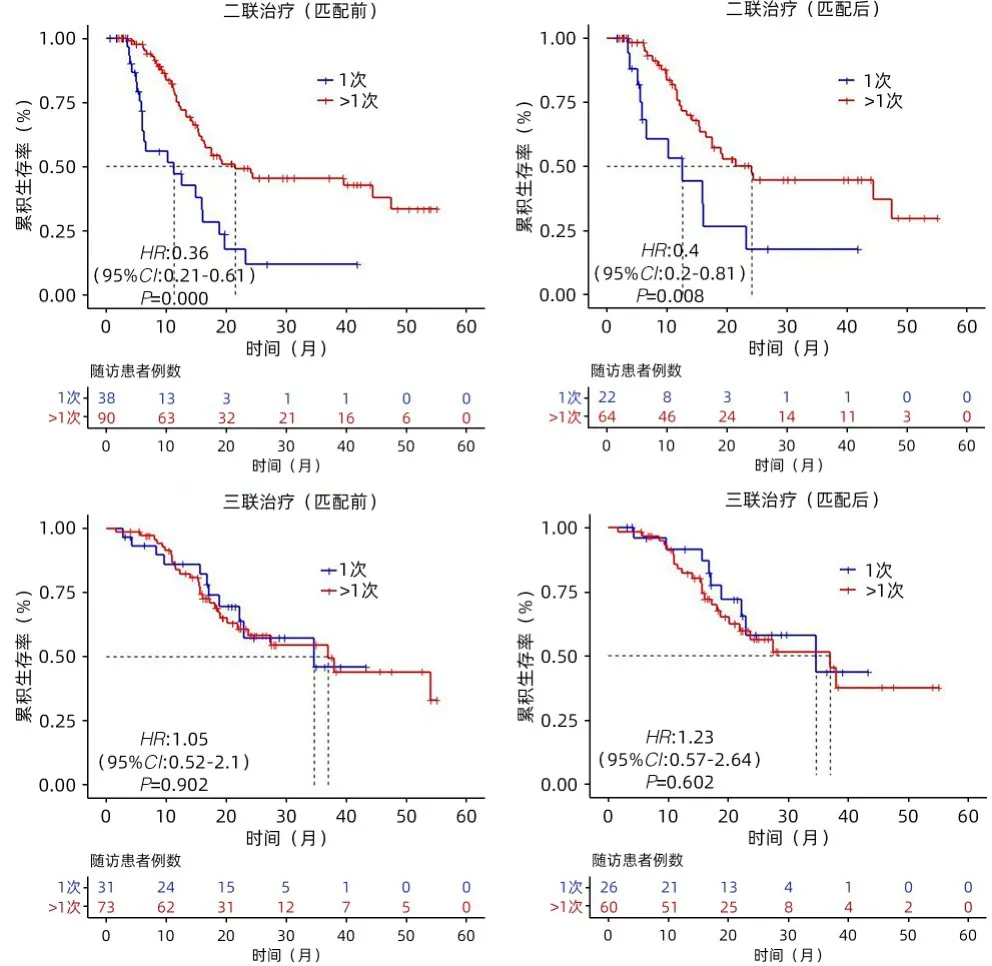
图3 PSM前后两组行1次或>1次冷冻消融患者的OS比较Figure 3 OS comparison of the number of 1 or more cryoablation before and after PSM between the two groups
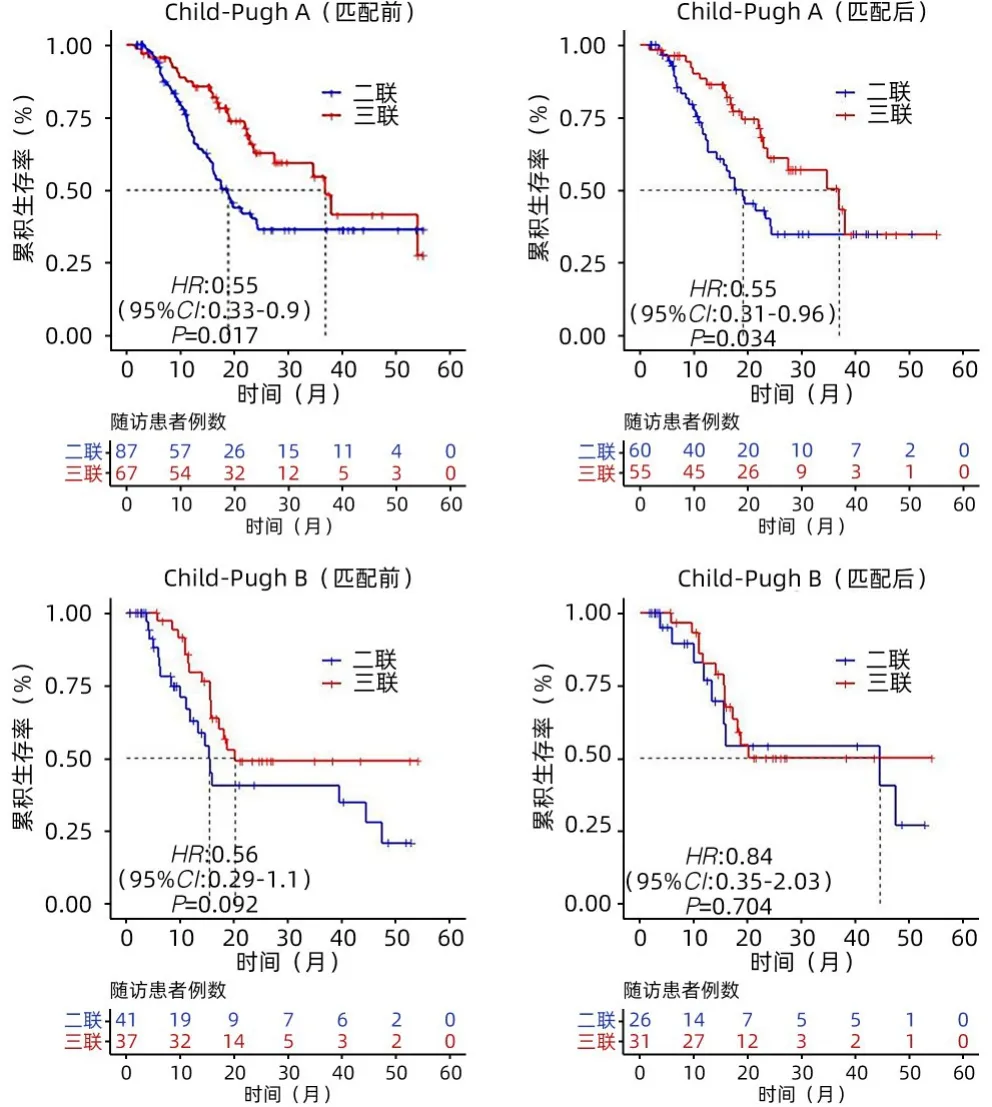
图4 PSM前后Child-Pugh A或B期患者的OS比较Figure 4 Comparison of OS before and after PSM in patients with Child-Pugh A or B

图5 PSM前后BCLC B或C期患者的OS比较Figure 5 Comparison of OS before and after PSM in BCLC B or C patients

图6 PSM前后两组有或无远处转移患者的OS比较Figure 6 Comparison of OS before and after PSM patients with or without distant metastasis
2.5 两组不良反应的比较 PSM后共有159例患者(92%)出现不良事件,三联组治疗相关不良事件前10位依次为低蛋白血症、AST升高、ALT升高、高胆红素血症、腹泻、高血压、白细胞减少、手足综合征、乏力、蛋白尿。在二联组中,低蛋白血症是最常见的治疗相关不良事件,其次分别为高胆红素血症、高血压、AST升高、白细胞减少、腹泻;高血压和白细胞减少是三联组及二联组最常见的3/4级不良事件;三联组中有2例发生了消化道出血,二联组中有1例出现肝衰竭,无死亡事件,在2组中总共有50例患者停止治疗或改变治疗方案,因为不能忍受的不良反应或者经济情况不允许或其他原因,总体上,不良事件的类型和频率在2组间相对相似(表6)。
3 讨论
冷冻消融+仑伐替尼+PD-1单抗三联疗法对于晚期HCC患者可能是一种较好的治疗选择。分析原因如下:(1)冷冻消融可以通过从冷冻肿瘤细胞中释放肿瘤抗原和激活细胞毒性T淋巴细胞来触发抗肿瘤活性[15],可能引起抗癌免疫应答[16],PD-1单抗可能进一步增强此作用。(2)仑伐替尼是一种具有抗增殖和抗血管生成活性的多激酶抑制剂[17],仑伐替尼可以通过抑制血管内皮生长因子来减轻肿瘤微环境中的免疫抑制,也可以增加免疫抑制微环境中的T淋巴细胞浸润,为免疫检查点抑制剂的功能提供有效的免疫治疗微环境[18-19]。也可以抑制冷冻消融术后缺氧诱导的血管生成并能调节肿瘤免疫微环境,增强PD-1单抗在HCC中的免疫应答。因此,联合应用冷冻消融、仑伐替尼和PD-1单抗可能产生协同抗肿瘤活性,有助于改善晚期肝癌患者的临床预后。
在本研究中,uHCC患者PD-1单抗可以提高冷冻消融联合仑伐替尼的疗效。三联组相比二联组的中位OS显著延长,中位PFS得到改善,ORR、DCR也显著提高。一些其他局部联合系统治疗的研究也取得不错结果,先前有研究[20]评估了索拉非尼联合冷冻消融治疗晚期HCC的安全性和有效性。结果显示联合治疗组的中位疾病进展时间(TTP)为9.5个月(95%CI:8.4~13.5),索拉非尼组为5.3个月(95%CI:3.8~6.9)(P=0.02);联合治疗组的中位OS为12.5个月(95%CI:10.6~16.4),索拉非尼组为8.6个月(95%CI:7.3~10.4)(P=0.01);联合治疗组中高微血管密度(MVD)患者的TTP和OS中位数明显长于对照组。另一些研究[8,11,21-25]评估了TACE、仑伐替尼、PD-1抑制剂联合治疗uHCC患者,其PFS为5.2~25.2个月,OS为12.8~35.1个月,这与本研究中采用冷冻消融+仑伐替尼+PD-1单抗方案的疗效大致相似。在一项针对门静脉癌栓合并HCC患者的研究[26]中,TACE-HAIC联合靶向治疗和免疫治疗组ORR显著高于TACE组(53.7% vs 7.8%,P<0.001),联合组OS明显优于TACE组(P<0.001),联合组和TACE组的中位PFS分别为14.8个月和2.3个月(P<0.001)。而另一项研究[27]根据HCC肿瘤最大直径分为A组(≥5 cm~<10 cm)、B组(≥10 cm~<15 cm)、C组(≥15 cm),在B组中,与单纯TACE相比,TACE+冷冻消融的生存情况显著改善(11.0个月 vs 6.0个月,P=0.008),C组亦如此(8.0个月 vs 5.0个月,P=0.001)。值得注意的是,这些研究大多数排除了有门静脉侵犯或远处转移或肝功能失代偿的患者,有的也仅纳入了BCLC A期患者。而本研究中肿瘤负荷大(肿瘤最大直径为25.3 cm,且多数有门静脉浸润或肝外转移),从而可能导致这些uHCC患者经过治疗能够获得有限生存益处,PFS提高的不甚明显。但在本研究中一部分患者既往接受了介入治疗、局部治疗、外科手术、其他系统治疗、放化疗或接受了贯序治疗,所以中位OS得到明显提高。综上,在本研究中与二联治疗相比,三联治疗确实能显著提高晚期HCC患者的生存率。
本研究中,治疗方案、AFP水平、糖尿病、之前是否接受过局部治疗、有无远处转移被确定为影响生存的独立危险因素,这与之前的研究结果[8,11,20-24]相似。在进一步亚组分析中,Child-Pugh A级、有远处转移HCC患者,三联组相比二联组的中位OS显著延长;在二联组接受>1次的冷冻消融可以延长OS。因此,对于Child-PughA级、有远处转移患者,在冷冻消融联合仑伐替尼的基础上联合PD-1单抗是必要的。
在本研究中,所有三联组中的不良事件都是可控的,并且与既往报道的关于HCC研究中发生的不良事件大致相同[11,21,23-25,28],未观察到新的或意外的不良事件。此外,三联组不良事件的发生率和严重程度与二联组相近,无显著性差异,提示冷冻消融+仑伐替尼+PD-1单抗并未显著增加不良事件的风险,表明该三联治疗方案具有可接受的安全性。
其次,本研究也存在一些局限性。本研究是一个回顾性研究,在单一的医疗中心进行的,数量有限,可能导致一些固有的选择偏倚,PSM分析不能完全消除所有这些偏倚。亚组分析的结果应谨慎解释。其他混杂的预后因素(例如合并症和社会经济状况)可能存在,还有匹配不完美等。因此,通过进一步的随机试验验证本研究结论是必要的。
总之,本研究冷冻消融+仑伐替尼+PD-1单抗治疗晚期HCC显示了不错的疗效和良好的安全性。与冷冻消融+仑伐替尼相比,接受冷冻消融+仑伐替尼+PD-1单抗治疗的患者显示出更好的治疗反应且提高了生存期。但该结果需要在大样本、前瞻性随机对照试验中得到进一步证实。
伦理学声明:本研究方案于2021年12月1日经由解放军总医院第五医学中心伦理委员会审批,批号:KY-2021-12-33-1,所纳入患者均签署知情同意书。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:刘腾负责研究数据的获取分析、解释过程以及论文起草;何权威参与部分影像学评估;徐然参与部分随访;常秀娟负责修改文章内容;杨永平设计研究思路。

