胆固醇代谢在结直肠癌调控中的作用研究进展
杨驰,罗长江
兰州大学第二医院普通外科,甘肃兰州 730030
2020年统计数据显示,结直肠癌(colorectal cancer,CRC)已跃居消化系统癌症发病率与死亡数的首位,严重威胁人类生命健康[1]。胆固醇(cholesterol)参与细胞膜的构成,参与维持细胞膜的完整性和膜内物质的稳定性,其在合成、摄取、转化及分解等代谢过程中所产生的细胞因子及活性物质共同参与细胞内及细胞间信号的传导[2-3],不仅调控正常细胞周期的转化,同时与癌症的代谢重编程有关。胆固醇代谢是近年癌症治疗探索的热点,阐述其复杂的作用机制潜在地奠定了脂-癌相关的分子基础。本文对胆固醇代谢在CRC调控中的研究进展进行综述,旨在为靶向胆固醇治疗CRC提供新思路。
1 细胞膜胆固醇的结构与功能
胆固醇作为一种27 碳多环脂质分子(C27H46O),广泛存在于哺乳动物细胞膜中,主要依赖于甾醇转运蛋白来维持自身的分布及构象,并与其他疏水性脂质成分共同参与调节双层细胞膜的刚性及渗透性,能够在膜上锚定多种跨膜蛋白来介导膜两侧物质的交换,从而达到对细胞内外物质功能活性的精准调控[4]。由胆固醇参与形成的膜基本构架在细胞运动及代谢过程中可充当信号传导的载体——“脂筏”。脂筏不仅能够提供丰富的理化环境直接影响蛋白质的构象及活性,还可作为一种识别性多态域结构来诱导病原体及其产物的渗透[5]。重要的是,这种脂筏所支撑的跨膜信号传导与肿瘤血管形成、上皮-间充质转化(epithelial mesenchymal transition,EMT)及癌症转移密切相关[6],潜在地奠定了肿瘤发生受胆固醇代谢调控的分子基础。
2 生物体内胆固醇代谢的基本途径
胆固醇内源性生物合成是一项复杂的高耗能过程,其中主要转录调节因子甾醇调节元件结合蛋白(sterol regulatory element binding protein,SREBP)及两种限速酶3-羟基-3-甲基戊二酰辅酶A 还原酶(3-hydroxy-3-methylglutaryl-CoA reductase,HMGCR)和角鲨烯环氧酶(squalene epoxidase,SQLE)发挥着关键作用[7]。SREBP 包括SREBP1 和SREBP2 两种亚型,其中SREBP2能够编码多种胆固醇合成酶基因,是调控胆固醇生物合成的关键亚型[8]。在胆固醇缺乏的状态下,SREBP2 能够与SREBP 裂解激活蛋白(SREBP cleavage activator protein,SCAP)结 合 形 成SREBP2-SCAP复合物,该复合物经由内质网向高尔基体的活化转运后进入细胞核,并与其靶基因启动子中的甾醇调节元件(sterol regulatory element,SRE)相结合来启动甲羟戊酸途径[9]。随后,由SREBP2编码转录的HMGCR 在还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH) 的协助下将羟甲基戊二酰辅酶A(hydroxymethylglutaryl coenzyme A,HMG-CoA)还原成甲羟戊酸,然后依次经异戊二烯化及SQLE环氧化反应完成甲羟戊酸-角鲨烯-羊毛甾醇的过渡,最后经多步骤氧化、去甲基化及还原反应形成胆固醇[10]。除内源性合成外,胆固醇还可经肝细胞小管膜与肠上皮细胞顶膜上的跨膜蛋白尼曼-匹克C1 样蛋白1(Niemann-Pick C1-like 1,NPC1L1)直接进行外源性摄取[11]。“摄取”的另一概念是指组织细胞依赖低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)介导的胆固醇内吞作用[12]。经低密度脂蛋白(lowdensity lipoprotein,LDL)与LDLR 识别后,内吞的胆固醇酯被靶向运输至溶酶体进行水解,然后在溶酶体膜上锚定的尼曼-匹克C1/2(Niemann-Pick C1/2,NPC1/2)蛋白及多种转运蛋白的协作下输出胆固醇到质膜及内质网上[13]。细胞内富余的胆固醇既可储存在脂滴中,也可与血浆中其他脂蛋白结合被运输回肝脏分解并被代谢为胆汁酸盐,从而参与消化吸收或转化为类固醇激素及维生素D 来调节内分泌状态。然而,当细胞内胆固醇水平偏高时,肝脏X 受体(liver X receptor,LXR)则作为胆固醇稳态传感器负责驱动胆固醇外流并减少其合成,以平衡细胞内胆固醇浓度[14]。胆固醇代谢信号机制如图1所示。
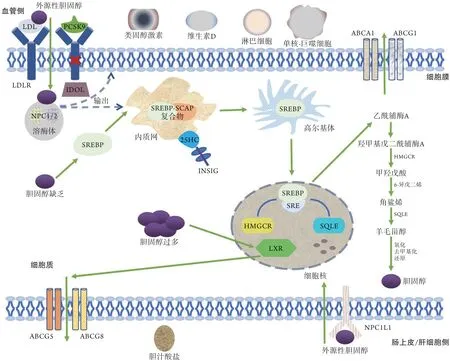
图1 胆固醇代谢信号机制Fig.1 Cholesterol metabolism signaling mechanism
3 胆固醇代谢参与CRC的调控
充足的能量供应及稳定的信号调控是维持肿瘤生长的关键前提,尽管目前尚未发现任何一种物质能够彻底氧化胆固醇,但胆固醇代谢通路中的甲羟戊酸反应参与肿瘤编程的内在机制已被证实[15]。在肿瘤细胞中,胆固醇的异常代谢往往表现为其合成或摄取水平增高、代谢酶活性上调或缺失以及衍生物异常聚积等,这些都可能通过重塑肿瘤微环境(tumor microenvironment,TME)来参与肿瘤细胞的增殖与转移。以下重点综述胆固醇代谢途径中相关衍生物、调节蛋白,以及免疫细胞在CRC发病及进展中的信号机制,以为CRC靶向胆固醇治疗提供理论依据。
3.1 胆固醇代谢途径中相关衍生物及调节蛋白对CRC的调控
3.1.1 25-羟基胆固醇(25-hydroxycholesterol,25HC)/27HC SREBP-SCAP 复合物的形成是胆固醇合成启动的必要条件,但其与胰岛素诱导基因(insulininducible gene,INSIG)编码的内质网蛋白(INSIG 蛋白)结合时则表现出SREBP-SCAP 向下游转运的阻碍效应[16]。近期研究显示,胆固醇的氧化衍生物25HC能够作为中间体嵌合在SREBP-SCAP与INSIG蛋白之间以介导SREBP 的活化,负责调节胆固醇的生理代谢[17]。然而,25HC 在CRC 中往往被视为一种抑癌因素。2013 年Tanaka 等[18]首次确定25HC 能以浓度依赖的方式抑制CRC 细胞的集落形成,并经Western blotting 证实,在25HC 存在的条件下Rho 相关卷曲螺旋蛋白激酶(Rho-associated coiled-coil protein kinase,ROCK)和p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)的磷酸化水平与CRC 细胞的失巢凋亡状态呈正相关(P<0.05),由此推测,25HC 可能以诱导ROCK/p38MAPK 蛋白活化的形式实现对CRC 细胞的抑制。在此基础上,Hitsuda 等[19]使用荧光电镜观察到25HC 可通过改变肌动蛋白纤维的排列方式以诱导细胞骨架重塑而直接破坏与细胞外基质的相互作用,促使CRC细胞形成失巢状态,该结果提示25HC 也可通过参与细胞骨架蛋白的重构而发挥抑癌作用。此外,Kakimoto等[20]认为,25HC 对CRC 的抑制可能与SREBP2 的表达沉默有关,因为癌细胞的增殖活力可通过诱导SREBP2 上调后恢复。然而,25HC 并非只表现出抑癌效应,在胃癌及肝细胞癌等其他类型癌症中,其在促增殖及迁移方面同样发挥作用,并参与肿瘤的耐药表达[21-22],这种复杂现象仍需系统性地研究。
丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinase,Akt)信号的活化与肿瘤细胞周期进程及蛋白质合成密切相关,而胆固醇的另一类衍生物27HC在CRC 的信号传导中表现出双重效应:27HC 既可通过活化Akt以促进促血管物质如血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、基质金属酶(matrix metallopeptidase,MMPs)及多种炎性因子[如白细胞介素-6(interleukin-6,IL-6)和IL-8]的释放,且这种活化效应仅表现在晚期CRC 的扩散阶段;同时还可直接靶向抑制Akt来阻止有丝分裂以抑制CRC细胞的克隆与迁移,最终导致两种截然相反的临床结局[23-25]。由此可见,27HC在CRC不同发展阶段可能存在颇具差异的代谢需求,并可能仅参与到CRC的晚期进展中。因此,基于CRC不同分期层次水平的研究可能有利于捕捉胆固醇代谢在其不同阶段影响的关键。
3.1.2 SREBP 如前所述,SREBP 是胆固醇合成的关键因素。微小RNA(miRNAs)是一类序列较短的非编码RNA,在其诸多亚型中,定位于SREBP2内含子序列上的miR-33 与胆固醇稳态的调节密切相关,miR-33 能够靶向抑制ATP 结合盒亚家族成员A1/G1(ATP-binding cassette sub-family A/G member 1,ABCA1/ABCG1)来 减 少 高 密 度 脂 蛋 白(high density lipoprotein,HDL)的球状修饰,从而控制胆固醇的流出[25]。研究表明,当胞质内胆固醇水平偏高时,SREBP2 在miR-33 转录水平抑制状态下被明显下调,结合双荧光素酶报告基因分析证实原癌基因PIM3能够作为下游靶点被激活,并通过参与多种抗凋亡反应以维持细胞活性状态;由此推测,SREBP2在CRC细胞中接受反馈调节的同时可能以促PIM3活化的形式促进肿瘤增殖[26]。另有研究表明,miR-33 可能与线粒体呼吸抑制有关,并通过降低线粒体能量的产生来阻碍胆固醇外流,而靶向抑制miR-33 后细胞整体功能则处于活跃状态,但该机制目前尚未在癌细胞中证实[27]。
此外,转移性结直肠癌(metastatic colorectal cancer,mCRC)一直被认为是限制治疗手段及预后较差的主要原因[28],转移瘤常会发生代谢活性的改变以适应新的生存环境。雷帕霉素靶蛋白(mechanistic target of rapamycin,mTOR)作为Akt的下游靶点之一,负责细胞内蛋白质与脂质的合成[29],其在细胞代谢异常时经常被上调[30]。研究显示,在肝转移灶微环境中肝细胞生长因子(hepatocyte growth factor,HGF)能够刺激原癌基因Met活化,并通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/Akt/mTOR 轴特异性激活SREBP2,继而启动胆固醇合成以维持CRC 细胞的增殖状态;同时靶向沉默实验证实,转移瘤细胞的存活必须依赖于SREBP2的上调,由此推测,胆固醇是CRC转移瘤生存的必需物质[31]。然而其他证据表明,由HGF 激活的Met 不仅能够上调SREBP2以促进肿瘤细胞存活,还可募集大量具有抗肿瘤活性的中性粒细胞来拮抗肿瘤增殖,部分抵消了Met的致癌作用,故Met作为胆固醇上游抗癌靶点可能存在潜在的双向趋势[32]。因此,这种胆固醇代谢与免疫细胞之间的协同或拮抗作用对肿瘤发展趋势的综合影响值得进一步探讨,不同机制之间可能存在相互串扰来最终确定肿瘤的发展方向。
SREBP1 异常表达同样参与CRC 的调控。Gao等[33]对60例CRC患者的癌组织及癌旁组织标本进行对比发现,SREBP1在癌组织中被明显上调,并且与细胞内活性氧(reactive oxygen species,ROS)水平呈正相关(P<0.05),而ROS 不仅参与诱导肿瘤血管形成,还 能 够 通 过 激 活 核 因 子-κB(nuclear factor kappa-B,NF-κB)来促进MMP-7的表达,MMP-7是一种与CRC获取高侵袭性相关的金属基质酶,在肿瘤增殖方面具有明显促进作用[34]。此外,Jin 等[35]检测两类SREBP 蛋白对辐射刺激的反应,结果显示,SREBP1明显上调而SREBP2 呈绝对下降趋势,据此将SREBP1鉴定为辐射状态下的快速反应基因;进一步采用流式细胞术检测发现由SREBP1介导的胆固醇积累能够增高辐射条件下CRC细胞的存活率,由此推测,SREBP1 可能与CRC 辐射抗性及耐药表达有关,可作为CRC患者调控放疗敏感性的靶点。
3.1.3 HMGCR/SQLE HMGCR除受SREBP2的直接编码转录外,其结构中嵌有一个甾醇感应域(sterol sensing domain,SSD)负责感应胆固醇浓度,当胞质内胆固醇水平偏高时,INSIG 蛋白与HMGCR 上的SSD 相结合并诱导其发生降解,进一步阻止胆固醇合成[36]。肿瘤干细胞(cancer stem cells,CSCs)与肿瘤的起源、进展及耐药有关,而DNA 结合抑制(inhibitor of DNA binding,ID)蛋 白 被 认 为 是 操 纵CSCs 侵袭性表型的关键调控物质[37]。Gao 等[38]研究发现,在结肠癌CSCs 中,HMGCR 和胆固醇的另一合成酶法尼基二磷酸合酶(farnesyl diphosphate synthase,FDPS)均上调,并以胆固醇依赖的方式促进 转 化 生 长 因 子-β(transforming growth factor-beta,TGF-β)/ID 蛋白轴的活化表达,从而维持CSCs 的自我更新能力。而通过补充胆固醇或FDPS催化相关中间体香叶基香叶基二磷酸(geranylgeranyl diphosphate,GGPP)能够逆转由HMGCR 或FDPS 抑制所导致的CSCs 凋亡[38]。由此可见,胆固醇诱导结肠癌CSCs干性表达可能存在两种途径:一种直接由胆固醇累积所诱发;另一种则可能是由GGPP 作为胆固醇合成过程中异戊二烯化的底物并通过激活小GTP 结合蛋 白(small GTP-binding protein,GTPases)来 实 现CSCs 的膜信号传导[39]。因此,限制胆固醇或GGPP的累积可能有助于阻止CSCs的恶性转化,这为从机制上理解他汀类(Statins)药物的抗癌效应提供了佐证。
事实上,SQLE 同样受SREBP2 的转录调控并在高胆固醇状态下被E3泛素连接酶降解,在癌症中频繁地异常表达[40-41]。据报道,SQLE上调可能仅作为CRC 发生的始动因素而与晚期转移相对无关,因为SQLE 在Ⅰ-Ⅲ期CRC 中的表达明显高于Ⅳ期,并显著刺激肿瘤细胞的集落形成[42]。RNA 测序和组织微阵列分析也证实,CRC 细胞中胆固醇的另一衍生物骨化三醇能够在SQLE 上调的基础上继发性增高,并且可促使MAPK 蛋白活化以促进癌细胞增殖,当靶向敲除SQLE后仅通过补充骨化三醇即可逆转癌细胞的活性,由此推测,由SQLE介导上调的骨化三醇同样具备潜在致癌性[42]。由此可见,胆固醇的不同衍生物对CRC展现了丰富的调控作用。
然而,在CRC 中SQLE 促胆固醇合成的同时也受胆固醇的降解调控,并与糖原合成激酶-3β(glycogen synthase kinase-3β,GSK-3β)及抑癌基因p53的表达失活有关[43]。GSK-3β 是一种多功能丝氨酸/苏氨酸蛋白激酶,与炎症、代谢性疾病、神经系统疾病和癌症存在着广泛的联系,并且参与Wnt/β-catenin、PI3K/Akt 和Notch 等多种癌症相关信号通路的调控[44]。Jun等[43]发现,GSK-3β和p53功能活性的维持依赖于SQLE 的正常转录,但当SQLE 被过量胆固醇降解后,GSK-3β/p53复合物的稳定性也遭到破坏,而GSK-3β作为负向调控因素在被抑制的状态下能够激活Wnt 信号,并持续阻碍E-钙黏蛋白的积累,最终诱导EMT 形成而导致癌细胞转移性浸润。一种三萜类化合物Pristimerin已被证实具有通过激活GSK-3β来抑制Wnt信号传导的作用[45],尽管该化合物并未表现出与SQLE 的直接作用,但其作为针对SQLE 靶向CRC 的辅助治疗仍存在可观的药用价值。依据此机制,在针对SQLE 靶向用药上尚存在将CRC 诱导向更差表型的风险,而联合降胆固醇药物及SQLE抑制剂可能是一种潜在有效的治疗策略。
3.1.4 LXR LXR 是转录因子核受体超家族的成员,包括LXRα和LXRβ两种亚型,其通常被细胞内氧甾醇作为配体激活,功能上可促进全身细胞内胆固醇的逆向消除并抑制胆固醇再摄取[14]。在CRC 中,LXRα 上调可激活多种膜通道蛋白如ABCA1、ABCG5 及ABCG8 来介导胆固醇外流,并通过抑制S期激酶相关蛋白2(S-phase kinase-associated protein 2,SKP2)的表达使肿瘤细胞分裂阻滞在G1期;同时动物实验证实,使用LXRα 激动剂诱导后小鼠成瘤体积更小,数量更少,具有明显的抑瘤效能[46]。
表皮生长因子受体(epidermal growth factor receptor,EGFR)是参与细胞有丝分裂调控的关键跨膜糖蛋白,被激活后通过酪氨酸激酶的磷酸化来促进细胞的增殖与分化,并在癌症中频繁地扩增或突变[47-48]。研究发现,LXRα 蛋白水平与EGFR 的表达呈负相关(P<0.05),且双荧光素酶报告分析显示,LXRα 可靶向结合EGFR 的启动子并对其产生抑制作用,由此推测,LXRα 的抑癌作用可能是通过其作为EGFR 的沉默结合蛋白而实现的[49]。Wnt/β-catenin 是多种癌症的经典信号通路,尤其是在CRC中几乎呈覆盖性激活[50]。Uno 等[51]共转染LXR 类似物后经免疫共沉淀证实,尽管LXR 不能直接抑制Wnt 信号的活化,但其能够与该信号下游多种靶蛋白如原癌基因蛋白MYC、骨形态发生蛋白4(bone morphogenetic protein 4,BMP4)和MMP-7的启动子序列结合来阻碍Wnt信号传递,并且LXRβ 较LXRα 显示出更强的阻碍作用。也有研究认为,EGFR与Wnt两种信号通路在参与肿瘤调控时发生了不同程度的串扰。例如,在CRC 中Wnt 信号可通过上调前列腺素E2(prostaglandin E2,PGE2)的表达来激活EGFR,而EGFR 也可通过EGFR/PI3K/Akt 信号轴来激活β-catenin 并与其形成复合物再激活Wnt 信号,共同形成一种协同促增殖循环[52]。而LXR对这两种信号在CRC中的调控均表现出强烈的干扰,所以,靶向刺激LXR 的转录活性可能通过多途径减缓CRC的发展,并改善预后。
3.1.5 LDLR LDLR 广泛存在于各类细胞表面,在每次完成胆固醇酯的内吞后,其会依赖于胞质内pH重新返回细胞表面,形成再循环内吞机制以提升胆固醇的转运效率[53]。Lum 等[54]通过与癌旁正常黏膜比较,发现结肠肿瘤标本中几乎均存在LDLR 和环加氧酶2(cyclooxygenase 2,COX-2)转录水平的关联性增高,故推测LDLR 在肿瘤形成的初始阶段可能通过增加炎癌转化的风险来增加致瘤性。Wang等[55]研究发现,CRC 细胞表面LDLR 的上调与淋巴转移及远处转移风险呈正相关(P<0.05),并以促胆固醇积累的形式介导ROS 产生,然后通过活化MAPK 信号通路来参与癌症侵袭表型的形成,提示LDLR 可能是预测CRC不良预后的生物标志物。此外,前蛋白转 化 酶 枯 草 杆 菌 素/kexin9 型(proprotein convertase subtilisin/kexin type 9,PCSK9)作为一种丝氨酸蛋白酶能够附着在LDLR 表面,并通过靶向溶酶体破坏受体来减少LDLR 再循环以调节胆固醇转运[56]。一项研究显示,在使用纳米脂质体抗PCSK9 疫苗对小鼠进行注射后,由于PCSK9 的抑制可明显提升肝细胞表面LDLR 的摄取效率,并可通过肝细胞的吸收与转化降低循环中的胆固醇水平,从而抑制小鼠结肠肿瘤的生长[57]。但该研究并未指出PCSK9 抑制剂与CRC 细胞表面LDLR 的作用关系,仅推测其可能与LDLR在不同组织细胞表面的表达丰度差异及癌细胞内的胆固醇代谢机制有关,故仍有待进一步研究证实。而近期研究表明,PCSK9 的抑制能够促进癌细胞表面主要组织相容性复合体Ⅰ(major histocompatibility complex Ⅰ,MHCⅠ)的上调,并且吸引更多的CD8+T细胞来对肿瘤进行杀伤[58]。尽管此机制并不依赖于LDLR,但提示PCSK9抑制剂在肿瘤联合辅助治疗中可能存在巨大的潜在研究价值。
3.2 免疫细胞中异常胆固醇代谢对CRC的调控作用
3.2.1 淋巴细胞与胆固醇 淋巴细胞(lymphocytes)是参与构建机体免疫屏障的关键活性细胞,可通过释放穿孔素和颗粒酶等多种活性物质在抗肿瘤免疫中发挥作用[59]。X-box 结合蛋白1(X-box binding protein 1,XBP1)是一种调节内质网应激反应的活性转录因子,已被证实可通过促进树突状细胞(dendritic cells,DCs)中的脂质合成来削弱由其介导的CD8+T细胞的抗肿瘤免疫[60]。在结肠癌中,Ma等[61]采用抗原染色发现,CD8+T 细胞表面程序性死亡蛋白1(programmed death protein 1,PD-1)和自然杀伤细胞受体2B4(natural killer cell receptor 2B4,CD244)等免疫检查点的上调与胞质内胆固醇诱导的XBP1 过表达有关,同时XBP1 能够通过降低CD8+T 细胞的氧耗率及糖酵解率来诱导其衰竭表型,故推测由XBP1介导的内质网应激反应可能是参与高胆固醇水平下免疫检查点上调的主要原因。而通过抑制XBP1或降低CD8+T细胞内胆固醇水平可明显恢复其抗肿瘤活性,提示由胆固醇介导的XBP1 可能作为调节CD8+T 细胞免疫活性的重要靶点。此外,肠屏障微生态的维持离不开肠黏膜中淋巴细胞的浸润,其中,表达转录因子 蛋 白RORγ 的 调 节 性T 细 胞(regulatory T cells,Tregs)受来自饮食或肠道的因子共同调控,并被认为与肠黏膜炎症反应有关[62]。肠道内胆固醇代谢产物初级胆汁酸在肠黏膜免疫稳态的维持中发挥着重要作用。研究显示,少量进入结肠的胆汁酸经肠道内微生物修饰后可能通过与维生素D 受体(vitamin D receptor,VDR)相互作用而稳定RORγ+Tregs 的分布并建立起稳固的肠黏膜免疫屏障,从而减少炎症刺激以降低结肠黏膜炎癌转化的风险[63]。因此,增加结肠内胆固醇代谢产物胆汁酸的含量对于肠屏障功能的构建及维持具有促进意义。
3.2.2 单核-巨噬细胞与胆固醇 受肿瘤因素影响,血液中单核细胞(monocytes)趋向性迁移并聚集在TME 中形成肿瘤相关巨噬细胞(tumor-associated macrophages, TAM)。 COP9 信 号 小 体5(COP9 signalosome subunit 5,CSN5)是一种参与癌细胞表面受体活化的泛素调节酶,通常与癌细胞免疫检查点上调有关[64]。Liu 等[65]研究发现,胆固醇能够刺激TAM释放趋化因子配体5(chemokine ligand 5,CCL5)并促进p65 蛋白及信号转导转录激活子3(signal transduction transcription activator 3,STAT3)发生核转位,从而与CSN5启动子结合以上调癌细胞表面程序性死亡蛋白配体1(programmed death protein ligand 1,PD-L1),因此,由胆固醇诱导TAM 释放的CCL5 能够通过CSN5/PD-L1 轴来参与CRC 免疫检查点的调控,并可能在合并高胆固醇血症的CRC患者中存在靶向价值。IL-1β是一种促炎和促癌因子,已被证实与CRC的不良预后有关[66]。Du等[67]研究发现,胆固醇能够阻断巨噬细胞中腺苷单磷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)的活化而导致线粒体ROS 大量产生,并通过激活炎症小体NLRP3 以诱导IL-1β 持续释放,增加结直肠黏膜炎症与癌症的发生风险。Donadon 等[68]从细胞形态学角度分析发现,CRC 肝转移灶中的TAM具有更大的表面积(以L-TAM表示)并存在独特的胆固醇反向转运现象,即LXR 获得上调,而LDLR、HMGCR 等多种胆固醇摄取相关基因受到抑制,从而造成巨噬细胞内胆固醇代谢缺陷;Donadon等[68]指出,L-TAM 的数目与患者更差的无病生存期(disease-free survival,DFS)呈正相关(P<0.05)。但该研究并未阐述L-TAM内胆固醇代谢缺陷具体通过何种机制影响CRC的进展,而仅将其视为一种与CRC患者不良预后相关的形态学参数,故有待进一步探索。
4 胆固醇代谢靶向治疗癌症的应用
目前,针对胆固醇代谢靶向治疗癌症的研究正逐步开展,并取得一定成果。然而,CRC 的靶向治疗正处于阶段性发展过程中,充满了巨大的潜力。以下主要介绍近年来靶向胆固醇治疗癌症的相关应用,以期为CRC的治疗带来新启示。
4.1 靶向胆固醇合成途径 实体肿瘤中胆固醇代谢途径相关调节蛋白如HMGCR、SREBP、SQLE 等被上调是癌细胞发挥恶性潜能的主要原因,阻断其表达是遏制肿瘤进展的有效选择。他汀类药物作为经典的HMGCR 特异性靶向抑制剂,可通过阻断甲羟戊酸途径来破坏细胞膜上的脂筏结构,以及通过降低胞质内胆固醇含量来破坏肿瘤细胞代谢稳态,并且其还具有抗血管生成和免疫调节的作用,这些作用共同抑制了肿瘤的发展[69]。流行病学调查显示,他汀类药物能够明显降低CRC[70]、乳腺癌[71]、前列腺癌[72]等多种癌症的发生风险,在癌症预防、控制复发和延长生存期方面取得了显著成效;但仍有多个基于多中心、大样本的临床回顾性研究不支持他汀类药物在癌症进展中具有明显的改善效应[73-75]。
中药类物质应用于癌症的辅助治疗是近年来兴起的热门话题,中药相关抑癌研究报道,大黄素(Emodin)可通过抑制SREBP2 转录来阻止Akt 信号的活化,从而降低肝癌细胞对索拉菲尼靶向治疗的耐药性,为晚期肝癌患者提供了潜在的治疗方案[76];青蒿素类似物青蒿琥酯(artesunate,ART)能够通过阻断SREBP2的核转位来抑制HMGCR的表达,且免疫共沉淀反应证实其能够破坏SREBP2对肿瘤抑制蛋白p52 的沉默效应,最终诱导神经胶质瘤细胞凋亡[77];呋喃香豆素类物质佛手柑(bergapten)能够上调LXR以促进肝癌细胞内胆固醇流出,并通过抑制PI3K/Akt轴来阻断SREBP1的成熟[78];且佛手柑还与一种E3泛素连接酶—肌球蛋白调节轻链互作蛋白(myosin regulatory light chain interacting protein,IDOL)的表达上调有关,可进一步增加LDLR 的胞质内降解,二者协同抑制胆固醇的积累,从而阻止肝细胞癌的发展[78]。以上结果表明,中药类物质靶向胆固醇代谢在癌症的治疗应用中正处于一种积极态势,有望成为CRC靶向治疗的新策略。
SQLE是目前关注较少的靶点,有研究显示,抗真菌药物特比萘芬(Terbinafine)已被美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于靶向SQLE的阻断治疗,其不仅能够恢复抑癌基因磷 酸 酶 张 力 蛋 白 同 源 物(phosphatase and tensin homolog,PTEN)被沉默的功能活性,并且参与抑制Akt/mTOR 轴的信号传导,在肝细胞癌的抗代谢靶向治疗中取得了良好疗效[79]。
4.2 靶向胆固醇转运途径 近年来,伊曲康唑(Itraconazole)作为另一类抗真菌药物在抑癌方面的功效逐渐被发现。据报道,伊曲康唑具备两种抑癌途径:一是依赖与电压依赖性阴离子通道1(voltagedependent anion channel 1,VDAC1)的 结 合 来 阻 止AMPK 活化,从而抑制mTOR 的表达以限制肿瘤血管的生成;二是能够与溶酶体上的NPC1 直接结合来阻止胆固醇的流出,导致溶酶体中胆固醇无法释放从而破坏肿瘤的代谢需求,且二者在机制上对mTOR 产生协同抑制,显著增加了抗癌效力[80]。这是一种巧妙的单药双靶点治疗,优势在于其靶向内皮细胞而非癌细胞,在耐药变异率控制方面效用较为显著。
在胰腺癌的阻断治疗中,依折麦布(Ezetimibe)可通过抑制NPC1L1 转运蛋白来降低外源性胆固醇的摄取效率,有效阻止胰腺癌的发展[81]。而依折麦布对其他类型肿瘤是否产生类似效应尚无法确定,即使被认为具有抑制肿瘤血管生成的作用,但其潜在致癌风险尚处于研究之中[82-83]。此外有报道指出,鸡蛋提取成分蛋黄鞘磷脂和磷脂酰胆碱可通过降低结肠腺癌上皮细胞顶端NPC1L1 蛋白的表达水平来减少肿瘤细胞内胆固醇的积累,同时在SREBP 转录水平表现出明显的抑制作用,协同减缓了结肠癌的进展[84]。
5 总结与展望
近年来,从癌细胞代谢微环境角度理解癌症的发展是较为热门的研究方向,因为癌细胞总是利用各种途径创造出适合自身发展的微环境以满足其庞大的代谢需求。随着前期大量基础研究工作的不断积累,癌细胞内异常胆固醇代谢逐渐走进人们的视野,但目前多数研究仅聚焦于胆固醇的直接致癌影响,而在其代谢过程中相应的衍生物、被上调或抑制的调节蛋白以及免疫细胞等往往受到忽视。
胆固醇在多种癌症尤其是CRC 的重编程机制中发挥着明显的作用。在胆固醇代谢过程中如25HC/27HC、SREBP、HMGCR、SQLE、LXR、LDLR,以及肿瘤相关免疫细胞(如淋巴细胞、单核-巨噬细胞等)不断受到肿瘤因素的干扰,并接受多因素的共同调控而展现出相当复杂的机制。但目前的工作对于胆固醇代谢靶点在CRC 调控中的研究依旧非常缺乏,且在针对靶向胆固醇治疗CRC的单一靶点用药方面存在明显争议,而多靶点联合用药或将成为提升抑癌效能的新策略。积极关注并研究这些靶点在CRC 中的作用机制是开展胆固醇靶向治疗的关键,有望为靶向胆固醇治疗CRC提供新方向。

