基于CCTA的ΔCT-FFR对重度钙化冠状动脉功能学评估的临床价值分析
魏凯,王玺,何柏,赵子强,张威,荆晶,单冬凯*
1 解放军总医院第一医学中心心血管内科,北京 100853;2 解放军总医院第六医学中心心血管病医学部,北京100048;3科亚医疗科技股份有限公司,北京 100176
在人口老龄化和代谢性危险因素流行的双重压力下,我国心血管疾病负担持续加重,其中冠心病(coronary artery disease,CAD)患者已达1100余万,仅2020 年即有100 余万患者接受介入治疗[1-2]。因此,有效指导CAD患者的临床决策,减少不必要的有创检查或治疗,是目前亟待解决的关键问题,具有重要的卫生经济学意义[3]。在侵入性冠状动脉造影(invasive coronary angiography,ICA)检查过程中借助血流储备分数(fractional flow reserve,FFR)可实现冠状动脉功能学评估,而基于冠状动脉计算机断层扫描血管成像(coronary computed tomography angiography,CCTA)的 血 流 储 备 分 数(CT-derived fractional flow reserve,CT-FFR)也可实现冠状动脉血流动力学检测,且具有无创、便捷的优势。既往研究发现,与FFR金标准比较,CT-FFR 具有较佳的诊断效能,然而CT-FFR 不可避免地会受冠状动脉重度钙化的影响,导致检测结果差强人意[4-5]。Takagi 等[6]发现,冠状动脉病变最严重狭窄处近端与远端CT-FFR的测量差值(ΔCT-FFR),对血管特异性缺血表现的判别具有一定优势。因此,本研究通过ΔCT-FFR 校正CT-FFR的检测结果,在血管水平分析其对重度钙化冠状动脉功能学评估诊断效能的增量价值,以提高其对重度钙化冠状动脉功能学评估的诊断效能。
1 资料与方法
1.1 研究对象 收集2018 年1 月-2019 年6 月解放军总医院心血管内科住院治疗的107 例CAD 患者进行回顾性分析,其中男67 例、女40 例,年龄(61.8±9.9)岁。在血管水平共包括149支冠状动脉,根据钙化 积 分(coronary artery calcium score,CACS)分 为CACS≥100 组(n=56)和CACS<100 组(n=93)。纳入标准:(1)年龄18~75岁;(2)住院期间依次进行CCTA、CT-FFR、ICA 和FFR 检查;(3)CCTA 提示主支冠状动脉管腔直径狭窄率为50%~99%;(4)CCTA 图像质量达到Likert量表3级及以上。排除标准:(1)病历资料缺失严重;(2)冠状动脉存在起源、走行或终止异常;(3)既往有血运重建治疗史;(4)FFR检查对应冠状动脉的CACS≥1000。本研究已获解放军总医院医学伦理委员会审批(S2020-255-01),所有患者在接受各项检查前均签署知情同意书。
1.2 一般临床资料 详细记录所有纳入患者的一般临床资料、心血管疾病危险因素、实验室检验结果、临床用药情况及CCTA、FFR检测结果。
1.3 CCTA 扫描 所有患者均在解放军总医院第一医学中心进行CCTA 扫描。扫描设备为西门子第二代 双 源 螺 旋CT(Definition Flash, 德 国Siemens Healthcare公司),机架旋转速度280 ms,探测器准直2 mm×64 mm,扫描层厚0.6 mm,螺距3.4,具备z轴飞焦点技术。扫描流程依次为前瞻性心电门控CACS扫描和回顾性心电门控增强扫描。患者事先接受呼吸训练并于扫描前3 min 舌下含服硝酸甘油片(0.5 mg,北京益民药业有限公司),增强扫描开始后经肘前静脉以4.5~5.0 ml/s 的速度注射碘对比剂(37 g/100 ml 碘帕醇注射液,上海博莱科信谊药业有限公司),当升主动脉感兴趣区的CT 阈值达到预设的100 Hu时即触发扫描[7]。CCTA图像质控参考5级Likert量表进行评价[8]。
1.4 CACS 测量和CCTA 定性评估 影像序列传输至西门子后处理工作站(MMWP2011A,Siemens Healthcare,德国),由2 名具有3 年以上影像分析经验的心内科医师独立完成CACS测量和CCTA定性评估。CACS 测量基于钙化体积和钙化密度以Agatston积分方法进行计算,钙化斑块定义为至少4 个像素连续出现的CT 密度值>130 Hu 的冠状动脉病变[9]。参考既往文献[10-11],本研究以单支冠状动脉CACS≥100 为切点值判断为血管水平的重度钙化。CCTA定性评估参考国际心血管CT 协会(Society of Cardiovascular Computed Tomography,SCCT)发布的相关指南[12],根据冠状动脉管腔直径狭窄率判定狭窄程度:0,正常;1%~24%,轻微狭窄;25%~49%,轻度狭窄;50%~69%,中度狭窄;70%~99%,重度狭窄;100%,完全闭塞[13]。
1.5 有创FFR 检查 所有患者均在解放军总医院第一医学中心进行ICA和FFR检查。由具有3年以上丰富经验的介入团队按照标准流程进行相关操作,术中将压力导丝(美国St.Jude Medical 公司)置于冠状动脉病变远端,校准主动脉压力后经外周静脉以160 μg/(kg.min)的速度注射三磷酸腺苷注射液(2 ml/20 mg,上海国药集团)使冠状动脉达到并维持最大充血状态,通过压力监测系统评估FFR 值[14]。FFR 值定义为:在稳定充血状态下,冠状动脉病变远 端压力与平均主动脉压力的比值,FFR≤0.8 为受检冠状动脉存在血流动力学异常,FFR>0.8为检查结果阴性[15]。
1.6 无创CT-FFR 检测 影像序列经脱敏后传输至基于机器学习(machine learning,ML)算法的国产人工智能CT-FFR 分析平台(DeepFFR V1.0.0,北京科亚医疗科技有限公司),由1 名具有3 年以上影像分析经验的工程师独立测量CT-FFR值。整体工作流程概括如下:(1)基于深度学习算法建立冠状动脉血流动力学特征性参数样本数据库;(2)采用改进的3D-U型网络结构模型生成血管树并通过切割图形细化血管边界;(3)通过基于路径的深度学习模型预测模拟FFR 值[16]。于受检冠状动脉病变远端10~20 mm 处评估CT-FFR 值,CT-FFR≤0.8 为受检冠状动脉存在血流动力学异常,CT-FFR>0.8 为检查结果阴性[15]。ΔCT-FFR 定义为冠状动脉病变最严重狭窄处的近端与远端的CT-FFR 测量差值,即跨病变CT-FFR 值之差[6,17](图1)。
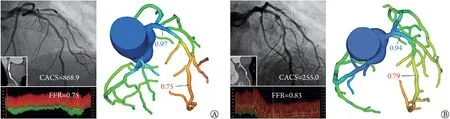
图1 重度钙化冠状动脉ΔCT-FFR评估冠状动脉血流动力学示例Fig.1 Example of ΔCT-FFR in assessing coronary hemodynamics of severe calcification
1.7 ΔCT-FFR 校正 以FFR 作为诊断冠状动脉缺血的“金标准”,通过受试者工作特征(receiver operating characteristic,ROC)曲线计算ΔCT-FFR评估重度钙化冠状动脉缺血的临界切点值为0.165。ΔCTFFR 校正指对于重度钙化冠状动脉,若ΔCT-FFR≥0.165 则维持诊断为阳性,若ΔCT-FFR<0.165 则校正诊断为阴性(图1)。
1.8 统计学处理 采用SPSS 23.0和MedCalc 15.2.2软件进行统计分析。计量资料满足正态分布者以±s表示,组间比较采用Student t 检验;不满足正态分布者以M(Q1,Q3)表示,组间比较采用Mann-Whiney U检验。计数资料以例(%)表示,组间比较采用χ2检验或Fisher 精确检验。在血管水平采用Pearson 相关分析CT-FFR 与FFR 值的相关性,并绘制散点图与Bland-Altman图。整理诊断四格表,计算敏感度、特异 度、准 确 度 和 曲 线 下 面 积(area under the curve,AUC)等指标,不同诊断方法ROC 曲线比较使用Delong检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般临床资料 纳入患者合并高血压病、2 型糖尿病、血脂异常和吸烟等传统心血管疾病危险因素的比例分别为61.7%、32.7%、44.9%和29.9%。实验室检验结果显示,纳入患者总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)水平分别为(4.14±0.95)mmol/L 和(2.57±0.79) mmol/L,高达97.2%的患者接受他汀类药物治疗(表1)。

表1 纳入患者基线人口学与临床特征Tab.1 Baseline general demographics and clinical characteristics of the enrolled patients
2.2 两组冠状动脉影像学和功能学特征比较 两组冠状动脉病变均以前降支为主(分别为76.8%和68.8%),CACS≥100 组中FFR(P=0.004)和CT-FFR 值(P<0.001)均明显低于CACS<100 组,而CACS≥100 组的ΔCT-FFR 值 则 明 显 高 于CACS<100 组(P<0.001,表2)。
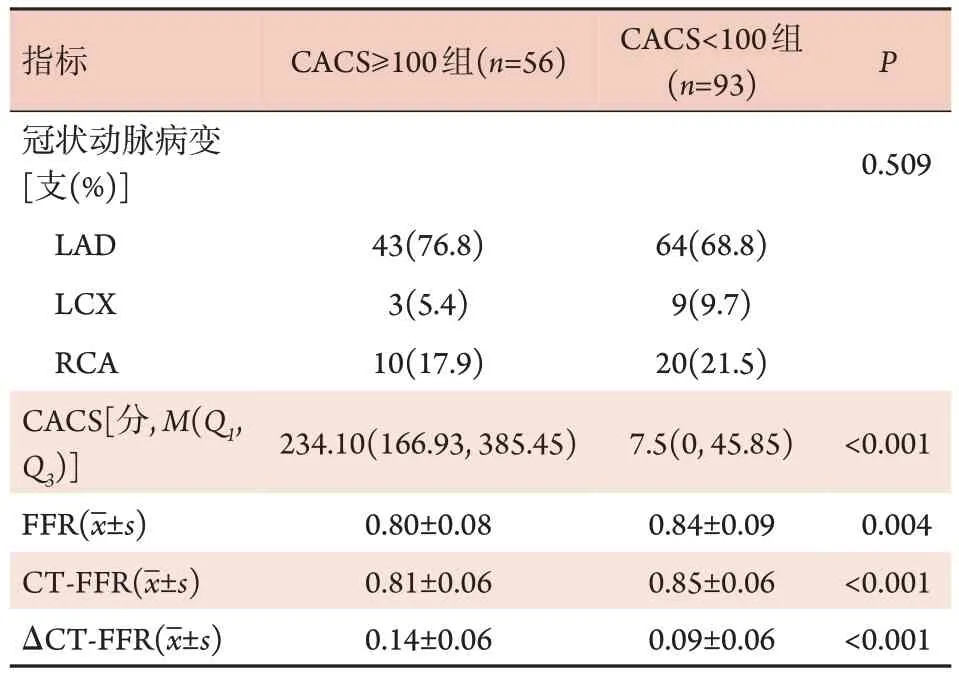
表2 两组冠状动脉影像学和功能学特征比较Tab.2 Comparison of coronary imaging and functional characteristics on vessel level between the two groups
2.3 CT-FFR与FFR值相关性和一致性分析 Pearson相 关 分 析 显 示,CACS≥100 组(r=0.71,P<0.01)和CACS<100 组(r=0.73,P<0.01)中CT-FFR 与FFR 值均呈正性相关(图2A)。Bland-Altman 图分析显示,CACS≥100 组(Mean=-0.01,P=0.25)和CACS<100 组(Mean=0,P=0.96)中CT-FFR 与FFR 值的差值均值和理论零值的差异无统计学意义,两者具有较好的一致性(图2B)。
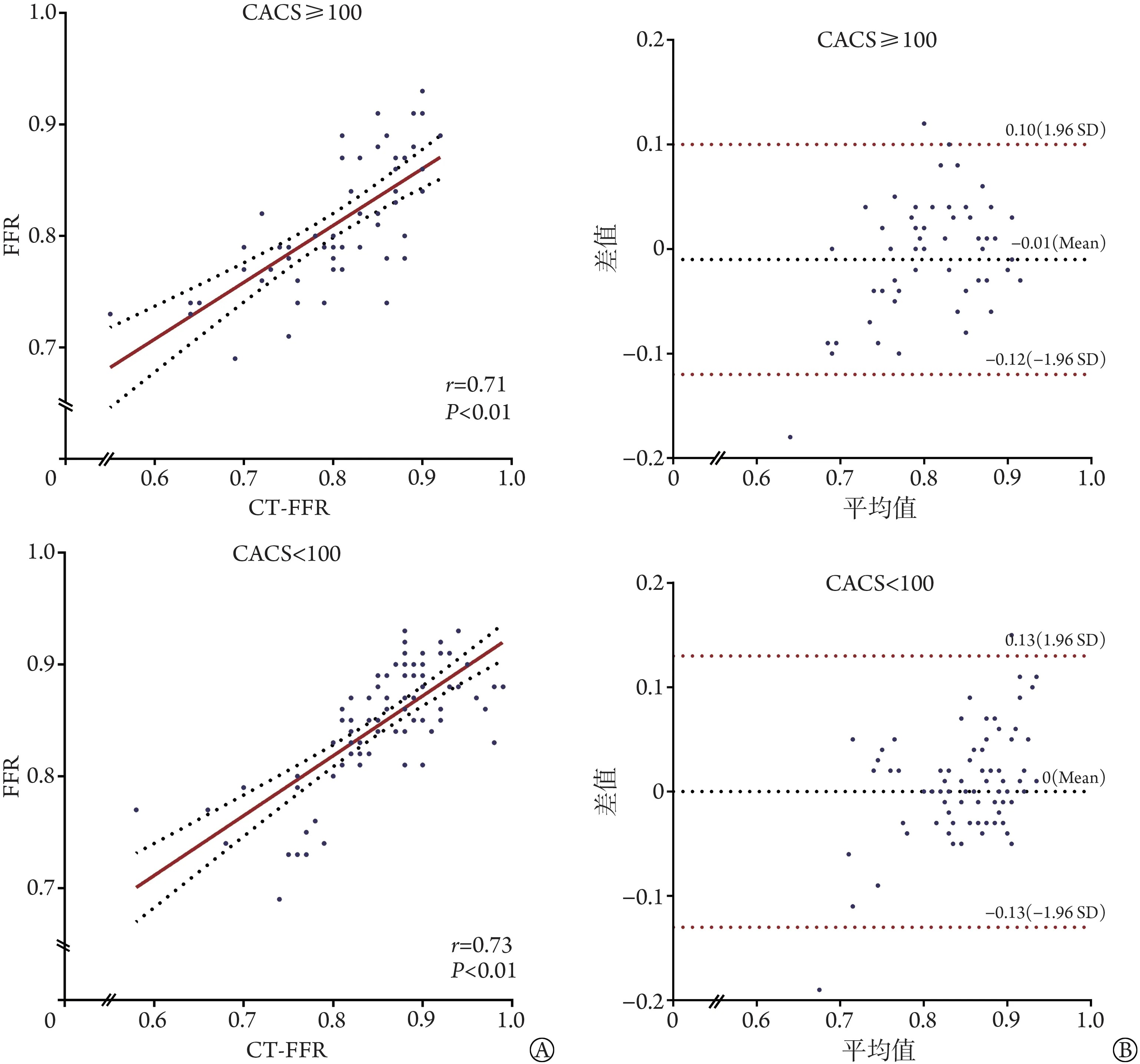
图2 CT-FFR与FFR的相关性散点图(A)和Bland-Altman图(B)Fig.2 Scatter plot (A) and Bland-Altman (B) of correlation between CT-FFR and FFR
2.4 重度钙化对于CT-FFR 评估的不利影响 ROC曲线显示,CT-FFR对于冠状动脉缺血具有较佳的诊断效能(AUC=0.892,95%CI 0.831~0.937,P<0.001)。CACS<100 组CT-FFR 的 诊 断 效 能(AUC=0.929,95%CI 0.856~0.972,P=0.04)明 显 高 于CACS≥100 组(AUC=0.792, 95%CI 0.663~0.889, P<0.05) (P=0.04,图3A)。经ΔCT-FFR校正后,CACS≥100组诊断效能明显增高(AUC=0.876,95%CI 0.760~0.949,P=0.04),诊断效能较前明显提高(P=0.02),与CACS<100 组比较差异无统计学意义(P=0.37)(图3B)。

图3 ΔCT-FFR校正冠状动脉缺血诊断的临床价值Fig.3 ROC analysis of the influence of severe calcification and the clinical value of ΔCT-FFR adjustment for coronary ischemia
2.5 ΔCT-FFR 校正诊断的临床价值 在CACS≥100组中,FFR 诊断阳性冠状动脉26 支、阴性冠状动脉30支,其中CT-FFR误诊阳性冠状动脉9支,诊断敏感度、特异度和准确度分别为88.46%、70.00%和78.57%,约登指数为0.58。经ΔCT-FFR 校正诊断后,误诊阳性冠状动脉仅4 支,诊断敏感度、特异度和准确度分别为88.46%、86.67%和87.50%,约登指数为0.75(表3)。

表3 重度钙化组中CT-FFR与ΔCT-FFR校正诊断四格表Tab.3 Diagnosis crosstab of CT-FFR and ΔCT-FFR for coronary ischemia in CACS≥100 group
3 讨 论
CCTA 作为一项重要的无创影像学检查技术,被广泛应用于CAD 患者的临床评估与随访,相较ICA具有较高的诊断准确性和一致性[18-21]。然而部分研究发现,CAD 患者冠状动脉解剖性狭窄与功能性缺血可能存在不一致的情况,因此在CCTA 解剖学评估的基础上完善功能学评估,已经逐渐成为学界的主流共识[22-24]。由于CT-FFR 使用CCTA 影像数据,无须额外扫描和药物干预,因此对于主支冠状动脉中重度狭窄的CAD患者,该技术有助于诊断血管特异性缺血并指导临床决策,避免不必要的有创检查、治疗及相关并发症[25]。基于真实世界的ADVANCE 研究显示,CT-FFR 在常规CCTA 的基础上改变了约2/3 纳入患者的临床决策,有效降低了ICA 阴性发现率和血运重建治疗的比例,同时CTFFR 阴性患者在90 d 内未发生主要不良心血管事件(major adverse cardiovascular events,MACEs)[26]。
目前,CT-FFR主要基于以下3类技术:3D-计算流体力学(computational fluid dynamics,CFD)、降维CFD 和ML 算法。本研究采用的CT-FFR 是基于ML算法的国产人工智能分析平台,该平台主要通过多层神经网络结构模型确定冠状动脉树结构及其对应血流动力学之间的复杂关系,利用规模庞大的数据库对预测模型反复进行模拟训练,最终建立符合CFD规则的CT-FFR预测模型[16,23]。该分析平台相较FFR 具有较佳的诊断效能,前期诊断试验表明其在血管水平的诊断准确度、敏感度和特异度达88.73%、97.56%和76.67%,对应AUC 高达0.933(95%CI 0.848~0.979)[16]。然而CT-FFR 的诊断效能既受到算法本身的影响,也在很大程度上受到CCTA 图像质量的影响,其中钙化容积效应是最主要的不利影响因素之一。本研究发现,CT-FFR对于重度钙化冠状动脉功能学评估的诊断效能出现一定程度下降[CACS≥100 AUC=0.792(95%CI 0.663~0.889), CACS<100 AUC=0.929(95%CI 0.856~0.972),P=0.04],与本团队前期研究结果相似[Q4AUC=0.767(95%CI 0.581~0.899),Q1~Q3AUC=0.936(95%CI 0.865~0.976),P<0.05][5]。
目前,有关CT-FFR对于重度钙化冠状动脉功能学评估的局限性仍存在争议[27]。NXT 亚组研究发现,按照CACS四分位分组后分析重度钙化对于CTFFR(基于CFD 模型)诊断效能的影响,在患者水平[Q4AUC=0.86(95%CI 0.76~0.96), Q1~Q3AUC=0.92(95%CI 0.88~0.96),P=0.45]和血管水平[Q4AUC=0.91(95%CI 0.85~0.97), Q1~Q3AUC=0.95(95%CI 0.91~0.98),P=0.65]的差异无统计学意义[28]。另外一项基于中国人群的多中心研究表明,CT-FFR(基于CFD模型)对于重度钙化具有较佳的诊断准确度、敏感度和特异度[11]。然而MACHINE 研究则发现,根据CACS 水平以0、100、400 进行分组,重度钙化对于CT-FFR(基于ML 算法)诊断效能具有明显影响,在血管水平的差异有统计学意义[CACS≥400 AUC=0.71(95%CI 0.57~0.85), CACS<400 AUC=0.85(95%CI 0.82~0.89),P=0.04][10]。因此,如何充分利用现有ML 算法的技术条件,进一步稳定甚至改善CT-FFR对于重度钙化冠状动脉的诊断效能仍是一项挑战。
本研究还发现,CT-FFR将部分重度钙化冠状动脉误诊为阳性,从而导致诊断特异度下降,推测是由于在手动分割冠状动脉边界过程中受重度钙化的影响,导致高估冠状动脉实际狭窄情况,因而不可避免地加重冠状动脉树对应节段的狭窄程度,造成分析CT-FFR预测值时出现偏差。参考有创FFR检查过程中通过压力导丝连续回撤技术评价病变与缺血的关系,考虑基于ML 算法的分析平台可以预测冠状动脉树任意一点的CT-FFR 值,本研究尝试以ΔCT-FFR 对重度钙化冠状动脉进行校正,即ΔCTFFR 未达到诊断阈值的校正诊断为阴性[24]。既往研究曾阐述ΔCT-FFR 在急性冠状动脉综合征(acute coronary syndrome,ACS)患者罪犯血管功能学评估中的价值[29],但鲜有文献报道ΔCT-FFR 在重度钙化冠状动脉功能学评估中的临床应用前景。本研究发现,经ΔCT-FFR校正后诊断效能明显提高[校正前AUC=0.792(95%CI 0.663~0.889),校正后AUC=0.876(95%CI 0.760~0.949),P=0.02],对应诊断准确度和特异度也得到一定程度提升。由于ΔCT-FFR 概念并未脱离CCTA影像序列和CT-FFR分析过程,因此其也很可能受到重度钙化的影响,具体原理需要持续深入探讨。
本研究存在以下局限性:(1)为单中心、回顾性研究,样本量偏小,研究结果需要在更大规模的临床研究中验证;(2)相较其他研究以四分位或100、400、1000 进行分组,仅以单支冠状动脉CACS≥100为切点值判定血管水平的重度钙化分层略显单薄;(3)未讨论CT-FFR 在CACS≥1000 极重度钙化冠状动脉功能学评估中的应用价值;(4)有关ΔCT-FFR对于CAD患者远期预后的相关性研究仍需深入探讨。
综上所述,本研究发现,通过ΔCT-FFR 校正CT-FFR检测结果,可明显提高其对重度钙化冠状动脉功能学评估的诊断效能。充分利用现有技术条件,从多角度理解CT-FFR检测结果的临床价值,有助于发挥CCTA 心脏介入中心“看门人”的优势。基于CCTA 精准进行“一站式”解剖学与功能学无创评估,对于指导CAD患者的个体化临床决策与改善远期预后,具有重要的临床意义和卫生经济学价值。

