基于血常规和颈动脉斑块构建缺血性脑卒中nomogram风险预测模型*
王益松,赵 沨,张红珍
(1.安徽理工大学,安徽 淮南 232001;2.安徽理工大学第一附属医院)
脑卒中为全球第二大致死性疾病,我国每年因脑卒中导致的病死率高达151/10万人[1]。缺血性脑卒中的发生往往是由于CAS斑块在毫无预警的情况下破裂、脱落引发脑供血动脉狭窄或闭塞,最终导致脑组织坏死[2-5]。随着人们生活水平不断提高,CIS发病越发常见,一旦发病,往往预后较差,给家庭和社会带来沉重负担。目前,临床主要应用彩色多普勒超声检查进行颈动脉内膜中层厚度(carotid intima-media thickness,CIMT)和CAS斑块的检测来筛查和诊断CAS病变[6-8]。但是目前我国超声医师紧缺与技术水平不均的现状,阻碍了此项检查在预测CAS患者发生缺血性脑卒中筛查中的广泛应用[9-10]。因此,有必要提出一种简单实用的风险预测模型,辅助临床医生及早预测CAS患者发生CIS的风险概率,不仅可缓解我国颈动脉彩色多普勒超声检查的现状,临床医师还可利用此模型早期预测CIS发生的风险概率,采取有针对性的临床策略改善患者预后,对提高患者生存质量具有重要意义。本研究基于血常规和颈动脉斑块构建并验证了一个预测CAS患者发生缺血性脑卒中的nomogram风险预测模型,该模型具有良好的预测度和区分度,对评估CAS患者发生缺血性脑卒中风险具有较高的临床预测价值。
1 对象与方法
1.1研究对象 本研究收集2021年3月1日至2022年3月1日在上海市第八人民医院神经内科住院的CAS患者214例。纳入标准:(1)年龄≥35岁;(2)经颈动脉彩色多普勒超声检查诊断为CAS的住院患者;(3)无任何颈部血管手术史;(4)无严重脑血管疾病史。排除标准:(1)合并严重的肝、肾、心肺及消化系统疾病;(2)颈动脉内膜剥脱术、颈动脉支架成形术或血管搭桥术等颈部血管手术治疗史;(3)患有严重脑血管疾病史;(4)各种原因导致颈动脉闭塞;(5)住院信息不全或临床随访资料不全。缺血性脑卒中的诊断结合临床表现及MRI检查,符合中华医学会2018年发布的“中国急性缺血性脑卒中诊治指南”中制定的标准[11]。
1.2检查方法 颈部血管超声由上海市第六人民医院(徐汇分院)超声科完成,严格参照中国医师协会超声医师分会的《血管超声检查指南》[12]扫查标准进行。使用GE Vivid E9超声诊断仪,配备L9探头,频率为5~12 MHz。患者去枕平卧,充分暴露颈部,头后仰偏向对侧,检查患者双侧颈动脉,测量颈动脉内-中膜(imtima-media thickness,IMT)厚度,记录有无斑块、斑块的内部回声、表面形态、内部构成、测量斑块大小及颈动脉狭窄率。CAS诊断依据2005美国放射学年会超声会议公布的CAS超声标准:IMT厚度>1.0 mm,诊断为增厚;IMT≥1.5 mm,局限性增厚或内中膜增厚大于周边IMT的50%,并凸向血管腔内,则诊断为斑块[13-14]。
1.3观察指标 收集患者的基线资料包括年龄、性别、既往史(吸烟史、高血压、糖尿病);血常规指标,包括白细胞计数、嗜碱性粒细胞比率、中性粒细胞计数、淋巴细胞计数、单核细胞计数、嗜酸性粒细胞计数、嗜碱性粒细胞计数、红细胞平均体积、平均血红蛋白量、平均血红蛋白浓度、红细胞计数、红细胞分布宽度、RDW-CV、血小板分布宽度、平均血小板体积、血小板压积、大型血小板比率、血小板计数、血红蛋白计数、红细胞压积、中性粒细胞比率、C-反应蛋白、血清淀粉样蛋白A、淋巴细胞比率、单核细胞比率、嗜酸性粒细胞比率。超声影像学数据,包括颈动脉彩超结果。

2 结果
2.1两组患者基线特征比较 根据缺血性脑卒中诊断标准,将纳入的214例CAS患者分为无缺血性脑卒中组和缺血性脑卒中组,其中缺血性脑卒中组118例(患病率55.14%)。经统计学检验,两组间年龄、红细胞分布宽度、平均血小板体积、大型血小板比率、血小板计数、血清淀粉样蛋白A和单核细胞比率等指标差异具有统计学意义(P<0.05)。见表1。
2.2单因素logistic回归及Lasso回归筛选模型预测因子 以组间差异有统计学意义的因素为自变量,以是否发生缺血性脑卒中为因变量进行单因素logistic回归,筛选出年龄、红细胞分布宽度、平均血小板体积、大型血小板比率、血小板计数组间差异具有统计学意义(P<0.05)(表2)。将所有变量进一步进行Lasso回归分析,结果显示,当最小均方误差的λ=0.038时,对应模型的变量选择为红细胞分布宽度+大型血小板比率+血小板计数+单核细胞比率;当最小距离的标准误差的λ为0.079时,对应模型的变量选择为红细胞分布宽度+大型血小板比率(图1)。同时,结合临床工作经验,考虑到年龄(P=0.001,OR=1.04)的重要临床意义,因而将其纳入模型。
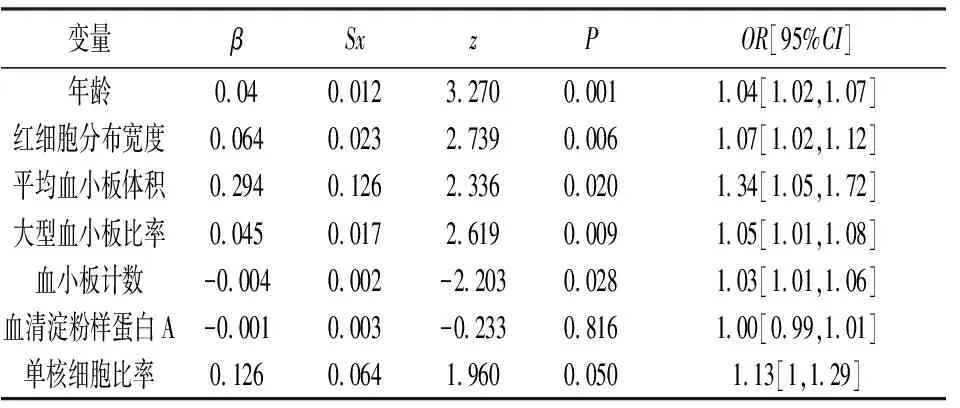
表2 单因素logistic回归分析
采用极端梯度提升树(XGBOOST)对所有P<0.05有统计学意义的变量进行变量重要性分析,筛选出相关度较高,排名前六位的变量。可以看见重要度最高的6个变量(由高到低)分别为:单核细胞比率、红细胞分布宽度、年龄、大型血小板比率、血小板计数、血清淀粉样蛋白A(图2)。利用spearman相关性检验分析年龄、红细胞分布宽度、大型血小板比率、血小板计数这四个变量之间的相互关系,相关性热图分析结果显示年龄与红细胞分布宽度,大型血小板比率与红细胞分布宽度之间存在低度相关性(图3)。因此,最终选择年龄、红细胞分布宽度、大型血小板比率、血小板计数作为nomogram模型预测因子。
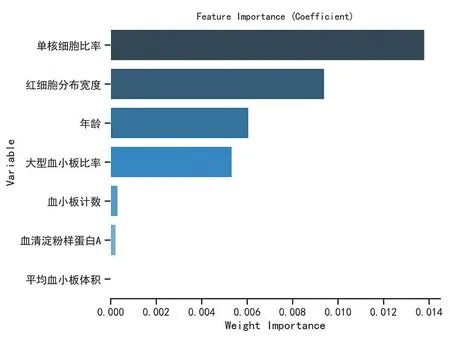
图2 影响因素重要性排序

图3 相关性热图分析
2.3nomogram预测模型建立 基于年龄、红细胞分布宽度、大型血小板比率、血小板计数这四个风险预测因子建立预测CAS患者发生缺血性脑卒中的nomogram风险列线图模型(图4)。根据每个变量对应的分值刻度进行相应赋分,将每个变量得分相加即得总评分,根据总评分向下绘制一条垂直线,可得出CAS患者发生缺血性脑卒中的概率。
2.4nomogram预测模型验证 对nomogram模型进行内部验证,结果显示验证组ROC曲线下面积(AUC)为0.769(图5)。Hosmer-Lemeshow拟合优度检验验证nomogram模型的校准度,模型绝对误差为0.058(图6),表明该模型预测概率与实际概率接近一致,提示该预测模型具有良好的区分度和预测度。同时,校准曲线也提示nomogram预测模型的校正能力良好。另外,利用DCA决策曲线评价nomogram风险预测模型的临床效能,当模型的阈值概率>8%时,采用该nomogram风险预测模型预测CAS患者发生缺血性脑卒中的风险将会获得更多的临床实用效益(图7)。
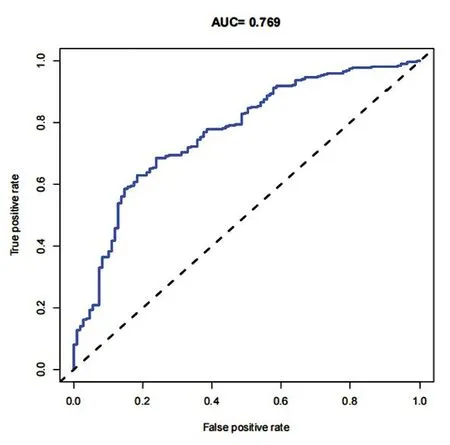
图5 ROC曲线
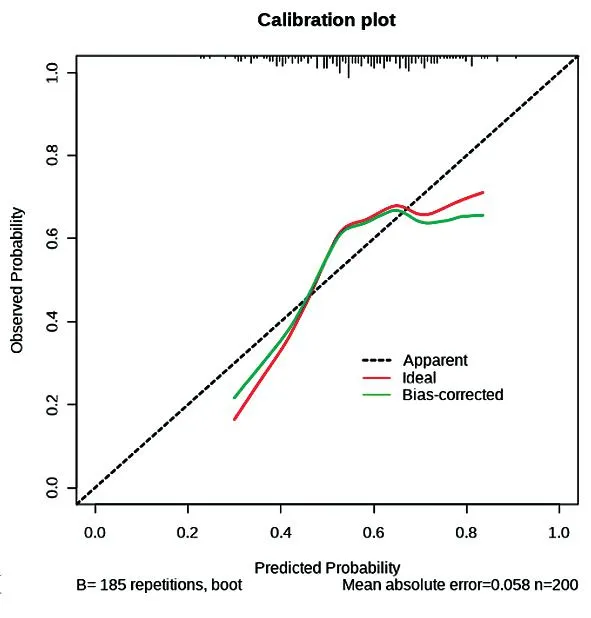
图6 校准曲线

图7 DCA验证曲线
3 讨论
目前,nomogram模型已被国内外广泛应用于重大疾病的风险预测中[15]。nomogram预测模型简单便捷且准确性高,有助于辅助临床医生早期识别CAS患者发生缺血性脑卒中的风险,并采取有针对性的临床预测策略[16-17]。本研究构建并验证了CAS患者发生CIS风险的nomogram预测模型,预测模型包含4个预测因子:年龄、红细胞分布宽度、大型血小板比率、血小板计数。预测模型的AUC为0.769,提示模型的预测水准良好。校准图显示了实际诊断与预测诊断之间的良好一致性。DCA曲线提示该模型具有临床有效性。
年龄(OR=1.04;95%CI:1.02~1.07)是CAS患者发生缺血性脑卒中的重要危险因素。有学者[18-19]研究发现老年患者CIS的发病率和死亡率比年轻患者更高,且预后更差,因此,本研究推荐将年龄作为诊断CAS患者发生缺血性脑卒中的危险预测因子之一。随着年龄的增长,机体各器官组织机能逐渐衰退;与此同时,随着CAS患者病程延长,颈部血管内皮细胞的损伤逐渐加重,CAS斑块不稳定性增加,CAS患者发生缺血性脑卒中概率增加[20]。本研究同样证实,随着年龄增长,CAS患者发生CIS病变的概率也随之增高,年龄>65岁的CAS患者并发CIS的概率在30%以上,可为诊断CIS提供支持性证据。
红细胞分布宽度(red blood cell distribution width,RDW))是缺血性脑卒中的主要诊断指标。Feng等[21]研究证实,红细胞分布宽度是CAS患者CIS发生和发展的独立危险因素。Mohindra 等[22]发现RDW数值每升高1.6%,发生缺血性脑卒中的风险将增加33%。另外,Wang等[23]同样证实,红细胞分布宽度与缺血性脑卒中存在显著的相关性,且RDW ≥13.05%的CIS患者预后较差。本研究结果佐证了这些研究,RDW(OR=1.07;95%CI:1.02~1.12)是CAS患者发生缺血性脑卒中的独立危险因素。
大型血小板比率(platelet-large cell rate,P-LCR)是评估CAS患者发生缺血性脑卒中的常用指标,也是CAS的独立危险因素[24-25],与缺血性脑卒中的发生发展密切相关[26-29]。P-LCR是反映血小板活化的有效指标。既往有研究者指出,P-LCR在缺血性脑卒中的病程进展中发挥着重要作用,P-LCR对凝血酶和胶原具有较强的聚集反应,可释放更多的生物活性物质如5-羟色胺、B-血栓蛋白等,P-LCR异常的患者更易发生血小板凝集反应形成血栓,进而发生缺血性脑卒中[30-31]。本研究同样证实了P-LCR(OR=1.05;95%CI:1.01~1.08)是CAS患者发生CIS的独立风险预测因子,与上述研究学者观点一致。
血小板计数(platelet count,PLT)是评估CAS患者发生缺血性脑卒中的基本衡量指标。血小板具有黏附、释放和聚集的生理功能,其在动脉粥样硬化脑血栓形成的病理过程中发挥着重要作用[32]。Zhu等[33]研究显示,PLT正常的患者CAS发生率明显较低,且发展为缺血性脑卒中的风险也较低。本研究结果与上述观点一致,PLT(OR=1.03;95%CI:1.01~1.06)是CAS患者发生缺血性脑卒中的独立风险预测因子。
在本研究中,我们比较了多个潜在的影响因素来探讨其与缺血性脑卒中之间的相关性。首先,我们发现颈动脉内膜中层厚度与缺血性脑卒中之间呈现出显著的正相关关系,内膜中层厚度越大,缺血性脑卒中发生的风险越高。这一结果也与先前的研究成果相符合。内膜中层厚度是颈动脉粥样硬化的重要指标,可以理解为颈动脉粥样硬化会导致内膜中层厚度的增加,这也是导致脑卒中的重要因素之一。其次,我们发现高血压也是另一个与缺血性脑卒中显著相关的因素。高血压会导致颈动脉粥样硬化,增加血栓和栓子形成的风险,因此与缺血性脑卒中相关性较高。除此之外,吸烟史和糖尿病也被发现是缺血性脑卒中的独立风险因素。吸烟可以导致动脉粥样硬化,并增加血栓形成的风险,而糖尿病则会导致血糖水平失控,引发炎症和血管损伤,增加血栓形成和缺血性脑卒中发生的风险。在本研究中,我们并未发现性别、体质量指数和饮酒史与缺血性脑卒中之间的显著相关性。这虽然不意味着这些因素不会增加缺血性脑卒中发生的风险,但其对脑卒中风险的影响相对较小,而不足以作为预测缺血性脑卒中的重要指标。总的来说,在制定缺血性脑卒中预防策略时,我们需要重点关注那些已被证明对缺血性脑卒中风险有重要影响的因素,如颈动脉内膜中层厚度、高血压、吸烟史和糖尿病等,依此制订预防措施可以大幅降低缺血性脑卒中的发生率。
本研究主要基于常见的血常规指标构建了一个包含年龄、红细胞分布宽度、大型血小板比率、血小板计数等4个预测变量的nomogram预测模型,ROC曲线、校准曲线和DCA曲线均显示该模型具有良好的预测性能,可为临床医生预测缺血性脑卒中提供诊疗决策,从而采取有针对性、个性化的干预措施来预防CAS患者缺血性脑卒中的发生发展。然而,本研究尚存在一些局限性。首先,本研究是一项回顾性临床研究,且样本量较小,结果的可信度需进一步验证,尤其需要其他不同地区、不同种族人群的多中心、大样本的数据,通过外部验证来检验该nomogram模型的预测效能。其次,本研究的危险因素纳入不全,其他更多的临床指标与CIS风险发生密切相关,如饮食、运动和同型半胱氨酸等其他指标。在下一步的研究中,我们将继续扩大样本量,并收集更多的相关变量指标,筛选出更精准的缺血性脑卒中预测因子纳入模型,进一步优化提升模型的准确性和预测性。

