黑地黄丸通过调控IGF-1 表达对慢性肾衰竭大鼠肾纤维化的抑制作用
叶莉莹,潘广辉,赵 平,王泽鹏,柳 成,李颖颖,张法荣*
(1.山东中医药大学,山东 济南 250355; 2.山东中医药大学附属医院,山东 济南 250012; 3.泰安市中医院,山东 泰安 271000; 4.北大医疗淄博医院,山东 淄博 255000)
慢性肾衰竭(chronic renal failure,CRF) 是一种肾功能进行性减退直至衰竭的临床综合征,病情危重,病死率高,严重威胁患者生命健康[1-2]。肾间质纤维化(renal interstitial fibrosis,RIF) 是各种原因引起的CRF 进展为终末期肾衰的共同途径[3]。胰岛素样生长因子-1 (insulin-like growth factor-1,IGF-1) 是重要的促生长因子,在肾小管以及肾小球上均有IGF-1 受体(IGF-1R) 的表达,IGF-1 能够刺激各种肾脏细胞生长,与纤维化密切相关[4]。目前临床治疗CRF 以腹膜透析等为主[5],但随着透析时间延长,患者代谢紊乱、微炎症状态随之加重,给预后带来严重影响[6]。因此,临床迫切需要安全有效的药物来防治CRF 肾纤维化的进展。
中医学认为CRF 属本虚标实之证,本虚为脾肾亏虚,标实为湿浊、血瘀,需以健脾补肾、活血化瘀、解毒化湿之法治之[7]。黑地黄丸出自刘完素《素问病机气宜保命集》,由熟地黄、苍术、干姜、大枣4 味中药组成,具有补肾健脾、燥湿化浊之效[8-9]。课题组前期研究证实黑地黄丸能够延缓CRF 进展,且发现CRF 大鼠血清IGF-1 变化明显[10]。基于此,本实验重点探究黑地黄丸对CRF大鼠肾纤维化的影响以及IGF-1 在其中的作用,以期为黑地黄丸临床研究提供实验室依据。
1 材料
1.1 动物 SPF 级雄性Wistar 大鼠,体质量(180±20) g,由北京维通利华动物技术有限公司提供[实验动物生产许可证号SCXK (京) 2016-0006],饲养于山东中医药大学附属医院实验中心,环境温度(24±2)℃,相对湿度(60±5)%,12 h/12 h光/暗循环,标准饮食,自由饮水。实验过程中所有操作均符合山东中医药大学附属医院实验中心实验动物伦理原则(伦理号AWE-2019-015)。
1.2 药物 黑地黄丸由熟地黄32 g、苍术32 g、干姜2 g、大枣34 g 组成,中药饮片购自山东中医药大学附属医院药房,经该院中药师谷明举主任鉴定为正品,在本院煎药室进行药物制备。将4 味药加10 倍量水浸泡30 min,煎煮2 次,每次2 h,纱布过滤后合并滤液,浓缩至最终质量浓度为1 g/mL,4 ℃保存备用。
1.3 试剂 IGF-1R 阻断剂JB1 (货号T6017) 购自上海陶术生物科技有限公司; BCA 蛋白定量试剂盒(货号P0010) 购自上海碧云天生物技术股份有限公司; TGF-β (货号ab215715)、GAPDH (货号ab181602) 抗体均购自英国Abcam 公司; IGF-1R 抗体(货号20254-1-AP)、辣根过氧化物酶标记的山羊抗兔IgG (货号20536-1-AP) 均购自武汉三鹰生物技术有限公司; α-SMA 抗体 (货号GB11364)、HIF-1α 抗体(货号GB13031)、免疫组化试剂盒DAB 显色剂(货号G1211) 均购自武汉赛维尔生物科技有限公司; ECL 发光试剂盒(货号MA0186)、组织固定液(货号MA0192) 均购自大连美仑生物技术有限公司; 快速RNA 提取试剂盒 (货号AC0202)、反转录试剂盒 (货号AG0304)、实时荧光定量聚合酶链式反应(Realtime PCR) 试剂(货号AH0104) 均购自青岛浩赛科技股份有限公司。
1.4 仪器 BX53 荧光显微镜(日本Olympus 公司); 5404 离心机 ( 德国 Eppendorf 公司);RM2235 切片机(德国Leica 公司); FluorChemQ显影仪(美国Protein-Simple 公司); 5424R 型低速离心机(美国Thermo Fisher 公司); DK-8D 型电热恒温水浴锅 (上海比朗仪器制造有限公司);LDZM-80KCS-Ⅱ型立式压力蒸汽灭菌器(上海申安医疗器械厂); SIM-F124 制冰机(日本SANYO公司); CascadaI 型纯化水系统(美国PALL 公司),Axiovert40 型倒置显微镜(德国Carl Zeiss 公司)。
2 方法
2.1 CRF 大鼠模型的建立 60 只大鼠适应性喂养1 周后,随机取12 只大鼠作为空白组,剩余大鼠采用5/6 肾切除法复制CRF 模型[11]。大鼠腹腔注射戊巴比妥钠(30 mg/kg) 麻醉,俯卧位固定,常规消毒皮肤,暴露右肾,剥离肾被膜,结扎肾门,切除右肾(保留肾上腺),逐层缝合皮肤。第1 次手术后10 d,同样方法麻醉后切除左肾上、下极肾实质,以明胶海绵压迫止血,关闭腹腔。各组大鼠于第2 次术后4 周,断尾取血,并检测血清中肌酐(serum creatinine,Scr)、尿素氮(blood urea nitrogen,BUN) 水平,以Scr、BUN 水平较空白组均显著升高表明模型复制成功[12](本实验共剔除死亡和未成模大鼠8 只)。
2.2 分组及给药 将造模成功的大鼠随机分成模型组(14 只)、黑地黄丸组(13 只) 及黑地黄丸+JB1 组(13 只),另设空白组(12 只)。根据体表面积法换算等效剂量,黑地黄丸组大鼠每天皮下注射生理盐水; 黑地黄丸+JB1 组大鼠每天9: 00 皮下注射18 ng/g IGF-1R 阻断剂JB1 (50 ng/μL),连续7 d。注射7 d 后,黑地黄丸组和黑地黄丸+JB1 组大鼠均灌胃给予10.43 g/kg 黑地黄丸药液,空白组和模型组均灌胃给予等量生理盐水,每天1次,连续8 周。
2.3 大鼠肾功能检测 给药8 周后,大鼠腹腔注射戊巴比妥钠(30 mg/kg) 麻醉,腹主动脉取血,静置30 min 后离心取血清,于-80 ℃冰箱保存。采用全自动生化分析仪检测血清Scr、BUN 水平。
2.4 肾组织病理学观察 将残余肾脏沿肾蒂剪下,以10%多聚甲醛溶液固定后,流水冲洗过夜,常规脱水,透明,浸蜡,包埋,切片,展片,烤片,再进行苏木素-伊红(HE) 和马松(Masson) 染色。HE 染色切片在光镜下观察肾脏组织的改变;Masson 染色切片在光学显微镜下观察肾纤维化改变。在200 倍镜下随机选取10 个不同视野,将呈现为蓝色区域的胶原纤维作为阳性目标,以阳性区域面积与整个视野总面积的比值为肾纤维化指数。采用Image Pro Plus 6.0 软件进行半定量分析。
磨矿是选矿过程中的一个重要环节,尤其是对硫化矿来说,磨矿会使其矿浆性质(如矿浆电位、pH)产生较大的改变[1],这些改变对浮选回收率起着至关重要的作用。因此,磨矿对方铅矿矿浆电位及浮选行为影响的研究十分必要。
2.5 免疫组化法检测肾组织TGF-β、HIF-1α、α-SMA 蛋白表达 肾组织石蜡切片采用免疫组织化学染色测定肾小管间质TGF-β、HIF-1α、α-SMA蛋白表达。
2.6 Western blot 法检测肾组织IGF-1R、TGF-β 蛋白表达 取肾组织,在冰上用RIPA 细胞裂解液裂解,提取蛋白,BCA 法测定蛋白浓度后,加入上样缓冲液煮沸10 min 进行变性。取40 μg蛋白上样,经SDS-PAGE 凝胶电泳后,将蛋白电转至聚偏氟乙烯(PVDF) 膜上,用50 g/L 脱脂奶粉溶液室温封闭1 h,加入一抗4 ℃孵育过夜,洗膜后加入辣根过氧化物酶(HRP) 标记的二抗室温孵育1 h,洗膜后采用电化学发光(ECL) 法使蛋白条带显色,以GAPDH 为内参,采用Image J 分析软件对各组条带的灰度值进行分析。
2.7 RT-qPCR 法检测肾组织IGF-1R、TGF-βmRNA表达 收集各组肾组织后,使用快速RNA 提取试剂盒提取肾组织总RNA,按照试剂盒说明书反转录合成cDNA 后,采用RT-qPCR 系统检测关键靶点IGF-1R和TGF-β的表达。PCR 扩增以GAPDH为内照,引物序列见表1。扩增条件为95 ℃预变性30 s,95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸30 s,循环40 次。PCR 实验重复3 次,每次3 个复孔,根据RT-qPCR 原始数据CT值,以2-ΔΔCT法分析样本的相对表达量。

表1 引物序列Tab.1 Primer sequences
2.8 统计学分析 通过SPSS 25.0 软件进行处理,计量资料以(±s) 表示,多组间比较采用单因素方差分析,两组间比较采用最小显著性差异法(LSD)。P<0.05 认为差异有统计学意义。
3 结果
3.1 CRF 造模后大鼠肾功能指标比较 以血清Scr、BUN 水平为指标,通过对比造模前后指标变化,评价CRF 模型是否建立成功。如表2 所示,与空白组比较,CRF 造模组大鼠血清Scr、BUN 水平均升高(P<0.05),表明大鼠CRF 模型复制成功。
表2 造模后大鼠肾功能指标比较(±s)Tab.2 Comparison of renal function indexes levels in rats after modeling (±s)

表2 造模后大鼠肾功能指标比较(±s)Tab.2 Comparison of renal function indexes levels in rats after modeling (±s)
注: 与空白组比较,#P<0.05。
组别动物数/只Scr/(μmol·L-1)BUN/(mmol·L-1)空白组1220.00±0.126.92±0.72造模组4038.29±14.58#12.81±4.91#
3.2 黑地黄丸对CRF 大鼠血清Scr、BUN 水平的影响 与空白组比较,模型组大鼠血清Scr、BUN水平升高(P<0.05),表明模型组大鼠肾功能衰退; 与模型组比较,黑地黄丸组大鼠血清Scr、BUN 水平降低(P<0.05),黑地黄丸+JB1 组大鼠血清BUN 水平降低(P<0.05),Scr 水平无明显变化(P>0.05),见表3。结果表明,连续给药8 周后,CRF 大鼠肾功能好转,而此效应被JB1 减弱。
表3 黑地黄丸对CRF 大鼠血清Scr、BUN 水平的影响(±s)Tab.3 Effects of Heidihuang Pills on serum Scr and BUN levels in CRF rats (±s)
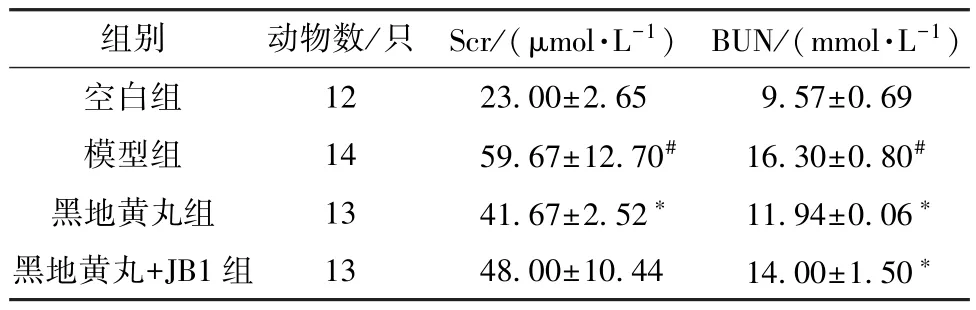
表3 黑地黄丸对CRF 大鼠血清Scr、BUN 水平的影响(±s)Tab.3 Effects of Heidihuang Pills on serum Scr and BUN levels in CRF rats (±s)
注: 与空白组比较,#P<0.05; 与模型组比较,*P<0.05。
组别动物数/只 Scr/(μmol·L-1) BUN/(mmol·L-1)空白组1223.00±2.659.57±0.69模型组1459.67±12.70#16.30±0.80#黑地黄丸组1341.67±2.52*11.94±0.06*黑地黄丸+JB1 组1348.00±10.4414.00±1.50*
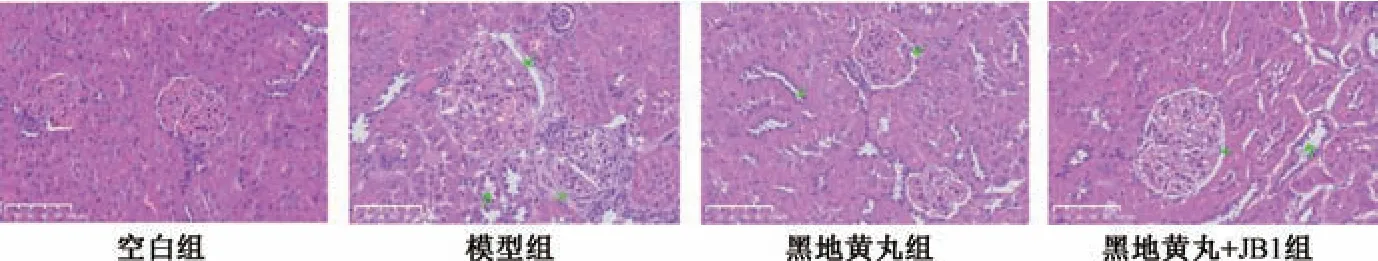
图1 各组大鼠肾组织HE 染色(×200)Fig.1 HE staining of rat renal tissue for each group (×200)
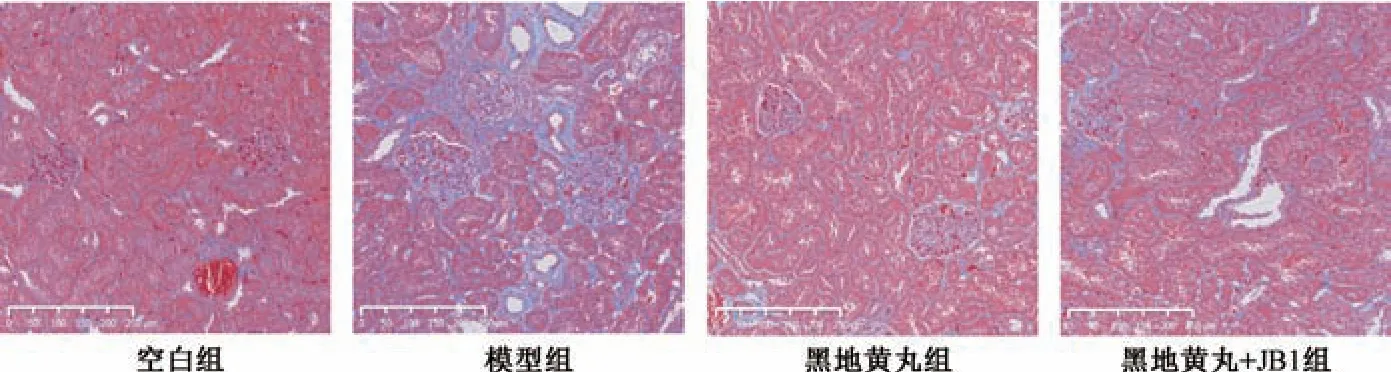
图2 各组大鼠肾组织Masson 染色(×200)Fig.2 Masson staining of rat renal tissue for each group (×200)
表4 黑地黄丸对CRF 大鼠肾脏纤维化的影响(±s,n =6)Tab.4 Effects of Heidihuang Pills on renal fibrosis in CRF rats (±s,n=6)

表4 黑地黄丸对CRF 大鼠肾脏纤维化的影响(±s,n =6)Tab.4 Effects of Heidihuang Pills on renal fibrosis in CRF rats (±s,n=6)
注: 与空白组比较,#P<0.05; 与模型组比较,*P<0.05。
组别纤维化阳性面积占比/%空白组5.43±0.63模型组25.25±3.02#黑地黄丸组16.15±1.20*黑地黄丸+JB1 组18.39±1.03*
3.4 黑地黄丸对CRF 大鼠肾组织TGF-β、α-SMA、HIF-1α 蛋白表达的影响 如图3 所示,与空白组比较,模型组大鼠肾组织TGF-β、α-SMA、HIF-1α 蛋白表达增加(P<0.05); 与模型组比较,黑地黄丸组和黑地黄丸+JB1 组大鼠肾组织TGF-β、α-SMA、HIF-1α 蛋白表达减少(P<0.05); 与黑地黄丸组比较,黑地黄丸+JB1 组大鼠肾组织TGFβ、α-SMA 蛋白表达增加(P<0.05)。结果表明,黑地黄丸可以下调CRF 大鼠肾组织中TGF-β、α-SMA 及HIF-1α 蛋白表达,而此效应会被IGF-1R阻断剂JB1 所抑制。
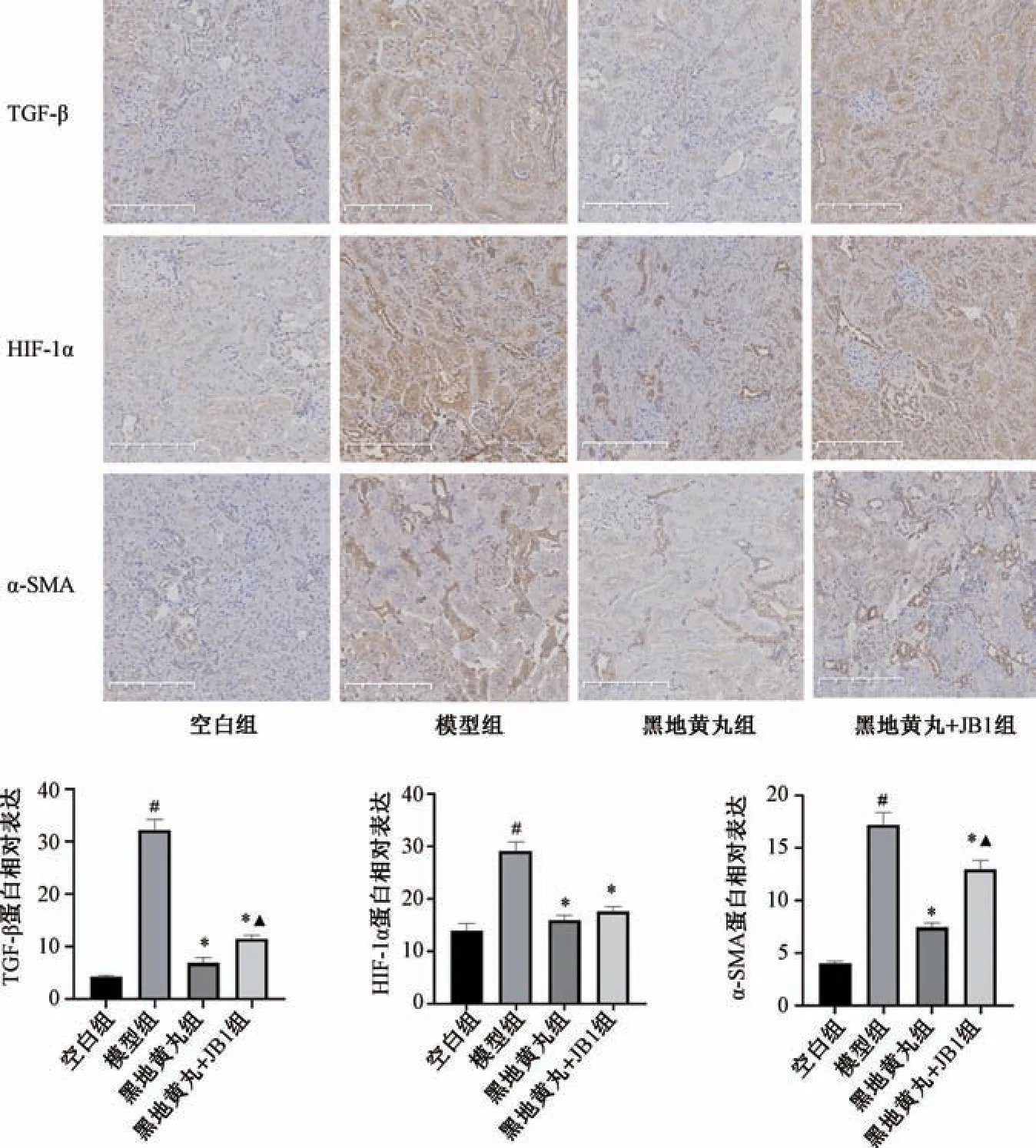
图3 黑地黄丸对CRF 大鼠肾组织TGF-β、α-SMA、HIF-1α 蛋白表达的影响(×200,±s,n=3)Fig.3 Effects of Heidihuang Pills on the renal protein expressions of TGF-β,α-SMA and HIF-1α in CRF rats (×200,±s,n=3)
3.5 黑地黄丸对CRF 大鼠肾组织IGF-1R、TGF-β蛋白表达的影响 如图4 所示,与空白组比较,模型组大鼠肾组织IGF-1R 蛋白表达降低(P<0.01),TGF-β 蛋白表达升高(P<0.01); 与模型组比较,黑地黄丸组和黑地黄丸+JB1 组大鼠肾组织IGF-1R蛋白表达升高(P<0.05),TGF-β 蛋白表达降低(P<0.05); 与黑地黄丸组比较,黑地黄丸+JB1 组大鼠肾组织IGF-1R 表达降低(P<0.05)。结果表明,黑地黄丸可以上调CRF 大鼠肾组织IGF-1R 蛋白表达,下调TGF-β 蛋白表达,而联用JB1 后,可减弱黑地黄丸对肾组织IGF-1R、TGF-β 的调控作用。
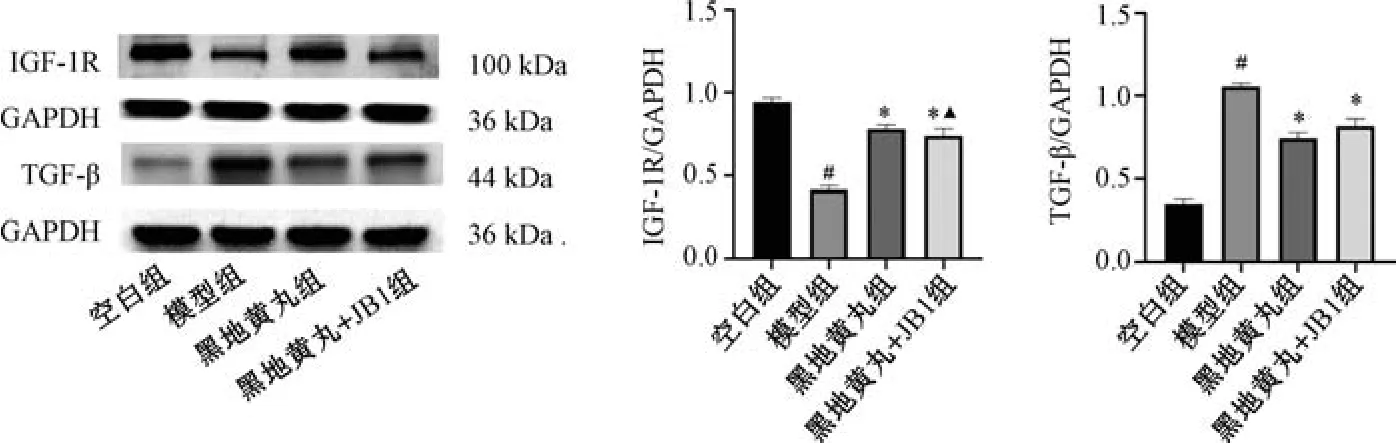
图4 黑地黄丸对CRF 大鼠肾组织IGF-1R、TGF-β 蛋白表达的影响(±s,n=3)Fig.4 Effects of Heidihuang Pills on the renal protein expressions of IGF-1R and TGF-β in CRF rats (±s,n=3)
3.6 黑地黄丸对CRF 大鼠肾组织IGF-1R、TGF-βmRNA 表达的影响 与空白组比较,模型组大鼠肾组织IGF-1RmRNA 表达降低(P<0.05),TGF-βmRNA 表达升高(P<0.05); 与模型组比较,黑地黄丸组和黑地黄丸+JB1 组大鼠肾组织IGF-1RmRNA 表达均升高(P<0.05),TGF-βmRNA 表达均降低(P<0.05); 与黑地黄丸组比较,黑地黄丸+JB1 组大鼠肾组织IGF-1RmRNA 表达降低(P<0.05),而TGF-βmRNA 表达升高(P<0.05),见表5。结果表明,黑地黄丸能够上调CRF 大鼠肾组织IGF-1RmRNA 表达,抑制TGF-βmRNA 表达,而联用JB1 后,黑地黄丸对肾组织IGF-1R、TGF-βmRNA 表达的调控作用被抑制。
表5 黑地黄丸对CRF 大鼠肾组织IGF-1R、TGF-β mRNA 表达的影响(±s,n=3)Tab.5 Effects of Heidihuang Pills on the renal mRNA expressions of IGF-1R and TGF-β in CRF rats(±s,n=3)

表5 黑地黄丸对CRF 大鼠肾组织IGF-1R、TGF-β mRNA 表达的影响(±s,n=3)Tab.5 Effects of Heidihuang Pills on the renal mRNA expressions of IGF-1R and TGF-β in CRF rats(±s,n=3)
注: 与空白组比较,#P<0.05; 与模型组比较,*P<0.05; 与黑地黄丸组比较,▲P<0.05。
组别IGF-1R mRNATGF-β mRNA空白组1.00±0.001.00±0.00模型组0.32±0.12#1.94±0.76#黑地黄丸组0.95±0.41*1.18±0.33*黑地黄丸+JB1 组0.77±0.36*▲1.52±0.67*▲
4 讨论
中医学认为CRF 应归于“肾劳” “癃闭” “水肿” 等范畴,其病程缠绵,且反复发作,根本病机当属于脾肾亏虚,湿浊血瘀之证。黑地黄丸是针对CRF 病机特点而设制剂,主治脾肾不足证。课题组前期研究表明,黑地黄丸能够通过调控氧化应激、微炎症状态以及钙磷代谢等途径提高大鼠肾功能,延缓CRF 进展[13-15],证实了黑地黄丸在CRF中具有一定的治疗潜力。
RIF 的病理改变主要为肾单位的进行性破坏,同时伴有大量成纤维细胞及肌成纤维细胞增生,细胞外基质产生堆积导致肾小球硬化,从而加重RIF,最终引起CRF[16]。因此,抑制RIF 的发展,对CRF 的治疗有十分重要的意义。研究表明,TGF-β 是公认的体现肾纤维化的特效性指标,α-SMA 也被作为早期纤维化的标志,而HIF-1α 在RIF 的发展中具有重要的调节作用,三者是肾间质纤维化的重要指标[17-19]。本研究通过5/6 肾切除构建CRF 大鼠模型,结果显示,CRF 大鼠Scr、BUN 水平升高,肾组织出现纤维化,TGF-β、α-SMA 和HIF-1α 表达升高; 使用黑地黄丸干预后,可以有效调节上述指标,改善CRF 大鼠肾功能。
IGF-1 是一类促进细胞生长,抑制细胞凋亡,具有胰岛素样代谢效应的因子,能够刺激各种肾脏细胞生长,进而对肾损伤大鼠肾小管上皮细胞起到保护作用[20]。有研究报道,IGF-1 的缺失会导致高血压小鼠进一步加重左室功能障碍和肾功能损伤[21]; 注射IGF-1 后能够下调肾小管上皮细胞凋亡达38%,下调肾间质胶原沉积达44%,因此,IGF-1 是重要的肾脏保护性因子[22]。但也有学者持有不同的观点,目前两者的关系存在争议[23],IGF-1 在肾脏疾病发展过程中的作用及机制尚有待进一步研究。本研究发现,空白组大鼠肾小管间质仅少量表达HIF-1α、α-SMA 及TGF-β,而模型组大鼠肾小管间质中上述指标表达增多且与肾功能下降相平行; 同时发现IGF-1 表达增加和HIF-1α、α-SMA 及TGF-β 的表达成反比,使用IGF-1R 抑制剂并没有使HIF-1α、α-SMA 及TGF-β 蛋白表达下调,且IGF-1 表达量与肾间质纤维化成反比,提示IGF-1 可能对损伤的肾上皮细胞起到了保护作用。其中黑地黄丸组IGF-1 表达升高,HIF-1α、α-SMA及TGF-β 表达均降低且与肾脏纤维化程度相平行,表明黑地黄丸能够调控IGF-1 因子发挥肾脏保护作用。黑地黄丸是否能够调控其他作用途径改善肾纤维化,将是本课题将来探索的新方向。
综上所述,本研究通过构建CRF 模型探究黑地黄丸对肾纤维化的影响,结果显示黑地黄丸能够通过上调IGF-1 表达,促进IGF-1 与IGF-1R 受体相结合,激活IGF-1 通路,抑制肾纤维化,缓解CRF 肾损伤。该结果初步证实了黑地黄丸在CRF中的治疗作用,为后期临床应用提供了实验依据。

