毛蕊花糖苷对腺嘌呤所致不育症大鼠的影响
王 志,侯 强,冉 峥,杨建华*
(1.新疆医科大学第一附属医院药学部,省部共建中亚高发病成因与防治国家重点实验室,新疆 乌鲁木齐 830054; 2.新疆医科大学药学院,新疆 乌鲁木齐 830017)
据世卫组织统计,目前全世界大约有15% 的育龄夫妇患不孕不育症,由男方原因所致的不育症比例超过50%[1]。近年来,受环境污染、社会压力增加等因素的影响,不育症的发病率呈逐年递增的趋势[2]。不育症病因复杂,目前其发病机制尚未十分明确,现代医学对不育症的治疗主要为经验性药物治疗、手术以及辅助生殖技术,但疗效不确定,且费用昂贵[3]。
毛蕊花糖苷是列当科肉苁蓉属植物的活性成分中含量最高的苯乙醇苷类单体化合物[4]。2020 年版《中国药典》 收载毛蕊花糖苷为控制肉苁蓉药材质量的指标成分[5]。肉苁蓉作为历代补肾壮阳类处方中使用频度最高的补益药物,具有补肾阳、益精血等功效[6]。临床实验表明,以肉苁蓉为君药的名老中医验方可重建生殖内分泌环境的平衡,促进精子质量的提高[7]。研究显示,肉苁蓉苯乙醇苷能改善大鼠生殖功能指标[8]。但目前尚未见有关毛蕊花糖苷对生殖功能改善作用的研究报道。因此,本研究拟建立腺嘌呤诱导的不育症大鼠模型,以毛蕊花糖苷给药干预,观察其对不育症大鼠生殖功能的改善效果,并初步探讨可能的作用机制,以期为毛蕊花糖苷治疗不育症的临床研究奠定基础。
1 材料
1.1 实验动物 雄性SD 大鼠40 只,体质量(250±20) g,购自新疆医科大学动物实验中心[实验动物生产许可证号SCXK (新) 2021-0003],饲养于新疆医科大学动物实验中心SPF 屏障环境[实验动物使用许可证号SYXK (新) 2021-0002],环境温度24~26 ℃,相对湿度40% ~70%,每天昼夜交替,光照时间12 h,自由进食和饮水,常规适应性饲养1 周。本实验依照动物实验替代、减少、优化的原则进行操作,符合动物伦理原则,动物实验伦理审批号20210301-180。
1.2 药物 毛蕊花糖苷(湖南青纯科技有限公司,纯度≥98%,批号516V079); 复方玄驹胶囊(浙江施强制药有限公司,批号20201126)。
1.3 试剂 羧甲基纤维素钠(CMC-Na) (上海麦克林生化科技股份有限公司,批号2019010); 腺嘌呤、BCA 蛋白定量试剂盒(北京索莱宝科技有限公司,批号J05D10104855、2307001); 睾酮(testosterone,T)、促黄体生成素 (luteinizing hormone,LH)、促卵泡激素 (follicle stimulating hormone,FSH) ELISA 试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号 8LDB6IPQ9C、FRSF2TX2IP、YXTDI1VCB3); 促性腺激素释放激素(gonadotropin-releasing hormone,GnRH) ELISA试剂盒 (美国Sigma 公司,批号WXBB7889V);4%组织细胞固定液、微管相关蛋白轻链3-B( microtubule-associatedproteinlightchain3-B,LC3B)、UNC-51 样激酶1 (ULK1) 多克隆抗体(北京博奥森生物科技有限公司,批号BA02198228、BA09153033、AB10234578); SDSPAGE 凝胶制备试剂盒(北京博泰斯生物技术有限公司,批号6110207); PVDF 膜(瑞士罗氏公司,批号69290400); 兔抗哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、p-mTOR抗体 (美国CST 公司,批号2983S、5536S);cDNA 反转录试剂盒、TRIzol 试剂、甲醇(美国Thermo Fisher Scientific 公司,批号 91258333、98597501、DU644-US); qPCR 试剂盒(南京诺唯赞生物科技股份有限公司,批号027E2260IA)。
1.4 仪器 全波长自动酶联免疫反应检验测试仪、Sorvall ST 16R 型高速冷冻离心机、实时荧光定量PCR 仪(美国Thermo Fisher Scientific 公司); DWHL678 型超低温冰箱(中科美菱低温科技股份有限公司); 光学显微镜(江苏鱼跃医疗设备股份有限公司); 细胞计数板(日本岛津公司); ME215S型分析天平[赛多利斯科学仪器(北京) 有限公司]; 包埋机(武汉俊杰电子有限公司); 病理切片机(上海徕卡仪器有限公司); 脱色摇床(北京六一生物科技有限公司); 电泳仪、转膜仪(美国Bio-Rad 公司); PURELAB Chorus 1 Complete 型超纯水仪(英国Elga 公司)。
2 方法
2.1 分组、造模及给药 大鼠随机分为空白组、模型组、阳性对照组(复方玄驹胶囊) 和毛蕊花糖苷低、高剂量组(50、100 mg/kg),每组8 只,大鼠给药量按人与大鼠体表面积等效换算[9],空白组灌胃生理盐水(10 mL/kg),其余各组每天灌胃150 mg/kg 腺嘌呤,连续灌胃14 d 后,用大鼠代谢笼收集尿液,并计算大鼠24 h 的进食量和尿量; 与空白组比较,模型组大鼠食量减少,尿量增加,精子计数减少,血清T 水平降低,即表示造模成功。第15 天起,阳性对照组灌胃给予100 mg/kg 复方玄驹胶囊溶液,毛蕊花糖苷低、高剂量组灌胃给予50、100 mg/kg 毛蕊花糖苷,空白组和模型组灌胃给予等量生理盐水(10 mL/kg),连续给药28 d。
2.2 样本采集 末次给药后,大鼠禁食不禁水24 h,腹腔注射10%水合氯醛(0.3 mL/100 g) 进行麻醉,腹主动脉采血,全血4 ℃放置2 h 后,3 000 r/min 离心10 min,留取血清,分装后保存待检; 取血完成后处死大鼠,迅速剖取肝脏、肾脏、睾丸和附睾组织,使用生理盐水漂洗后称重,计算各脏器指数。肝脏、肾脏和睾丸分成2 份,一份于4% 组织细胞固定液中固定,用于病理学染色,另一份液氮速冻后于-80 ℃保存,附睾只做精子检查。
2.3 一般情况观察 实验过程中观察各组大鼠体质量变化、饮食变化、排尿变化、活动情况及精神状况等。
2.4 精子情况检测
2.4.1 精子计数 将附睾置于37 ℃生理盐水中,剪开附睾孵育5 min。精子可以通过轻轻摇晃或挤压完全游出去,然后用普通光学显微镜观察精子的活力。当附睾中的精子完全游出后,用不锈钢细胞筛过滤,反复多次,滤液以4 000 r/min 离心5 min,留取沉淀,将沉淀加入预先准备的1 mL 精子固定液中充分搅拌。混合后,用细胞计数板对精子进行计数。
2.4.2 精子活动率 计数细胞计数板上活精子数占总精子数的百分比,即为精子活动率。
2.4.3 精子指数 精子计数除以单位睾丸质量(每100 g) 即为精子指数。
2.5 血清性激素水平检测 从冷藏室取出各试剂盒,室温平衡30 min,同时从-80 ℃冰箱取出血清样本放至室温,根据相应ELISA 试剂盒说明书检测各组大鼠血清T、LH、FSH、GnRH水平。
2.6 各脏器组织病理学检测 取固定的组织,流水冲洗,梯度乙醇脱水,二甲苯透明,浸蜡,包埋,制备4 μm 切片。石蜡切片用二甲苯、无水乙醇、梯度乙醇和蒸馏水处理,然后脱蜡、水化,用苏木精染色剂染色,1% 盐酸-甲醇分化,流水清洗,用伊红染液染色,梯度乙醇和二甲苯脱水后,中性胶封片,于显微镜下观察,收集图像并进行分析。其中睾丸组织切片于显微镜下观察生精细胞的数量和排列情况,并采用Johnsen 评分定量判定精子发生,最高10 分,精子发生正常; 得分越低,生精细胞分化越差,生精细胞的破坏也越严重,评分标准见表1。每只小鼠取50 根圆形切片的输精管进行评分,取平均值进行统计分析。

表1 Johnsen 评分标准Tab.1 Johnsen scoring criteria
2.7 RT-qPCR 法检测睾丸组织mTOR、LC3B、ULK1 mRNA 表达 取于-80 ℃保存的睾丸组织,采用TRIzol 试剂盒提取总RNA,按照反转录试剂盒说明书逆转录为cDNA,通过荧光定量PCR 仪进行检测,2-ΔΔCT法计算mTOR、LC3B、ULK1 mRNA相对表达。引物由生工生物工程(上海) 股份有限公司设计与合成,序列见表2。

表2 引物序列Tab.2 Primer sequences
2.8 Western blot 法检测睾丸组织mTOR、pmTOR、LC3B、ULK1 蛋白表达 称取0.05 g 睾丸组织,用冰预冷PBS 洗涤,加入200 μL 裂解液,研磨匀浆,裂解10 min,4 ℃、12 000 r/min 离心15 min,移取120 μL 蛋白上清,加入5×loading buffer,混匀后变性。蛋白样本经电泳、转模后封闭,加一抗mTOR (1 ∶500)、p-mTOR (1 ∶500)、LC3B (1 ∶500)、ULK1 (1 ∶500)、β-actin (1 ∶5 000) 4 ℃孵育过夜,次日加二抗(1 ∶5 000)孵育90 min,ECL 法显色、曝光,扫描底片,采用Image J 软件对条带灰度值进行分析,以β-actin 为内参,计算目的蛋白相对表达。
2.9 统计学分析 通过SPSS 23.0 软件进行处理,数据以(±s) 表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD 法。P<0.05 表示差异具有统计学意义。
3 结果
3.1 毛蕊花糖苷对不育症大鼠一般情况的影响模型组大鼠食量减少,尿量增加,精神萎靡,反映迟缓,嗜睡,毛质粗糙化,色稍黄,存在弓背、竖发现象,尿量增加,垫料极度潮湿,表现不育症阳虚症状; 与模型组比较,给药组大鼠食量增加,尿量恢复正常,活跃能力增强,精神好,弓背、竖发现象及垫料潮湿程度改善。
3.2 毛蕊花糖苷对不育症大鼠脏器指数的影响与空白组比较,模型组大鼠肾脏指数升高 (P<0.05),肝脏、睾丸及附睾脏器指数无明显变化(P>0.05); 与模型组比较,阳性对照组和毛蕊花糖苷各剂量组肾脏指数降低(P<0.05),肝脏、睾丸及附睾脏器指数均无明显变化(P>0.05),见图1。

图1 毛蕊花糖苷对不育症大鼠脏器指数的影响(±s,n=8)Fig.1 Effects of verbascoside on organ indices levels in infertile rats (±s,n=8)
3.3 毛蕊花糖苷对不育症大鼠精子情况的影响与空白组比较,模型组大鼠精子计数、精子活动率及精子指数均降低(P<0.05),说明造模成功; 与模型组比较,阳性对照组和毛蕊花糖苷高剂量组精子计数、精子活动率增加(P<0.05),精子指数无明显变化(P>0.05),毛蕊花糖苷低剂量组精子计数、精子活动率及精子指数均无明显变化 (P>0.05),见图2。

图2 毛蕊花糖苷对不育症大鼠精子情况的影响(±s,n=8)Fig.2 Effects of verbascoside on sperm conditions in infertile rats (±s,n=8)
3.4 毛蕊花糖苷对不育症大鼠血清性激素水平的影响 与空白组比较,模型组大鼠血清T、GnRH水平降低(P<0.05),LH、FSH 水平升高 (P<0.05),表明模型大鼠体内性激素水平严重失调;与模型组比较,阳性对照组和毛蕊花糖苷各剂量组大鼠血清T 水平升高(P<0.05),FSH 水平降低(P<0.05),GnRH 水平无明显变化(P>0.05),毛蕊花糖苷高剂量组大鼠血清LH 水平降低(P<0.05),阳性对照组和毛蕊花糖苷低剂量组大鼠血清LH 水平无明显变化(P>0.05),见图3。
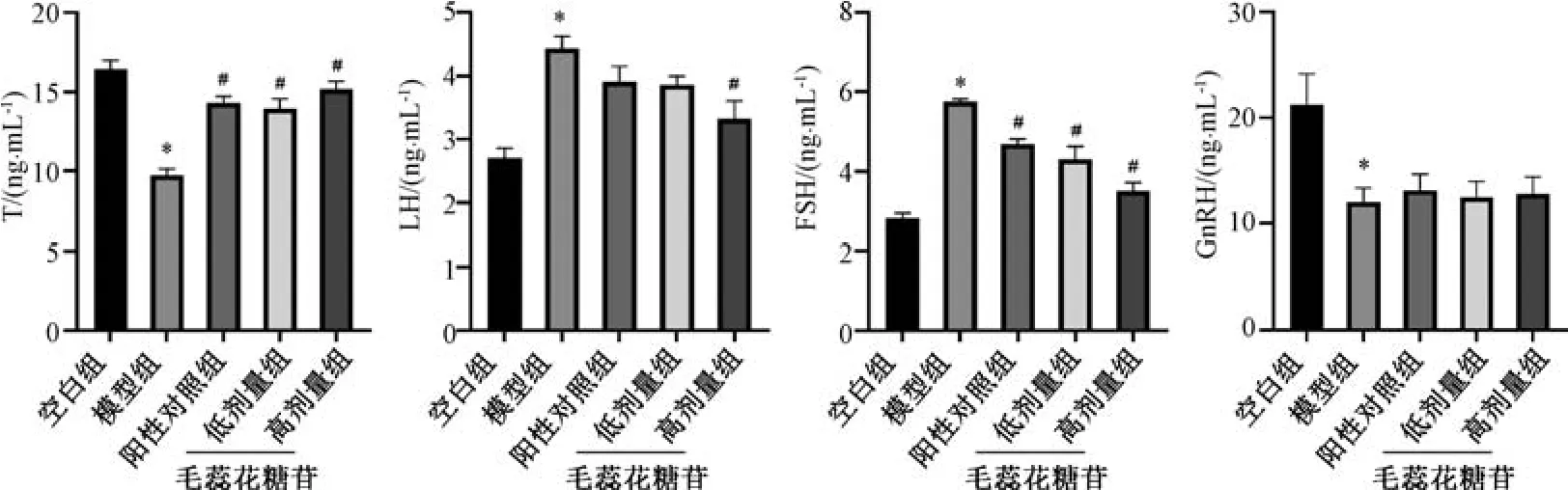
图3 毛蕊花糖苷对不育症大鼠血清性激素水平的影响(±s,n=8)Fig.3 Effects of verbascoside on serum sex hormone levels in infertile rats (±s,n=8)
3.5 毛蕊花糖苷对不育症大鼠各脏器组织病理学的影响
3.5.1 肝脏 空白组大鼠肝脏组织结构完整,而肝细胞索以中部静脉为主要中枢,成辐射状地完全排出,未发现变性或坏死的细胞,且细胞器构造紧密; 与空白组比较,其余各组大鼠肝组织未表现出较为突出的异常,见图4。
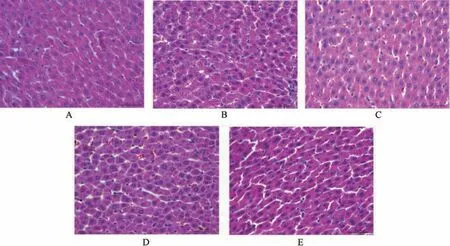
图4 毛蕊花糖苷对不育症大鼠肝脏组织形态的影响(HE 染色,×200)Fig.4 Effects of verbascoside on the liver morphology in infertile rats (HE staining,×200)
3.5.2 肾脏 空白组蚕状肾切片大小相同,未见明显病理改变,肾小管未见异物,管腔规则; 模型组蚕状部分面积增大,肾小管内可见大量棕黄色结晶,肾小管上皮细胞变性、坏死、崩解,表现为病变萎缩,散在囊状扩张成空泡,炎症细胞浸润,显示腺嘌呤可诱发肾实质损害; 阳性对照组蚕状横截面积增大; 毛蕊花糖苷各剂量组肾小球体积变小,管状针状棕色晶体沉积减少,上皮细胞萎缩、间质纤维化、囊性扩张及炎细胞浸润程度均存在不同程度减轻,见图5。

图5 毛蕊花糖苷对不育症大鼠肾脏组织形态的影响(HE 染色,×200)Fig.5 Effects of verbascoside on the kidney morphology in infertile rats (HE staining,×200)
3.5.3 睾丸 空白组生精管基底膜完好无缺,视野中层次清晰,生精细胞层丰富,支持细胞排列紧密,管腔内可见大量生精细胞,间质细胞分布均匀; 模型组生精小管基底膜破坏严重,细胞层次不清,排列凌乱,可见大部分细胞脱落,细胞碎片散在管腔,管腔内生精细胞欠缺,间质细胞数量极少; 阳性对照组和毛蕊花糖苷高剂量组生精管基底膜较为完整,生精细胞层相比模型组稍多,管腔生精细胞较多,间质细胞散在排列,见图6。Johnson评分见图7,由此可知,与空白组比较,模型组Johnson 评分降低(P<0.05); 与模型组比较,阳性对照组和毛蕊花糖苷各剂量组Johnson 评分均升高(P<0.05)。

图6 毛蕊花糖苷对不育症大鼠睾丸组织形态的影响(HE 染色,×200)Fig.6 Effects of verbascoside on the testicular morphology in infertile rats (HE staining,×200)

图7 毛蕊花糖苷对不育症大鼠睾丸Johnsen 评分的影响(±s,n=8)Fig.7 Effects of of verbascoside on Johnsen score for testicular biopsy in infertile rats (±s,n=8)
3.6 毛蕊花糖苷对不育症大鼠睾丸组织mTOR、LC3B、ULK1 mRNA 表达的影响 与空白组比较,模型组大鼠睾丸组织mTORmRNA 表达升高(P<0.05),LC3B、ULK1 mRNA 表达降低(P<0.05);与模型组相比较,阳性对照组和毛蕊花糖苷高剂量组大鼠睾丸组织mTORmRNA 表达降低 (P<0.05),LC3B、ULK1 mRNA 表达升高(P<0.05),毛蕊花糖苷低剂量组大鼠睾丸组织mTOR、LC3B、ULK1 mRNA 表达无明显变化(P>0.05),见图8。

图8 毛蕊花糖苷对不育症大鼠睾丸组织mTOR、LC3B、ULK1 mRNA 表达的影响(±s,n=8)Fig.8 Effects of verbascoside on the testicular mRNA expressions of mTOR,LC3B and ULK1 in infertile rats (±s,n=8)
3.7 毛蕊花糖苷对不育症大鼠睾丸组织mTOR、p-mTOR、LC3B、ULK1 蛋白表达的影响 与空白组比较,模型组大鼠睾丸组织mTOR 蛋白表达升高(P<0.05),p-mTOR、LC3B、ULK1 蛋白表达降低(P<0.05); 与模型组比较,阳性对照组和毛蕊花糖苷高剂量组大鼠睾丸组织mTOR 蛋白表达降低(P<0.05),p-mTOR、LC3B、ULK1 蛋白表达升高(P<0.05),毛蕊花糖苷低剂量组大鼠睾丸组织mTOR、p-mTOR、LC3B、ULK1 蛋白表达无明显变化(P>0.05),见图9。
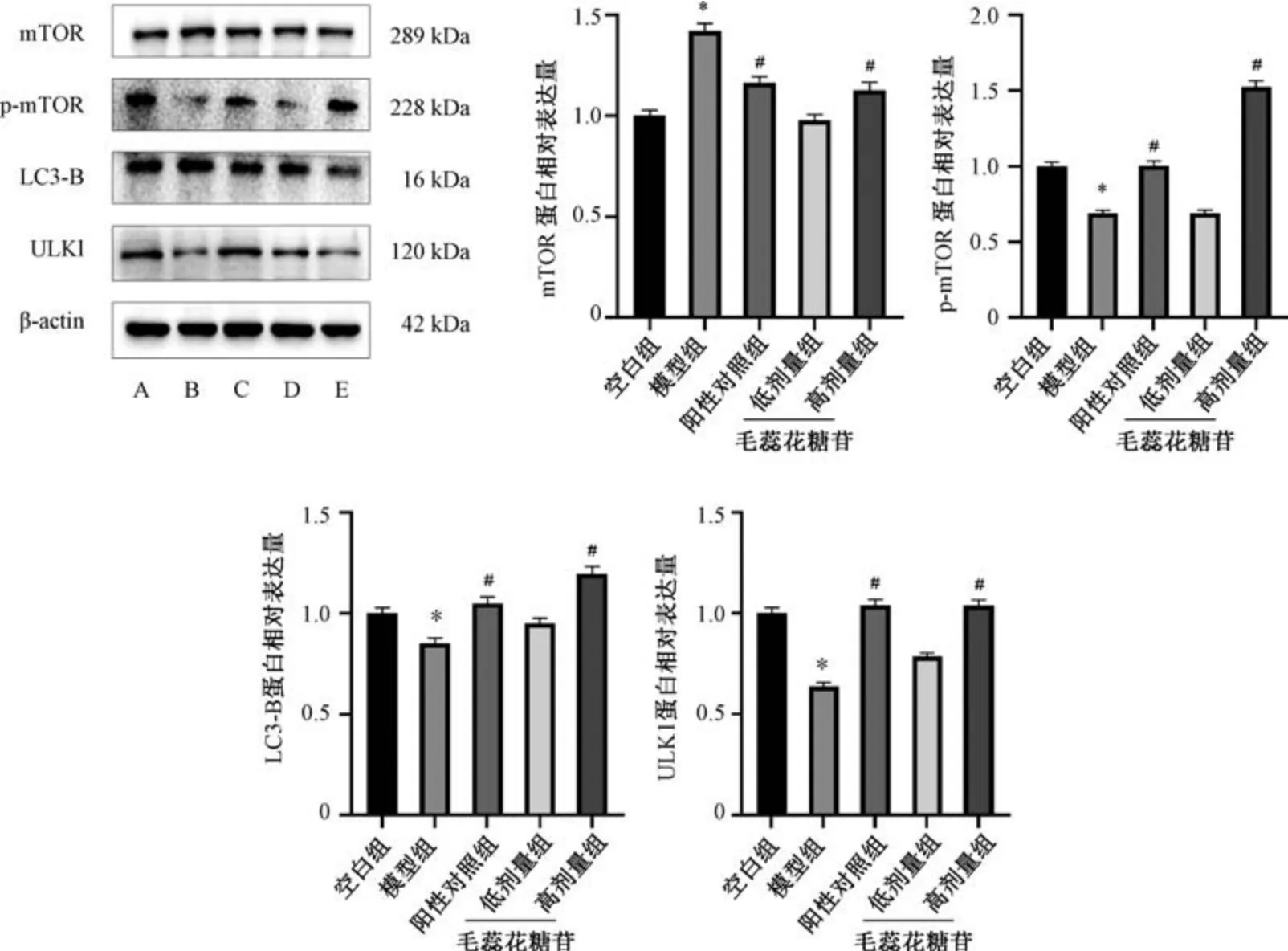
图9 毛蕊花糖苷对不育症大鼠睾丸组织mTOR、p-mTOR、LC3B、ULK1 蛋白表达的影响(±s,n=8)Fig.9 Effects of verbascoside on the testicular protein expressions of mTOR,p-mTOR,LC3B and ULK1 in infertile rats(±s,n=8)
4 讨论
不育症是一种男科常见疾病,因其病因复杂,目前尚无明确的治疗药物[3]。肉苁蓉为补肾之要药,在不育症的治疗方面优势显著,而毛蕊花糖苷作为肉苁蓉的主要功效成分,药理作用不明确。腺嘌呤诱导的动物模型不仅出现血清激素水平的异常,并出现睾丸的损害精子数量、活动率下降,这些特征与不育症临床表征相一致[10-11]。因此,本研究选用腺嘌呤诱导构建不育症模型,通过药效学方法评价毛蕊花糖苷对不育症生殖功能的改善作用。
腺嘌呤经体内代谢,产生大量的氧自由基(reactive oxygen species,ROS),致使睾丸内环境紊乱进而对性激素等生物大分子产生毒性反应[12]。下丘脑-垂体-睾丸轴 (hypothalamic-pituitary-testicular axis,HPTA) 作为男性生殖内分泌系统的关键环节,其中GnRH 促进LH、FSH 分泌,LH 可促进间质细胞(leydig cells,LCs) 合成T,FSH 和T 共同促进精子生成,T 通过负反馈作用调节FSH 和LH的合成和释放,维持激素之间的相对平衡[13]。本研究显示,模型组大鼠T、GnRH 呈现低水平,同时LH、FSH 呈现一定程度的上升趋势; 与模型组比较,毛蕊花糖苷可通过提高T 水平,继而对HPTA 的激素发挥正向调节作用。
不育症的发生发展与氧化应激密切相关,ROS引起的损伤可通过自噬途径活化,形成自噬小体,从而导致细胞微环境异常[14]。自噬是细胞拮抗应激反应、依赖溶酶体的细胞分解代谢过程,是有机生物体对不同环境自我调节的内部机制[15]。作为合成、分泌睾酮的睾丸LCs,其基础自噬水平较高,能够通过自噬作用维持雄性生殖功能[16-18]。ROS 诱导LCs 自噬减弱,自噬影响睾酮合成,因此对自噬发生机制的深入研究,可能是探讨调控睾酮合成非经典通路新的重要线索。mTOR 是当今公认的与不育症相关的LCs 自噬关键靶标[19]。当机体或细胞能量物质充裕时,激活的mTOR 磷酸化ULK1,抑制ULK1 激酶活性,从而抑制自噬; 当能量物质缺乏时,mTOR 被磷酸化,ULK1 解除抑制,促使自噬发生[20]。实验研究证明,mTOR 被抑制后可改变睾丸的结构形态并促进其细胞自噬的发生[21]。因此,选择自噬通路中 mTOR、pmTOR、LC3B、ULK1 作为本研究的关键靶点。本实验结果显示,给予毛蕊花糖苷后,睾丸pmTOR、LC3B、ULK1 蛋白表达升高,mTOR 蛋白表达降低,表明毛蕊花糖苷通过影响mTOR 磷酸化水平,促进ULK1 表达,使自噬增强,进而提高睾酮合成。
本实验以腺嘌呤诱导的不育症大鼠为研究对象,对毛蕊花糖苷的干预作用进行考察,并初步探讨毛蕊花糖苷改善生殖功能的潜在作用靶点。发现毛蕊花糖苷能够有效地提高不育症模型大鼠体内的精子质量,改善不育症模型大鼠身体的一般机能状态,对肾脏、睾丸组织结构的病理性损伤有显著的修复作用,可调节性腺轴激素水平,发挥改善生殖功能的功效,其作用机制可能与增强正性调控自噬,调节HPTA 紊乱,改善生殖功能有关。

