靶向Trop-2抗体药物偶联物在乳腺癌治疗中的研究进展
卢蓉蓉,瞿菲,刘谦,李薇
(南京医科大学第一附属医院/江苏省人民医院肿瘤科,江苏 南京 210029)
根据世界卫生组织国际癌症研究机构发布的2020年全球癌症数据,乳腺癌首次超越肺癌成为全球女性最常见的新发恶性肿瘤,占全球新发癌症病例的11.7%[1]。乳腺癌的治疗先后历经了3次革命,引领了临床治疗进入化疗时代、靶向时代和免疫治疗时代[2-6]。随着治疗手段的不断发展,乳腺癌患者的生存期明显延长,预后显著改善,但仍有诸多未被满足的诊疗需求。例如,转移性三阴性乳腺癌(metastatic triple-negative breast cancer,mTNBC)和激素受体(hormone receptor,HR)阳性/人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性转移性乳腺癌(metastatic breast cancer,MBC)一旦进入晚期经二线治疗后,疗效和预后均较差,这与连续化疗的耐药性和毒副作用的积累部分相关。靶向滋养层细胞表面抗原2(trophoblast cell surface antigen 2,Trop-2)抗体药物偶联物(antibody-drug conjugate,ADC)结合了高特异性靶向能力和强效杀伤作用的优点,实现了对肿瘤细胞的精确高效清除,改善了化疗的耐药和毒性限制[7-8]。本文对靶向Trop-2 ADC药物的结构和功能、近期发布的相关大型III期临床研究进展进行综述,以期为多线治疗失败的乳腺癌患者提供参考与选择。

续表2
1 Trop-2的结构与功能
目前,研究较多的乳腺癌靶点Trop-2又称肿瘤相关钙信号转导器2(tumor-associated calcium signal transducer 2,TACSTD2)或膜成分染色体1表面标志物1(M1S1)。Trop-2蛋白由染色体1P32区域的TACSTD2基因编码,是一种位于细胞表面的单次跨膜糖蛋白,属于上皮细胞黏附分子家族成员。Trop-2在正常组织低表达,在宫颈癌、尿路上皮癌、甲状腺乳头状癌、乳腺癌、肺鳞癌、子宫内膜癌等多种上皮性癌组织中过表达[9]。
Trop-2蛋白包含323个氨基酸,由疏水前导肽(AA1 ~ 26)、胞外结构域(AA27 ~ 274)、跨膜结构域(AA275 ~ 297)和胞质尾部(AA298 ~ 323)组成。Trop-2胞外结构域具有富含半胱氨酸结构域(cysteine-rich domain,CRD)、甲状腺球蛋白1型结构域(thyroglobulin type-1 domain,TY)和半胱氨酸缺乏结构域(cysteine poor domain,CPD),使得胞外结构域形成稳定的二硫键。通过单向跨膜结构域(transmembrane domain,TM)连接胞外域及胞内域多肽尾区,将其固定在细胞膜上。Trop-2胞质尾区具有高度保守的磷脂酰肌醇-4,5-二磷酸结合序列,在Trop-2信号转导中起调节作用[10]。胞质尾区第303位存在保守的丝氨酸残基,被蛋白激酶C(protein kinase C,PKC)磷酸化的过程是参与钙信号调节的环节[11]。
Trop-2作为一种具有细胞外和细胞内成分的跨膜糖蛋白,参与细胞内钙信号转导,增强细胞周期蛋白D/E的蛋白质水平,影响丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇-3-羟激酶/蛋白激酶B(PI3K/AKT)等多种信号转导通路促进细胞的增殖、迁移和侵袭[12-13]。Zhao等[14]研究发现,Trop-2表达与淋巴结状态、转移、TNM分期相关,Trop-2高表达预示着较低的总生存期(overall survival,OS)。Ambrogi等[15]研究显示,Trop-2膜定位和功能状态对肿瘤进展产生影响,膜定位Trop-2和预后不佳相关,而细胞内Trop-2对预后具有有利影响,值得进一步研究探讨。
2 抗体药物偶联物的结构与作用机制
ADC药物由单克隆抗体通过连接子与细胞毒性药物共价连接而成。理想的单克隆抗体需要具备免疫原性低,稳定性好,抗肿瘤活性强等特征。在多种单抗中,人源化单克隆抗体(不良反应发生率为0.1% ~ 8%)较鼠源单抗(不良反应发生率为50% ~80%)、人鼠嵌合单抗(不良反应发生率1% ~57%)免疫原性低,副作用少,具有明显的优势[16-17]。ADC药物中载药通常具备远超化疗药物的抗肿瘤活性,能有效穿透肿瘤组织,高效精准杀伤肿瘤细胞。连接子需要具备亲水性、在血液循环中的稳定性,不会过早裂解而产生脱靶效应,且在被目标细胞内吞后,快速裂解,高效释放毒物[18-19]。可裂解连接子在酸性环境(肿瘤微环境)或经溶酶体蛋白酶裂解,裂解后的载药不包含连接子,透膜性高,可实现旁观者效应。不可裂解的连接子通常为硫醚,完全依赖溶酶体蛋白酶降解来释放内化后的有效载荷,产生抗肿瘤活性,断裂后的载药含有残留的连接子,透膜性低,无旁观者效应[20]。
ADC药物进入循环系统后,首先与肿瘤细胞表面受体抗原结合,然后ADC-抗原复合物通过网格蛋白或小窝介导的内吞作用或胞饮作用内化进入胞内[21],连接子在溶酶体裂解,抗体通过降解释放细胞毒性药物,从而抑制微管或损伤DNA,导致肿瘤细胞凋亡[7]。
3 靶向Trop-2抗体药物偶联物在乳腺癌中的应用
3.1 戈沙妥珠单抗
戈沙妥珠单抗(sacituzumab govitecan,SG)是全球首个获批的靶向Trop-2的ADC药物,采用人源化IgG1单克隆抗体沙西妥珠单抗(hRS7)。hRS7通过可水解的CL2A连接子,与伊立替康(拓扑异构酶I抑制剂)的活性代谢产物SN-38偶联,药物/抗体比(drug-to-antibody ratio,DAR)高达7.6。pH敏感性的CL2A连接子不依赖于特异性酶促裂解,可在靶细胞溶酶体或肿瘤酸性微环境下裂解,产生旁观者效应。即使在Trop-2表达具有异质性的复杂肿瘤中,旁观者效应使得SG的抗肿瘤作用最大化[22]。SG可通过2种方式实现旁观者效应:第1种是再透膜方式,SG在肿瘤细胞内裂解,SN-38在破坏肿瘤细胞后,再次透膜杀伤临近肿瘤细胞;第2种是微环境方式,SG与Trop-2受体结合后,在肿瘤微环境内裂解,释放SN-38透膜杀伤临近肿瘤细胞[23]。
Ⅰ/Ⅱ期篮式试验IMMU-132-01研究初步验证了SG在多线治疗失败的mTNBC患者中的疗效与安全性[24]。关键性Ⅲ期ASCENT临床试验(NCT02574455)纳入既往接受过至少一线前序治疗的mTNBC患者,研究确认了10 mg · kg-1剂量SG对比医生选择的化疗(treatment of physician's choice,TPC)显著改善mTNBC患者的主要终点无进展生存期PFS(5.6个月vs1.7个月;风险比HR:0.39;P<0.000 1)、OS(12.1个月vs6.7个月;HR:0.48;P<0.000 1),疾病进展风险降低61%,死亡风险降低52%。在亚组分析中,SG治疗的各亚组均有一致的PFS及OS获益。在有胚系BRCA1/2突变亚组及HER2阴性和低表达亚组中,SG的客观缓解率(objective response rate,ORR)、PFS及OS均优于TPC[25-26]。ASCENT试验的安全性分析显示,常见3级及以上治疗相关不良事件(treatment-related adverse event,TRAE)为中性粒细胞减少和腹泻,未发现治疗相关的间质性肺病。其中,3级和4级中性粒细胞减少症发生率分别为34%和17%,3级和4级腹泻发生率分别为10%和0[27]。基于上述研究结果,2021年4月,美国食品和药品管理局(Food and Drug Administration,FDA)批准SG治疗二线及以上晚期TNBC适应证。2022年6月,中国国家药品监督管理局(National Medical Products Administration,NMPA)批准SG治疗二线及以上mTNBC适应证。
Ⅲ期TROPiCS-02研究(NCT03901339)进一步探索SG在既往接受过细胞周期蛋白依赖性激酶4/6(cyclin dependent kinase 4/6,CDK4/6)抑制剂、紫杉烷类药物、内分泌治疗及二 ~ 四线化疗方案的HR阳性/HER2阴性MBC患者中的疗效和安全性。该研究结果显示,SG对比TPC中位OS延长3.2个月(14.5个月vs11.2个月,HR:0.79,95%CI:0.65 ~0.95,P= 0.013 3),SG组客观缓解率(objective response rate,ORR)达21%[28]。值得注意的是,ASCENT、TROPiCS-02等研究表明,无论Trop-2表达水平如何,SG均可改善mTNBC、HR阳性/HER2阴性MBC患者的预后,为更多乳腺癌患者提供了治疗新选择[25,28]。
目前,乳腺癌领域有多项SG相关临床试验正在进行中,包括SG用于早期TNBC的新辅助治疗的NeoSTAR研究(NCT04230109)、HER2阴性早期乳腺癌辅助治疗的SASCIA研究(NCT04595565)、程序性死亡配体1(programmed death ligand-1,PD-L1)阴性mTNBC一线治疗的ASCENT03研究(NCT05382299)。除SG单药临床研究进展外,SG联合治疗策略也在积极探索中,例如SG联合帕博利珠单抗用于PD-L1阳性mTNBC一线治疗的ASCENT-04研究(NCT05382286)等。
3.2 datopotamab deruxtecan
Datopotamab deruxtecan(Dato-DXd,DS-1062)通过人源化单抗hTINA1靶向Trop-2,有效载荷强效拓扑异构酶Ⅰ抑制剂DXd(毒性是SN38的近10倍,具有膜渗透性,可发挥旁观者效应),两者由溶酶体蛋白酶切割的GGFG四肽连接子偶联而成,DAR为4[29]。一项全球、开放标签、随机、Ⅲ期TROPION-Breast01研究(NCT05104866)纳入既往接受过至少1种系统化疗,并接受内分泌治疗后疾病进展或不适合内分泌治疗的HR阳性/HER2阴性乳腺癌患者。该研究结果显示,Dato-DXd与研究者选择的化疗(investigator's choice of therapy,ICC)相比,中位PFS[6.9个月vs4.9个月,HR:0.63(95%CI:0.52 ~ 0.76),P<0.000 1]显著延长;在安全性方面,Dato-DXd组大多为1 ~ 2级TRAE且易管理,3级及以上TRAE发生率(21%)不到ICC组(45%)的一半,同时Dato-DXd与ICC相比,导致剂量减少(21%vs30%)或中断(12%vs25%)的TRAE均较少[30]。该项研究中,Dato-DXd组PFS显示出统计学和临床意义的显著改善,安全性良好且可管理,有望为HR阳性/HER2阴性乳腺癌治疗再添新证。Dato-DXd在乳腺癌领域的其他研究包括:TROPION-PanTumor01(NCT03401385)、TROPION-Breast02(NCT05374512)、TROPIONBreast03(NCT05629585)和BEGONIA(NCT03742102)等。TROPION-PanTumor01是一项Ⅰ期、多中心、开放标签临床研究,旨在评估Dato-DXd治疗复发/难治转移性实体瘤患者的疗效。该试验入组了44例mTNBC患者,ORR达32%,其中未接受过拓扑异构酶Ⅰ抑制剂的27例患者的ORR达44%,未经Trop-2 ADC治疗患者疗效更好,提示含有相同作用机制载药的ADC序贯使用可能存在交叉耐药[31]。Ⅲ期TROPION-Breast02研究主要评估Dato-DXd对比ICC在不适合程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1)及其配体1治疗的局部复发不能手术或转移的TNBC患者中疗效。Ⅲ期试验TROPION-Breast03评估Dato-DXd单药治疗和联合度伐利尤单抗(durvalumab,durva)用于新辅助化疗[包括蒽环类药物和(或)紫杉烷±卡铂±帕博利珠单抗6周期以上]后未能达到病理完全缓解(non-pathological complete response,non-pCR)的无局部/远处复发的TNBC辅助强化治疗疗效。Ⅰb/Ⅱ期BEGONIA是一项评估durva联合其他新型疗法用于mTNBC一线治疗的研究。在2023年欧洲肿瘤内科学会(ESMO)年会中更新的治疗队列7的初步结果显示,Dato-DXd联合durva在mTNBC患者一线治疗中的ORR为79%(95%CI:66.8% ~88.3%),证实Dato-DXd联合抗PD-L1治疗有望重塑mTNBC一线治疗格局,为更多乳腺癌患者提供更多的治疗选择。
3.3 SKB264
SKB264(MK-2870)和SG同样采用人源化抗Trop-2单克隆抗体hRS7、pH依赖的可水解的CL2A型连接子,载药选用拓扑异构酶Ⅰ抑制剂贝洛替康的衍生物KL610023(T-030),半抑制浓度(half maximal inhibitory concentration,IC50)低于SN38,DAR为7.4。SG连接子的抗体端采用马来酰亚胺连接头,存在不稳定性。SKB264连接子的抗体端采用甲磺酰基嘧啶连接头,与抗体不可逆偶联,减少毒素脱落,提高ADC在循环系统中的稳定性[32]。2023年ESMO年会公布的一项Ⅰ/Ⅱ期、单臂、篮子试验KL264-01(NCT04152499),共纳入41名经过多线治疗的HR阳性/HER2阴性MBC患者,中位随访时间为8.2个月。该试验结果显示,在Ⅱ期剂量扩展阶段,SKB264在经过多线治疗的HR阳性/HER2阴性MBC中展现出良好的抗肿瘤活性及可控的安全性,ORR为36.8%,中位缓解持续时间(during of response,DoR)为7.4个月,中位PFS为11.1个月(95%CI:5.4% ~ 13.1%);所有亚组均有获益,包括HER2未表达和低表达、既往使用或未使用过CDK4/6抑制剂、原发或继发内分泌治疗耐药患者;主要不良反应以血液学毒性为主,最常见的3级及以上TRAE为中性粒细胞计数降低(36.6%)、白细胞计数降低(22%)、贫血(14.6%)和血小板计数降低(9.8%),未报告神经病变和药物相关间质性肺病/肺炎,无导致停药或死亡的TRAE发生。多线常规治疗方案进展的HR阳性/HER2阴性MBC患者治疗方案有限、预后较差(中位PFS为4 ~ 5个月),SKB264也因此被国家药品审评中心授予突破性疗法认证,期待Ⅲ期临床研究更加夯实本研究结果。
3.4 其他在研靶向Trop-2抗体药物偶联物
Trop-2作为目前最受关注的ADC靶点之一,其更多靶向药物正在研发中[33]。目前已有临床数据的TROP-2 ADC包括SG、Dato-Dxd、SKB264、ESG-401(由hRS7、酶降解的VC 连接子、SN38偶联而成)、SHR-A1921(抗体为改造的hRS7,通过GGFG四肽可裂解连接子与载药拓扑异构酶Ⅰ抑制剂shr9265连接)等药物。ADC药物涉及的技术表现出高度的多样性、复杂性和演变性,差异化的设计可产生不同的临床效果。期待未来更多的临床试验能得到阳性的循证医学证据,惠及更多肿瘤患者。
4 结语与展望
Trop-2蛋白在肿瘤的增殖、凋亡、侵袭、转移等过程中发挥重要作用,凭借结构优势、出色的临床疗效,SG成为全球首个且唯一获批用于TNBC的Trop-2 ADC药物。Dato-DXd及SKB264在TNBC、HR阳性/HER2阴性MBC治疗中潜力也已得到初步证实,能够改善患者的生存预后。然而Trop-2 ADC在临床应用中仍存在诸多挑战:1)目前Trop-2 ADC临床用药及研究设计主要依据其分型,无需生物标志物检测,考虑真实世界病人复杂多样,亟需理想的生物标志物以筛选Trop-2 ADC应用的优势人群。2)随着ADC耐药性的逐渐显露,Trop-2 ADC的联合治疗策略(包括与内分泌治疗、酪氨酸激酶抑制剂、免疫治疗、抗血管生成等药物联合)需要更多临床试验的探索。有研究表明低剂量SN-38通过促进NK/CD8+T细胞浸润并分泌干扰素-γ和颗粒酶B增强抗肿瘤免疫反应,提高肿瘤对免疫治疗的敏感性[34]。3)尽管ADC药物研发初衷是利用单克隆抗体的高特异性靶向能力将载药定向运输至肿瘤细胞,但受连接子性质、连接子与抗体偶联方式以及细胞毒性药物类型等因素的影响,就目前而言,ADC药物脱靶毒性不可避免,需更加合理的药物结构设计以提高Trop-2 ADC在乳腺癌患者治疗中的疗效和安全性。
靶向Trop-2的ADC药物,诸如SG、Dato-DXd、SKB264的研发管线从后线到前线并逐步推进到辅助与新辅助治疗,涵盖了疾病早期至晚期的全过程,均在积极开展相关临床试验(3种靶向Trop-2 ADC药物在乳腺癌中的布局见表1和表2),未来更多的技术创新和理念有待在临床实践中不断验证。
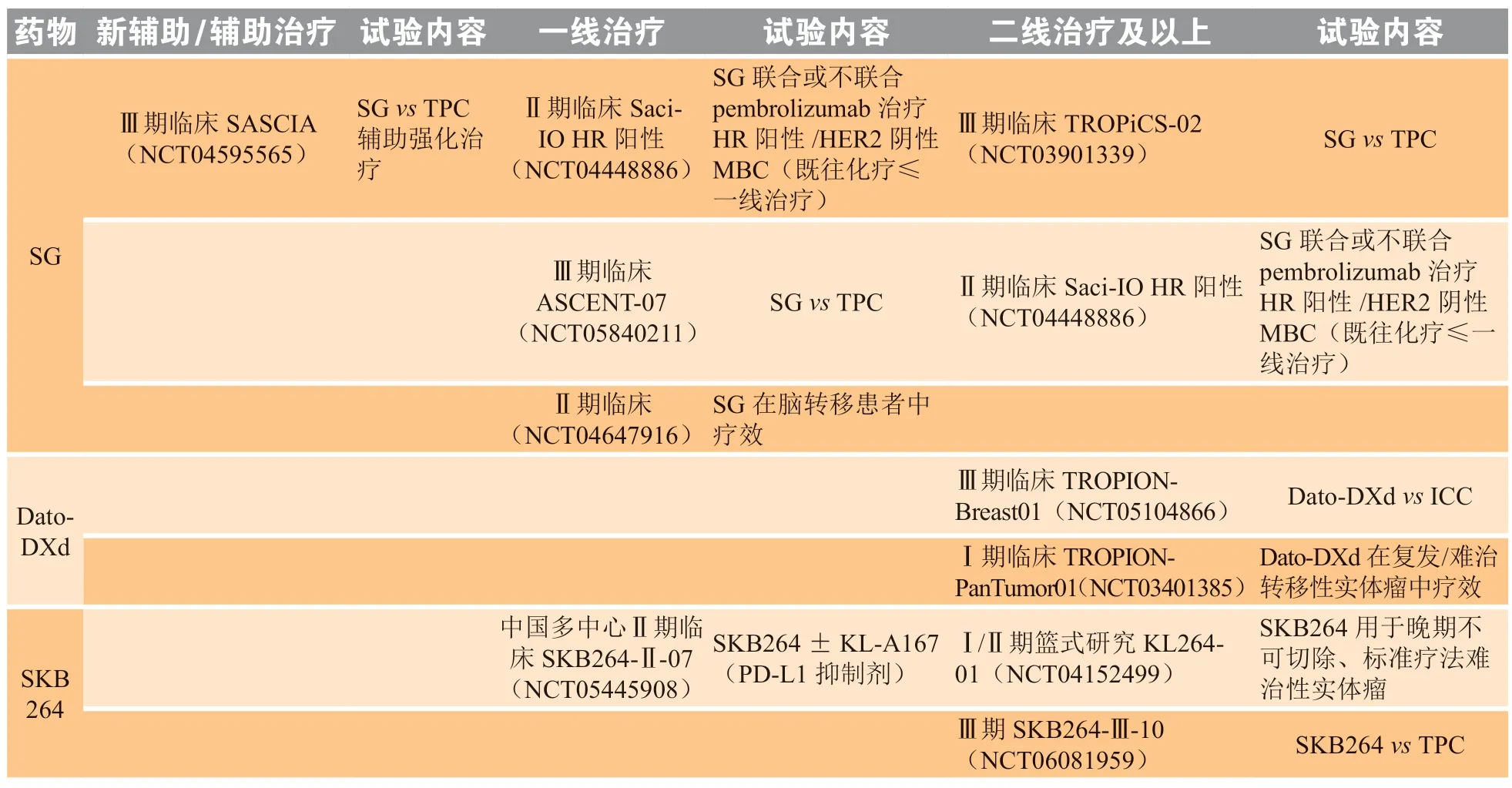
表1 3种靶向Trop-2抗体药物偶联物在HR阳性/HER2阴性乳腺癌患者中的研究布局Table 1 Research layout of three antibody-drug conjugates targeting Trop-2 antibody in HR+/HER2- breast cancer patients

表2 3种靶向Trop-2抗体药物偶联物在三阴性乳腺癌患者中的研究布局Table 2 Research layout of three antibody-drug conjugates targeting Trop-2 antibody in triple negative breast cancer patients

