灭菌方式对人参连作土壤养分及真菌群落结构的影响
战宇 苗馨月 王二刚 周一 闫宁 陈长宝 李琼
摘要: 强还原土壤灭菌和氯化苦土壤熏蒸是2种常用的农业措施,为了探寻2种灭菌方式对人参连作土壤养分及真菌群落结构的影响,采用化学分析和高通量测序技术研究氯化苦土壤熏蒸技术加复合微生物菌肥(SFC_CB)、强还原土壤灭菌技术加复合微生物菌肥(RSD_CB)和氯化苦土壤熏蒸技术加强还原土壤灭菌技术(SFC_RSD)对人参连作土壤养分及真菌群落结构的影响。结果表明,SFC_CB处理组显著提高了土壤有机质(SOM)和全鉀(TK)含量,RSD_CB 处理组显著提高了土壤电导率(EC值)和速效钾(AK)、水解氮(AN)含量,SFC_RSD处理组显著提高了土壤pH值和有效磷(AP)含量;与RSD_CB处理组相比,SFC_CB、SFC_RSD处理组显著降低了土壤真菌群落丰富度、多样性和均匀度,提高了覆盖度;从不同处理土壤样本中共检测到5个真菌门、9个真菌纲、15个真菌目、19个真菌科和24个真菌属,其中共有OTU被划分为20个真菌属,有17个真菌属的相对丰度发生显著变化,特有OTU被划分为47个真菌属,SFC_CB、RSD_CB、SFC_RSD处理组分别包含15、29、18个属。此外,土壤真菌群落多样性与土壤养分密切相关,其中EC值、pH值、SOM含量、AK含量和AP含量是主要驱动因素。从不同处理土壤中共鉴定出12个真菌功能群,且各真菌功能群在不同处理中的相对丰度不同。综上,2种灭菌方式均可显著改善土壤结构,提高真菌多样性,重组核心微生物群,因此强还原土壤灭菌技术有望替代传统的化学熏蒸技术。
关键词: 人参;连作障碍;强还原土壤灭菌;土壤养分;真菌群落
中图分类号:S567.5+10.6 文献标志码:A
文章编号:1002-1302(2024)02-0235-10
人参(Panax ginseng C. A. Mey.)为五加科人参属多年生宿根草本植物[1],具有丰富的营养价值和药用功效,是我国中医药和大健康产业独具特色的重要资源[2-3]。但是,人参忌地性极强,栽过人参的土壤(俗称老参地)在30年内不能重复种植,否则会出现“烧须”“红皮”“烂根”等问题,严重时甚至会导致植株死亡[4]。因此,重复利用有限参地资源、缩短参业土地资源再生周期显得越来越迫切。
土壤化学熏蒸是目前生产上应用最广泛的抑制土传病原菌的方法,氯化苦是常用的土壤熏蒸剂之一,能杀死土壤中85%以上的细菌、真菌和放线菌,但是其土传病原菌的数量在再植作物根系分泌物的诱导下会迅速回升[5-6]。同时,随着国家对农业可持续发展和人类健康关注度的日益提高,传统的化学熏蒸剂已逐步被淘汰。强还原土壤灭菌法(reductive soil disinfestation,RSD)由日本[7]和荷兰[8]科学家自主研发,通过在土壤-作物-微生物关系中创造有利于作物生长、不利于病原微生物生长的土壤环境,达到降低土传疾病发生率、提高作物产量的目的[9-10]。具有操作简单、改善土壤结构、修复土壤酸化和盐渍化、重建土壤微生物区系等多重效应[11-12]。
土壤微生物被广泛认为是维持土壤功能稳定性、完整性的主要驱动力,维持着土壤有机质分解、腐殖质形成及植物与环境间的物质循环和能量交换等多个生态过程,对土壤肥力、土壤环境起到指示作用[13-14]。土壤真菌是土壤微生物的重要组成部分,在土壤养分循环、结构形成、肥力提高、微生态平衡等方面具有积极作用。研究发现,连作障碍会导致真菌多样性、丰富度降低,使病原真菌数量增加[15]。同时,人参根部病害主要由病原真菌引起,如尖孢镰刀菌会引起人参根腐病,立枯丝核菌会引起人参立枯病,核盘菌会引起人参菌核病[16-17],是因为人参根区特殊的土壤环境为微生物提供了可以生存的寄主和繁殖场所,随着人参生长年限的增加,人参根区土壤微生物代谢活性及物种多样性逐渐增大,使土壤中的病原微生物数量增加、养分失衡、元素比例失调,从而导致连作障碍加剧。
因此,探寻2种灭菌方式对人参连作土壤养分及真菌群落结构的影响显得尤为重要。本研究设计了氯化苦土壤熏蒸加复合微生物菌肥、强还原土壤灭菌加复合微生物菌肥和氯化苦土壤熏蒸加强还原土壤灭菌3个处理,研究不同处理对人参连作土壤的改良效果,以期为消减人参连作障碍,实现人参绿色生态可持续发展及人参药材稳定供给提供技术支撑,同时对三七、西洋参等人参属植物及其他中药材连作障碍的研究提供参考。
1 材料与方法
1.1 研究区概况与试验设计
田间试验在吉林省吉林市左家镇北方药用植物资源圃(44°02′N、126°15′E,海拔237 m)进行,该地区属温带大陆性季风气候,年平均气温5.8 ℃,年平均降水量550 mm,年平均日照时数2 530 h。试验开始前该地点已连续栽培人参3年,病害严重。试验开始时的土壤理化性质已在之前的试验中描述过[18]。
试验设置3个处理组:(1)土壤中注射0.3 t/hm2 氯化苦,覆盖蓝色塑料薄膜,移栽前1周加入复合微生物菌肥(SFC_CB);(2)土壤中加入15 t/hm2动物粪便,灌溉至100%持水能力,覆盖蓝色塑料薄膜,移栽前1周加入复合微生物菌肥(RSD_CB);(3)土壤中注射0.3 t/hm2氯化苦,覆盖蓝色塑料薄膜,灭菌完成后加入15 t/hm2动物粪便,灌溉至100%持水能力,再次覆盖蓝色塑料薄膜(SFC_RSD)。采用随机完全区组设计,分为3个重复,每个重复 30 m2。于2019年10月20日进行人参移栽,采用斜栽法移栽大小相近的2年生健康人参苗,行距为20 cm,株距为15 cm,移栽时将人参苗倾斜30°~45°置于斜面上,覆盖6 cm厚土,铺上有叶树枝,再用适量土压住,保持土壤温度、湿度。试验期间,田间管理措施与当地生产实践一致。
1.2 试验材料
2年生健康人参苗购自抚松县万良镇人参交易市场,品种为大马牙;蓝色塑料薄膜(厚度 0.04 mm)购自吉林省鑫丰裕塑料有限公司;动物粪便购自吉林省吉林市昌邑区左家镇居民养殖场(鸡粪、牛粪、猪粪的体积比=1 ∶ 1 ∶ 1);土壤熏蒸用氯化苦购自大连绿峰化学股份有限公司(有毒,用专用注射器注射);复合微生物菌肥购自石家庄沃福沃肥业有限公司。
1.3 试验仪器
PHSJ-3F pH计,购自上海仪电科学仪器股份有限公司;WX-4000消解仪,购自上海新仪微波化学科技有限公司;ZQZY-85CNS振荡培养箱,购自上海知楚仪器有限公司;M200pro型酶标仪,购自瑞士TECAN公司;PE Optima 8000电感耦合等离子体发射光谱仪,购自美国珀金埃尔默公司。
1.4 测定方法
1.4.1 样品采集与处理 在采收期(2020年10月1日)进行土壤样品采集,每个处理按“S”形设置15个土壤采样点并采集0~20 cm的土壤,将5个土壤采樣点混成1个复合样本,每个处理得到3个复合样本。去除复合样本中的根和杂质,一部分自然风干磨碎,过2 mm筛网进行养分分析,剩余部分装在冻存盒中带到实验室内,于低温(-80 ℃)保存,用于微生物群落的测定。
1.4.2 土壤性质及养分含量测定 参考《土壤农化分析》(第3版)对土壤性质进行测定[19]。土壤pH值和电导率(EC)分别通过pH计和电导率仪在1 ∶ 5(质量 ∶ 体积)的土水比例下测定;有机质(OM)含量采用重铬酸钾滴定法测定;水解氮(AN)含量采用碱解扩散法测定;有效磷(AP)含量采用碳酸氢钠浸提-钼锑抗比色法测定;速效钾(AK)含量采用M3浸提法测定;全钾(TK)含量采用浓硝酸消煮法测定。
1.4.3 土壤DNA的提取与群落检测 根据E.Z.N.ASoil DNA kit试剂盒说明书,从土壤样本中进行微生物群落总DNA的提取,使用1%琼脂糖凝胶电泳检测DNA提取质量,用NanoDrop 2000测定DNA浓度和纯度。用内转录间隔区(ITS)序列可变区进行PCR扩增。用Illumina公司的Miseq PE300平台进行测序。
1.4.4 真菌FUNGuild功能的预测 用FUNGuild数据库预测真菌群落的功能组成,根据营养方式不同,将真菌分为病理营养型(pathotroph)、共生营养型(symbiotroph)和腐生营养型(saprotroph)3种,基于以上营养方式,又分为动物病原菌(animal pathogens)、丛枝菌根真菌(arbuscular mycorrhizal fungi)、外生菌根真菌(ectomycorrhizal fungi)、杜鹃花类菌根真菌(ericoid mycorrhizal fungi)、叶内生真菌(foliar endophytes)、地衣寄生真菌(lichenicolous fungi)、地衣共生真菌(lichenized fungi)、菌寄生真菌(mycoparasites)、植物病原菌(plant pathogens)、未定义根内生真菌(undefined root endophytes)、未定义腐生真菌(undefined saprotrophs)和木质腐生真菌(wood saprotrophs)12种。
1.5 数据分析
用QIIME V1.9.1将经过质量筛选的真菌序列以97%的序列相似性聚类到OTU中,基于OTU丰度表在各分类学水平上分析样本的群落组成。用OTU生成稀疏曲线,根据稀疏曲线OTU(指分类操作单元,通常用OTU表示,不会写中文名称)表,计算真菌多样性、丰富度、均匀度和覆盖度。应用Adonis和PERMDISP分析,筛选不同处理土壤样本中的共有OTU和特有OTU。通过分析不同样本真菌群落结构、组成和多样性的变化,确定真菌群落与土壤环境因素间的相关性。
利用IBM SPSS 21.0统计软件,通过单因素方差分析(ANOVA)测定不同处理间的差异,用软件Graphpad Prism 8.01绘图。
2 结果与分析
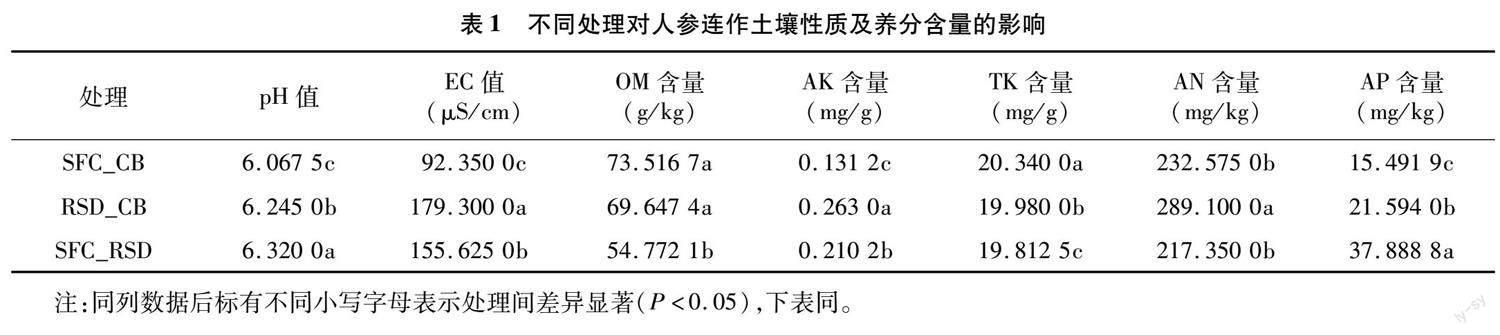
2.1 不同处理对人参连作土壤性质及养分含量的影响
从表1可以看出,SFC_CB处理组显著提高了OM、TK含量,且均表现为SFC_CB>RSD_CB>SFC_RSD,其中OM含量分别为RSD_CB、SFC_RSD处理组的1.056、1.342倍,TK含量分别为RSD_CB、SFC_RSD处理组的1.018、1.027倍。RSD_CB处理组显著提高了土壤EC值和AK、AN含量,且除AN含量外,均表现为RSD_CB>SFC_RSD>SFC_CB,其中EC值分别为SFC_RSD、SFC_CB处理组的1.152、1.942倍,AK含量分别为SFC_RSD、SFC_CB处理组的1.251、2.005倍。SFC_RSD 处理组显著提高了土壤pH值和AP含量,且均表现为SFC_RSD> RSD_CB>SFC_CB,其中pH值分别为RSD_CB、SFC_CB处理组的1.012、1.042倍,AP含量分别为RSD_CB、SFC_CB处理组的1.755、2.446倍。
2.2 不同处理对人参连作土壤真菌群落多样性和组成的影响
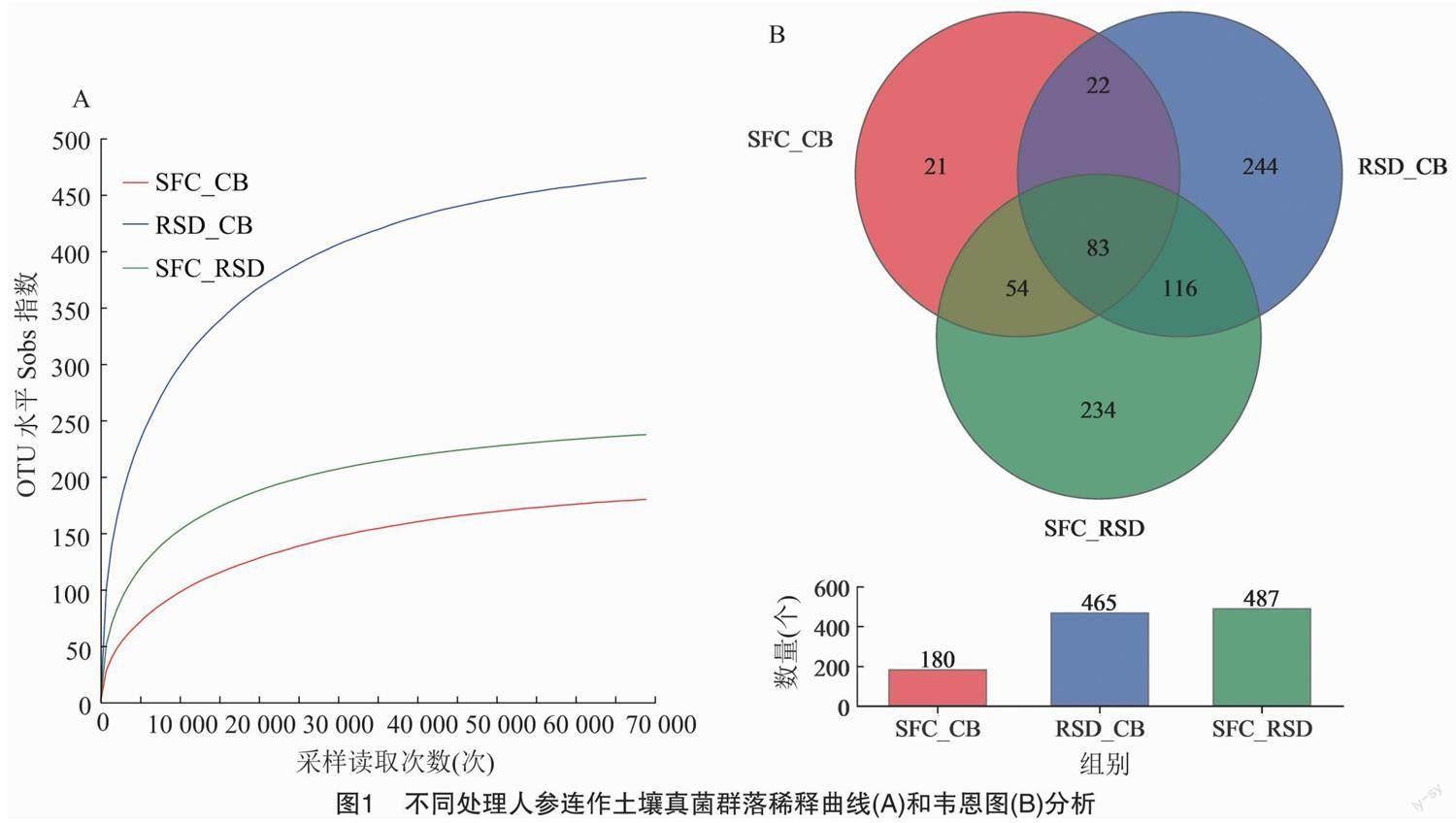
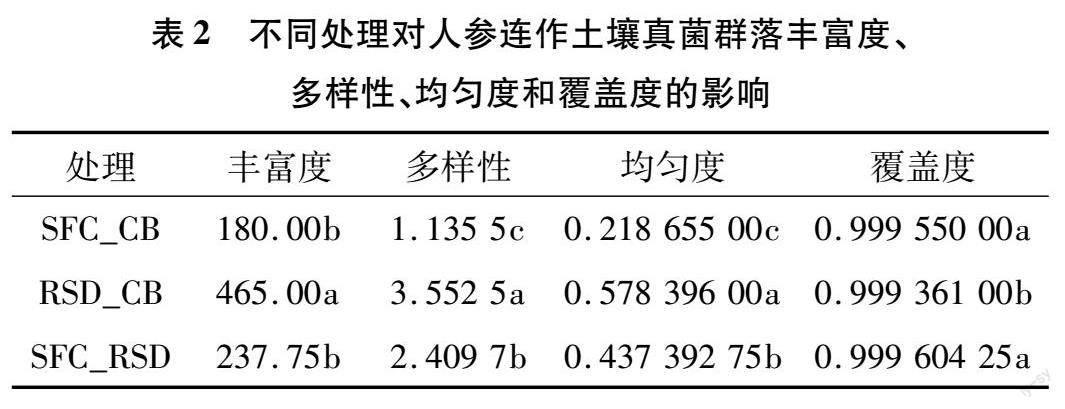
2.2.1 不同处理对人参连作土壤真菌群落多样性和组成的影响 通过测序,从不同处理的12个土壤样本(不同样本序列数量范围为69 292~71 961)中得到848 789条高质量的基因序列,序列长度为 143~425 bp。这些序列以97%的相似性分布在774个不同OTU中。所有处理的真菌稀释曲线都趋于饱和,表明测序工作在覆盖真菌多样性方面较为全面(图1-A)。同时,3个处理共有的OTU数量为83个,而特有的OTU数量以RSD_CB处理最多(图1-B)。此外,与RSD_CB处理组相比,SFC_CB、SFC_RSD处理组土壤的真菌群落丰富度、多样性和均匀度均显著降低,覆盖度均显著提高,但在丰富度、覆盖度上,SFC_CB和SFC_RSD处理组间的差异不显著(表2)。
2.2.2 不同处理对人参连作土壤真菌群落组成的影响 从不同处理土壤样本的OTU中共检测到5门9纲15目19科24属。在门分类水平下,将相对丰度大于10%的菌门定为优势菌门,发现在SFC_CB、SFC_RSD处理组中仅有子囊菌门(Ascomycota,91.30%~98.22%)1个优势菌门,而在RSD_CB处理组中的优势菌门为子囊菌门(54.13%)、被孢霉门(Mortierellomycota,31.02%)和担子菌门(Basidiomycota,11.64%)(图2-A)。 在纲分类水平下,将相对丰度大于10%的菌纲定为优势菌纲,发现SFC_CB 处理组中的优势菌纲为锤舌菌纲(Leotiomycetes,80.79%)、 座囊菌纲( Dothideomycetes,11.83%),RSD_CB处理组中的优势菌纲为粪壳菌纲(Sordariomycetes,40.40%)、被孢霉纲(Mortierellomycetes,30.95%)和银耳纲(Tremellomycetes,10.61%),SFC_RSD处理组中的优势菌纲为锤舌菌纲(29.35%)、散囊菌纲(Eurotiomycetes,26.07%)和粪壳菌纲(24.09%)(图2-B)。在目分类水平下,将相对丰度大于10%的菌目定为优势菌目,发现SFC_CB处理组的优势菌目为柔膜菌目(Helotiales,80.04%)、煤炱目(Capnodiales,11.65%),RSD_CB处理组中的优势菌目为被孢霉目(Mortierellales,30.95%)、肉座菌目(Hypocreales,18.05%)和粪壳菌目(Sordariales,17.68%),SFC_RSD处理组中优势菌目为柔膜菌目(Helotiales,26.80%)、肉座菌目(10.21%)、粪壳菌目(12.06%)和散囊菌目(Eurotiales,25.06%)(图2-C)。在科分类水平下,将相对丰度大于10%的菌科定为优势菌科,发现SFC_CB处理组中的优势菌科为柔膜菌科(76.75%)和枝孢霉科(Cladosporiaceae,11.65%),RSD_CB处理组中的优势菌科为被孢霉科(Mortierellaceae,30.95%)、毛壳菌科(Chaetomiaceae,13.51%)和丛赤壳科(Nectriaceae,16.65%),SFC_RSD处理组中的优势菌科为柔膜菌科(26.34%)、曲霉科(Aspergillaceae, 24.84%)和毛壳科(12.02%)(图2-D)。
根据所有样本各属分类平均丰度前20名作热图,发现在SFC_CB处理组中柱霉属(Scytalidium)、枝孢菌属(Cladosporium)、Tetracladium和unclassified_o_Helotiales的相对丰度显著增加,曲霉属(Aspergillus)、被孢霉属(Mortierella)、镰刀菌属(Fusarium)、短梗蠕孢菌属(Trichocladium)、毛壳菌属(Chaetomium)、梭孢壳属(Thielavia)、新赤壳属(Neocosmospora)、Eleutherascus、Pseudeurotium和unclassified_k_Fungi的相对丰度显著降低;在RSD_CB处理组中被孢霉属、镰刀菌属、短梗蠕孢菌属、毛壳菌属、新赤壳属、Tausonia、Pseudeurotium、Solicoccozyma和unclassified_k_Fungi的相对丰度显著增加,柱霉属、曲霉属、梭孢壳属、枝孢菌属、Eleutherascus、Tetracladium和unclassified_o_Helotiales的相对丰度显著降低;在SFC_RSD处理组中曲霉属、梭孢壳属(Thielavia)、Eleutherascus和unclassified_k_Fungi的相对丰度显著增加,被孢霉属、短梗蠕孢菌属、枝孢菌属、Tausonia、Pseudeurotium、Solicoccozyma和Tetracladium的相对丰度显著降低(图3)。
此外,不同处理组也塑造了共有、特有真菌微生物群。3个处理土壤中共有的OTU数量为83个,均占总保留OTU(774个)的10.72%,保留OTU的46.11%、17.85%和17.04%(表3)。大多数共有OTU被划分为20个真菌属,其中17个真菌属的相对丰度在不同处理间发生了显著变化(图4)。此外,3个处理土壤中特有的OTU数量为499个,分别占总保留OTU(774个)的64.47%和保留OTU的11.67%、52.47%和48.05%(表3)。特有OTU被划分为47个真菌属,SFC_CB、RSD_CB、SFC_RSD处理组分别包含15、29、18个属,表明强还原土壤灭菌技术能够比氯化苦土壤熏蒸技术重组更多特有微生物群(表4)。其中,毛球腔菌属(Setosphaeria)、Glomus、Lipomyces、Gorgomyces、Farlowiella、Lophiotrema、Saitozyma和unclassified_f_Chionosphaeraceae仅在SFC_CB处理组中存在;Chaetosphaeria、Burgoa、Schizothecium、Syncephalis、 Cladophialophora、Chloridium、Cercophora、Mastigobasidium、 Thelonectria、Minimedusa、Eucasphaeria、Humicolopsis_f_Pezizomycotina_fam_Incertae_sedis、unclassified_f_Nectriaceae、unclassified_f_Helotiaceae、unclassified_f_Melanommataceae、Dactylonectria、unclassified_f_Sordariaceae、unclassified_f_Microascaceae和Mastigobasidium unclassified_f_Hypocreales_fam_Incertae_sedis仅在RSD_CB处理组中存在;梭孢壳属、根囊壶菌属(Rhizophlyctis)、黑孢霉属(Nigrospora)、黑团孢属(Periconia)、青霉属(Penicillium)、厚壁孔孢属(Gilmaniella)、曲霉属(Aspergillus)、Talaromyces和unclassified_p_Chytridiomycota仅在SFC_RSD处理组中存在。
2.3 人参连作土壤真菌群落变化与环境因子的相关性分析
通过VIF方差膨胀因子分析,筛选去除VIF>10的环境因子。经过筛选,保留下EC值、pH值、SOM含量、AK含量和AP含量进行相关性分析(表5)。将相对丰度排前20名的真菌属与环境因子进行相关性分析,发现真菌群落与环境因子存在显著相关性(图5)。其中,AP含量与Aspergillus呈极显著正相关,与Tausonia呈显著负相关,与Cladosporium呈极显著负相关;pH值与Eleutherascus、Thielavia呈显著正相关,与Chrysosporium、Westerdykella呈极显著正相关;SOM含量与Tausonia呈显著正相关;AK含量与Chaetomium呈显著正相关,与unclassified_o_Helotiales呈显著负相关;EC值与Neocosmospora、Epicoccum和Mortierella呈显著正相关,与Chaetomium呈极显著正相关,与Trichoderma呈显著负相关。
2.4 土壤真菌群落FunGuild功能预测
采用FunGuild对不同处理土壤真菌群落进行功能预测,共鉴定出12个主要功能分组(图6)。在SFC_CB处理组中,木质腐生真菌(wood saprotroph)的相对丰度最高,而动物病原-植物病原-未定义腐生真菌(animal pathogen-plant pathogen-undefined saprotroph)、动物病原-粪腐生-内生- 附生-植物腐生- 木质腐生真菌(animal pathogen-dung saprotroph-endophyte-epiphyte-plant saprotroph-wood saprotroph)和粪腐生-未定义腐生真菌(dung saprotroph-undefined saprotroph)基本没有;在RSD_CB处理组中,内生-垃圾腐生-土壤 腐生-未定义腐生真菌(endophyte-litter saprotroph- soil saprotroph-undefined saprotroph)的相對丰度最高,而木质腐生真菌(wood saprotroph)和粪腐生-未定义腐生真菌(dung saprotroph-undefined saprotroph)的相对丰度最低。在SFC_RSD处理中,未定义腐生真菌(undefined saprotroph)的相对丰度最高,而植物病原菌(plant pathogen)的相对丰度最低。
3 讨论
土壤为植物、微生物提供了生存环境,而其理化性质和养分循环又直接影响着植物生长发育和微生物群落组成,对土壤改良和腐殖质形成起到至关重要的作用[17,20]。大量研究发现,长期连作会导致土壤养分含量减少和土传病原菌发生,而强还原土壤灭菌和氯化苦土壤熏蒸技术可改善土壤酸化、盐渍化,增加土壤养分含量[21-22]。在本研究中,SFC_RSD处理组显著提高了土壤pH值,表明强还原土壤灭菌、氯化苦土壤熏蒸技术均可缓解土壤酸化,而2种技术相结合的效果更显著,与前人研究结果[18]一致。进一步分析发现,土壤pH值与梭孢壳属、Chrysosporium、Eleutherascus和Westerdykella显著正相关,表明pH值是转化微生物的一个重要因素,与微生物丰富度、多样性密切相关[23]。前人研究发现,强还原土壤灭菌处理后,土壤盐度(以EC值表示)显著降低[24],这与本研究结果略有不同。这可能与有机基质添加和厌氧过程有关,导致特定微生物类群和特定功能基因大量繁殖。刘世鹏等研究发现,金银花树根系分泌N、P、S等在提高土壤肥力的同时,对Solicoccozyma、Tausonia、曲霉属等有害真菌有抑制作用[25]。土壤有机质是植物营养的主要来 源之一,能促进植物生长发育和营养元素分解, 改善土壤性质[26]。本研究发现,SFC_CB、RSD_CB处理组均可显著提高土壤SOM含量,且SOM含量与Tausonia显著正相关。这可能与2个方面的原因有关,一是土壤中的致病真菌增加,需要分泌更多营养物质来抑制其生长繁殖;二是土壤中添加的复合微生物菌肥加快了土壤中有机物质的分解,从而提高了土壤SOM含量。此外,添加可分解碳源和灌水覆膜对营养元素及其转化的影响在不同研究中并不一致。营养元素及其有效性的升高或降低可能直接源于有機物的厌氧降解,也可能间接来源于营养元素的循环[27-28]。本研究发现,RSD_CB处理组可显著提高土壤AK、AN含量,降低土壤TK、AP含量。其中,AK含量与毛壳菌属显著正相关,而毛壳菌属是一种生防菌,可降解土壤中纤维素及木质素等,从而导致土壤AK含量增加[17]。土壤水解氮又称碱解氮,包括无机态氮及易水解的有机态氮,土壤AN含量的增加可能与土壤中反硝化细菌的减少有关。前人研究发现,强还原土壤灭菌可显著提高土壤AP含量[29],这与本研究结果略有差异,可能因为AP含量与曲霉属呈极显著正相关,与Tausonia呈显著负相关,而曲霉属、Tausonia均为致病真菌,抑制了磷的吸收,降低了磷的有效性。
真菌是土壤生态系统的重要组分之一,能够分解土壤有机质和腐殖质,为植物生长发育提供养分[30-31]。对真菌丰富度指数、多样性指数、均匀度指数和覆盖度指数进行分析发现,RSD_CB处理组显著提高了土壤真菌群落丰富度、多样性和均匀度,降低了覆盖度,这与前人的研究结果[27]一致,可能是因为不同动物粪便的发酵组合可以刺激真菌类群,从而获得更高的真菌多样性。同时,本研究从不同处理土壤样本中共检测到5门9纲15目19科24属,其中共有优势菌门为子囊菌门,占比达54.13%~98.22%,其之所以在该研究区占有较高的比重,与其遗传特性有关。子囊菌门是分解有机物料的关键菌群,具有较高的物种多样性和进化速度[32-33]。但在RSD_CB处理组中,除子囊菌门外,担子菌门也为优势菌门。担子菌门多为腐生菌,可以促进土壤物质循环,而许多菌根真菌也为担子菌,可以拮抗根部病原菌,改良土壤微生态环境[34]。进一步分析发现,除在门水平各处理组成较为相似外,从目水平到科水平,不同处理的土壤优势菌群均存在差异,这可能归因于有机物料的碳成分和分解特性,因为不同有机物料在碳成分、分解特性上存在差异,这种差异对微生物群落组成的影响也不同[35]。从属水平进行分析,发现RSD_CB处理组虽然增加了镰刀菌属这一致病菌的相对丰度,但是也增加了被孢霉属、毛壳菌属等有益菌的相对丰度。被孢霉属、毛壳菌属均是具有较强分解纤维素能力的真菌,对改善土壤结构、提高土壤养分有效性具有良好效果[17,36-37]。镰刀菌属是一种土传致病菌,在多数土壤中均大量存在,总的来说,RSD_CB处理组中有益菌的数量大于致病菌数量,会使植物趋于正向生长,因此可忽略不计。此外,特定微生物类群的丰度、多样性和活性是决定特定土壤功能的重要因素。本研究发现,大多数共有OTU被划分为20个真菌属,其中有17个真菌属的相对丰度在不同处理间发生了显著变化。而特有OTU被划分为47个真菌属,SFC_CB、RSD_CB、SFC_RSD处理组分别包含15、29、18个属,可能因为不同有机残留物组合刺激了微生物种群,从而增加了微生物多样性。
采用FunGuild对不同处理土壤真菌群落进行功能预测,共鉴定出12个主要功能分组。根据营养类型主要分为腐生营养型、病理营养型和复合营养型,其中腐生营养型、复合营养型所占比例较高,病理营养型所占比例较低。病理营养型真菌主要从宿主细胞获取营养来源,可以抑制植物生长,表明3种处理均可减少病原真菌的数量[38-39]。但在本研究土壤中,几乎没有发现共生营养型真菌,这可能与试验前期该地区连续多年种植人参有关,土壤连续多年种植人参会导致土壤养分降低,从而降低共生真菌的相对丰度[40]。同时,不同处理土壤真菌功能组相对丰度并不相同,在SFC_CB处理组中,木质腐生真菌的相对丰度最高,在RSD_CB处理组中,内生-垃圾腐生-土壤腐生-未定义腐生真菌的相对丰度最高,在SFC_RSD处理中,未定义腐生真菌的相对丰度最高。这可能与人为翻动土壤和施入复合微生物菌肥有关,由于改变了真菌生存环境,使易受人为干扰的真菌功能进行了转换,趋于复杂化[41]。此外,不同处理中未明确分类的真菌仍有很多,还需通过宏基因组进行进一步的功能挖掘。
4 结论
本研究结果表明,氯化苦土壤熏蒸技术和强还原土壤灭菌技术均能显著改变土壤养分含量和真菌群落结构。其中,SFC_CB处理组显著提高了土壤SOM、TK含量,RSD_CB处理组显著提高了土壤EC值和AK、AN含量,SFC_RSD处理组显著提高了土壤pH值和AP含量,且土壤真菌群落组成与土壤养分密切相关,其中EC值、pH值、SOM含量、AK含量和AP含量是主要驱动因素。同时,不同处理除在门水平组成较为相似外,从目水平到属水平土壤优势菌群均存在差异,且RSD_CB处理组显著增加了被孢霉属、毛壳菌属等有益菌的丰度。此外,从不同处理土壤中共鉴定出12个真菌功能群,不同处理均表现为腐生营养型和复合营养型所占比例较高,病理营养型所占比例较低。综上,强还原土壤灭菌技术有望替代传统的化学熏蒸技术,用于消减连作障碍土壤。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典:一部[S]. 北京:中国 医药科技出版社,2020:8-9.
[2]高 健,吕邵娃. 人参化学成分及药理作用研究进展[J]. 中医药导报,2021,27(1):127-130,137.
[3]李 倩,柴艺汇,高 洁,等. 人参现代药理作用研究进展[J]. 贵阳中医学院学报,2019,41(5):89-92.
[4]张连学,陈长宝,王英平,等. 人参忌连作研究及其解决途径[J]. 吉林农业大学学报,2008,30(4):481-485,491.
[5]Gullino M L,Minuto A,Gilardi G,et al. Efficacy of preplant soil fumigation with chloropicrin for tomato production in Italy[J]. Crop Protection,2002,21(9):741-749.
[6]Haar M J,Fennimore S A,Ajwa H A,et al. Chloropicrin effect on weed seed viability[J]. Crop Protection,2003,22(1):109-115.
[7]Momma N,Kobara Y,Uematsu S,et al. Development of biological soil disinfestations in Japan[J]. Applied Microbiology and Biotechnology,2013,97(9):3801-3809.
[8]Blok W J,Lamers J G,Termorshuizen A J,et al. Control of soilborne plant pathogens by incorporating fresh organic amendments followed by tarping[J]. Phytopathology,2007,90(3):253-259.
[9]劉亮亮,崔慧灵,孔继婕,等. 强还原处理所使用有机物料与其杀菌效果的相互关系[J]. 植物保护,2017,43(2):73-81.
[10] 黄新琦,温 腾,孟 磊,等. 土壤快速强烈还原对于尖孢镰刀菌的抑制作用[J]. 生态学报,2014,34(16):4526-4534.
[11]蔡祖聪,张金波,黄新琦,等. 强还原土壤灭菌防控作物土传病的应用研究[J]. 土壤学报,2015,52(3):469-476.
[12]Ueki A,Kaku N,Ueki K. Role of anaerobic bacteria in biological soil disinfestation for elimination of soil-borne plant pathogens in agriculture[J]. Applied Microbiology and Biotechnology,2018,102:6309-6318.
[13]Goldford J E,Lu N,Baji c ' C,et al. Emergent simplicity in microbial community assembly[J]. Science,2018,361(6401):469-474.
[14]檀兴燕.强还原土壤灭菌法缓解番茄连作障碍的效果及其土壤微生物群落的响应机制[D]. 淮北:淮北师范大学,2019.
[15]董林林,牛玮浩,王 瑞,等. 人参根际真菌群落多样性及组成的变化[J]. 中国中药杂志,2017,42(3):443-449.
[16]张梦昌,金裕姬,马 晶,等. 老参地改良后微生物生态类群的变化[J]. 吉林农业大学学报,1990(4):42-46,105.
[17]张建勋,苑雪琪,巩金壮,等. 老参地种植白屈菜及玉米对土壤养分及真菌群落结构的影响[J]. 吉林农业大学学报,2022,44(1):51-60.
[18]Zhan Y,Yan N,Miao X Y,et al. Different responses of soil environmental factors,soil bacterial community and root performance to reductive soil disinfestation and soil fumigant chloropicrin[J]. Frontiers in Microbiology,2021,12:796191.
[19]鲍士旦.土壤农化分析[M]. 3版.北京:中国农业出版社,2000:34-79.
[20]张红霞,张舒雅,张玉涛,等. 山药根际土壤微生物16S rRNA多样性及影响因素[J]. 土壤学报,2019,56(5):1235-1246.
[21]滕 凯,张清壮,彭镜先,等. 强还原土壤灭菌对烟草种植前后土壤化学性质及微生物群落结构的影响[J]. 烟草科技,2022,55(4):9-19.
[22]欧小宏,刘迪秋,王麟猛,等. 土壤熏蒸处理对连作三七生长发育及土壤理化性状的影响[J]. 中国现代中药,2018,20(7):842-849.
[23]Kim J M,Roh A S,Choi S C,et al. Soil pH and electrical conductivity are key edaphic factors shaping bacterial communities of greenhouse soils in Korea[J]. Journal of Microbiology,2016,54(12):838-845.
[24]Huang X Q,Liu L L,Wen T,et al. Reductive soil disinfestations combined or not with Trichoderma for the treatment of a degraded and Rhizoctonia solani infested greenhouse soil[J]. Scientia Horticulturae,2016,206:51-61.
[25] 刘世鹏,江林春,韦洁敏,等. 金银花根际土壤真菌群落多样性及其土壤影响因子研究[J]. 陕西林业科技,2021,49(1):1-8.
[26]郑聚锋,陈硕桐. 土壤有机质与土壤固碳[J]. 科学,2021,73(6):13-17.
[27]Zhao J,Zhou X,Jiang A Q,et al. Distinct impacts of reductive soil disinfestation and chemical soil disinfestation on soil fungal communities and memberships[J]. Applied Microbiology & Biotechnology,2018,102(17):7623-7634.
[28]Zhang D Q,Cheng H Y,Hao B Q,et al. Fresh chicken manure fumigation reduces the inhibition time of chloropicrin on soil bacteria and fungi and increases beneficial microorganisms[J]. Environmental Pollution,2021,286(7):117460.
[29]魏光鈺,胡 勇,吴永琴,等. 土壤强还原处理对植烟土壤真菌群落结构及烤烟产质量的影响[J]. 湖南农业科学,2021(3):34-39.
[30]孙鹏洲,罗珠珠,李玲玲,等. 黄土高原干旱区长期种植紫花苜蓿和一年生作物轮作对土壤真菌群落的影响[J]. 中国生态农业学报(中英文),2022,30(6):965-975.
[31]郭瑞齐,管仁伟,李红霞,等. 基于ITS序列分析传统轮作对参田土壤真菌群落组成及多样性的影响[J]. 江苏农业科学,2022,50(20):240-245.
[32]Bastian F,Bouziri L,Nicolardot B,et al. Impact of wheat straw decomposition on successional patterns of soil microbial community structure[J]. Soil Biology & Biochemistry,2009,41(2):262-275.
[33]Ma A Z,Zhuang X L,Wu J M,et al. Ascomycota members dominate fungal communities during straw residue decomposition in arable soil [J]. PLoS One,2013,8(6):e66146.
[34]Sterkenburg E,Bahr A,Durling M B,et al. Changes in fungal communities along a boreal forest soil fertility gradient[J]. The New Phytologist,2015,207(4):1145-1158.
[35]Tan X Y,Liao H K,Shu L Z,et al. Effect of different substrates on soil microbial community structure and the mechanisms of reductive soil disinfestation[J]. Frontiers in Microbiology,2019,10:e02851.
[36]Goto B T,Maia L C. Glomerospores:a new denomination for the spores of Glomeromycota,a group molecularly distinct from the Zygomycota[J]. Mycotaxon,2006,96(4):129-132.
[37]宁 琪,陈 林,李 芳,等. 被孢霉对土壤养分有效性和秸秆降解的影响[J]. 土壤学报,2022,59(1):206-217.
[38]Wang J C,Rhodes G,Huang Q W,et al. Plant growth stages and fertilization regimes drive soil fungal community compositions in a wheat-rice rotation system[J]. Biology and Fertility of Soils,2018,54:731-742.
[39] Anthony M A,Frey S D,Stinson K A. Fungal community homogenization,shift in dominant trophic guild,and appearance of novel taxa with biotic invasion[J]. Ecosphere,2017,8(9):e01951.
[40]Xu J,Zhang Y Z,Zhang P F,et al. The structure and function of the global citrus rhizosphere microbiome[J]. Nature Communications,2018,9(1):4894.
[41]燕红梅,张欣钰,檀文君,等. 5种植物根际真菌群落结构与多样性[J]. 应用与环境生物学报,2020,26(2):364-369.
收 稿日期:2023-02-08
基金项目:国家自然科学基金(编号:82204558);吉林省重大科技专项(编号:20200504003YY);吉林省自然科学基金(编号:YDZJ202101ZYTS015);吉林省重点研发项目(编号:20220204078YY);长春市科技发展规划(编号:21ZGY13);长春中医药大学青年科学家项目(编号:QNKXJ2-2021ZR19)。
作者简介:战 宇(1995—),女,吉林长春人,博士研究生,主要从事中药学方面的研究。E-mail:2507546505@qq.com。
通信作者:李 琼,博士,助理研究员,主要从事药用植物栽培研究。E-mail:wode17k@163.com。

