钠基吸收剂在垃圾焚烧烟气中脱酸失活热力学研究
龚建涛, 孙 慧, 宗永兰,吴泳霖,蒋 明
(云南农业大学资源与环境学院,云南 昆明 650201)
近年来,随着经济社会的快速发展,城市生活垃圾产生量与日俱增,环境问题也日益突出。当前,我国城市生活垃圾的处理方法主要有填埋、焚烧和堆肥三种[1]。与传统填埋和堆肥方式相比,垃圾焚烧具有占地面积小、处理周期短、处理量大、无害化、资源循环利用等优点[2-3],焚烧成为城市生活垃圾处理的主要技术[4]。根据垃圾成分的复杂性及副产物形态的不同,生活垃圾中含有碳、氯、硫和氮等元素[5],因而垃圾在热解焚烧过程中,产生的烟气含有大量酸性气体(HCl、SOx、NOx、HF、CO2),其中主要以HCl 气体为主[6-7]。这些酸性气体不仅会对焚烧炉的使用寿命产生影响,而且也会严重影响周围生态环境,对人类的生命健康造成诸多危害[8]。
目前,针对垃圾焚烧烟气中酸性气体的净化,国内外研究的脱酸工艺主要有干法、半干法、湿法[9]。现阶段,关于这三种方法脱除材料的研究,主要以NaHCO3[10]、NaCO3[11]等钠基材料为主。钠基吸收剂因其储备丰富、设备腐蚀性低、成本低、再生能耗低,对垃圾焚烧烟气中的酸性气体脱除性能较好,成为众多学者研究的主要对象。
垃圾焚烧烟气中酸性气体会对钠基吸收剂的活性产生不同影响,干法脱酸的适宜温度一般为140~150 ℃[12],故文章通过应用HSC Chemistry 6.0热力学计算程序,计算在100~200 ℃操作温度条件下,从化学反应热力学角度推断垃圾焚烧烟气中酸性气体(HCl、SO2、CO2、NO、HF)在H2O 和O2共存时,与钠基吸收剂(NaHCO3、NaCO3)可能发生的化学反应,并探究可能失活的产物,以期掌握钠基吸收剂在垃圾焚烧烟气中酸性气体的失活机理及规律。
1 热力学计算基础
根据纯物质的热化学属性和物理性质,应用吉布斯自由能(ΔG)最小原理,通过使用HSC Chemistry 6.0 计算非均相化学反应达到化学平衡时在热力学的自发可能性。在计算前,根据纯物质属性对可能产生的化学产物进行了分析查询和推断[13];在计算时,默认压力为常压(101.325 kPa),温度范围100~200 ℃,10 ℃的升温步长。
2 不同反应体系热力学计算结果
2.1 NaHCO3吸收剂热力学计算结果
2.1.1 NaHCO3-HCl-O2-H2O体系
在HCl、O2、H2O 共存条件下,与NaHCO3可能发生的非均相反应见反应式(1)~(6)。
图1 是由HSC Chemistry 6.0 计算得到的反应式(1)~(6)吉布斯自由能(ΔG)随温度变化的关系。由图1 可知,在100~200 ℃范围内,只有反应式(1)的ΔG小于零,表明该反应可向右自发进行,HCl 单独存在时会导致NaHCO3失活,生成的固态产物为NaCl。此外,该反应的ΔG随温度的升高逐渐下降,表明升高温度能加速NaHCO3的失活。
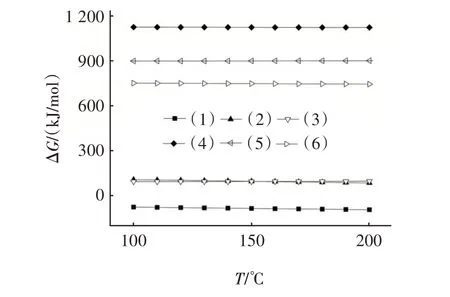
图1 式(1)~(6)的吉布斯自由能与温度的关系Fig.1 Relationship between Gibbs energy and temperature of Eq.(1)~Eq.(6)
2.1.2 NaHCO3-SO2-O2-H2O体系
在SO2、O2、H2O 共存时,与NaHCO3可能发生的非均相反应见反应式(7)~(11)。
图2 是由HSC Chemistry 6.0 计算得到的反应式(7)~(11)吉布斯自由能(ΔG)随温度变化的关系。由图2 可知,在100~200°C 范围内,反应式(7)~(8)的ΔG小于零,表明该系列反应可以自发向右进行,SO2单独存在时能导致NaHCO3失活,生成失活固态产物Na2SO3和Na2SO4,其中反应式(8)的ΔG绝对值最大,是该体系中NaHCO3失活的主导反应。
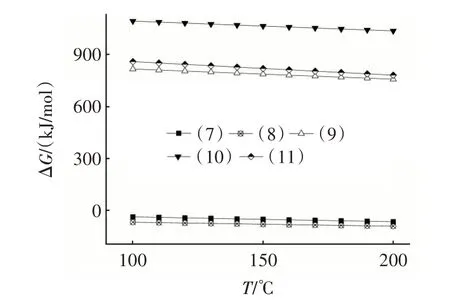
图2 式(7)~(11)的吉布斯自由能与温度的关系Fig.2 Relationship between Gibbs energy and temperature of Eq.(7)~Eq.(11)
2.1.3 NaHCO3-CO2-O2-H2O体系
在CO2、O2、H2O 共存时,与NaHCO3可能发生的非均相反应见反应式(12)~(14)。图3 是由HSC Chemistry 6.0 计算得到的反应式(12)~(14)吉布斯自由能(ΔG)随温度变化的关系。
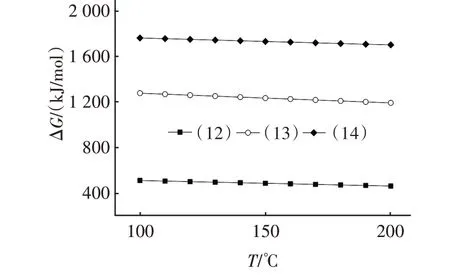
图3 式(12)~(14)的吉布斯自由能与温度的关系Fig.3 Relationship between Gibbs energy and temperature of Eq.(12)~Eq.(14)
由图3 可知,在100~200 ℃范围内,反应式(12)~(14)的ΔG均大于零,表明在温度范围内该系列反应不能自发向右进行,可能原因为NaHCO3中HC较饱和,会抑制碳酸电离。因此CO2单独存在或分别与O2、H2O共存都不会对NaHCO3产生影响。
2.1.4 NaHCO3-NO-O2-H2O体系
在NO、O2、H2O 共存时,与NaHCO3可能发生的非均相反应见反应式(15)~(22)。图4 是由HSC Chemistry 6.0 计算得到的反应式(15)~(22)吉布斯自由能(ΔG)随温度变化的关系。
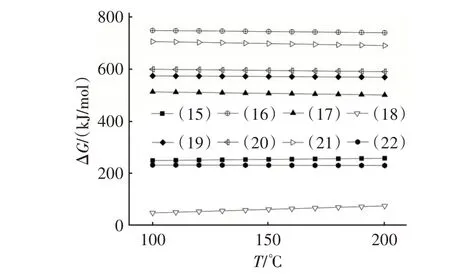
图4 式(15)~(22)的吉布斯自由能与温度的关系Fig.4 Relationship between Gibbs energy and temperature of Eq.(15)~Eq.(22)
由图4 可知,在100~200 ℃范围内,反应(15)~(22)的ΔG均大于零,表明在温度范围内该系列反应不能自发向右进行。因此,NO单独存在或分别与O2和H2O共存都不会导致NaHCO3在脱氮过程中失活。
2.1.5 NaHCO3-HF-O2-H2O体系
在HF、O2、H2O 共存时,与NaHCO3可能发生的非均相反应见反应式(23)~(26)。
图5 是由HSC Chemistry 6.0 计算得到的反应式(23)~(26)吉布斯自由能(ΔG)随温度变化的关系。由图5 可知,在100~200 ℃范围内,仅反应式(23)的ΔG小于零,表明该反应可向右自发进行,HF单独存在时会导致NaHCO3在脱氟过程中失活,生成的固态失活产物为NaF。
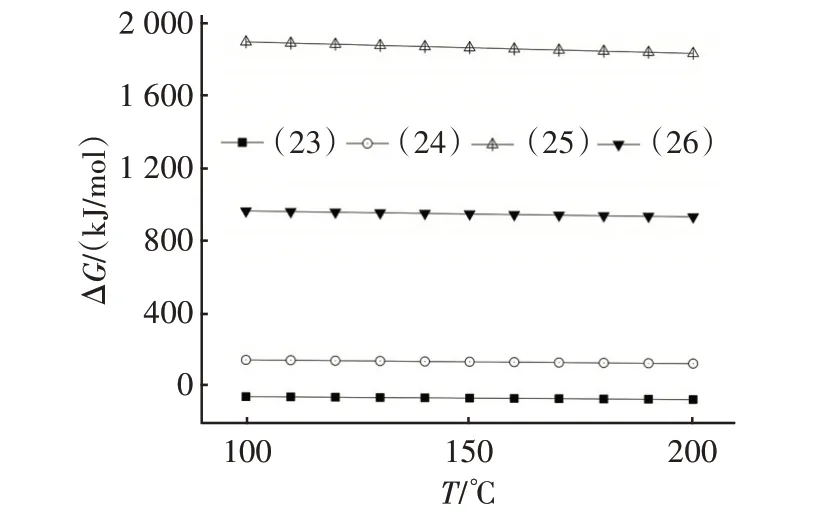
图5 式(23)~(26)的吉布斯自由能与温度的关系Fig.5 Relationship between Gibbs energy and temperature of Eq.(23)~Eq.(26)
2.2 Na2CO3吸收剂热力学计算结果
2.2.1 Na2CO3-HCl-O2-H2O体系
在HCl、O2、H2O 共存时,与Na2CO3可能发生的非均相反应见反应式(27)~(36)。图6 是由HSC Chemistry 6.0 计算得到的反应式(27)~(36)吉布斯自由能(ΔG)随温度变化的关系。
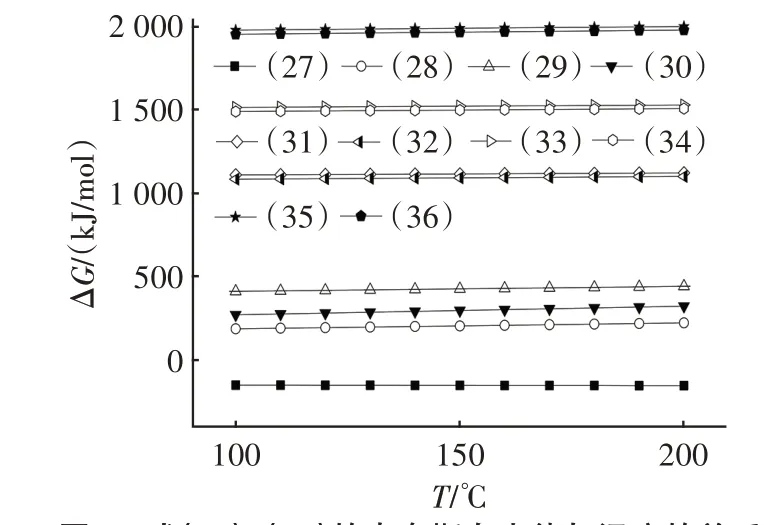
图6 式(27)~(36)的吉布斯自由能与温度的关系Fig.6 Relationship between Gibbs energy and temperature of Eq.(27)~Eq.(36)
由图6 可知,在100~200 ℃范围内,仅反应式(27)的ΔG小于零,表明该反应可向右自发进行,HCl 单独存在时会导致Na2CO3在脱氯过程中失活,生成固态产物NaCl。O2或H2O 的存在不会对Na2CO3的脱氯过程造成影响。
2.2.2 Na2CO3-SO2-O2-H2O体系
在SO2、O2、H2O共存时,与Na2CO3可能发生的非均相反应见反应式(37)~(51)。
图7 是由HSC Chemistry 6.0 计算得到的反应式(37)~(51)吉布斯自由能(ΔG)随温度变化的关系。由图7 可知,在100~200 ℃范围内,反应式(37)~(39)的ΔG均小于零,表明该系列反应可向右自发进行,而反应式(39)ΔG的绝对值最大,是该体系中脱除SO2酸性气体的主导反应,失活产物为Na2SO4。此外,三个自发反应的ΔG并未随温度的升高发生变化,表明反应温度对其自发程度的影响并不明显。
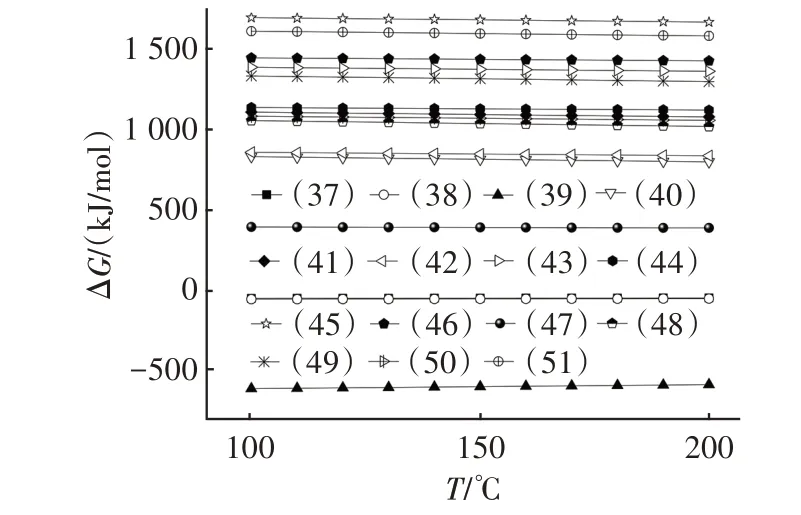
图7 式(37)~(51)的吉布斯自由能与温度的关系Fig.7 Relationship between Gibbs energy and temperature of Eq.(37)~Eq.(51)
2.2.3 Na2CO3-CO2-O2-H2O体系
在CO2、O2、H2O 共存时,与Na2CO3可能发生的非均相反应见反应式(52)~(57)。图8 是由HSC Chemistry 6.0 计算得到的反应式(52)~(57)吉布斯自由能(ΔG)随温度变化的关系。

图8 式(52)~(57)的吉布斯自由能与温度的关系Fig.8 Relationship between Gibbs energy and temperature of Eq.(52)~Eq.(57)
由图8可知,在计算温度范围内,仅反应式(55)的ΔG小于零,表明该反应可向右自发进行,H2O 的存在会对Na2CO3的脱碳过程产生影响。生成的固态失活产物为NaHCO3。此外,该反应ΔG随温度升高逐渐增大,当温度超过140°C时,ΔG大于零,表明温度升高会显著影响该反应的自发程度。
2.2.4 Na2CO3-NO-O2-H2O体系
在NO、O2、H2O 共存时,与Na2CO3可能发生的非均相反应见反应式(58)~(66)。图9 是由HSC Chemistry 6.0 计算得到的反应式(58)~(66)吉布斯自由能(ΔG)随温度变化的关系。
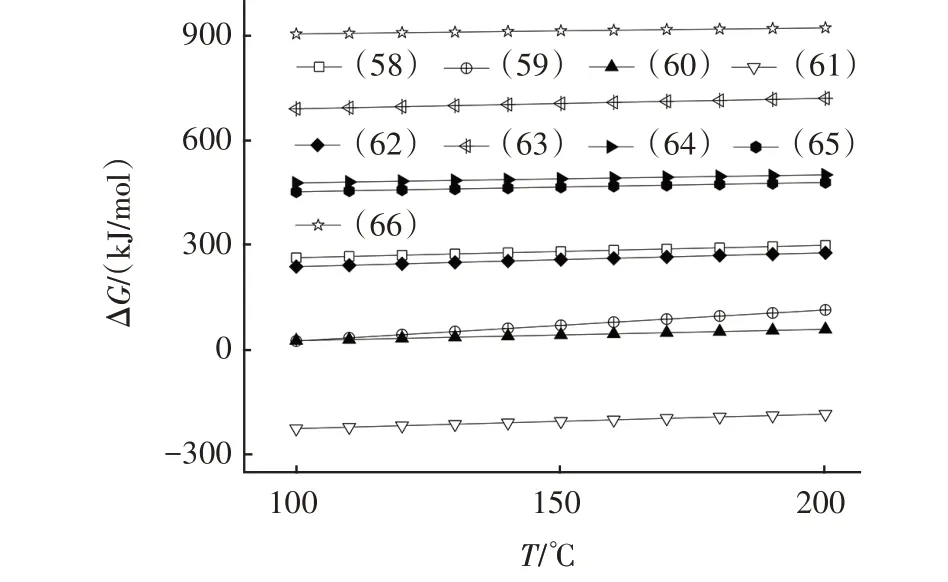
图9 式(58)~(66)的吉布斯自由能与温度的关系Fig.9 Relationship between Gibbs energy and temperature of Eq.(58)~Eq.(66)
由图9 可知,在计算温度范围内,仅反应式(61)的ΔG小于零,表明该系列反应可自发向右进行,是脱除NO 的主导反应,生成固态失活产物为NaNO3,O2的存在会对Na2CO3的脱氮过程产生影响。
2.2.5 Na2CO3-HF-O2-H2O体系
在HF、O2、H2O 共存时,与Na2CO3可能发生的非均相反应见反应式(67)~(71)。图10 是由HSC Chemistry 6.0 计算得到的反应式(67)~(71)吉布斯自由能(ΔG)随温度变化的关系。
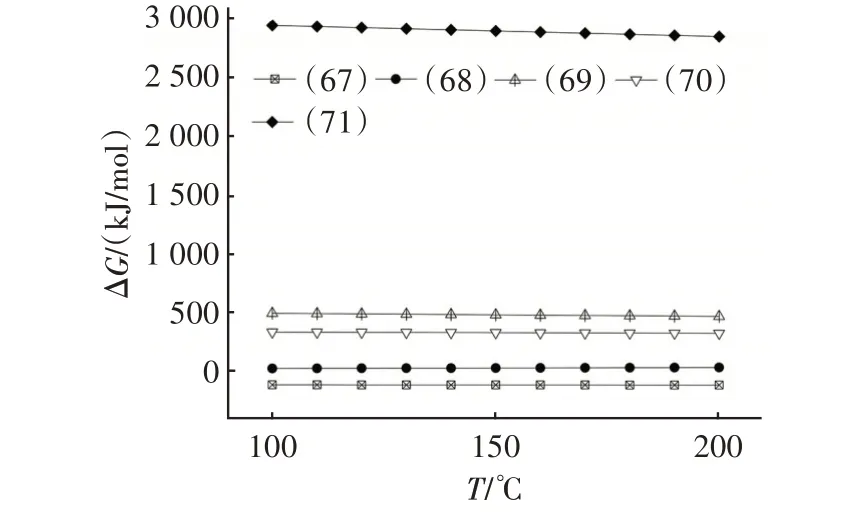
图10 式(67)~(71)的吉布斯自由能与温度的关系Fig.10 Relationship between Gibbs energy and temperature of Eq.(67)~Eq.(71)
由图10可知,在计算温度范围内,仅反应(67)的ΔG小于零,表明该反应可向右自发进行,HF单独存在时会导致Na2CO3失活,生成固态产物NaF。O2或H2O的存在不会影响Na2CO3的脱氟过程。
3 分析与讨论
在100~200 ℃操作温度范围内,钠基吸收剂(NaCO3、NaHCO3)在垃圾焚烧烟气中酸性气体(HCl、SO2、CO2、NO、HF)发生的主导反应见表1。

表1 钠基吸收剂在100~200 ℃温度下发生的主导反应Tab.1 The dominant reaction of sodium-based absorbent at a temperature of 100~200°C
对比该体系5 种气体组分的非均相主导反应,Na2CO3与SO2化学反应的ΔG绝对值最大,化学反应平衡常数(logK)值最大,表明在该系列化学反应中其热力学竞争力最强,生成的固态产物为Na2SO4。
4 结论
1)100~200 ℃范围内,垃圾焚烧烟气中酸性气体(HCl、SO2和HF)均会使NaHCO3和Na2CO3失活,生 成 的 固 态 失 活 产 物 有NaCl、Na2SO3、Na2SO4和NaF。其中,SO2对吸收剂的失活影响最大。
2)当焚烧烟气中共存O2或H2O 时,仅对Na2CO3吸收剂的失活造成影响,固态失活产物为Na2SO4、NaHCO3和NaNO3,气态失活产物为CO2。

