鸡血藤在大鼠体内的排泄动力学研究△
杨秀伟,刘晓艳,徐嵬,张鹏,赵威,龚云,刘逆夫
1.北京大学 药学院 天然药物学系/天然药物及仿生药物国家重点实验室,北京 100191;
2.株洲千金药业股份有限公司,湖南 株洲 412000
在长期临床实践中,中医形成了以口服为主的给药方式防治疾病并延续至今。鸡血藤(Spatholobi Caulis)为豆科植物密花豆Spatholobus suberectusDunn的干燥藤茎[1],始载于《本草纲目拾遗》,史谓“诸病要药”[2]。其味苦、微甘,性温,归肝、肾经,具有行血补血、调经、舒筋活络之功效,主治月经不调、痛经、闭经、风湿痹痛、手足麻木、肢体瘫痪、血虚萎黄。口服鸡血藤或其制剂后,要经过吸收入血,随后到达全身各器官组织,在体内发挥作用后,以原型药物或代谢产物的形式排出体外。鸡血藤中含有黄酮[3-4]和非黄酮[4-5]类成分,不同化学结构类型的化合物吸收不同[6-7],大鼠灌胃鸡血藤水提取物后大部分吸收入血的化合物,特别是异黄酮类化合物,具有良好的药动学行为[8]。但鸡血藤为天然药物,其生长情况及药效物质基础的积累受环境因素影响较大,样品批次不同,在物质基础含量上存在差异[9]。为阐明鸡血藤的效应物质,有必要从排泄物探究的角度逆向推论其在体内的吸收、分布、代谢过程和性质[10]。此外,鲜见文献报道鸡血藤在大鼠体内的排泄研究。
本研究在鸡血藤药动学研究[8]的基础上,用超快速液相色谱-质谱法(UFLC-MS/MS)研究鸡血藤水提取物灌胃给予大鼠,其内含化合物在大鼠尿液和粪便中的排泄情况,为全面阐明鸡血藤的体内吸收、分布、代谢、排泄过程和作用(ADME/Act)提供参考。
1 材料
1.1 实验动物
健康清洁级雄性SD 大鼠,体质量200~220 g,由北京大学医学部实验动物科学部提供,使用许可证号:SYXK(京)2016-0041。在相对湿度为(60±5)%、室温为(22±2)℃的条件下用普通饲料饲养3 d以适应环境,期间给予昼夜交替12 h的节律性光照,实验前大鼠禁食12 h,但正常饮水。本研究经北京大学生物医学伦理委员会批准,审批号为LA2021275。
1.2 药材
鸡血藤药材产于云南省普洱市,经北京大学药学院杨秀伟教授鉴定为豆科植物密花豆Spatholobus suberectusDunn 的干燥藤茎,凭证标本(标本号:Y008-1608010)保存于北京大学药学院天然药物及仿生药物全国重点实验室和株洲千金药业有限公司。
1.3 仪器与试药
UFLC-MS/MS 8050 型液相色谱-质谱仪 [包括Nexera X2 系列UFLC 系统,配备SPD M30A 型光电二极管阵列(PDA)检测器、LC-30AD 型二元泵、SIL-30AC 型自动进样器、CTO-20AC 型柱温箱、电喷雾离子源(ESI)和LabSolution 工作站,日本岛津公司];Kinetex®C18色谱柱(100 mm×2.1 mm,2.6 μm,美国Phenomenex 公司),带有配套的Phenomenex p/n AJ0-9000 C18保护柱;3K15 型高速(冷冻)离心机(德国Sigma 公司);KQ5200 型超声波清洗仪(昆山市超声仪器有限公司,功率:250 W,频率:40 kHz);CV200型真空离心浓缩仪(北京吉艾姆科技有限公司);XW-80A 型涡旋混匀器(江苏省海门市其林贝尔仪器制造有限公司);AR4120 型万分之一电子天平(奥豪斯国际贸易上海有限公司);XS105 型十万分之一电子分析天平(瑞士Mettler-Toledo 公司);Millipore Milli-Q 型超纯水仪(美国Millipore公司)。
对照品烟酸(nicotinic acid,1)、对羟基苯甲酸(p-hydroxybenzoic acid,2)、水杨酸(salicylic acid,3)、6,9-二羟基大柱香波龙-4,7-二烯-3-酮(6,9-dihydroxymegastigma-4,7-dien-3-one,4)、大豆苷(daidzin,5)、8,9-二羟基大柱香波龙-4,6-二烯-3-酮(8,9-dihydroxymegastigma-4,6-dien-3-one,6)、异落叶松脂素(isolariciresinol,7)、芒柄花素(formononetin,8)、4′,8-二甲氧基-7-O-β-D-吡喃葡萄糖基异黄酮(4′,8-dimethoxy-7-O-β-Dglucosylisoflavone,9)、(+)-松脂酚[(+)-pinoresinol,10]、(+)-表松脂酚[(+)-epipinoresinol,11]、8-甲雷杜 辛(8-O-methylretusin,12)、芒柄花素钠(formononetin sodium,13)、3′-甲氧基大豆素(3′-methoxydaidzein,14)、鸡血藤黄醇A(spasuberol A,15)、毛蕊异黄酮(calycosin,16)、艳紫铆素A(butesuperin A,17)、奥刀拉亭(odoratin,18)、鹰嘴豆芽素A(biochanin A,19)和 (6aR,11aR)-高丽槐素 [(6aR,11aR)-maackiain,20] 均由本课题组从鸡血藤中分离制备纯化而得[3-5],化学结构经质谱和核磁共振波谱确定,高效液相色谱法(HPLC)和液相色谱-质谱法(LC-MS/MS)检测纯度均大于98%,化学结构见图1。
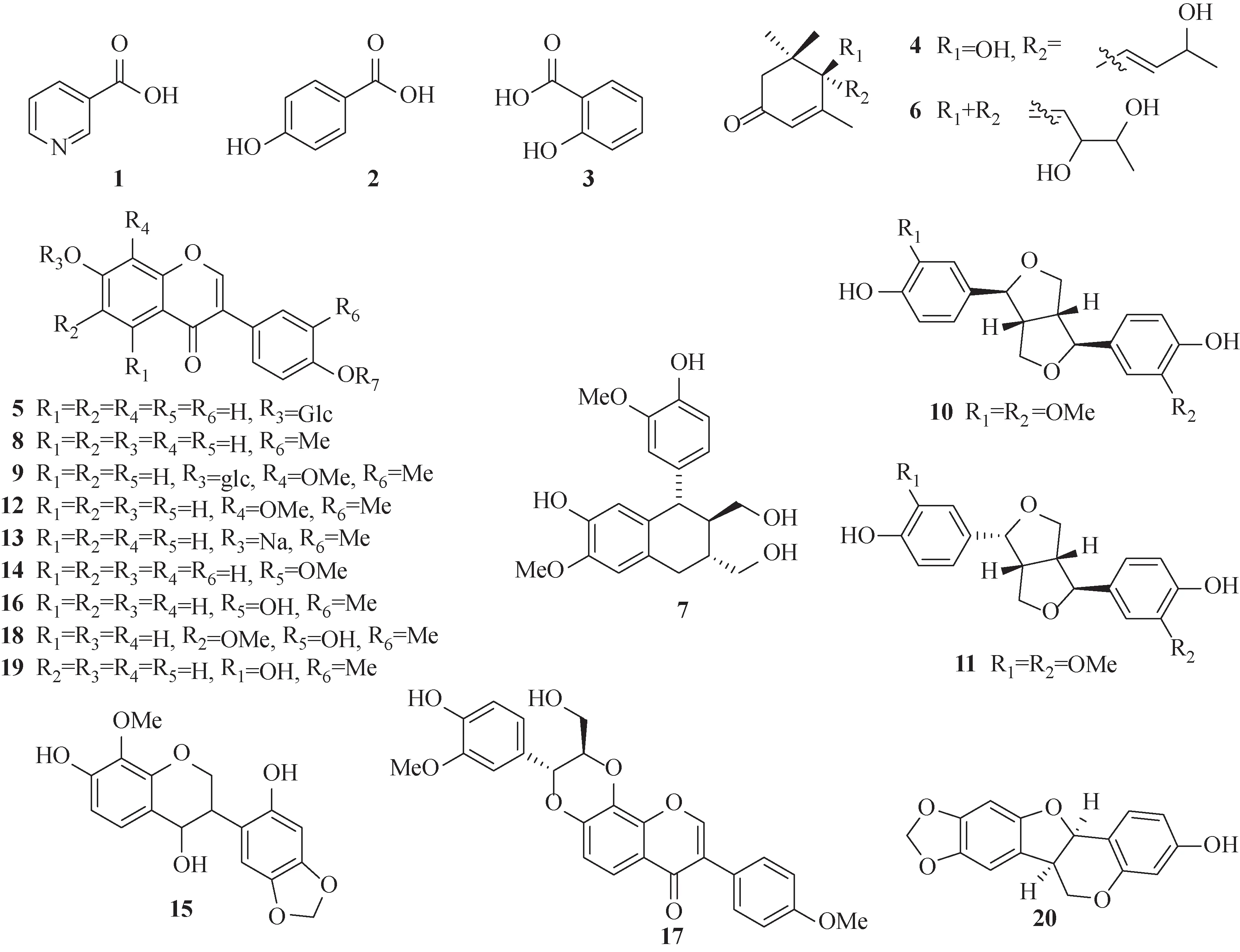
图1 鸡血藤中大鼠排泄研究对照品化合物1~20的化学结构
β-葡萄糖醛酸苷酶(β-glucuronidase,批号:G0251)、硫酸酯酶(sulfatase,批 号:S9626)、HPLC 级乙酸铵均购于美国Sigma-Aldrich 公司;三水合乙酸钠(北京偶合科技有限公司,批号:20191114);冰乙酸(北京化工厂);LC-MS 级甲醇和乙腈(美国Fisher 公司);内标卡马西平(北京百灵威科技有限公司,批号:LLA0P07,纯度:98%);实验用超纯水由Millipore Milli-Q 超纯水仪制备。
2 方法
2.1 样品的制备
称取干燥鸡血藤药材70 kg,加5 倍量水回流提取2次,每次2 h,合并提取液,减压浓缩,75 ℃真空干燥7 h,得鸡血藤干浸膏6 kg(收率为8.57%,相当于11.67 g·g-1干浸膏,以生药量计)。称取适量的冻干粉,用0.9% 氯化钠溶液配制得到0.35 g·mL-1提取物溶液,-4 ℃保存,备用。
2.2 对照品溶液配制
精密称取20个对照品适量,加入LC-MS级甲醇配制成质量浓度为1 mg·mL-1的储备液。精密称取内标化合物卡马西平适量,加入甲醇配制成质量浓度为0.5 mg·mL-1的储备液。精密量取各化合物的储备液适量,配制成含所有对照品和内标卡马西平的混合对照品溶液,逐级对倍稀释,得到一系列不同质量浓度的混合对照品溶液,4 ℃保存,备用。
2.3 动物分组与给药
12 只大鼠随机分成6 笼,每笼2 只,1 笼为对照组,另外5 笼为给药组。给药组大鼠按照30 g·kg-1剂量灌胃给药,随后立即置于代谢笼内,分别在给药后的2、4、6、8、12、24、48 h 收集每组的粪便和尿液,并记录质量或体积,置于4 ℃冰箱保存,备用。
2.4 排泄动力学样品的收集和处理
2.4.1 尿液样品的处理 称取适量三水合乙酸钠,加入适量冰醋酸和去离子水,配成0.2 mol·L-1的乙酸钠缓冲溶液(记为溶液A),称取适量β-葡萄糖醛酸苷酶和硫酸酯酶,分别用适量溶液A 溶解,配成终浓度为100 U·mL-1的溶液B 和溶液C。量取大鼠尿液3 份,每份1000 μL,分别向其中加入溶液A、B 和C 1000 μL,适当混匀,于37 ℃、60 r·min-1水浴振摇12 h,每个样品加入内标溶液10 μL,混匀后加入3 倍体积的甲醇-乙腈(2∶1)混合溶液,涡旋2 min,超声1 min,15 000×g离心10 min,转移上清液,残渣再加入3 倍体积的甲醇-乙腈混合液,重复操作1 次,合并上清液,在45 ℃、430×g条件下离心浓缩4 h 至干,残渣加入甲醇200 μL 复溶,涡旋1 min,超声溶解2 min,15 000×g离心10 min,取上清液4 μL进样分析。
2.4.2 粪便样品的处理 取大鼠粪便适当碾碎,每个样品称取200 mg 置于离心管中,加入内标溶液10 μL,再加入0.9%氯化钠溶液1000 μL 充分混匀,随后加入3 倍体积的甲醇-乙腈(2∶1)混合溶液,涡旋2 min,超声1 min,在15 000×g离心10 min,转移上清液,残渣再加入3 倍体积的甲醇-乙腈(2∶1)重复上述步骤1次,合并上清液,置离心浓缩仪中,在45 ℃、430×g条件下离心浓缩4 h 至干,残渣加入甲醇200 μL 复溶,涡旋混匀1 min,超声2 min,15 000×g离心10 min,取上清液4 μL 进样分析。
2.5 色谱与质谱条件
2.5.1 色谱条件 Kinetex®C18色谱柱(100 mm×2.1 mm,2.6 μm);柱温为30 ℃;流动相为0.5 mmol·L-1的乙酸铵水溶液(A)-乙腈(B),梯度洗脱(0~2.5 min,5.0%~7.5%B;2.5~3.0 min,7.5%~18.0%B;3.0~3.5 min,18.0%~26.0%B;3.5~10.0 min,26.0%~49.0%B;10.0~10.1 min,49.0%~52.0%B;10.1~11.2 min,52.0%~55.0%B;11.2~11.4 min,55.0%~95.0%B;11.4~14.4 min,95.0%B);自动进样器温度为4 ℃;流速为0.35 mL·min-1;进样量为4 μL。
2.5.2 质谱条件 ESI,扫描方式为多反应监测(MRM),分别对待测物进行离子对优化;雾化气体为氮气,雾化气流速为3 L·min-1,加热气流速为10 L·min-1,干燥气流速为10 L·min-1,接口加热器温度为300 ℃,脱溶剂管温度为250 ℃,接口电压为3.0 kV,检测器电压为1.80 kV。分析物和内标的检测参数:保留时间(tR)、先驱离子种、先驱离子、碎片离子、停留时间(DT)、四极杆1预杆偏压(Q1)、碰撞能量(CE)和Q3参考文献[8]。
2.5.3 方法学考察 根据美国食品药品监督管理局《Guidance for Industry Bioanalytical Method Validation》指导意见进行UFLC-MS/MS 定量的方法学考察[11]。
2.5.3.1 专属性 分别取空白尿液和粪便样品、混合对照品溶液 [质量控制(QC)样品]、尿液和粪便的含药样品,按照2.4项下方法处理,按照2.5项下方法进样分析,考察样品的内源性成分和空白基质是否会干扰鸡血藤分析物和内标成分的定性和定量。
2.5.3.2 标准曲线、检测下限(LLOD)和定量下限(LLOQ)取空白尿液和粪便,分别加入对倍稀释的各化合物混合对照品溶液适量和内标溶液10 μL,按照2.4 项下方法对尿液和粪便分别进行处理,制作各分析物的标准曲线。每个分析物的标准曲线至少设置6个质量浓度点,按照2.5项下方法测定各分析物的峰面积,以质量浓度为横坐标(X),以峰面积与内标峰面积比值为纵坐标(Y)绘制标准曲线,得到线性回归方程。将线性方程的最低质量浓度点继续逐级对倍稀释,分别将信噪比(S/N)为3 ∶1 和10∶1 对应的质量浓度定为LLOD和LLOQ。每个样品平行测定3次。
2.5.3.3 准确度和精密度 用QC 样品分别考察所建方法的日内、日间精密度和准确度。分别取空白尿液和粪便,定量加入各分析物的混合对照品储备液和10 μL 内标溶液,配制成高、中、低和LLOQ 4个质量浓度的QC 样品溶液,每个质量浓度平行制备6 份,按照尿液和粪便处理项下方法处理,按照2.5 项下方法检测分析。用所建标准曲线计算各个样品的质量浓度,用6 份样品的RSD为指标评价方法的精密度,用计算质量浓度和实际质量浓度的比值为指标评价方法的准确度。各样品1 d内连续测定3 次,计算日内精密度和准确度;连续测定3 d,计算日间精密度和准确度。精密度的RSD 不超过15%(LLOQ 的RSD 不超过20%)、准确度为100%±15%(LLOQ的范围为100%±20%)则方法可行。
2.5.3.4 稳定性 用QC 样品分别考察储备液稳定性、常温稳定性、循环冻融稳定性和长期稳定性,以验证样品在制备、处理和分析过程中采取的每步操作及使用的储存条件不会影响分析物的质量浓度。取空白尿液和粪便,分别向其中加入各分析物的混合对照品储备液适量和内标溶液10 μL,配制成高、中、低3个质量浓度的QC 样品溶液,每个样品平行制备3 份,按2.4 项下方法处理,按2.5 项下方法检测分析,考察样品的储存稳定性;将每个质量浓度的QC样品在室温条件下密闭放置24 h,按照上述方法处理、进样分析后测定质量浓度,考察常温稳定性;每个质量浓度的QC 样品在-20 ℃和室温环境下反复冻融3次(-20 ℃存放时间为12 h),处理后进样分析,考察循环冻融稳定性;QC样品在-20 ℃条件下冻存30 d,处理后进样分析,测定质量浓度,考察长期稳定性。
2.5.3.5 回收率和基质效应 用QC 样品考察回收率和基质效应,以验证尿液和粪便空白基质中的某些干扰物质或未被识别的成分是否会引起分析物响应的变化。取各分析物的混合对照品溶液适量,配成高、中、低3个质量浓度的QC 样品溶液,每个质量浓度平行6份,加入内标溶液10 μL、乙酸钠缓冲溶 液1000 μL 和甲醇-乙腈(2∶1)混合溶剂4000 μL,按照2.4.1 项下方法进行处理,按照2.5项下方法测定各分析物和内标的峰面积,标记为A;取各分析物的混合对照品溶液适量,配成高、中、低3个质量浓度的QC 样品溶液,每个质量浓度平行6 份,加入内标溶液10 μL、0.9% 氯化钠溶液1000 μL 和甲醇-乙腈(2∶1)混合溶剂3000 μL,按照2.4.2项下方法进行处理,按照2.5项下方法测定各分析物和内标的峰面积,标记为B;取空白尿液和粪便,分别加入同A 和B 等量的各分析物的混合对照品储备液,配制成高、中、低3 个质量浓度的QC 样品溶液,每个质量浓度平行6 份,按照2.4项下方法处理,按照2.5 项下方法测定各分析物及内标的峰面积,将尿液和粪便的回收率考察样品分别标记为C 和D;另取空白尿液和粪便适量,分别加入同2.4 项下方法各自等量的乙酸钠缓冲溶液、0.9%氯化钠溶液和甲醇-乙腈(2∶1)混合溶剂,涡旋2 min、超声1 min,在15 000×g条件下离心10 min,转移上清液,残渣再加入甲醇-乙腈(2∶1)混合溶剂重复1次,合并上清液,加入同A和B 等量的化合物储备液和内标溶液10 μL 浓缩至干,其余步骤按照2.4 项下方法继续处理,按照2.5项下方法测定分析物和内标的峰面积,将尿液和粪便的基质考察样品分别标记为E 和F。以C/A 和D/B的比值分别评价尿液和粪便样品的回收率,用E/A和F/B 的比值分别作为尿液和粪便样品基质效应的评价指标。
2.6 数据分析
用Microsoft Excel 2018 根据相关化合物的峰面积计算药物的质量浓度,将数据导入GraphPad Prism 7.0 绘制累积排泄率曲线图,相关数据均用(±s)表示。
3 结果
3.1 方法学考察
3.1.1 专属性 从大鼠的尿液和粪便空白样品和灌胃鸡血藤水提取物后的含药样品的MRM 总离子流图可以看出(图2、图3),将尿液样品的离子流图放大相应的倍数后,含药药品的色谱峰在相同保留时间的空白样品上几乎没有对应其他杂质峰存在,说明尿液样品在处理和分析过程中没有其他内源性或干扰性物质影响。粪便样品的总离子流图色谱峰明显,在相同的保留时间内,仅有个别峰在粪便的空白样品中可见微弱的信号,但对样品的定量分析不会造成明显的影响,几乎可以忽略不计。总体而言,样品的制备过程符合定量分析要求,专属性可靠。

图2 大鼠尿液中20个鸡血藤分析物的总离子流图

图3 大鼠粪便中20个鸡血藤分析物的总离子流图
3.1.2 标准曲线、LLOD 和LLOQ 从表1、表2可知,大鼠尿液和粪便中各个分析物标准曲线的r分别为0.999 1~0.999 8 和0.998 5~0.999 9,说明线性范围良好,可用于样品含量的计算。
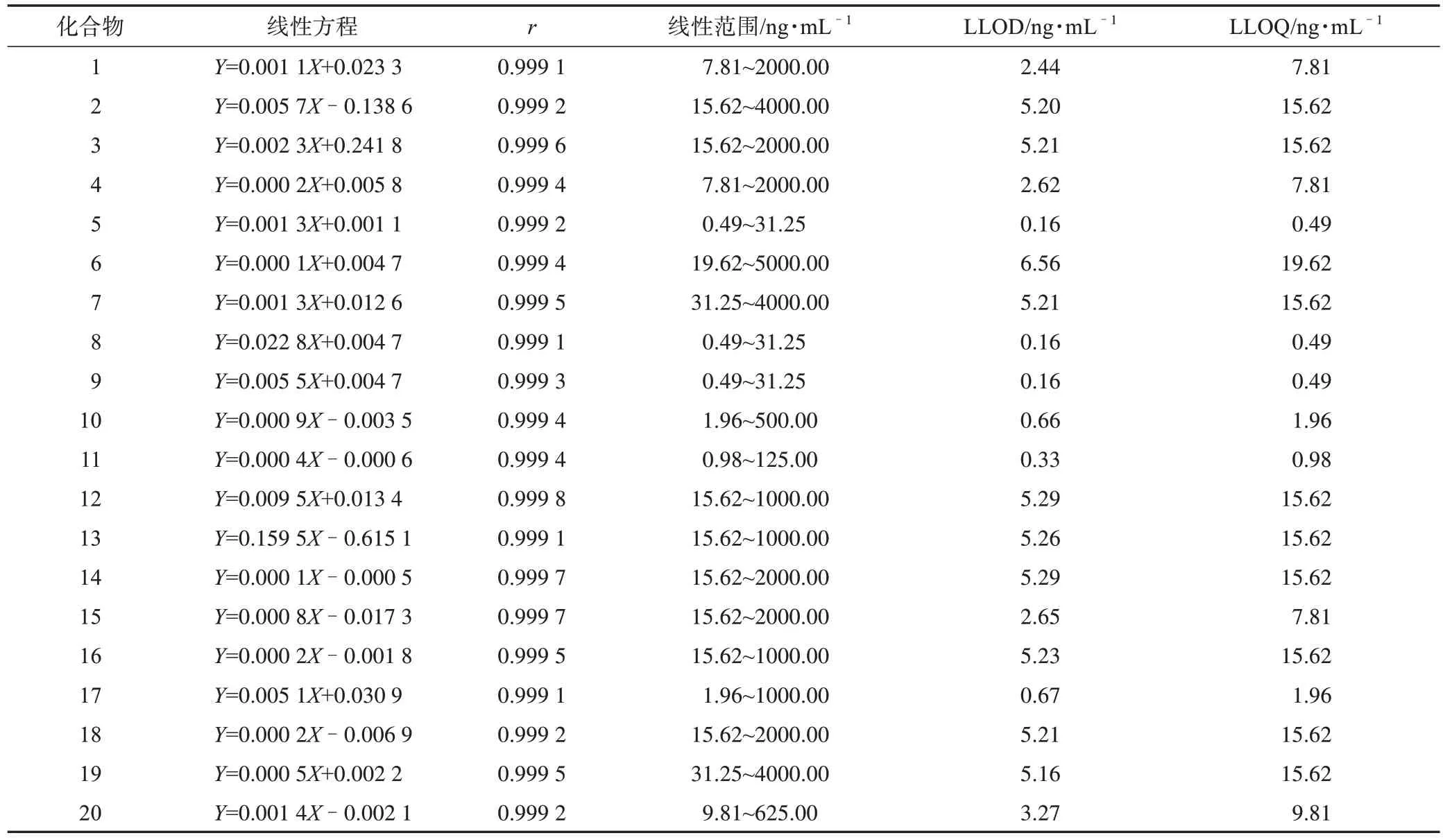
表1 大鼠尿液中20个分析物的标准曲线、LLOD和LLOQ

表2 大鼠粪便中20个分析物的标准曲线、LLOD和LLOQ
3.1.3 准确度和精密度 表3、表4 显示,大鼠尿液和粪便中鸡血藤QC 样品的日内、日间的准确度和精密度,及其RSD 均在定量要求的范围内,说明二者均符合要求。

表3 大鼠尿液中所检测分析物的准确度和精密度 %

表4 大鼠粪便中所检测分析物的准确度和精密度 %
3.1.4 稳定性 将尿液和粪便中的样品在不同条件下放置,考察样品的稳定性,结果见表5、表6。
表5 大鼠尿液中所测分析物在不同条件下的稳定性(±s,n=3) %
续表5
表6 大鼠粪便中所测分析物在不同条件下的稳定性(±s,n=3) %

表6 大鼠粪便中所测分析物在不同条件下的稳定性(±s,n=3) %
续表6
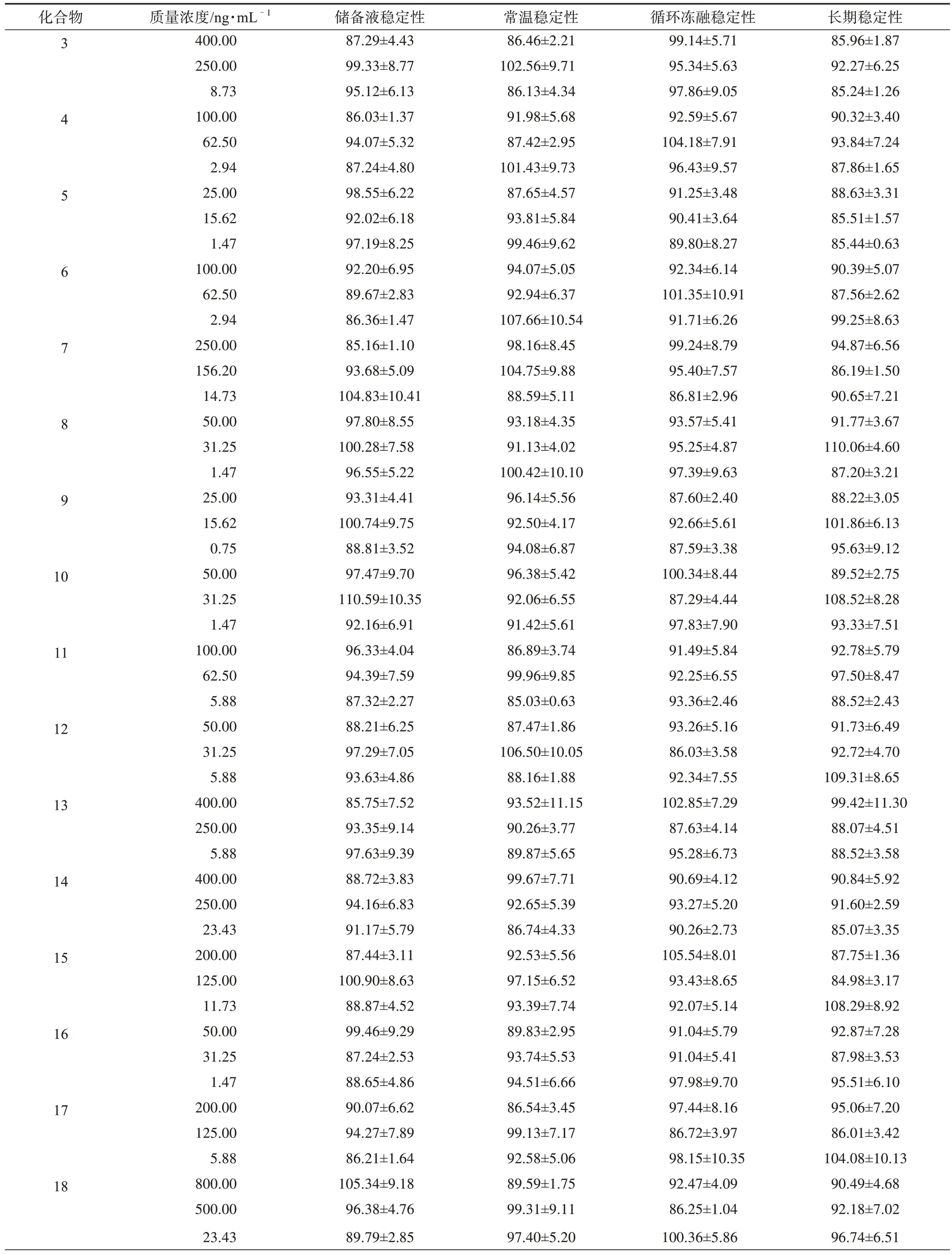
表6 大鼠粪便中所测分析物在不同条件下的稳定性(±s,n=3) %
续表6
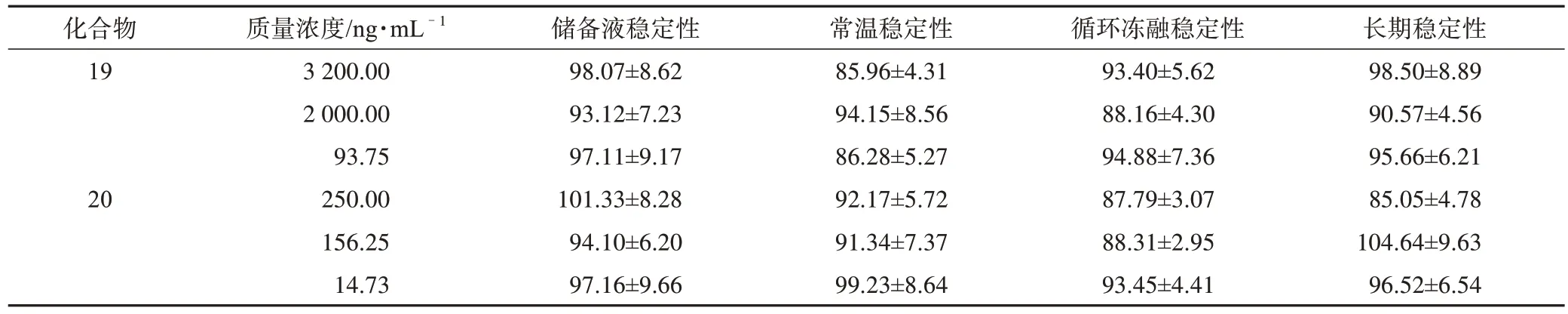
表6 大鼠粪便中所测分析物在不同条件下的稳定性(±s,n=3) %
根据样品测得的数据可知,尿液和粪便样品中各分析物能够在不同的条件下保持较好的稳定性,几乎不受储存温度、时间和处理步骤等因素的影响。
3.1.5 回收率和基质效应 根据表7、表8 中分析物的回收率和基质效应结果可知,尿液和粪便中的各个分析物回收率合格,基质效应不明显,所建方法适合整体生物样品的定量。
表7 大鼠尿液中所测分析物的回收率和基质效应(±s,n=6) %

表7 大鼠尿液中所测分析物的回收率和基质效应(±s,n=6) %
续表7
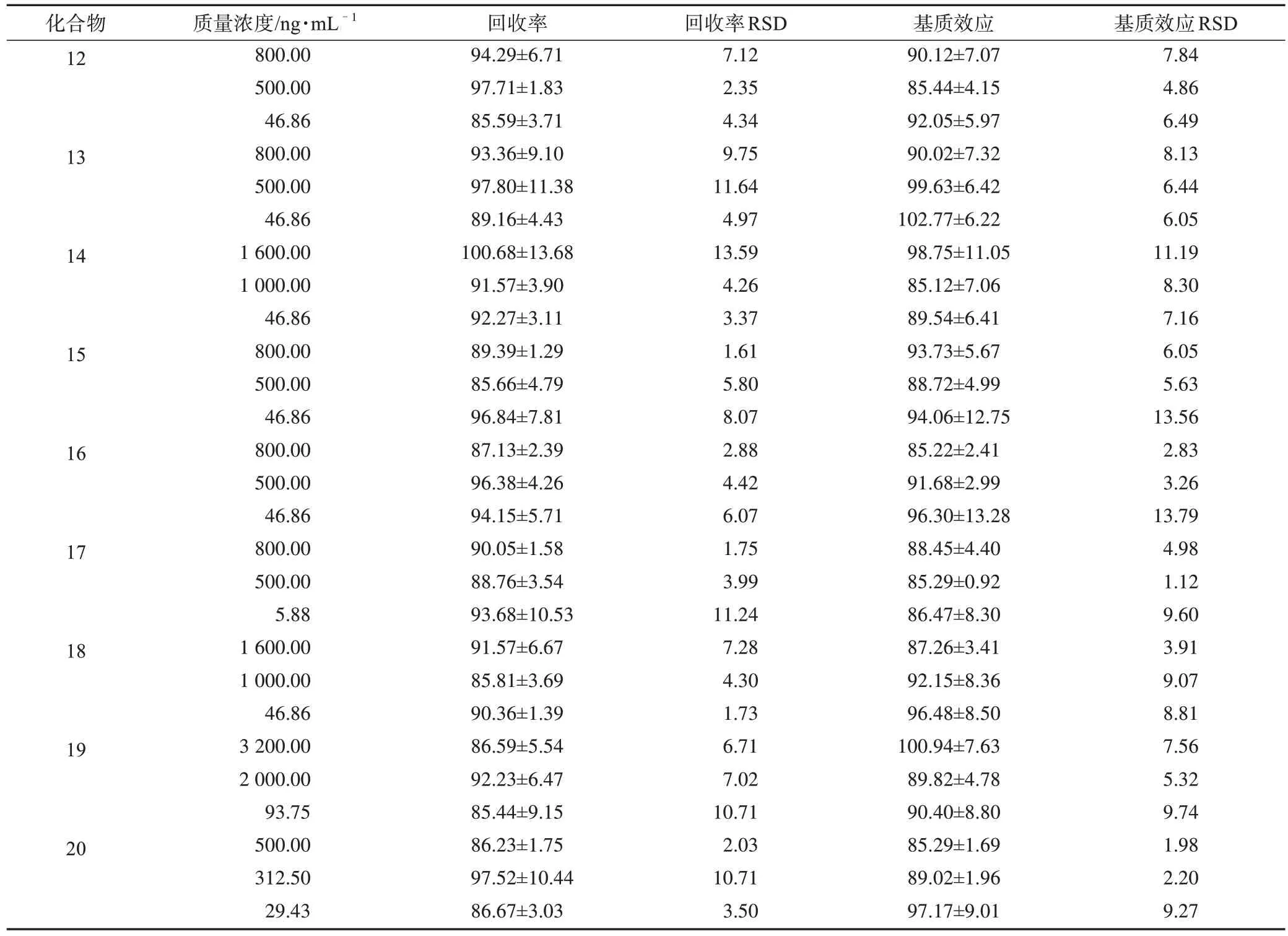
表7 大鼠尿液中所测分析物的回收率和基质效应(±s,n=6) %
表8 大鼠粪便中所测分析物的回收率和基质效应(±s,n=6) %

表8 大鼠粪便中所测分析物的回收率和基质效应(±s,n=6) %
续表8
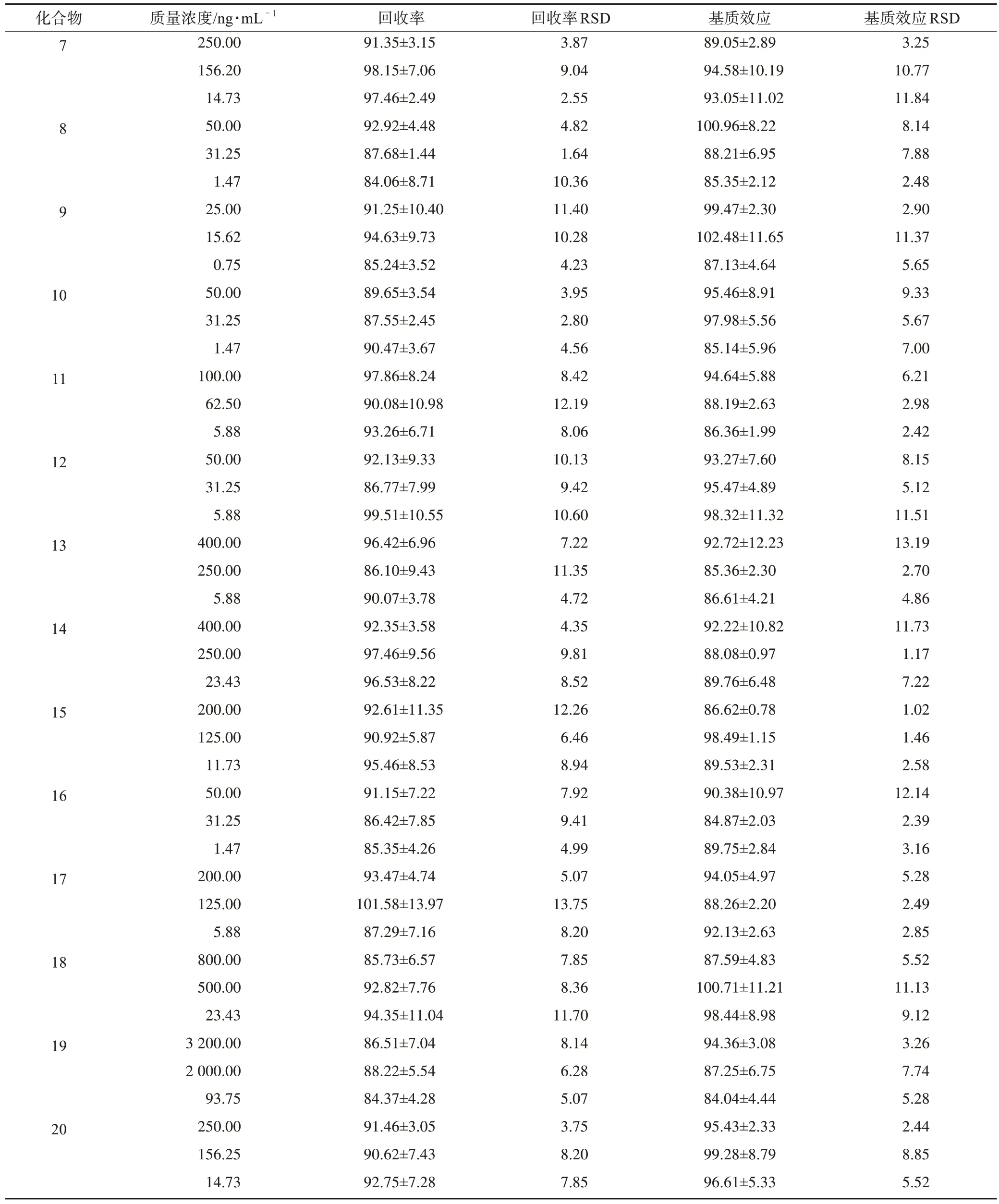
表8 大鼠粪便中所测分析物的回收率和基质效应(±s,n=6) %
3.1.6 原型化合物在尿液中的排泄 大鼠灌胃鸡血藤水提取物后,从尿液中检测到的20个原型化合物的累积排泄率见图4。在48 h内,对羟基苯甲酸(2)和奥刀拉亭(18)的累积排泄率最高,达到50%及以上;水杨酸(3)、6,9-二羟基大柱香波龙-4,7-二烯-3-酮(4)、8,9-二羟基大柱香波龙-4,6-二烯-3-酮(6)、3′-甲氧基大豆素(14)、鸡血藤黄醇A(15)和毛蕊异黄酮(16)的累积排泄率在30%左右,8-甲雷杜辛(12)和艳紫铆素A(17)的累积排泄率在15%左右;芒柄花素(8)、4′,8-二甲氧基-7-O-β-D-吡喃葡萄糖基异黄酮(9)和 (6aR,11aR)-高丽槐素(20)累积排泄率最少,在1%以下,其余化合物的排泄率为2%~10%。
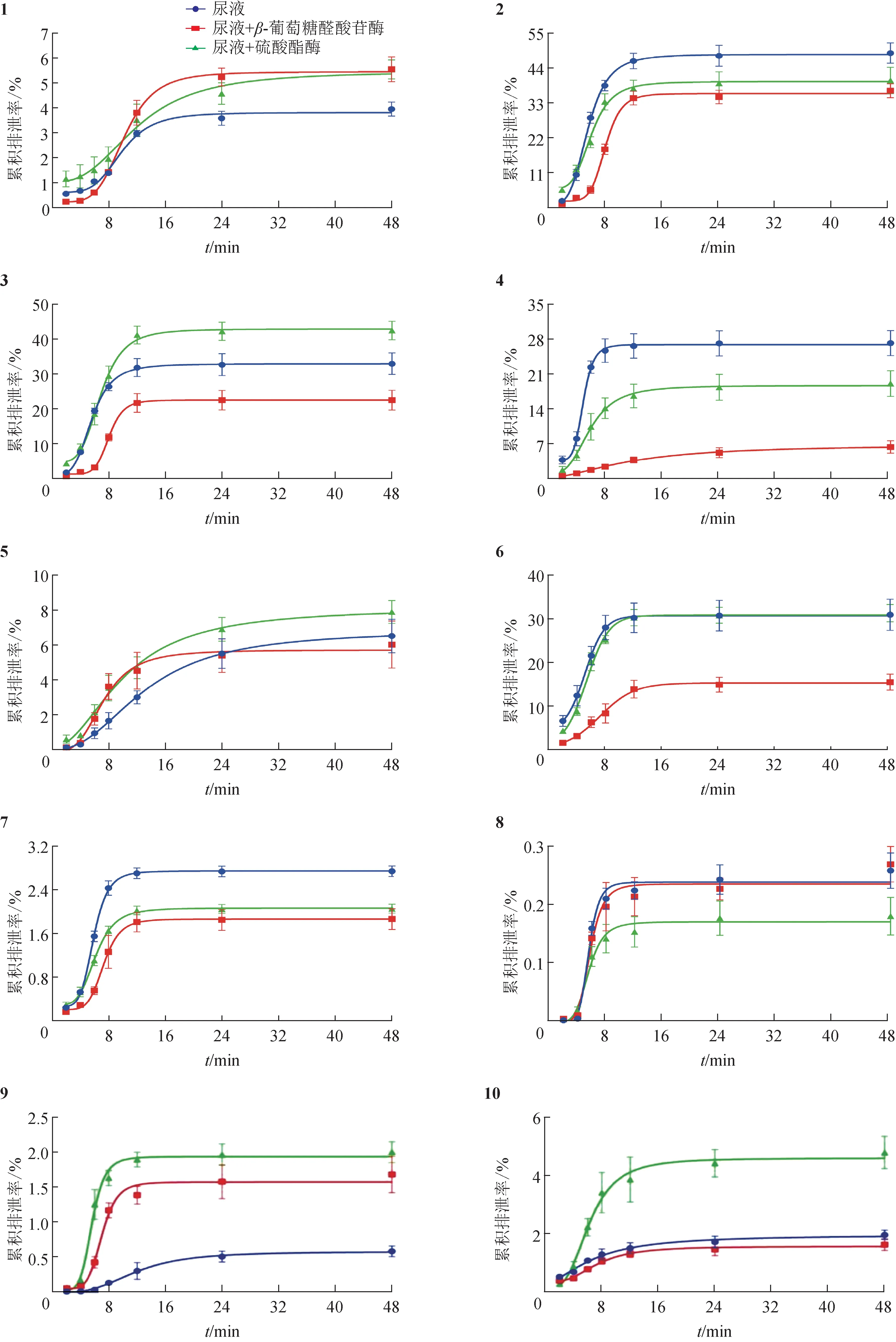
图4 大鼠尿液中20个鸡血藤分析物的累积排泄率(±s,n=3)
尿液样品经β-葡萄糖醛酸苷酶进一步处理后,化合物1、9、11和20的累积排泄率明显增加,推测这些化合物在体内代谢过程中发生了葡萄糖醛酸结合反应,生成相应水溶性更高的β-葡萄糖醛酸苷随尿液排出体外,经酶水解后原型药物在体外的排泄率增加。化合物9 和11 经酶处理后原型化合物的累积排泄率增加1倍及以上,说明这2个化合物在体内的结合产物量比较高。加入β-葡萄糖醛酸苷酶后,化合物2~4、6、7 和17 的尿液累积排泄率出现不同程度的降低,推测这些化合物可能在加入酶之后在尿液中其他酶或生物活性物质的作用下,原型化合物发生了不同形式的生物转化,使得原型化合物的累积排泄率出现降低的情况。而化合物5、10、12~16、18 和19 的累积排泄率几乎不受β-葡萄糖醛酸苷酶的影响,说明这些化合物在代谢过程中很少或没有发生相应的结合反应。
尿液样品经硫酸酯酶处理后,化合物1、3、5、9~11、16、17、19 和20 的累积排泄率出现不同程度的增加,说明这些化合物在体内代谢的过程中出现硫酸酯结合反应,生成相应的硫酸酯随尿液排出,在体外经硫酸酯酶作用后,硫酸酯键发生断裂释放出原型化合物,表现出排泄率增加。化合物1、9、10 和20 经硫酸酯酶作用后累积排泄率增加了1 倍及以上,说明这些化合物硫酸酯结合反应的产物量比较高。同时,在尿液中加入酶之后,化合物2、4、7 和8 累积排泄率降低,推测这4 个化合物可能在尿液中经酶或其他尿液成分的作用出现生物转化现象,具体情况有待进一步研究。化合物5、12~16、18 和19 在加入硫酸酯酶后的累积排泄率没有发生明显变化,说明这些化合物在代谢的过程中几乎不涉及硫酸酯结合反应。
总之,大鼠灌胃鸡血藤水提取物后,所检测到的20 个化合物几乎都是从肾脏中随尿液排出体外,从排泄速率来看,给药6~8 h排泄速率最高,之后随时间的延长排泄速率明显降低,12 h 之后排泄速率几乎不再增加。大多数化合物以原型药物的形式排出,部分化合物会发生葡萄糖醛酸或硫酸酯结合反应,化合物1、9、11 和20 可以同时发生2 种形式的结合反应,生成水溶性更强的结合产物随尿液排出体外。
3.1.7 原型化合物在粪便中的排泄 给大鼠灌胃鸡血藤水提取物后,在粪便中检测到的20 个原型化合物的累积排泄率如图5 所示。水杨酸(3)、3′-甲氧基大豆素(14)和毛蕊异黄酮(15)的平均累积排泄率最高,为8%~12%(图5C);烟酸(1)、8-甲雷杜辛(13)和奥刀拉亭(18)累积排泄率次之,为5%~7%(图5A);6,9-二羟基大柱香波龙-4,7-二烯-3-酮(4)、大豆苷(5)、芒柄花素(6)、芒柄花苷(9)和4′,8-二甲氧基-7-O-β-D-吡喃葡萄糖基异黄酮(10)的累积排泄率在1%以下(图5D、图5E);化合物5 和9 累积排泄率低于0.1%,其他化合物为1%~3%。

图5 大鼠粪便中20个鸡血藤分析物的累积排泄率(±s,n=3)
从排泄速率来看,几乎所有的化合物在给药6~8 h 累积排泄速率变化最快,多数化合物在给药12 h后排泄速率不再增加,累积排泄率逐渐达到稳定状态。而化合物14、15和20在给药48 h依旧保持累积排泄率增加的趋势。
以上结果表明,在粪便中检测到的原型化合物的变化趋势和在尿液中的变化趋势几乎一致,但粪便中的平均累积排泄率明显小于尿液中相应化合物的平均累积排泄率,说明鸡血藤口服给药后的大多数化合物的排泄途径为肾排泄,此结果也与化合物快速广泛地分布于各个组织脏器中的结果推测一致。
4 小结与讨论
本研究在大鼠灌胃鸡血藤水提取物后的尿液和粪便中分别检测到了鸡血藤中20 个原型化合物,按照原型成分在鸡血藤生药中的含量[9],折算成灌胃给药的剂量,在给药48 h,尿液中化合物的累积排泄率为0.13%~60.09%,粪便中化合物的累积排泄率为0.03%~11.38%,各化合物在尿液中的累积排泄率较高,说明大多数化合物的主要排泄途径为肾排泄。
在经尿液排泄的过程中,部分化合物在体内会经过葡萄糖醛酸苷或硫酸酯共价结合的形式,生成更易溶于水的结合产物排出体外。化合物烟酸(1)、4′,8-二甲氧基-7-O-β-D-吡喃葡萄糖基异黄酮(9)、(+)-表松脂酚(11)和 (6aR,11aR)-高丽槐素(20)能同时发生2 种形式的结合反应。这些药物形成葡萄糖醛酸苷之后,水溶性增加,容易经肾和胆汁排泄,经胆汁排泄的部分进入肠之后,又会经肠内细菌的作用转化为原型药物或代谢产物的形式被肠道重吸收形成肠肝循环。根据这4 种化合物的给药剂量,结合化合物的血浆药物代谢动力学,以及在肠和肝脏中的组织分布情况(另文报道)可知,这4 个化合物存在不同程度的肠肝循环。烟酸(1)在粪便中的累积排泄率为6.5%,4′,8-二甲氧基-7-O-β-D-吡喃葡萄糖基异黄酮(9)、(+)-表松脂酚(11)和(6aR,11aR)-高丽槐素(20)分别为2.1%、2.5%和2.8%,与在粪便中所检测到的其他化合物相比,累积排泄率处于中等水平,说明这些化合物大部分被吸收入血后进入组织,发生葡萄糖醛酸结合反应后经胆汁排泄进入肠,经肠内菌的生物转化或代谢,还原为原型化合物被重吸收形成肠肝循环,未被重吸收的部分原型化合物与灌胃给药时未被吸收的部分则随粪便排出体外。
8-甲雷杜辛(12)、3′-甲氧基大豆素(14)、鸡血藤黄醇A(15)和奥刀拉亭(18)在尿液中几乎不受葡萄糖醛酸苷酶和硫酸酯酶的影响,主要以原型化合物的形式经肾排泄,在粪便中与其他化合物相比也有较高的累积排泄率。而大豆苷(5)、芒柄花素(8)、(+)-松脂酚(10)在给药剂量比较高的情况下在尿液和粪便中的累积排泄率均比较低,结合这些化合物较低的血药浓度和较低的组织分布量综合分析,可能是这些化合物进入胃肠道后被肠内菌代谢或发生其他生物转化,以代谢产物的形式吸收入血在组织器官中发挥作用。
值得注意的是,芒柄花素钠在给药剂量明显低于芒柄花素的情况下尿液累积排泄率明显高于后者,加之在粪便中没有检测到芒柄花素钠的存在,说明其更容易被吸收入血;结合两者的组织分布情况,芒柄花素钠的组织分布更快速广泛,同一时间点的含量也比芒柄花素的含量更高,说明芒柄花素钠相比于芒柄花素更容易随血液进入机体各个组织器官,以原型药物发挥作用后经肾排泄。在人源肠Caco-2单层模型吸收实验[7]中,两者均属于易于被肠道吸收的化合物,由于芒柄花素钠的给药剂量偏低,又容易吸收入血,在药代动力学-时间变化过程中没有出现表示肠肝循环的双峰现象,所以在粪便中不容易检测到原型化合物。芒柄花素可能在整体给药的过程中,多种化合物相互作用限制了该化合物的吸收情况,以及口服进入胃肠道之后被肠内菌代谢,致使芒柄花素的组织分布量下降,累积排泄率降低。
芒柄花苷是芒柄花素结构的7-位碳连接了1 个葡萄糖基形成的苷类,仅在粪便中检测到了该化合物原型化合物,累积排泄率仅为0.02%,虽然给药剂量比较高,由于血药浓度比较低,仅在胃、小肠、肝和脑4 个组织中有分布,分布量也不高(另文发表),说明该化合物不容易被吸收入血,Caco-2单层模型吸收实验也证实了这一现象;经灌胃给药后该原型化合物被肠内菌代谢为其他代谢产物进入血液发挥作用,致使其分布量和累积排泄率均比较低。
本研究运用UFLC-MS/MS,对鸡血藤水提取物灌胃给药大鼠之后的20 个化合物进行了定性、定量检测分析,所检测的血浆中25 化合物有20 个在12~24 h 基本消除,个别化合物如对羟基苯甲酸、鹰嘴豆芽素A 的血药浓度能持续到48 h。部分化合物如原儿茶酸、对羟基苯甲酸、奥刀拉亭、鹰嘴豆芽素A 和(6aR,11aR)-高丽槐素等存在双峰现象[8],提示这些化合物的吸收过程中可能存在肠肝循环,并且具有较长的半衰期和体内生物利用度。在大鼠10 个组织检测到的21 个分析物(另文报道)可知,大部分化合物能够广泛分布于各个组织,分布量最多的组织为胃、小肠、肝、肾和肺,部分化合物还能通过血脑或血睾屏障进入脑和睾丸,在给药0.5~1.0 h左右达峰后浓度逐渐下降。各个组织器官中的化合物发挥作用后随血液循环到达排泄器官,以原型药物或代谢产物的形式主要经肾脏随尿液排出,有些化合物如烟酸、4′,8-二甲氧基-7-O-β-D-吡喃葡萄糖基异黄酮等在代谢的过程中还会发生葡萄糖醛酸基或硫酸基结合,以更易溶于水的结合产物形式排出体外;部分化合物,以及存在肠肝循环和未被吸收的化合物会经粪便排泄。总之,本研究对鸡血藤的体内过程进行了研究与分析,在此基础上将进一步展开相关的药效学研究,探讨药物到达相关的组织器官后发挥的药效及药物和靶器官之间的应答机制,为深入研究鸡血藤的药理药效和毒理提供了参考。
[利益冲突]本文不存在任何利益冲突。

