帕立骨化醇抑制氧化应激减轻小鼠肝细胞紧密连接受损
张威威,谢 婧,李丽华
1.沈阳医学院 病理生理教研室,辽宁 沈阳 110034;2.台州学院 医学院 基础教研室,浙江 台州 318000
氧化应激是酒精性肝病、非酒精性肝病、纤维增殖性肝病[1]、胆汁淤积性肝病[2]等多种肝脏疾病中肝损伤的病理生理基础,活性氧(reactive oxygen species,ROS)主要通过细胞色素酶P450在线粒体及肝细胞的内质网中产生[1]。研究表明,过度暴露于氧化应激会导致血液-胆道屏障功能障碍[3],并通过破坏肝细胞之间的紧密连接使得胆汁淤积在胆小管内,引发严重的胆汁淤积性肝损伤[4]。各种ROS引起的氧化应激,是导致不同组织中上皮和内皮屏障功能破坏的主要因素之一[5]。此外,研究发现在胆汁淤积性肝病动物模型中,肝细胞紧密连接的结构和功能会发生改变[6]。因此,抑制氧化应激来稳定肝细胞紧密连接可能是治疗胆汁淤积性肝损伤的有效手段。
帕立骨化醇(paricalcitol,Pal)是一种维生素D类似物,在肝脏代谢成活性形式的维生素D,是一种选择性维生素D受体(vitamin D receptor,VDR)的激动剂。维生素D受体在人体中起到多种重要的生理功能,包括维持骨骼健康、调节免疫系统和抗炎作用等。研究表明,VDR缺乏会损害胆管完整性,从而加剧胆汁淤积性肝损伤[7]。此外,帕立骨化醇可通过减少氧化应激和增加肝脏中的抗氧化物质来减轻肝脏损伤,也可能通过影响肝脏细胞的功能来降低损伤[7-8]。但帕立骨化醇是否可以调控肝细胞紧密连接及其机制过程,皆尚不清楚。本研究通过胆管结扎建立胆汁淤积小鼠模型及用H2O2诱导HepG2细胞构建细胞氧化应激损伤模型探讨帕立骨化醇对肝细胞紧密连接的作用,阐明其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 动物:SPF级C57BL/6小鼠45只,8~10周龄,体质量为(25±2)g,由常州卡文斯试验动物公司提供,动物生产许可证号:SCXK(苏)2021-0013。
1.1.2 细胞系:人肝癌细胞系HepG2(上海赛百慷生物有限公司)。
1.1.3 试剂:丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)(南京建成生物工程研究所);总胆汁酸(total bile acid,TBA)、总胆红素(total bilirubin,TBIL)剂盒(华美生物工程研究所);8-氧代鸟嘌呤DNA糖基化酶1(8-oxoguanine DNA-glycosylase 1,OGG1)抗体、尼克酰胺腺嘌呤二核苷酸磷酸氧化酶1(NOX1)抗体、ZO-1和occludin抗体、β-肌动蛋白抗体、ERK抗体、p-ERK抗体、HRP标记羊抗兔二抗和HRP标记羊抗鼠二抗(Proteintech公司);NF-κB、p65(Abcam公司);荧光二抗(Invitrogen公司);二氢乙啶(DHE)试剂盒(Beyotime公司);帕立骨化醇(particalcitol,Pal)(Sigma-Aldrich公司)。
1.2 方法
1.2.1 实验动物模型制备和分组:将45只8~10周雄性C57BL/6小鼠随机分为对照组(control)、模型组(胆管结扎,bile duct ligation,BDL)、治疗组(BDL+Pal),每组15只。对照组小鼠不行结扎手术,仅绕胆总管穿线。模型组、治疗组小鼠行胆总管双重结扎手术并切断。治疗组小鼠胆总管结扎后腹腔注射200 ng/kg帕立骨化醇,间隔1 d给药,持续5 d;模型组注射等量盐溶液。末次给药24 h后,各组小鼠经眼球取血,断髓,取肝脏。
1.2.2 检测各组小鼠肝损伤指标:各组小鼠眼眶取血,静置1 h后,2 000 r/min、4 ℃离心20 min。取血清后用试剂盒对各组小鼠血清ALT、AST活性进行检测,单位为U/L。酶联免疫吸附(ELISA)试剂盒测定血清和肝脏中的TBA浓度和TBIL水平,单位为μmol/L。
1.2.3 HE染色检测各组小鼠肝组织病理形态表现:取4%多聚甲醛固定后的肝组织,石蜡包埋、切片后进行HE染色。染色后在光学显微镜下可观察各组小鼠肝组织病理形态表现。
1.2.4 抗氧化状态的生化分析:使用MDA试剂盒测量肝组织丙二醛(malonic dialdehyde,MDA)水平,使用SOD试剂盒测量超氧化物歧化酶(superoxide dismutase,SOD)水平。将肝组织(0.1 g)加入到0.9 mL 0.9%氯化钠溶液中,制成10%均质肝组织混合物。收集肝组织匀浆的上清液。然后通过酶标仪在562 nm处测定吸光度,以确定总蛋白质浓度。对于MDA水平测量,将100 μL 1%总蛋白质上清液与2 mL工作缓冲液混合,并在40 ℃下孵育95 min。将反应混合物用流水冷却后进行4 000 rpm离心10 min。在532 nm处对上清液的吸光度进行检测。空白对照为100%乙醇,标准对照为10 nmol/L对照品溶液。对于SOD,将20 μL 10%总蛋白质与220 μL工作溶液混合,并在37 ℃下孵育20 min,而后在450 nm处记录吸光度值。
1.2.5 细胞培养与处理:HepG2细胞放置在DMEM培养基中,并在37 ℃、5% CO2条件下传代培养。取对数生长期的细胞用于后续实验。为了诱导氧化应激,将细胞置于孔板后,H2O2(400 μmol/L)处理24 h,治疗组为H2O2(400 μmol/L)与Pal(20 nmol/L)共孵育24 h。收集细胞置于-80 ℃用于后续蛋白质印迹分析,细胞爬片用于免疫染色。
1.2.6 细胞内活性氧的测定:通过DHE试剂盒对ROS水平加以检测。DHE荧光染色液滴加在细胞上并置于37 ℃培养箱中孵育30 min。ROS水平表现为在荧光显微镜下观察的红色荧光强度。显微镜下拍照后进行统计分析。
1.2.7 蛋白质印迹分析:将各组肝组织超声裂解后取上清,进行BCA定量。30 μg蛋白质行SDS-PAGE后,90 V、95 min条件下进行转膜,然后使用2% BSA于37 ℃烘箱封闭2 h。一抗4 ℃孵育过夜,TBST洗膜3次,每次15 min。二抗室温孵育2 h,TBST洗膜后ECL显影曝光。使用Image J软件对目的蛋白质条带进行分析,计算目的蛋白质表达水平。目的蛋白质表达水平=目的蛋白质条带灰度值/β-actin蛋白条带灰度值。
1.3 统计学分析

2 结果
2.1 Pal减轻小鼠胆汁淤积性肝损伤
与对照组比较,模型组小鼠血清中AST和ALT水平显著升高(P<0.05或P<0.01),提示BDL小鼠肝损伤程度增加;TBA和TBIL水平显著升高(P<0.05),提示BDL小鼠胆汁淤积造模成功。与模型组比较,Pal治疗组小鼠血清中AST和ALT活性、TBA和TBIL水平显著降低(P<0.05),提示Pal减轻BDL小鼠的胆汁淤积性肝损伤(图1)。

BDL.bile duct ligation;Pal.paricalcitol;*P<0.05,**P<0.01 compared with control group;#P<0.05 compared with BDL group.
2.2 Pal改善胆汁淤积小鼠肝组织的病理形态结构
对照组小鼠肝细胞形态完整,未见炎性细胞浸润及肝细胞坏死。模型组肝细胞坏死区面积较大,且炎性细胞浸润程度严重。而Pal治疗组小鼠显著改善小鼠胆汁淤积性肝损伤,较模型组相比,可见炎性细胞浸润减轻,肝细胞坏死区面积减少(图2)。
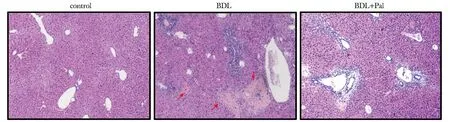
BDL.bile duct ligation;Pal.paricalcitol;The red arrow points to the necrotic area;Green arrows point to areas of inflammatory cell infiltration.
2.3 Pal降低胆汁淤积小鼠肝脏的氧化应激水平
与对照组比较,模型组小鼠肝脏中MDA活性及OGG1、NOX1的蛋白表达水平显著升高(P<0.05或P<0.01),SOD活性显著降低(P<0.01),表明模型组小鼠肝脏氧化应激水平显著提高。而Pal治疗可显著减轻小鼠肝脏氧化应激水平,MDA、OGG1、NOX1水平较模型组均显著降低(P<0.05或P<0.01),而SOD活性显著升高(P<0.05)(图3)。
2.4 Pal降低H2O2处理的HepG2细胞中的ROS水平
与对照组比较,模型组HepG2细胞中DHE染色阳性区增多,提示氧化应激水平升高。与模型组相比,治疗组HepG2细胞中阳性区显著减少(P<0.05),提示Pal可降低氧化应激水平(图4)。
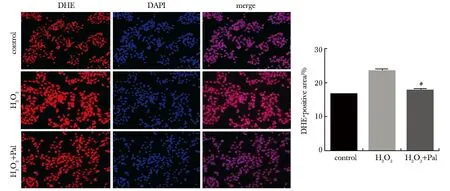
DHE.dihydroethidium;Pal.paricalcitol;#P<0.05 compared with BDL group.
2.5 Pal改善氧化应激诱导的HepG2细胞紧密连接受损
相比于对照组,ZO-1和occludin的蛋白表达水平显著降低(P<0.05),提示氧化应激诱导HepG2细胞紧密连接受损。然而Pal治疗可有效抑制细胞紧密连接受损,可见与模型组相比,ZO-1和occludin的蛋白表达水平显著升高(P<0.05)(图5)。
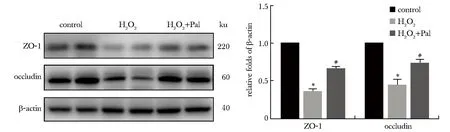
BDL.bile duct ligation;Pal.paricalcitol;*P<0.05 compared with control group;#P<0.05 compared with BDL group.
2.6 Pal改善胆汁淤积小鼠肝脏细胞紧密连接受损
相比于对照组,模型组小鼠肝脏中ZO-1和occludin的蛋白表达水平降低(P<0.05),提示胆汁淤积小鼠肝脏细胞紧密连接受损。相比于模型组,Pal治疗组小鼠肝脏中ZO-1和occludin的蛋白表达水平显著升高(P<0.05或P<0.01),这表明Pal能够有效改善胆汁淤积小鼠肝脏细胞紧密连接受损(图6)。

BDL.bile duct ligation;Pal.paricalcitol;*P<0.05 compared with control group;#P<0.05,##P<0.01 compared with BDL group.
2.7 Pal可能通过抑制NF-κB/p65和ERK信号通路,减轻胆汁淤积小鼠肝脏细胞紧密连接受损
相比于对照组,模型组小鼠肝脏组织中p-p65、p-ERK蛋白表达水平显著增加(P<0.05或P<0.01),这表明信号通路激活;MLCK、p-MLC水平显著上调,提示细胞紧密连接开放。相对于模型组,Pal治疗显著抑制小鼠肝脏中p-p65、p-ERK、MLCK、p-MLC水平(P<0.05或P<0.01),提示Pal可能通过抑制NF-κB/p65和ERK信号通路,减轻细胞紧密连接受损(图7)。
2.8 Pal可能通过抑制NF-κB/p65和ERK信号通路,减轻氧化应激诱导的HepG2细胞紧密连接受损
与对照组比较, 模型组HepG2细胞中p-p65、p-ERK、MLCK、p-MLC的蛋白表达水平显著升高(P<0.05或P<0.01或P<0.001或P<0.001)。与模型组比较,Pal治疗组小鼠肝脏中p-p65、p-ERK、MLCK、p-MLC水平显著降低(P<0.05),提示Pal可能通过抑制NF-κB/p65和ERK信号通路,减轻氧化应激诱导的HepG2细胞紧密连接受损(图8)。

BDL.bile duct ligation;Pal.paricalcitol;*P<0.05,**P<0.01,***P<0.001,****P<0.0001 compared with control group;#P<0.05 compared with BDL group.
3 讨论
胆汁淤积继发引起的各种肝脏疾病统称为胆汁淤积性肝病,它是一种常见的肝胆疾病,常伴有有害胆汁酸(bile acid,BA)积聚,从而导致肝胆损伤。胆汁淤积性肝损伤的发病机制非常复杂,氧化应激是主要的诱因之一。胆汁淤积过程中产生有毒的高水平BA,进而引起线粒体功能障碍,诱导细胞凋亡和氧化应激。此外,氧化应激也是参与胆汁淤积向肝纤维化及肝功能衰竭进展的必要因素。
在多种胆汁淤积性肝损伤动物模型中,可见肝细胞紧密连接受损。众所周知,氧化应激可破坏上皮的紧密连接,导致紧密连接蛋白解离,并使得紧密连接蛋白与细胞骨架失去联系[9]。在胆汁淤积性肝损伤期间,肝细胞紧密连接遭到破坏,使得胆小管因内容物外流至肝细胞间隙而丧失有利于胆汁分泌的渗透压,加剧肝损伤[10]。
Pal是一种VDR激动剂,具有抗炎、抗氧化应激、抗纤维化等诸多优点。Pal可通过多种信号机制抑制氧化应激,从而对肝脏、肾脏起到保护作用[11-12],但Pal对细胞紧密连接的影响,尚不清楚。本研究通过H2O2处理HepG2细胞构建氧化应激模型,通过对小鼠胆总管结扎(BDL)构建胆汁淤积模型,给予Pal治疗,结果提示Pal可减轻小鼠胆汁淤积性肝损伤,并可通过降低肝细胞氧化应激来维持肝细胞紧密连接稳定。
肌球蛋白轻链激酶(myosin light-chain kinase,MLCK)是调节紧密连接的主要物质[13]。MLCK依赖性肌球蛋白Ⅱ调节轻链(MLC)的磷酸化是紧密连接生理功能调节的重要中间体。在多种肠道疾病中,MLCK使得MLC磷酸化后破坏细胞紧密连接从而引发肠上皮屏障受损,破坏肠道功能[13-14]。ERK是经典的氧化应激相关信号通路,NFκB是经典的炎症相关信号通路。研究发现,ERK以及NFκB都可通过增加MLCK转录来促进紧密连接开放[15]。本研究结果提示帕立骨化醇可能通过抑制ERK和NFκB信号通路来稳定肝细胞紧密连接,从而缓解小鼠胆汁淤积性肝损伤。
综上所述,帕立骨化醇通过抑制胆汁淤积性小鼠及肝细胞系中的氧化应激并减轻肝细胞紧密连接受损,其潜在分子机制可能与抑制活性氧及NF-κB/p65、ERK信号通路有关。

