泽漆醇提取物抗氧化活性及对油酸诱导HepG2 细胞脂肪堆积的影响
甘露珍,姜 琼,饶志威,张聪子,杜 光,章登政
(咸宁市中心医院/湖北科技学院附属第一医院药学部,湖北咸宁 437199)
泽漆(Euphorbia helioscopiaL.)是大戟科一年生草本植物,广泛分布在中国各地,其作为一种药用植物,几十年来被广泛用于治疗水肿、痰咳、疟疾、结痂和骨髓炎等多种疾病[8-9],也被报道用作保健食品原料[10]。众所周知,泽漆具有广泛的生物活性,包括抗增殖、抗炎、驱虫、抗菌、抗真菌、降脂和促伤口愈合等活性[11-13]。研究表明,泽漆的不同提取液及多种活性小分子成分在抑制肿瘤细胞生长与增殖、诱导肿瘤细胞凋亡、抑制肿瘤细胞迁移与侵袭等方面展现了抗肿瘤的作用[14-17]。有研究报道,泽漆提取物具有清除自由基的活性[18-19];另有报道,泽漆提取物的抗氧化活性与抗糖尿病之间可能存在联系[20-21]。然而,关于泽漆不同提取物抗氧化活性的对比研究较少,尤其是其对细胞脂肪堆积的研究鲜有报道。
本研究拟采用不同的溶剂提取泽漆有效成分,比较其抗氧化能力大小,并进一步探讨泽漆提取物对油酸诱导HepG2 细胞脂肪堆积的影响,为其抗氧化性与治疗NAFLD 提供一定理论依据。
1 材料与方法
1.1 材料与仪器
泽漆干燥全草 为实验室自制,经粉碎、过40 目筛,备用;HepG2 细胞 美国典型生物库(ATCC);胎牛血清、DMEM 培养基 美国HyClone 公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)美国Alorich 公司;Foline-phehol 分析纯,上海Biosharp公司;丁基羟基茴香醚(BHA)、二丁基羟基甲苯(BHT)、芦丁(Rutin)、维生素C(VC)、乙二胺四乙酸(EDTA)等其它的分析试剂 上海晶纯生物科技股份有限公司;MTT、油红O 染料 美国Sigma 公司;甘油三脂(A110-1-1)、谷胱甘肽(A006-2-1)、超氧化物歧化酶(A001-3-2)活性、总抗氧化能力(A015-2-1)试剂盒 南京建成生物工程研究所。
HH-4 型水浴锅 常州市华普达教学仪器有限公司;SB-5200 型超声波清洗器 宁波新芝生物科技股份有限公司;Cary 60 型紫外可见分光光度计 美国安捷伦科技有限公司;Bio Tek Synergy 2 型多功能酶标仪 美国伯腾仪器有限公司。
1.2 实验方法
1.2.1 泽漆提取物的制备 参照文献[22]进行优化,等量称取6 份5.0 g 泽漆粉末放入锥形瓶中,分别用100 mL 的25%甲醇、25%乙醇、50%甲醇、50%乙醇、75%甲醇、75%乙醇预浸泡30 min,后30 ℃超声30 min,超声功率300 W,过滤,恒温80 ℃水浴干燥,获得提取物,依次命名为25%甲醇、25%乙醇、50%甲醇、50%乙醇、75%甲醇和75%乙醇。
1.2.2 DPPH 自由基的清除率测定 参照文献[23],采用DPPH 氧化法,将提取物用60%乙醇配成0.015~0.500 mg/mL 样液,分别取20 μL 样液加入200 μL 的0.004% DPPH 乙醇溶液中,立即混匀,室温静置30 min,以VC、Rutin、BHA、BHT 作阳性对照。用酶标仪于517 nm 处测吸光度。样品DPPH自由基的清除率计算公式见式(1):
式中,A1为待测样品与DPPH 作用后的吸光度值;A0为与样液等体积的60%乙醇溶液与DPPH 作用后的吸光度值。
完成年度公益性水利工程维修养护资金合规性审核。对24个中西部地区、贫困地区省份的县级国有管理单位及其所属单位申报的2013年度中央财政补助资金项目,从项目范围、项目类别、维修养护内容、维修养护经费等方面进行合规性审核,涉及承担防洪、排涝、抗旱、灌溉等公益性任务的水库、水闸、堤防、控导工程、泵站、淤地坝等6类工程6 000多个项目。
1.2.3 ABTS+自由基的清除率测定 参照文献[24],将7 mmol/L ABTS+溶液与2.45 mmol/L 过硫酸钾溶液混合,室温避光16 h。用甲醇稀释上述混合液,使混合液在734 nm 处吸光度为0.70±0.02。将提取物用60%乙醇配成一系列浓度样液,分别取50 μL样液加入100 μL 的混合液中,立即混匀,室温静置30 min,以VC、Rutin、BHA、BHT 作阳性对照。于734 nm 处测吸光度值。ABTS+自由基清除率计算公式见式(2):
式中,A1为待测样品与混合液反应后的吸光度值,A0为等体积60%乙醇溶液与混合液作用后的吸光度值。
1.2.4 还原Fe3+能力测定 参照文献[25],在100 μL样品溶液中加入100 μL 去离子水及25 μL 0.5 mmol/L FeCl2,立即于562 nm 处测吸光度值A1。加入25 μL 2.5 mmol/L 菲啰嗪,混匀后室温避光反应20 min,再测吸光度值A2。以EDTA 为阳性对照。Fe3+还原能力的计算公式见式(3):
1.2.5 总酚含量测定 参照文献[26],取40 μL 样品溶液(或没食子酸溶液),加入360 μL 蒸馏水后再加入40 μL 福林酚试剂,混匀,5 min 后加入400 μL 7%碳酸钠溶液,立即用蒸馏水稀释至1 mL,充分混合,室温孵育90 min,750 nm 测吸光度。以没食子酸作标准曲线,得回归方程y=0.112x-0.0544,R2=0.9993。样品中的总酚以没食子酸的含量表示,单位为1 mg 没食子酸当量/每克样品。
1.2.6 总黄酮含量测定 参照文献[27],准确称取8 mg 芦丁标准品,用60%乙醇溶解后转移到50 mL容量瓶并定容,然后配制成母液浓度为0.16 mg/mL的芦丁标准液。分别移取芦丁标准液0、0.2、1.0、1.8、2.6、3.4、4.2、5 mL 于25 mL 容量瓶中,加入1%的AlCl3乙醇溶液5 mL,pH5.5 的醋酸钠缓冲盐4 mL,再用60%乙醇液定容到25 mL。在200~400 nm 波长段进行紫外扫描,于最大吸收波长275 nm 处测定吸光度,以对照品溶度C(μg/mL)为横坐标,吸光值A 为纵坐标进行线性回归,回归方程为y=0.0347x-0.0068,R2=0.9996。
1.2.7 细胞培养 用含10%胎牛血清的DMEM 培养基培养HepG2 细胞,并置于37 ℃、体积分数5%CO2培养箱,备用。
1.2.8 MTT 实验 将泽漆50%乙醇提取物粉末采用DMSO 溶解配制成浓度为10 mg/mL 的泽漆50%乙醇提取物溶液。取生长状态良好的HepG2细胞以每孔5×103个接种于96 孔板中,待细胞生长至70%融合度时,采用0、25、50、100、200、400、800、1600 μg/mL 泽漆50%乙醇提取物处理HepG2细胞24 h。每孔加入20 μL MTT 后,放置培养箱中孵育4 h 后,弃掉液体,每孔再加150 μL DMSO,振荡10 min 充分溶解,酶标仪在490 nm 处测定A 值(A490),并以空白孔调零,以A490值代表增殖活性。
1.2.9 油酸诱导HepG2 细胞脂肪堆积模型的建立及分组 取生长状态良好的HepG2 细胞以每孔2×105个接种于6 孔培养板,待细胞生长至70%融合度时,采用0.2 mmol/L 油酸(OA)刺激HepG2 细胞24 h 构建脂肪堆积模型[21]。根据实验目的设置对照组、油酸组(OA 组)、油酸+泽漆50%乙醇提取物低、中、高剂量组(20.0、40.0、60.0 μg/mL),油酸和泽漆50%乙醇提取物干预同时进行,干预时间为24 h。其中对照组加100 μL DMEM 培养基,OA 组加50 μL 油酸溶液和50 μL DMEM 培养基,油酸+泽漆醇提取物组加50 μL 油酸溶液和50 μL 含泽漆醇提取物的DMEM 培养基。
1.2.10 油红O 染色 取生长状态良好的HepG2 细胞以每孔2×105个接种于6 孔培养板,按1.2.9 分组处理。弃去上清,PBS 洗3 次,10%福尔马林固定40 min,PBS 洗3 次,用油红O 染色液室温染色20 min,PBS 洗2 次,置于倒置显微镜下观察细胞内脂滴染色情况。
1.2.11 TG、GSH、T-AOC 含量和SOD 活性测定取生长状态良好的HepG2 细胞以每孔2×105个接种于6 孔培养板,按1.2.9 分组处理。弃去上清,PBS洗3 次。收集细胞,冰上裂解30 min,按照试剂盒说明书的操作步骤测定TG、GSH、T-AOC 含量和SOD活性。
1.3 数据处理
本研究数据均采用SPSS22.0 统计软件进行分析,并以均值±标准差的形式表示,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验。P<0.05 表示差异有统计学意义。
2 结果与分析
2.1 泽漆不同醇提取物对DPPH 自由基的清除作用
如图1 所示,25%甲醇、25%乙醇、50%甲醇、50%乙醇、75%甲醇和75%乙醇各组泽漆醇提取物在浓度0.015~0.500 mg/mL 的范围内,随着浓度的增加,对DPPH 自由基的清除活性逐渐增强,其中在0.030~0.500 mg/mL 的范围内,50%乙醇组活性最强(P<0.05)。
2.2 泽漆不同醇提取物对ABTS+自由基的清除作用
如图2 所示,25%甲醇、25%乙醇、50%甲醇、50%乙醇、75%甲醇和75%乙醇各组泽漆醇提取物在浓度0.010~0.080 mg/mL 的范围内,随着浓度的增加,对ABTS+自由基的清除活性逐渐增强,其中在0.010~0.040 mg/mL 的范围内50%乙醇组清除活性最强(P<0.01),并在浓度为0.080 mg/mL 时,达到最高值。
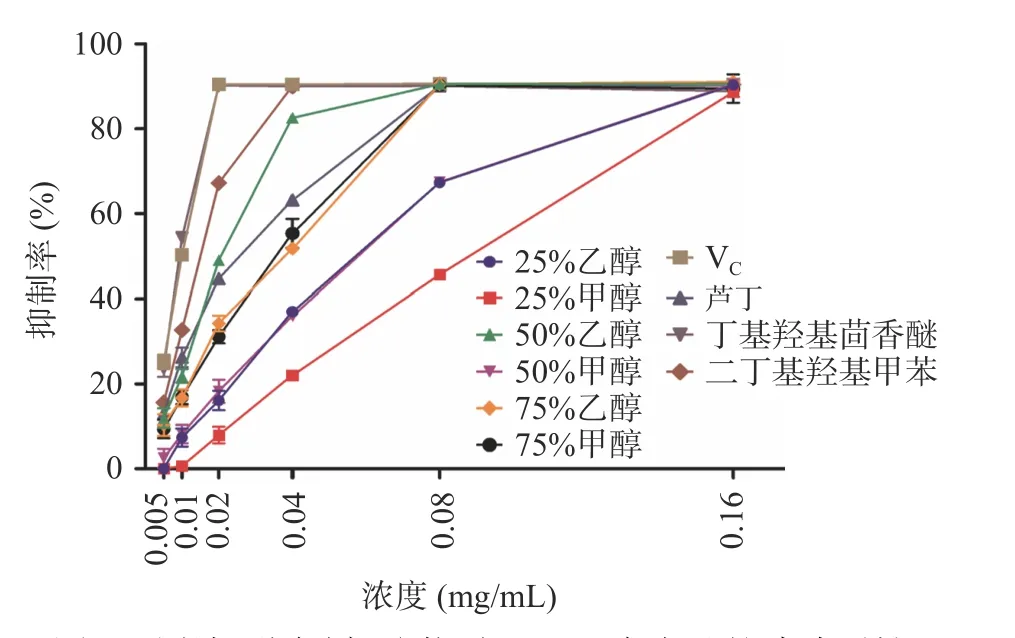
图2 泽漆不同醇提取物对ABTS+自由基的清除活性Fig.2 ABTS+ radical scavenging activity of different alcohol extracts of Euphorbia helioscopia
2.3 泽漆不同醇提取物对Fe3+的还原力
如图3 所示,25%甲醇、25%乙醇、50%甲醇、50%乙醇、75%甲醇和75%乙醇各组泽漆醇提取物在浓度0.125~2.000 mg/mL 的范围内,随着浓度的增加,对Fe3+的还原力逐渐增强。在0.063~2.000 mg/mL 的范围内,50%乙醇组和50%甲醇组还原能力明显比75%甲醇和75%乙醇组强(P<0.001);在浓度为0.063、0.125 mg/mL 时,50%乙醇组和50%甲醇组还原能力明显比25%甲醇和25%乙醇组强(P<0.001),随着浓度升高,四组还原能力有所波动,并在2 mg/mL 时螯合率接近100%。综上所述,在各组泽漆醇提取物中,50%乙醇提取物还原能力较高。有研究报道,泽漆甲醇和乙醇提取物具有抗氧化活性,其纯甲醇提取物对DPPH 和ABTS+的清除能力比纯乙醇提取物更强,分析原因可能是纯甲醇提取物中总酚和总黄酮含量比纯乙醇提取物中高[15]。因此,本研究接下来检测比较各组总酚和总黄酮含量。
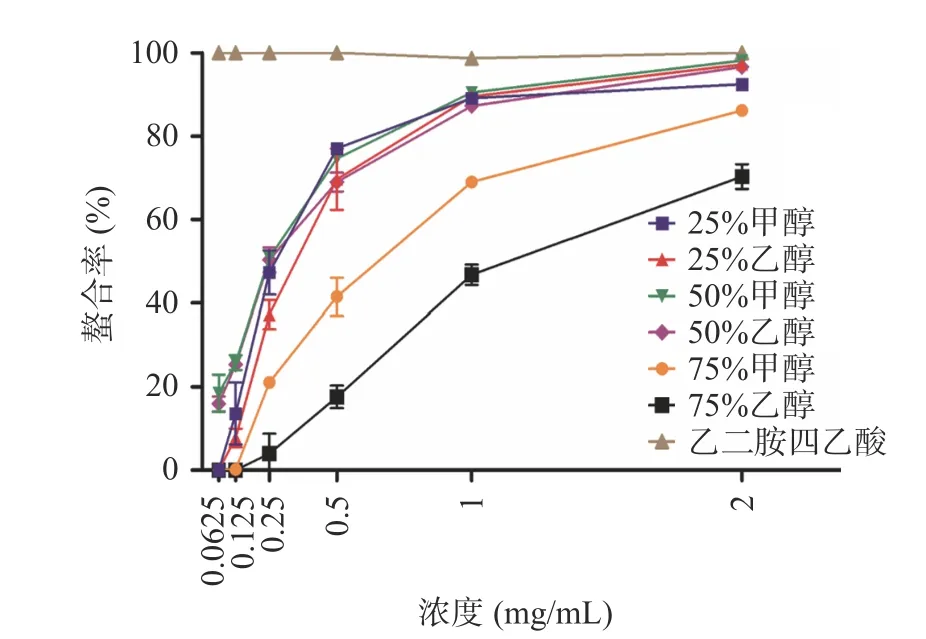
图3 泽漆不同醇提取物对Fe3+的还原力Fig.3 Fe3+ reducing power of different alcohol extracts of Euphorbia helioscopia
2.4 泽漆不同醇提取物中的总酚和总黄酮含量
多种酚类和黄酮类化合物具有抗氧化活性[28],本研究通过化学方法检测各组总酚和总黄酮含量。结果发现,50%乙醇提取物总酚和总黄酮含量均较高,与其更高的抗氧化活性相符。如图4 所示,测得25%甲醇、25%乙醇、50%甲醇、50%乙醇、75%甲醇和75%乙醇各组泽漆醇提取物中总酚和总黄酮含量,其中50%乙醇组的总酚含量明显高于25%甲醇组、50%甲醇组和25%乙醇组(P<0.05),而与75%甲醇组和75%乙醇组相比,无显著性差异(P=0.905 和0.314)。50%乙醇组的总黄酮含量明显高于25%甲醇组、50%甲醇组和25%乙醇组(P<0.05),而与75%甲醇组和75%乙醇组相比,无显著性差异(P=0.171 和0.155)。
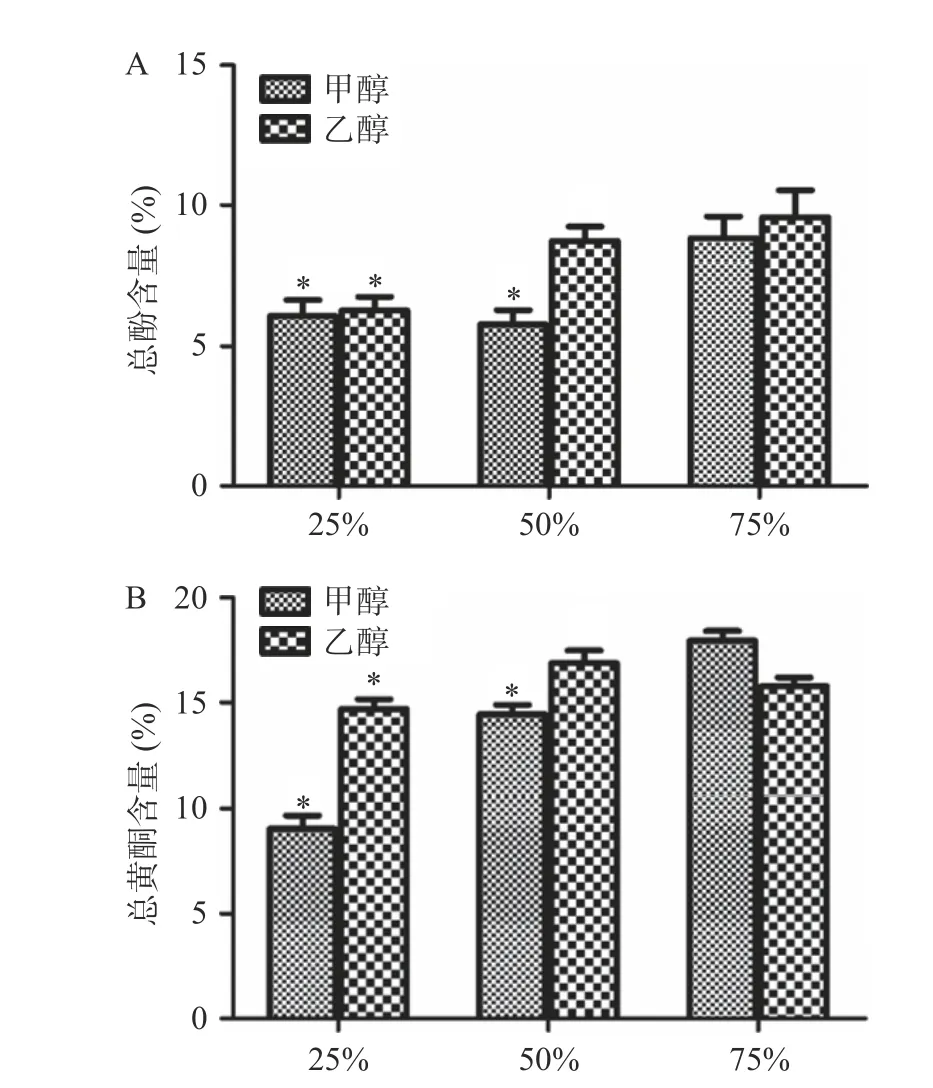
图4 泽漆不同醇提取物中的总酚和总黄酮含量Fig.4 Contents of total phenol and total flavone in different alcohol extracts of Euphorbia helioscopia
相对于其它组泽漆醇提取物,泽漆50%乙醇提取物的DPPH 自由基和ABTS+自由基的清除作用更强,对Fe3+的还原力也较高,并且其提取物中总酚和总黄酮含量也较高,与其高抗氧化活性相符。故选取泽漆50%乙醇提取物进行下一步研究。
2.5 泽漆50%乙醇提取物对HepG2 细胞脂肪堆积的影响
MTT 检测HepG2 细胞增殖活性(图5),与空白组相比,100~1600 μg/mL 泽漆50%乙醇提取物各干预组HepG2 细胞增殖活性明显降低,具有浓度依赖性(P<0.001),IC50值为237.486 μg/mL。选取细胞抑制率在15%范围内的最大泽漆50%乙醇提取物浓度60.0 μg/mL 作为后续实验的高剂量组,按照等比例设置中、低浓度组,即40、20 μg/mL 泽漆50%乙醇提取物作为后续实验处理HepG2 细胞的中、低剂量。
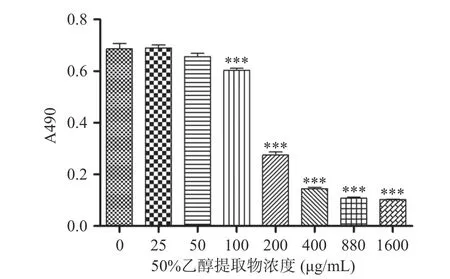
图5 不同浓度泽漆50%乙醇提取物对HepG2 细胞增殖活性的影响Fig.5 Effects of different concentrations of 50% ethanol extract of Euphorbia helioscopia on the proliferation activity of HepG2 cells
油酸诱导HepG2 细胞脂肪堆积模型常用来评价药物对肝细胞脂肪堆积的干预[21]。油红O 染色观察各组细胞内脂滴形成情况(橘红色油滴,用红色箭头标记),与对照组相比,OA 组细胞内大量油滴堆积,说明脂肪堆积模型建立成功;与OA 组相比,随着泽漆50%乙醇提取物浓度的增加,HepG2 细胞内油滴堆积量逐渐减少,具有一定的浓度依赖性(图6),说明泽漆乙醇提取物可以抑制HepG2 细胞内脂肪堆积。GPO-PAP 法测定结果显示,对照组、OA 组及50%乙醇提取物低、中、高剂量组HepG2 细胞中TG 含量分别为(0.111±0.015)、(0.286±0.010)、(0.238±0.004)、(0.207±0.005)和(0.176±0.010)mmol/g,差异有统计学意义(F=142.125,P<0.001)。与对照组比较,OA 组HepG2 细胞中TG 含量显著上升(P<0.001);与OA 组比较,50%乙醇提取物低、中、高剂量组HepG2 细胞中TG 含量均显著降低(P<0.001),具有浓度依赖性。结果说明,泽漆乙醇提取物可以增强HepG2 细胞内源性抗氧化能力,并且具有浓度依赖性。
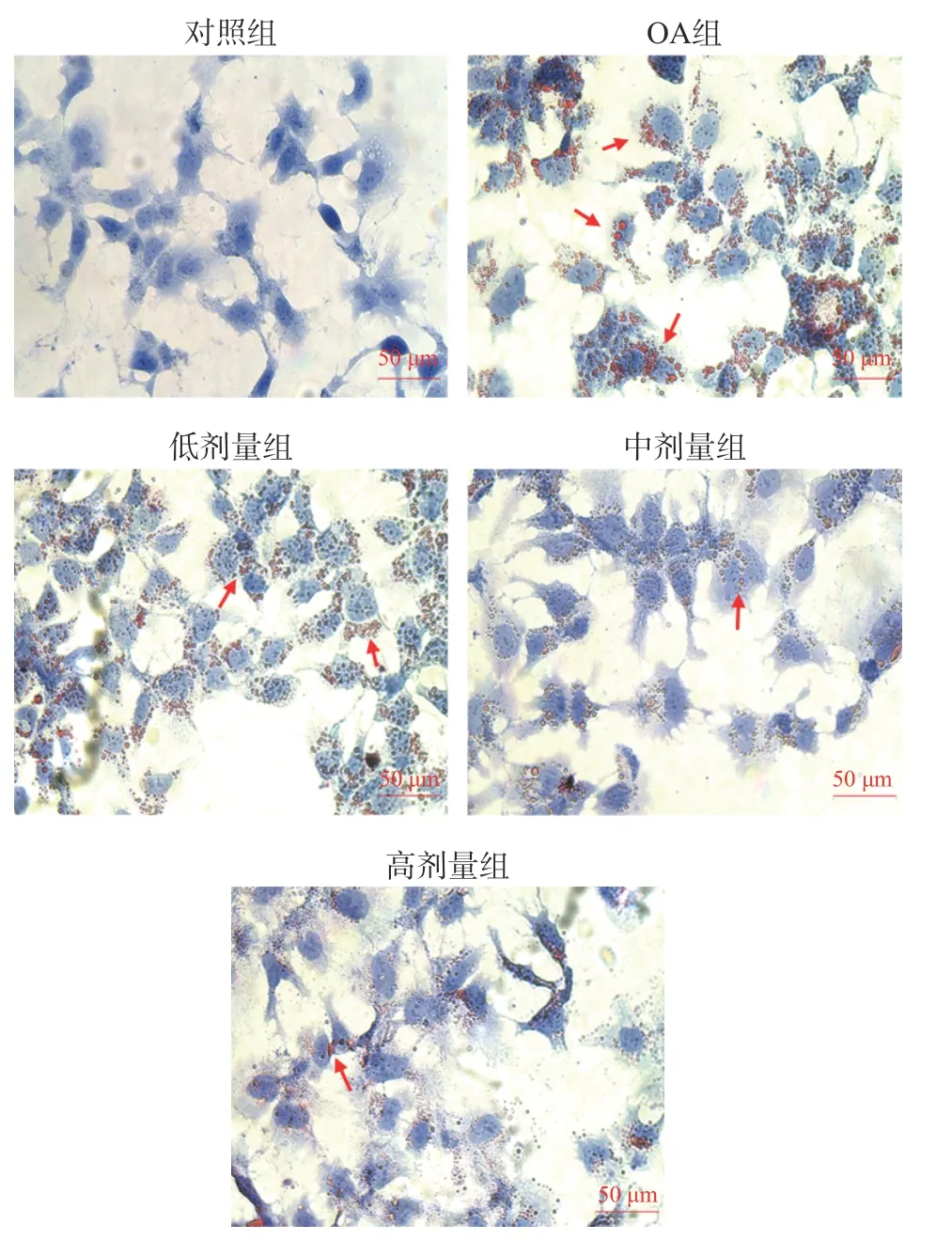
图6 HepG2 细胞油红O 染色(400×)Fig.6 Oil red O staining of HepG2 cells (400×)
2.6 泽漆50%乙醇提取物对HepG2 细胞内源性抗氧化能力的影响
如表1 所示,与对照组比较,OA 组HepG2 细胞中GSH 和T-AOC 含量及SOD 活性显著降低(P<0.001);与OA 组比较,50%乙醇提取物低、中、高剂量组HepG2 细胞中GSH 含量(P<0.05)和T-AOC含量(P<0.001)明显上升,SOD 活性也显著上升(P<0.001),具有浓度依赖性。
表1 泽漆50%乙醇提取物对HepG2 细胞中GSH、T-AOC含量和SOD 活性的影响(n=3,±s)Table 1 Effects of Euphorbia helioscopia 50% ethanol extract on GSH,T-AOC content and SOD activity in HepG2 cells (n=3,±s)
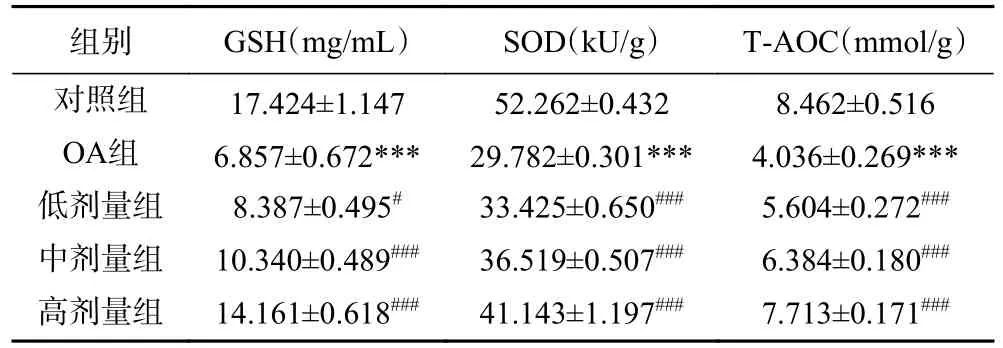
表1 泽漆50%乙醇提取物对HepG2 细胞中GSH、T-AOC含量和SOD 活性的影响(n=3,±s)Table 1 Effects of Euphorbia helioscopia 50% ethanol extract on GSH,T-AOC content and SOD activity in HepG2 cells (n=3,±s)
注:与对照组比较,***P<0.001;与OA组比较,#P<0.05,###P<0.001。
3 讨论与结论
本研究分别用25%、50%、75%的甲醇或乙醇作为溶剂对泽漆进行提取,通过体外抗氧化活性检测方法比较其抗氧化能力。结果发现,这六种泽漆提取物均具有抗氧化活性,且具有浓度依赖性,相对于其它组泽漆醇提取物,泽漆50%乙醇提取物的DPPH自由基和ABTS+自由基的清除作用更强,对Fe3+的还原力也较高,总体上50%乙醇提取物抗氧化效果更佳。多种酚类和黄酮类化合物具有抗氧化活性,本研究通过化学方法检测各组总酚和总黄酮含量,结果发现,50%乙醇提取物总酚和总黄酮含量均较高,与其高抗氧化活性呈正相关。有研究报道,泽漆提取物具有抗氧化和抗糖尿病活性,而且甲醇提取物中总酚和总黄酮含量比乙醇提取物中高,并且甲醇提取物对DPPH 和ABTS+的清除能力更强[21]。分析原因,可能是两者的提取方法不同,导致提取物中总酚和总黄酮含量不同,此外本研究中相同浓度的甲醇和乙醇提取泽漆也有75%甲醇提取物中总黄酮比75%乙醇提取物含量高的情况。
本研究用油酸诱导HepG2 细胞建立脂肪堆积模型,并进一步探讨泽漆50%乙醇提取物对油酸诱导HepG2 细胞脂肪堆积的影响。与空白组相比,100~1600 μg/mL 各组细胞增殖活性明显降低,具有浓度依赖性。根据其IC15值,选取无毒副作用的剂量作为后续实验的干预剂量。结果显示,OA 组细胞内大量油滴堆积,脂肪堆积模型建立成功;而泽漆50%乙醇提取物可以减少细胞内油滴堆积,降低TG 含量,存在浓度依赖性,说明泽漆乙醇提取物可以抑制HepG2 细胞内脂肪堆积。进一步研究发现,泽漆50%乙醇提取物可以促进HepG2 细胞内GSH和T-AOC 含量上升和SOD 活性上升,具有浓度依赖性。结果说明,泽漆乙醇提取物可以增强HepG2细胞内源性抗氧化能力。这可以为将泽漆醇提取物用于NAFLD 治疗提供新的理论依据。然而,有研究报道,泽漆乙酸乙酯提取物可能诱导MDA-MB-231 细胞中ROS 过量生成,通过线粒体损伤途径促进凋亡,从而抑制细胞生长[29]。泽漆提取物在细胞发挥的作用是否跟提取方式和细胞类型有关,有待于进一步研究。当然,本研究未对泽漆提取物做进一步提纯质谱分析,探讨某种或某类化合物的抗氧化作用,对此课题组后期将进行更加深入细致的研究。
综上所述,泽漆甲醇和乙醇提取物均具有抗氧化活性,其中以50%乙醇提取物抗氧化效果最佳,且其可以抑制油酸诱导的HepG2 细胞脂肪堆积,并增强HepG2 细胞内源性抗氧化能力。

